15.3: Fatores de virulência
- Page ID
- 181371
Objetivos de
- Explicar como os fatores de virulência contribuem para os sinais e sintomas de doenças infecciosas
- Diferencie entre endotoxinas e exotoxinas
- Descreva e diferencie entre vários tipos de exotoxinas
- Descreva os mecanismos que os vírus usam para adesão e variação antigênica
Na seção anterior, explicamos que alguns patógenos são mais virulentos do que outros. Isso se deve aos fatores de virulência exclusivos produzidos por patógenos individuais, que determinam a extensão e a gravidade da doença que eles podem causar. Os fatores de virulência de um patógeno são codificados por genes que podem ser identificados usando os postulados moleculares de Koch. Quando os genes que codificam fatores de virulência são inativados, a virulência no patógeno diminui. Nesta seção, examinamos vários tipos e exemplos específicos de fatores de virulência e como eles contribuem para cada etapa da patogênese.
Fatores de virulência para adesão
Conforme discutido na seção anterior, as duas primeiras etapas da patogênese são exposição e adesão. Lembre-se de que uma adesina é uma proteína ou glicoproteína encontrada na superfície de um patógeno que se liga a receptores na célula hospedeira. As adesinas são encontradas em patógenos bacterianos, virais, fúngicos e protozoários. Um exemplo de adesina bacteriana é a adesina fimbrial tipo 1, uma molécula encontrada nas pontas das fímbrias da E. coli enterotoxigênica (ETEC). Lembre-se de que as fímbrias são cerdas proteicas semelhantes a pêlos na superfície celular. A adesão fimbrial tipo 1 permite que as fímbrias das células ETEC se liguem aos glicanos da manose expressos nas células epiteliais intestinais. A tabela\(\PageIndex{1}\) lista as adesinas comuns encontradas em alguns dos patógenos que discutimos ou veremos mais adiante neste capítulo.
| Patógeno | Doença | Adesão | Site de anexos | |
|---|---|---|---|---|
| Streptococcus pyogenes | Estreptococos | Proteína F | Células epiteliais respiratórias | |
| Streptococcus mutans | Cárie dentária | Adesão P1 | Dentes | |
| Neisseria gonorrhoeae | Gonorréia | Pílula tipo IV | Células epiteliais uretrais | |
| E. coli enterotoxigênica (ETEC) | Diarreia do viajante | Fímbrias do tipo 1 | Células epiteliais intestinais | |
| Vibrio cholerae | Cólera | N-metilfenilalanina pili | Células epiteliais intestinais |
Foco clínico: Parte 3
A presença de bactérias no sangue de Michael é sinal de infecção, já que o sangue normalmente é estéril. Não há indicação de que a bactéria tenha entrado no sangue devido a uma lesão. Em vez disso, parece que o portal de entrada era a via gastrointestinal. Com base nos sintomas de Michael, nos resultados de seu exame de sangue e no fato de Michael ter sido o único na família a comer cachorros-quentes, o médico suspeita que Michael esteja sofrendo de um caso de listeriose.
Listeria monocytogenes, o patógeno intracelular facultativo que causa a listeriose, é um contaminante comum em alimentos prontos para consumo, como carnes de almoço e laticínios. Uma vez ingeridas, essas bactérias invadem as células epiteliais intestinais e se translocam para o fígado, onde crescem dentro das células hepáticas. A listeriose é fatal em cerca de uma em cada cinco pessoas saudáveis normais, e as taxas de mortalidade são ligeiramente mais altas em pacientes com doenças preexistentes que enfraquecem a resposta imune. Um conjunto de genes de virulência codificados em uma ilha de patogenicidade é responsável pela patogenicidade de L. monocytogenes. Esses genes são regulados por um fator de transcrição conhecido como fator de liberação da cadeia peptídica 1 (PrFa). Um dos genes regulados pelo PrFa é o hyl, que codifica uma toxina conhecida como listeriolisina O (LLO), que permite que a bactéria escape dos vacúolos ao entrar na célula hospedeira. Um segundo gene regulado pelo PrFa é o ActA, que codifica uma proteína de superfície conhecida como proteína indutora de montagem de actina (ActA). O ActA é expresso na superfície da Listeria e polimeriza a actina hospedeira. Isso permite que a bactéria produza caudas de actina, se mova pelo citoplasma da célula e se espalhe de célula para célula sem sair para o compartimento extracelular.
A condição de Michael começou a piorar. Ele agora está com rigidez no pescoço e hemiparesia (fraqueza de um lado do corpo). Preocupado com a disseminação da infecção, o médico decide realizar exames adicionais para determinar o que está causando esses novos sintomas.
Exercício\(\PageIndex{1}\)
- Que tipo de patógeno causa a listeriose e quais fatores de virulência contribuem para os sinais e sintomas que Michael está experimentando?
- É provável que a infecção se espalhe pelo sangue de Michael? Se sim, como isso pode explicar seus novos sintomas?
Exoenzimas bacterianas e toxinas como fatores de virulência
Após a exposição e adesão, o próximo passo na patogênese é a invasão, que pode envolver enzimas e toxinas. Muitos patógenos invadem a corrente sanguínea, um meio eficaz de disseminação porque os vasos sanguíneos passam perto de todas as células do corpo. A desvantagem desse mecanismo de dispersão é que o sangue também inclui vários elementos do sistema imunológico. Vários termos que terminam em —emia são usados para descrever a presença de patógenos na corrente sanguínea. A presença de bactérias no sangue é chamada de bacteremia. A bacteremia envolvendo piógenos (bactérias formadoras de pus) é chamada de piemia. Quando os vírus são encontrados no sangue, isso é chamado de viremia. O termo toxemia descreve a condição em que as toxinas são encontradas no sangue. Se as bactérias estiverem presentes e se multiplicarem no sangue, essa condição é chamada de septicemia.
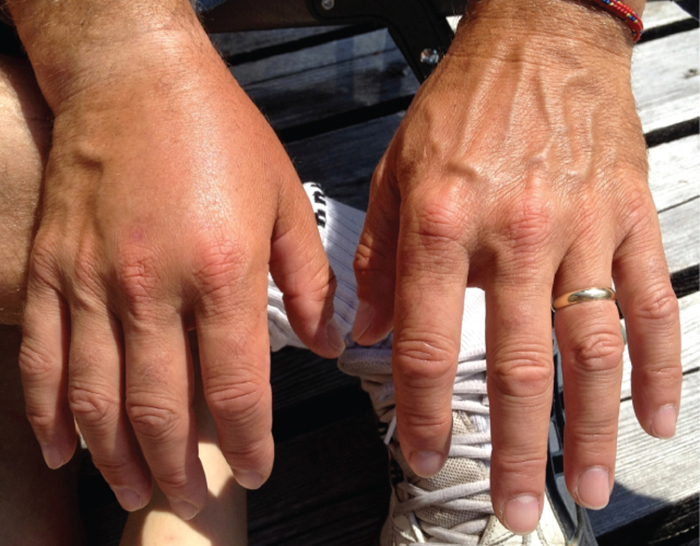
Pacientes com septicemia são descritos como sépticos, o que pode levar ao choque, uma diminuição da pressão arterial com risco de vida (pressão sistólica <90 mm Hg) que impede que células e órgãos recebam oxigênio e nutrientes suficientes. Algumas bactérias podem causar choque por meio da liberação de toxinas (fatores de virulência que podem causar danos aos tecidos) e levar à baixa pressão arterial. As bactérias gram-negativas são engolfadas pelos fagócitos do sistema imunológico, que então liberam o fator de necrose tumoral, uma molécula envolvida na inflamação e na febre. O fator de necrose tumoral se liga aos capilares sanguíneos para aumentar sua permeabilidade, permitindo que os fluidos saiam dos vasos sanguíneos para os tecidos, causando inchaço ou edema (Figura\(\PageIndex{1}\)). Com altas concentrações do fator de necrose tumoral, a reação inflamatória é grave e é perdido líquido suficiente do sistema circulatório para que a pressão arterial diminua para níveis perigosamente baixos. Isso pode ter consequências terríveis porque o coração, os pulmões e os rins dependem da pressão arterial normal para funcionar adequadamente; assim, podem ocorrer falência de vários órgãos, choque e morte.
Exoenzimas
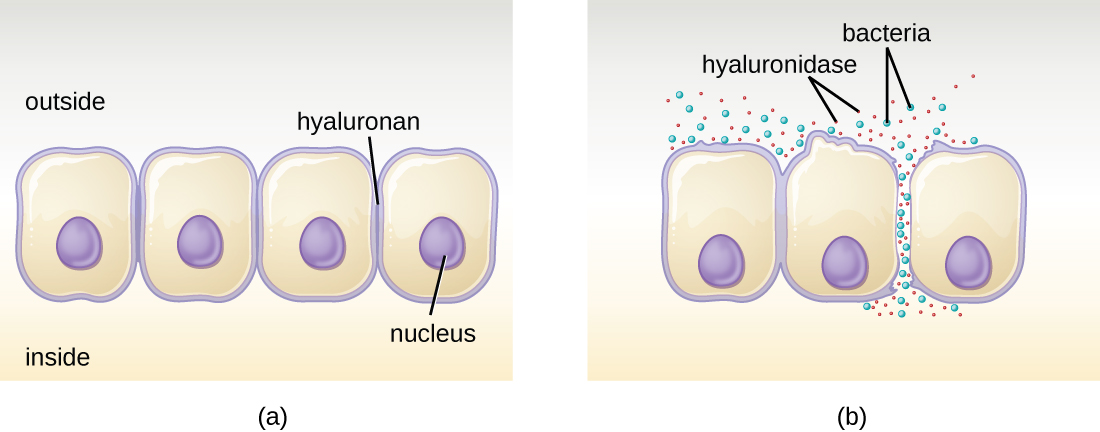
Alguns patógenos produzem enzimas extracelulares, ou exoenzimas, que lhes permitem invadir as células hospedeiras e tecidos mais profundos. As exoenzimas têm uma grande variedade de alvos. Algumas classes gerais de exoenzimas e patógenos associados estão listadas na Tabela\(\PageIndex{2}\). Cada uma dessas exoenzimas funciona no contexto de uma estrutura tecidual específica para facilitar a invasão ou apoiar seu próprio crescimento e se defender contra o sistema imunológico. Por exemplo, a hialuronidase S, uma enzima produzida por patógenos como Staphylococcus aureus, Streptococcus pyogenes e Clostridium perfringens, degrada o glicosídeo hilauronano (ácido hialurônico), que atua como um cimento intercelular entre células adjacentes no conjuntivo tecido (Figura\(\PageIndex{2}\)). Isso permite que o patógeno passe pelas camadas de tecido no portal de entrada e se dissemine em outras partes do corpo (Figura\(\PageIndex{2}\)).
| Classe | Exemplo | Função |
|---|---|---|
| Glicohidrolases | Hialuronidase S em Staphylococcus aureus | Degrada o ácido hialurônico que cimenta as células para promover a disseminação pelos tecidos |
| Nucleases | DNase produzida por S. aureus | Degrada o DNA liberado pelas células moribundas (bactérias e células hospedeiras) que podem prender a bactéria, promovendo assim a disseminação |
| Fosfolipases | Fosfolipase C de Bacillus anthracis | Degrada a bicamada fosfolipídica das células hospedeiras, causando lise celular, e degrada a membrana dos fagossomos para permitir a fuga para o citoplasma |
| Proteases | Colagenase em Clostridium perfringens | Degrada o colágeno no tecido conjuntivo para promover a disseminação |
Nucleases produzidas por patógenos, como a DNase produzida por S. aureus, degradam o DNA extracelular como meio de escape e disseminação pelo tecido. À medida que as células bacterianas e hospedeiras morrem no local da infecção, elas se lisam e liberam seu conteúdo intracelular. O cromossomo de DNA é a maior das moléculas intracelulares, e massas de DNA extracelular podem capturar bactérias e impedir sua disseminação. S. aureus produz uma DNase para degradar a malha do DNA extracelular para que ele possa escapar e se espalhar para os tecidos adjacentes. Essa estratégia também é usada por S. aureus e outros patógenos para degradar e escapar de teias de DNA extracelular produzidas pelos fagócitos do sistema imunológico para capturar a bactéria.
As enzimas que degradam os fosfolipídios das membranas celulares são chamadas de fosfolipases. Suas ações são específicas em relação ao tipo de fosfolipídios sobre os quais agem e onde clivam enzimaticamente as moléculas. O patógeno responsável pelo antraz, B. anthracis, produz fosfolipase C. Quando o B. anthracis é ingerido pelas células fagocíticas do sistema imunológico, a fosfolipase C degrada a membrana do fagossomo antes que ele possa se fundir com o lisossomo, permitindo que o patógeno escape para o citoplasma e multiplicação. As fosfolipases também podem atingir a membrana que envolve o fagossomo dentro das células fagocíticas. Conforme descrito anteriormente neste capítulo, esse é o mecanismo usado por patógenos intracelulares, como L. monocytogenes e Rickettsia, para escapar do fagossomo e se multiplicar dentro do citoplasma das células fagocíticas. O papel das fosfolipases na virulência bacteriana não se restringe à fuga fagossomal. Muitos patógenos produzem fosfolipases que agem degradando as membranas celulares e causando a lise das células-alvo. Essas fosfolipases estão envolvidas na lise dos glóbulos vermelhos, glóbulos brancos e células dos tecidos.
Os patógenos bacterianos também produzem várias enzimas digeridoras de proteínas, ou proteases. As proteases podem ser classificadas de acordo com seu substrato alvo (por exemplo, proteases de serina alvo com o aminoácido serina) ou se elas contêm metais em seu sítio ativo (por exemplo, metaloproteases de zinco contêm um íon zinco, que é necessário para a atividade enzimática).
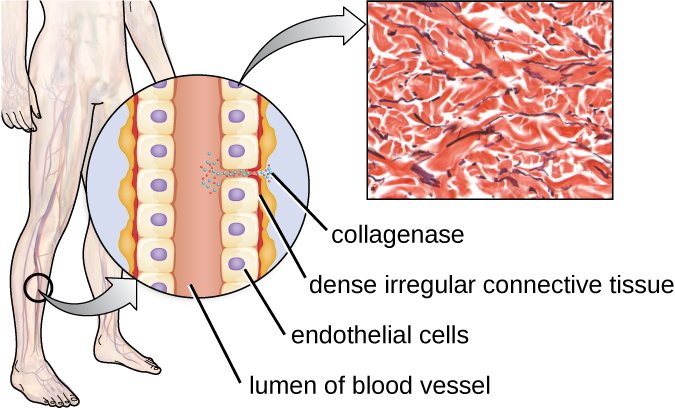
Um exemplo de protease que contém um íon metálico é a exoenzima colagenase. A colagenase digere o colágeno, a proteína dominante no tecido conjuntivo. O colágeno pode ser encontrado na matriz extracelular, especialmente perto das membranas mucosas, vasos sanguíneos, nervos e nas camadas da pele. Semelhante à hialuronidase, a colagenase permite que o patógeno penetre e se espalhe pelo tecido hospedeiro ao digerir essa proteína do tecido conjuntivo. A colagenase produzida pela bactéria gram-positiva Clostridium perfringens, por exemplo, permite que a bactéria atravesse as camadas teciduais e, posteriormente, entre e se multiplique no sangue (septicemia). C. perfringens então usa toxinas e uma fosfolipase para causar lise e necrose celular. Depois que as células hospedeiras morrem, a bactéria produz gás fermentando os carboidratos musculares. A necrose generalizada do tecido e o gás associado são característicos da condição conhecida como gangrena gasosa (Figura\(\PageIndex{3}\)).
Toxinas
Além das exoenzimas, certos patógenos são capazes de produzir toxinas, venenos biológicos que auxiliam em sua capacidade de invadir e causar danos aos tecidos. A capacidade de um patógeno de produzir toxinas para causar danos às células hospedeiras é chamada de toxigenicidade.
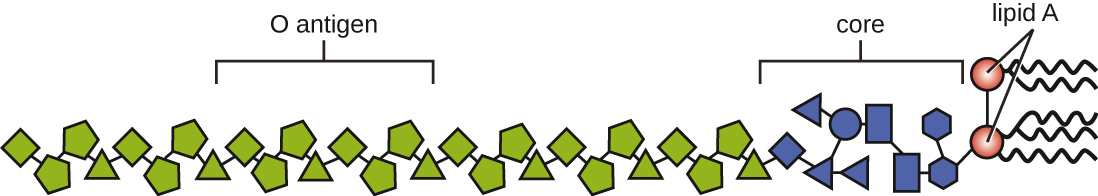
As toxinas podem ser categorizadas como endotoxinas ou exotoxinas. O lipopolissacarídeo (LPS) encontrado na membrana externa das bactérias gram-negativas é chamado de endotoxina (Figura\(\PageIndex{4}\)). Durante a infecção e a doença, patógenos bacterianos gram-negativos liberam endotoxina quando a célula morre, resultando na desintegração da membrana, ou quando a bactéria sofre fissão binária. O componente lipídico da endotoxina, o lipídio A, é responsável pelas propriedades tóxicas da molécula de LPS. O lipídio A é relativamente conservado em diferentes gêneros de bactérias gram-negativas; portanto, as propriedades tóxicas do lipídio A são semelhantes, independentemente do patógeno gram-negativo. De forma semelhante à do fator de necrose tumoral, o lipídio A desencadeia a resposta inflamatória do sistema imunológico (ver Inflamação e Febre). Se a concentração de endotoxina no corpo for baixa, a resposta inflamatória pode fornecer ao hospedeiro uma defesa eficaz contra infecções; por outro lado, altas concentrações de endotoxina no sangue podem causar uma resposta inflamatória excessiva, levando a uma queda severa na pressão arterial, multiórgão fracasso e morte.
Um método clássico de detecção de endotoxina é usar o teste de lisado de amebócito Limulus (LAL). Nesse procedimento, as células sanguíneas (amebócitos) do caranguejo-ferradura (Limulus polyphemus) são misturadas ao soro do paciente. Os amebócitos reagirão à presença de qualquer endotoxina. Essa reação pode ser observada cromogenicamente (cor) ou procurando a coagulação (reação de coagulação) que ocorre dentro do soro. Um método alternativo que tem sido usado é um ensaio de imunoabsorção enzimática (ELISA) que usa anticorpos para detectar a presença de endotoxina.
Ao contrário do lipídio tóxico A da endotoxina, as exotoxinas são moléculas proteicas produzidas por uma grande variedade de bactérias patogênicas vivas. Embora alguns patógenos gram-negativos produzam exotoxinas, a maioria é produzida por patógenos gram-positivos. As exotoxinas diferem da endotoxina em várias outras características-chave, resumidas na Tabela\(\PageIndex{3}\). Em contraste com a endotoxina, que estimula uma resposta inflamatória sistêmica geral quando liberada, as exotoxinas são muito mais específicas em sua ação e nas células com as quais interagem. Cada exotoxina tem como alvo receptores específicos em células específicas e danifica essas células por meio de mecanismos moleculares exclusivos. A endotoxina permanece estável em altas temperaturas e requer aquecimento a 121 °C (250 °F) por 45 minutos para ser inativada. Por outro lado, a maioria das exotoxinas são termicamente láveis devido à sua estrutura proteica, e muitas são desnaturadas (inativadas) em temperaturas acima de 41° C (106° F). Conforme discutido anteriormente, a endotoxina pode estimular uma resposta inflamatória letal em concentrações muito altas e tem uma medida de LD 50 de 0,24 mg/kg. Por outro lado, concentrações muito pequenas de exotoxinas podem ser letais. Por exemplo, a toxina botulínica, que causa botulismo, tem um LD 50 de 0,000001 mg/kg (240.000 vezes mais letal que a endotoxina).
| Característica | Endotoxina | Exotoxina |
|---|---|---|
| Fonte | Bactérias gram-negativas | Bactérias gram-positivas (principalmente) e gram-negativas |
| Composição | Lipídio Um componente do lipopolissacarídeo | Proteína |
| Efeito no hospedeiro | Sintomas sistêmicos gerais de inflamação e febre | Danos específicos às células dependentes do direcionamento das células mediado pelo receptor e de mecanismos de ação específicos |
| Estabilidade térmica | Estável ao calor | A maioria é termo-lábil, mas algumas são estáveis ao calor |
| LED 50 | Alto | Baixo |
As exotoxinas podem ser agrupadas em três categorias com base em seu alvo: direcionamento intracelular, ruptura de membrana e superantígenos. \(\PageIndex{4}\)A tabela fornece exemplos de toxinas bem caracterizadas em cada uma dessas três categorias.
| Categoria | Exemplo | Patógeno | Mecanismo e doença |
|---|---|---|---|
| Toxinas de direcionamento intracelular | Toxina da cólera | Vibrio cholerae | Ativação da adenilato ciclase nas células intestinais, causando aumento dos níveis de monofosfato de adenosina cíclico (cAMP) e secreção de fluidos e eletrólitos para fora da célula, causando diarreia |
| Toxina tetânica | Clostridium teta em | Inibe a liberação de neurotransmissores inibitórios no sistema nervoso central, causando paralisia espástica | |
| Toxina botulínica | Clostridium botulinum | Inibe a liberação do neurotransmissor acetilcolina dos neurônios, resultando em paralisia flácida | |
| Toxina diftérica | Corynebacterium diphtheriae | Inibição da síntese protéica, causando morte celular | |
| Toxinas que destroem a membrana | Estreptolisina | Streptococcus pyogenes | Proteínas que se acumulam nos poros das membranas celulares, interrompendo sua função e matando a célula |
| Pneumolisina | Streptococcus pneumoniae | ||
| Alfa-toxina | Staphylococcus aureus | ||
| Alfa-toxina | Clostridium perfringens | Fosfolipases que degradam os fosfolipídios da membrana celular, interrompendo a função da membrana e matando a célula | |
| Fosfolipase C | Pseudomonas aeruginosa | ||
| Beta-toxina | Staphylococcus aureus | ||
| Superantígenos | Toxina da síndrome do choque tóxico | Staphylococcus aureus | Estimula a ativação excessiva das células do sistema imunológico e a liberação de citocinas (mediadores químicos) das células do sistema imunológico. Febre, inflamação e choque potencialmente fatais são o resultado. |
| Exotoxina mitogênica estreptocócica | Streptococcus pyogenes | ||
| Toxinas pirogênicas estreptocócicas | Streptococcus pyogenes |
As toxinas direcionadas intracelulares compreendem dois componentes: A para atividade e B para ligação. Assim, esses tipos de toxinas são conhecidos como exotoxinas A-B (Figura\(\PageIndex{5}\)). O componente B é responsável pela especificidade celular da toxina e medeia a ligação inicial da toxina a receptores específicos da superfície celular. Uma vez que a toxina A-B se liga à célula hospedeira, ela é trazida para a célula por endocitose e aprisionada em um vacúolo. As subunidades A e B se separam à medida que o vacúolo acidifica. A subunidade A então entra no citoplasma celular e interfere na função celular interna específica que ela tem como alvo.
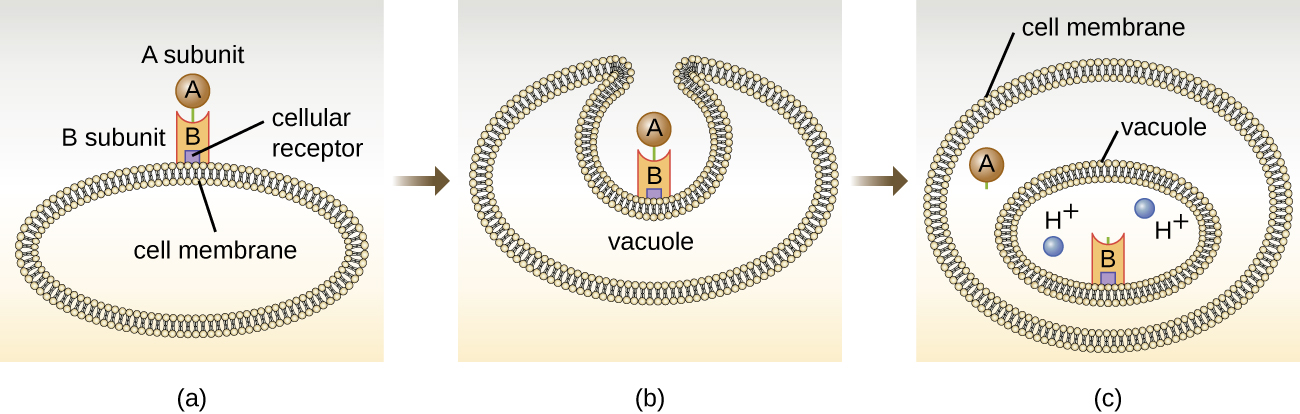
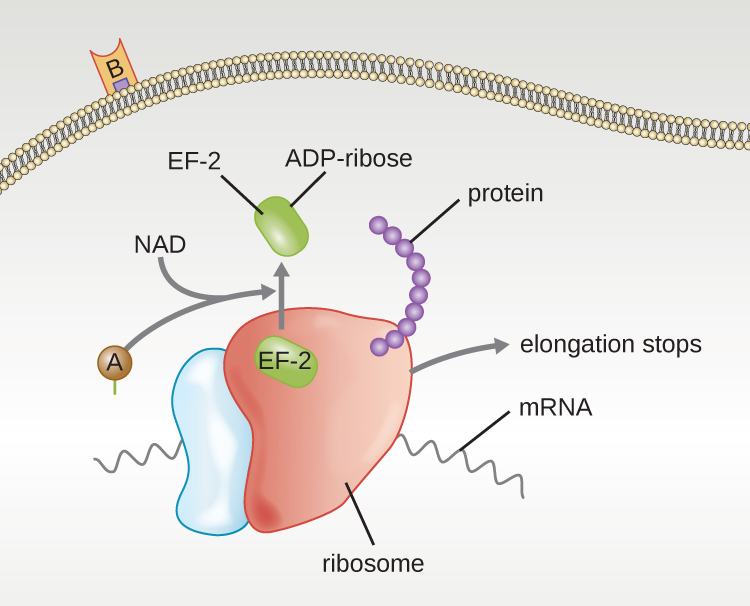
Quatro exemplos exclusivos de toxinas A-B são as toxinas da difteria, cólera, botulina e tétano. A toxina diftérica é produzida pela bactéria gram-positiva Corynebacterium diphtheriae, agente causador da difteria nasofaríngea e cutânea. Depois que a subunidade A da toxina diftérica se separa e obtém acesso ao citoplasma, ela facilita a transferência da adenosina difosfato (ADP) -ribose para uma proteína de fator de alongamento (EF-2) que é necessária para a síntese protéica. Portanto, a toxina da difteria inibe a síntese de proteínas na célula hospedeira, acabando por matar a célula (Figura\(\PageIndex{6}\)).
A toxina da cólera é uma enterotoxina produzida pela bactéria gram-negativa Vibrio cholerae e é composta por uma subunidade A e cinco subunidades B. O mecanismo de ação da toxina da cólera é complexo. As subunidades B se ligam aos receptores na célula epitelial intestinal do intestino delgado. Depois de entrar no citoplasma da célula epitelial, a subunidade A ativa uma proteína G intracelular. A proteína G ativada, por sua vez, leva à ativação da enzima adenilciclase, que começa a produzir um aumento na concentração da AMP cíclica (uma molécula mensageira secundária). O aumento do cAMP interrompe a fisiologia normal das células epiteliais intestinais e faz com que elas secretem quantidades excessivas de líquido e eletrólitos no lúmen do trato intestinal, resultando em diarreia grave por “fezes de água de arroz”, característica da cólera.
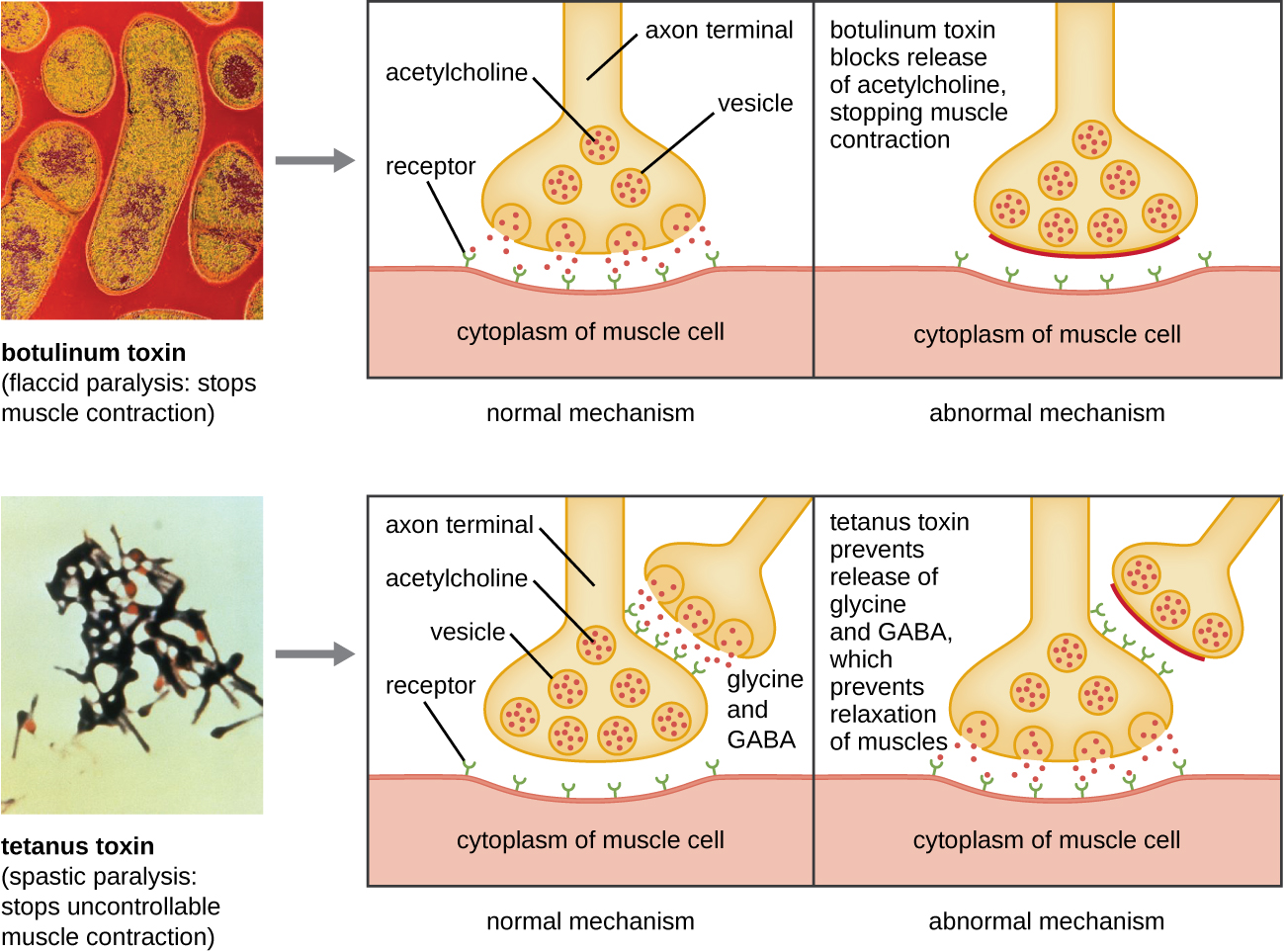
A toxina botulínica (também conhecida como botox) é uma neurotoxina produzida pela bactéria gram-positiva Clostridium botulinum. É a substância mais tóxica conhecida até hoje. A toxina é composta por uma subunidade A leve e uma subunidade de cadeia B de proteína pesada. A subunidade B se liga aos neurônios para permitir que a toxina botulínica entre nos neurônios na junção neuromuscular. A subunidade A atua como uma protease, clivando proteínas envolvidas na liberação de acetilcolina pelo neurônio, uma molécula neurotransmissora. Normalmente, os neurônios liberam acetilcolina para induzir contrações das fibras musculares. A capacidade da toxina de bloquear a liberação de acetilcolina resulta na inibição das contrações musculares, levando ao relaxamento muscular. Isso tem o potencial de parar de respirar e causar a morte. Por causa de sua ação, baixas concentrações de botox são usadas para procedimentos cosméticos e médicos, incluindo a remoção de rugas e o tratamento da bexiga hiperativa.
Outra neurotoxina é a toxina tetânica, produzida pela bactéria gram-positiva Clostridium tetani. Essa toxina também tem uma subunidade A leve e uma subunidade de cadeia B de proteína pesada. Ao contrário da toxina botulínica, a toxina tetânica se liga aos interneurônios inibitórios, responsáveis pela liberação dos neurotransmissores inibitórios glicina e ácido gama-aminobutírico (GABA). Normalmente, esses neurotransmissores se ligam aos neurônios na junção neuromuscular, resultando na inibição da liberação de acetilcolina. A toxina tetânica inibe a liberação de glicina e GABA do interneurônio, resultando em contração muscular permanente. O primeiro sintoma é tipicamente a rigidez da mandíbula (mandíbula). Surgem espasmos musculares violentos em outras partes do corpo, normalmente culminando com insuficiência respiratória e morte. A figura\(\PageIndex{7}\) mostra as ações das toxinas botulínica e tetânica.
As toxinas que interrompem a membrana afetam a função da membrana celular formando poros ou interrompendo a bicamada fosfolipídica nas membranas celulares hospedeiras. Dois tipos de exotoxinas que destroem a membrana são as hemolisinas e as leucocidinas, que formam poros nas membranas celulares, causando vazamento do conteúdo citoplasmático e lise celular. Originalmente, pensava-se que essas toxinas tinham como alvo os glóbulos vermelhos (eritrócitos) e os glóbulos brancos (leucócitos), respectivamente, mas agora sabemos que elas também podem afetar outras células. A bactéria gram-positiva Streptococcus pyogenes produz estreptolisinas, hemolisinas solúveis em água que se ligam às porções de colesterol na membrana celular hospedeira para formar um poro. Os dois tipos de estreptolisinas, O e S, são categorizados por sua capacidade de causar hemólise nos eritrócitos na ausência ou presença de oxigênio. A estreptolisina O não é ativa na presença de oxigênio, enquanto a estreptolisina S é ativa na presença de oxigênio. Outras importantes toxinas destruidoras da membrana formadoras de poros incluem a toxina alfa do Staphylococcus aureus e a pneumolisina do Streptococcus pneumoniae.
As fosfolipases bacterianas são toxinas destruidoras da membrana que degradam a bicamada fosfolipídica das membranas celulares em vez de formar poros. Já discutimos as fosfolipases associadas às espécies de B. anthracis, L. pneumophila e Rickettsia que permitem que essas bactérias efetuem a lise dos fagossomos. Essas mesmas fosfolipases também são hemolisinas. Outras fosfolipases que funcionam como hemolisinas incluem a toxina alfa de Clostridium perfringens, a fosfolipase C de P. aeruginosa e a toxina beta de Staphylococcus aureus.
Algumas cepas de S. aureus também produzem uma leucocidina chamada leucocidina Panton-Valentine (PVL). O PVL consiste em duas subunidades, S e F. O componente S age como a subunidade B de uma exotoxina A-B na medida em que se liga aos glicolipídios na membrana plasmática externa das células animais. O componente F age como a subunidade A de uma exotoxina A-B e carrega a atividade enzimática. A toxina se insere e se reúne em um poro na membrana. Genes que codificam PVL estão mais frequentemente presentes em cepas de S. aureus que causam infecções cutâneas e pneumonia. 1 A PVL promove infecções cutâneas causando edema, eritema (vermelhidão da pele devido à dilatação dos vasos sanguíneos) e necrose da pele. Também foi demonstrado que a LPV causa pneumonia necrosante. A PVL promove efeitos pró-inflamatórios e citotóxicos nos leucócitos alveolares. Isso resulta na liberação de enzimas dos leucócitos, que, por sua vez, causam danos ao tecido pulmonar.
A terceira classe de exotoxinas são os superantígenos. São exotoxinas que desencadeiam uma estimulação excessiva e inespecífica das células imunes para secretar citocinas (mensageiros químicos). A produção excessiva de citocinas, muitas vezes chamada de tempestade de citocinas, provoca uma forte resposta imune e inflamatória que pode causar febre alta, pressão arterial baixa, falência de múltiplos órgãos, choque e morte com risco de vida. O protótipo do superantígeno é a toxina da síndrome do choque tóxico de S. aureus. A maioria dos casos de síndrome do choque tóxico está associada à colonização vaginal por S. aureus produtor de toxinas em mulheres menstruadas; no entanto, a colonização de outros locais do corpo também pode ocorrer. Algumas cepas de Streptococcus pyogenes também produzem superantígenos; eles são chamados de exotoxinas mitogênicas estreptocócicas e toxinas pirogênicas estreptocócicas.
Exercício\(\PageIndex{2}\)
- Descreva como as exoenzimas contribuem para a invasão bacteriana.
- Explique a diferença entre exotoxinas e endotoxinas.
- Nomeie as três classes de exotoxinas.
Fatores de virulência para sobrevivência no hospedeiro e evasão imune
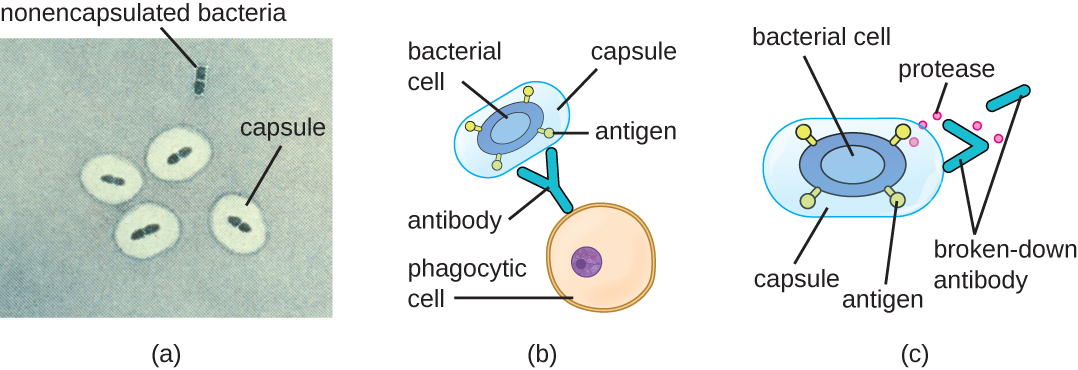
Evitar o sistema imunológico também é importante para a invasividade. As bactérias usam uma variedade de fatores de virulência para evitar a fagocitose pelas células do sistema imunológico. Por exemplo, muitas bactérias produzem cápsulas, que são usadas na adesão, mas também ajudam na evasão imune, impedindo a ingestão por fagócitos. A composição da cápsula impede que as células imunes sejam capazes de aderir e depois fagocitar a célula. Além disso, a cápsula torna a célula bacteriana muito maior, dificultando a absorção do patógeno pelas células do sistema imunológico (Figura\(\PageIndex{8}\)). Uma bactéria produtora de cápsulas notável é o patógeno gram-positivo Streptococcus pneumoniae, que causa pneumonia pneumocócica, meningite, septicemia e outras infecções do trato respiratório. As cepas encapsuladas de S. pneumoniae são mais virulentas do que as não encapsuladas e têm maior probabilidade de invadir a corrente sanguínea e causar septicemia e meningite.
Alguns patógenos também podem produzir proteases para se protegerem contra a fagocitose. Conforme descrito em Defesas Adaptativas Específicas do Hospedeiro, o sistema imunológico humano produz anticorpos que se ligam às moléculas de superfície encontradas em bactérias específicas (por exemplo, cápsulas, fímbrias, flagelos, LPS). Essa ligação inicia a fagocitose e outros mecanismos de eliminação e eliminação de antibacterianos. As proteases combatem a morte e a eliminação mediadas por anticorpos atacando e digerindo as moléculas de anticorpos (Figura\(\PageIndex{8}\)).
Além das cápsulas e proteases, alguns patógenos bacterianos produzem outros fatores de virulência que lhes permitem escapar do sistema imunológico. As fímbrias de certas espécies de Streptococcus contêm proteína M, que altera a superfície do Streptococcus e inibe a fagocitose ao bloquear a ligação das moléculas do complemento que auxiliam os fagócitos na ingestão de patógenos bacterianos. A bactéria resistente ao ácido Mycobacterium tuberculosis (o agente causador da tuberculose) produz uma substância cerosa conhecida como ácido micólico em seu envelope celular. Quando é engolida por fagócitos no pulmão, a camada protetora de ácido micólico permite que a bactéria resista a alguns dos mecanismos de morte dentro do fagolisossomo.
Algumas bactérias produzem fatores de virulência que promovem a infecção explorando moléculas produzidas naturalmente pelo hospedeiro. Por exemplo, a maioria das cepas de Staphylococcus aureus produz a exoenzima coagulase, que explora o mecanismo natural da coagulação do sangue para evitar o sistema imunológico. Normalmente, a coagulação sanguínea é desencadeada em resposta a danos nos vasos sanguíneos; as plaquetas começam a obstruir o coágulo e ocorre uma cascata de reações nas quais o fibrinogênio, uma proteína solúvel produzida pelo fígado, é clivado em fibrina. A fibrina é uma proteína insolúvel semelhante a um fio que se liga às plaquetas sanguíneas, se reticula e se contrai para formar uma malha de plaquetas agrupadas e glóbulos vermelhos. O coágulo resultante evita uma maior perda de sangue dos vasos sanguíneos danificados. No entanto, se as bactérias liberarem coagulase na corrente sanguínea, a cascata de fibrinogênio em fibrina é acionada na ausência de danos nos vasos sanguíneos. O coágulo resultante reveste a bactéria com fibrina, protegendo-a da exposição às células imunes fagocíticas que circulam na corrente sanguínea.
Enquanto a coagulase causa a coagulação do sangue, as quinases têm o efeito oposto ao desencadear a conversão do plasminogênio em plasmina, que está envolvida na digestão dos coágulos de fibrina. Ao digerir um coágulo, as quinases permitem que os patógenos presos no coágulo escapem e se espalhem, da mesma forma que a colagenase, a hialuronidase e a DNase facilitam a propagação da infecção. Exemplos de quinases incluem estafilocinases e estreptoquinases, produzidas por Staphylococcus aureus e Streptococcus pyogenes, respectivamente. É intrigante que o S. aureus possa produzir tanto coagulase para promover a coagulação quanto a estafilocinase para estimular a digestão dos coágulos. A ação da coagulase fornece uma importante barreira protetora do sistema imunológico, mas quando os suprimentos de nutrientes são diminuídos ou outras condições sinalizam a necessidade de o patógeno escapar e se espalhar, a produção de estafilocinase pode iniciar esse processo.
Um mecanismo final que os patógenos podem usar para se proteger contra o sistema imunológico é chamado de variação antigênica, que é a alteração das proteínas de superfície para que um patógeno não seja mais reconhecido pelo sistema imunológico do hospedeiro. Por exemplo, a bactéria Borrelia burgdorferi, o agente causador da doença de Lyme, contém uma lipoproteína de superfície conhecida como VlSe. Por causa da recombinação genética durante a replicação e reparo do DNA, essa proteína bacteriana sofre variação antigênica. Cada vez que ocorre febre, a proteína VlSe em B. burgdorferi pode diferir tanto que os anticorpos contra sequências anteriores de VlSe não são eficazes. Acredita-se que essa variação no VLSe contribua para a capacidade de B. burgdorferi de causar doenças crônicas. Outro importante patógeno bacteriano humano que usa variação antigênica para evitar o sistema imunológico é a Neisseria gonorrhoeae, que causa a doença sexualmente transmissível gonorréia. Essa bactéria é bem conhecida por sua capacidade de sofrer variações antigênicas de seus pili tipo IV para evitar defesas imunológicas.
Exercício\(\PageIndex{3}\)
- Cite pelo menos duas maneiras pelas quais uma cápsula fornece proteção contra o sistema imunológico.
- Além das cápsulas, cite dois outros fatores de virulência usados pelas bactérias para escapar do sistema imunológico.
Foco clínico: Resolução
Com base nos sintomas relatados por Michael de rigidez no pescoço e hemiparesia, o médico suspeita que a infecção possa ter se espalhado para o sistema nervoso. O médico decide pedir uma punção lombar para procurar qualquer bactéria que possa ter invadido as meninges e o líquido cefalorraquidiano (LCR), que normalmente seriam estéreis. Para realizar a punção lombar, a região lombar de Michael é esfregada com um antisséptico de iodo e depois coberta com um lençol estéril. A agulha é removida assepticamente da embalagem plástica selada do fabricante pelas mãos enluvadas do médico. A agulha é inserida e um pequeno volume de fluido é puxado para um tubo de amostra acoplado. O tubo é removido, tampado e uma etiqueta preparada com os dados de Michael é afixada nele. Esta amostra STAT (análise urgente ou imediata necessária) é dividida em três tubos estéreis separados, cada um com 1 mL de CSF. Esses tubos são imediatamente levados ao laboratório do hospital, onde são analisados nos departamentos de química clínica, hematologia e microbiologia. Os resultados preliminares dos três departamentos indicam que há uma infecção cefalorraquidiana ocorrendo, com o departamento de microbiologia relatando a presença de um bastonete gram-positivo no líquido cefalorraquidiano de Michael.
Esses resultados confirmam o que seu médico suspeitava: os novos sintomas de Michael são o resultado da meningite, inflamação aguda das membranas que protegem o cérebro e a medula espinhal. Como a meningite pode ser fatal e porque a primeira antibioticoterapia não foi eficaz na prevenção da propagação da infecção, Michael recebe um tratamento agressivo de dois antibióticos, ampicilina e gentamicina, a serem administrados por via intravenosa. Michael permanece no hospital por vários dias para cuidados de apoio e observação. Depois de uma semana, ele pode voltar para casa para descansar na cama e antibióticos orais. Após 3 semanas desse tratamento, ele se recupera completamente.
Virulência viral
Embora os patógenos virais não sejam semelhantes aos patógenos bacterianos em termos de estrutura, algumas das propriedades que contribuem para sua virulência são semelhantes. Os vírus usam adesinas para facilitar a adesão às células hospedeiras, e certos vírus envelopados dependem da variação antigênica para evitar as defesas imunológicas do hospedeiro. Esses fatores de virulência são discutidos com mais detalhes nas seções a seguir.
Adesões virais
Um dos primeiros passos em qualquer infecção viral é a adesão do vírus a receptores específicos na superfície das células. Esse processo é mediado por adesinas que fazem parte do capsídeo viral ou do envelope da membrana. A interação das adesinas virais com receptores celulares específicos define o tropismo (direcionamento preferencial) dos vírus para células, tecidos e órgãos específicos do corpo. A proteína spike hemaglutinina encontrada no Influenzavirus é um exemplo de adesina viral; ela permite que o vírus se ligue ao ácido siálico na membrana das células respiratórias e intestinais do hospedeiro. Outra adesina viral é a glicoproteína gp20, encontrada no HIV. Para que o HIV infecte as células do sistema imunológico, ele deve interagir com dois receptores na superfície das células. A primeira interação envolve a ligação entre o gp120 e o marcador celular CD4 encontrado em algumas células essenciais do sistema imunológico. No entanto, antes que a entrada viral na célula possa ocorrer, uma segunda interação entre o gp120 e um dos dois receptores de quimiocina (CCR5 e CXCR4) deve ocorrer. A tabela\(\PageIndex{5}\) lista as adesinas de alguns patógenos virais comuns e os locais específicos aos quais essas adesinas permitem que os vírus se fixem.
| Patógeno | Doença | Adesão | Site de anexos |
|---|---|---|---|
| Vírus da gripe | Gripe | Hemaglutinina | Ácido siálico das células respiratórias e intestinais |
| Vírus Herpes simplex I ou II | Herpes oral, herpes genital | Glicoproteínas gB, gC, gD | Sulfato de heparano nas superfícies mucosas da boca e órgãos genitais |
| Vírus da imunodeficiência humana | HIV/AIDS | Glicoproteína gp120 | CD4 e CCR5 ou CXCR4 das células do sistema imunológico |
Variação antigênica em vírus
A variação antigênica também ocorre em certos tipos de vírus envelopados, incluindo vírus influenza, que exibem duas formas de variação antigênica: deriva antigênica e mudança antigênica (Figura\(\PageIndex{9}\)). A deriva antigênica é o resultado de mutações pontuais que causam pequenas alterações nas proteínas de pico hemaglutinina (H) e neuraminidase (N). Por outro lado, a mudança antigênica é uma grande mudança nas proteínas de pico devido ao rearranjo de genes. Esse rearranjo para mudança antigênica ocorre normalmente quando dois vírus influenza diferentes infectam o mesmo hospedeiro.
A taxa de variação antigênica nos vírus da gripe é muito alta, tornando difícil para o sistema imunológico reconhecer as diferentes cepas do Influenzavirus. Embora o corpo possa desenvolver imunidade a uma cepa por meio de exposição natural ou vacinação, a variação antigênica resulta no surgimento contínuo de novas cepas que o sistema imunológico não reconhecerá. Esse é o principal motivo pelo qual as vacinas contra o vírus da gripe devem ser administradas anualmente. A vacina contra influenza de cada ano oferece proteção contra as cepas mais prevalentes nesse ano, mas cepas novas ou diferentes podem ser mais prevalentes no ano seguinte.
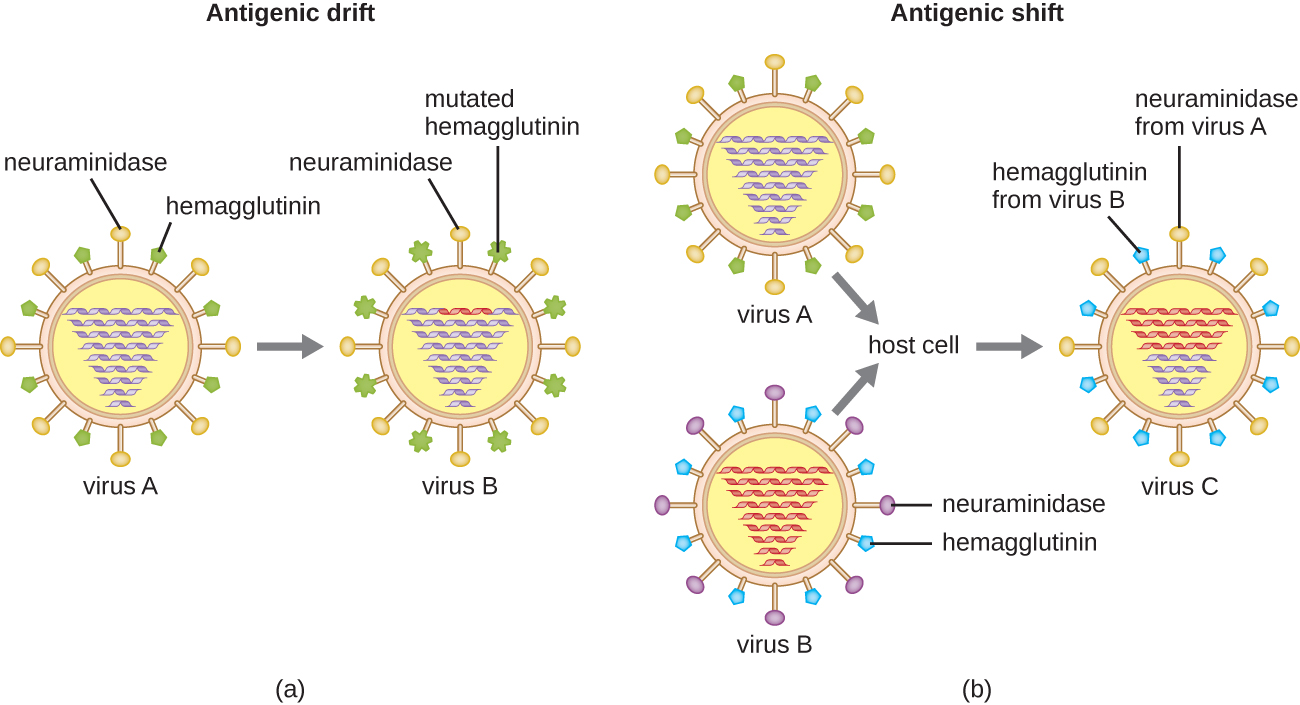
Para mais uma explicação de como a mudança e a deriva antigênica ocorrem, assista a este vídeo.
Exercício\(\PageIndex{4}\)
- Descreva o papel das adesinas no tropismo viral.
- Explique a diferença entre deriva antigênica e mudança antigênica.
Conceitos principais e resumo
Os fatores de virulência contribuem para a capacidade do patógeno de causar doenças. Exoenzimas e toxinas permitem que os patógenos invadam o tecido hospedeiro e causem danos aos tecidos. As exoenzimas são classificadas de acordo com a macromolécula alvo e as exotoxinas são classificadas com base em seu mecanismo de ação. As toxinas bacterianas incluem endotoxinas e exotoxinas. A endotoxina é o componente lipídico A do LPS do envelope celular gram-negativo. As exotoxinas são proteínas secretadas principalmente por bactérias gram-positivas, mas também são secretadas por bactérias gram-negativas. Os patógenos bacterianos podem evitar a resposta imune do hospedeiro produzindo cápsulas para evitar a fagocitose, sobrevivendo ao ambiente intracelular dos fagócitos, degradando anticorpos ou por meio de variação antigênica. Os patógenos virais usam adesinas para iniciar infecções e variações antigênicas para evitar defesas imunológicas. Os vírus da gripe usam tanto a deriva antigênica quanto a mudança antigênica para evitar serem reconhecidos pelo sistema imunológico.
Notas de pé
- 1 V. Meka. “Leucocidina Panton-Valentine”. http://www.antimicrobe.org/h04c.file...L-S-aureus.asp


