13.4: Testando a eficácia de antissépticos e desinfetantes
- Page ID
- 181144
Objetivos de
- Descreva por que o coeficiente de fenol é usado
- Compare e contraste os métodos de difusão em disco, diluição por uso e em uso para testar a eficácia de antissépticos, desinfetantes e esterilizantes
A eficácia de vários desinfetantes químicos se reflete nos termos usados para descrevê-los. Os desinfetantes químicos são agrupados pelo poder de sua atividade, com cada categoria refletindo os tipos de micróbios e vírus contra os quais seus componentes desinfetantes são eficazes. Germicidas de alto nível têm a capacidade de matar células vegetativas, fungos, vírus e endosporos, levando à esterilização, com uso prolongado. Germicidas de nível intermediário, como o próprio nome sugere, são menos eficazes contra endosporos e certos vírus, e germicidas de baixo nível matam apenas células vegetativas e certos vírus envelopados e são ineficazes contra endosporos.
No entanto, várias condições ambientais influenciam a potência de um agente antimicrobiano e sua eficácia. Por exemplo, a duração da exposição é particularmente importante, com uma exposição mais longa aumentando a eficácia. Da mesma forma, a concentração do agente químico também é importante, com concentrações mais altas sendo mais eficazes do que as mais baixas. Temperatura, pH e outros fatores também podem afetar a potência de um agente desinfetante.
Um método para determinar a eficácia de um agente químico inclui esfregar as superfícies antes e depois do uso para confirmar se um campo estéril foi mantido durante o uso. Testes adicionais são descritos nas seções a seguir. Esses testes permitem a manutenção de protocolos de desinfecção apropriados em ambientes clínicos, controlando o crescimento microbiano para proteger pacientes, profissionais de saúde e a comunidade.
Coeficiente de fenol
A eficácia de um desinfetante ou antisséptico pode ser determinada de várias maneiras. Historicamente, a eficácia de um agente químico era frequentemente comparada com a do fenol, o primeiro agente químico usado por Joseph Lister. Em 1903, os químicos britânicos Samuel Ridal (1863-1929) e J. T. Ainslie Walker (1868-1930) estabeleceram um protocolo para comparar a eficácia de uma variedade de produtos químicos com a do fenol, usando como organismos de teste Staphylococcus aureus (uma bactéria gram-positiva) e Salmonella enterica serovar Typhi (uma bactéria gram-negativa). Eles expuseram as bactérias de teste às soluções químicas antimicrobianas diluídas em água por 7,5 minutos. Eles então calcularam um coeficiente de fenol para cada produto químico para cada uma das duas bactérias testadas. Um coeficiente de fenol de 1,0 significa que o agente químico tem aproximadamente o mesmo nível de eficácia que o fenol. Um agente químico com um coeficiente de fenol inferior a 1,0 é menos eficaz que o fenol. Um exemplo é a formalina, com coeficientes de fenol de 0,3 (S. aureus) e 0,7 (S. enterica serovar Typhi). Um agente químico com coeficiente de fenol maior que 1,0 é mais eficaz que o fenol, como a cloramina, com coeficientes de fenol de 133 e 100, respectivamente. Embora o coeficiente de fenol já tenha sido uma medida útil de eficácia, ele não é mais comumente usado porque as condições e os organismos usados foram escolhidos arbitrariamente.
Exercício\(\PageIndex{1}\)
Quais são as diferenças entre os três níveis de eficácia do desinfetante?
Método de difusão de disco
O método de difusão em disco envolve a aplicação de diferentes produtos químicos em discos de papel de filtro estéreis separados (Figura\(\PageIndex{1}\)). Os discos são então colocados em uma placa de ágar que foi inoculada com a bactéria-alvo e os produtos químicos se difundem dos discos para o ágar, onde a bactéria foi inoculada. À medida que o “gramado” das bactérias cresce, as zonas de inibição do crescimento microbiano são observadas como áreas claras ao redor dos discos. Embora existam outros fatores que contribuam para o tamanho das zonas de inibição (por exemplo, se o agente é solúvel em água e capaz de se difundir no ágar), zonas maiores normalmente se correlacionam com o aumento da eficácia de inibição do agente químico. O diâmetro em cada zona é medido em milímetros.
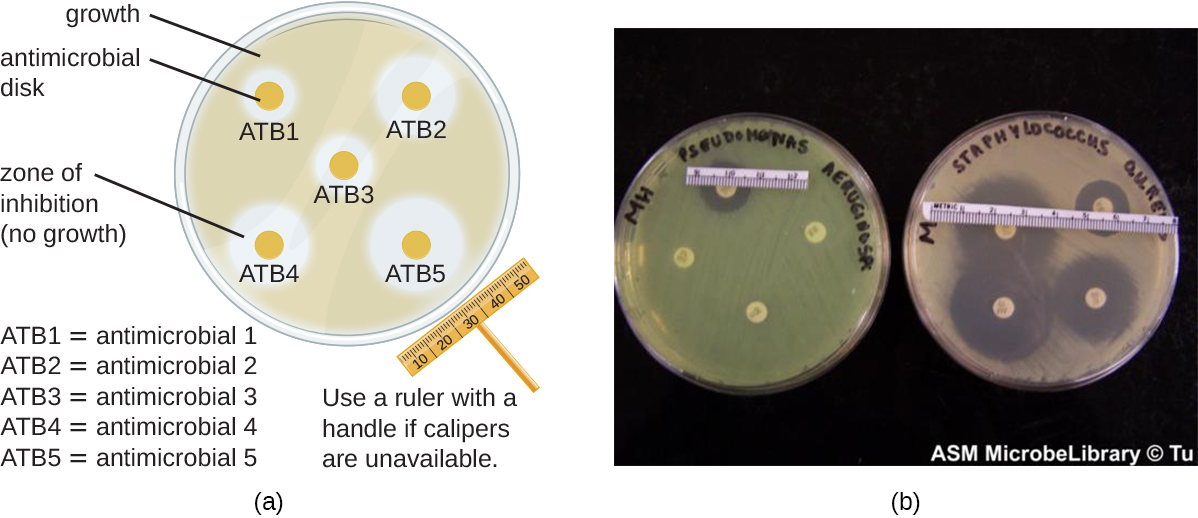
Exercício\(\PageIndex{2}\)
Ao comparar as atividades de dois desinfetantes com o mesmo micróbio, usando o ensaio de difusão em disco, e assumindo que ambos são solúveis em água e podem se difundir facilmente no ágar, um desinfetante mais eficaz teria uma zona de inibição maior ou menor?
Teste de Uso-Diluição
Outros métodos também são usados para medir a eficácia de um agente químico em ambientes clínicos. O teste de uso-diluição é comumente usado para determinar a eficácia da desinfecção de um produto químico em uma superfície inanimada. Para este teste, um cilindro de aço inoxidável é mergulhado em uma cultura do microrganismo alvo e depois seco. O cilindro é então mergulhado em soluções de desinfetante em várias concentrações por um período de tempo especificado. Finalmente, o cilindro é transferido para um novo tubo de ensaio contendo meio estéril fresco que não contém desinfetante, e esse tubo de ensaio é incubado. A sobrevivência bacteriana é demonstrada pela presença de turbidez no meio, enquanto a morte do organismo alvo no cilindro pelo desinfetante não produzirá turbidez.
A Association of Official Agricultural Chemists International (AOAC), um grupo sem fins lucrativos que estabelece muitos padrões de protocolo, determinou que um mínimo de 59 das 60 réplicas não devem mostrar crescimento em tal teste para obter um resultado aprovado, e os resultados devem ser repetíveis em diferentes lotes de desinfetante e quando realizado em dias diferentes. Os fabricantes de desinfetantes realizam testes de diluição de uso para validar as alegações de eficácia de seus produtos, conforme designado pela EPA.
Exercício\(\PageIndex{3}\)
O teste de uso-diluição é realizado em um ambiente clínico? Por quê?
Teste em uso
Um teste em uso pode determinar se uma solução de desinfetante usada ativamente em um ambiente clínico está contaminada microbiamente (Figura\(\PageIndex{2}\)). Uma amostra de 1 mL do desinfetante usado é diluída em 9 mL de meio de caldo estéril que também contém um composto para inativar o desinfetante. Dez gotas, totalizando aproximadamente 0,2 mL dessa mistura, são então inoculadas em cada uma das duas placas de ágar. Uma placa é incubada a 37 °C por 3 dias e a outra é incubada à temperatura ambiente por 7 dias. As placas são monitoradas quanto ao crescimento de colônias microbianas. O crescimento de cinco ou mais colônias em qualquer placa sugere que células microbianas viáveis existiam na solução desinfetante e que ela está contaminada. Esses testes em uso monitoram a eficácia dos desinfetantes no ambiente clínico.
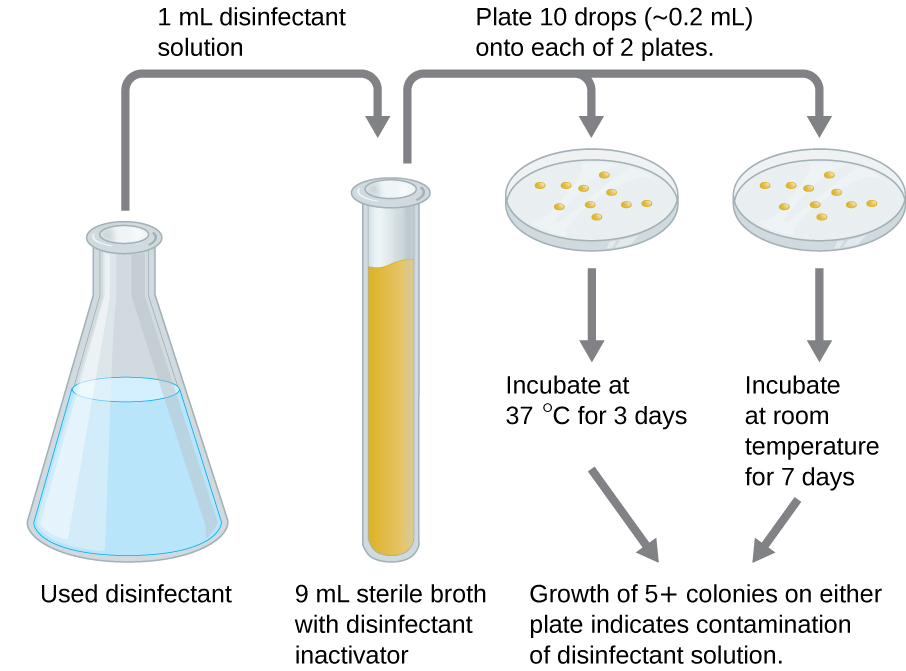
Exercício\(\PageIndex{4}\)
O que indica um teste positivo em uso?
Foco clínico: Resolução
Apesar do tratamento com antibióticos, os sintomas de Roberta pioraram. Ela desenvolveu pielonefrite, uma infecção renal grave, e foi rehospitalizada na unidade de terapia intensiva (UTI). Sua condição continuou a piorar e ela desenvolveu sintomas de choque séptico. Nesse ponto, seu médico solicitou uma cultura de sua urina para determinar a causa exata de sua infecção, bem como um teste de sensibilidade a medicamentos para determinar quais antibióticos seriam eficazes contra a bactéria causadora. Os resultados desse teste indicaram resistência a uma ampla gama de antibióticos, incluindo os carbapenêmicos, uma classe de antibióticos usada como último recurso para muitos tipos de infecções bacterianas. Esse foi um resultado alarmante, sugerindo que a infecção de Roberta foi causada pela chamada superbactéria: uma cepa bacteriana que desenvolveu resistência à maioria dos antibióticos comumente usados. Nesse caso, o agente causador pertencia às Enterobacteriaceae resistentes aos carbapenêmicos (CRE), uma família de bactérias resistentes a medicamentos normalmente encontrada no sistema digestivo (Figura\(\PageIndex{3}\)). Quando o CRE é introduzido em outros sistemas corporais, como pode ocorrer por meio de instrumentos cirúrgicos, cateteres ou endoscópios mal limpos, infecções agressivas podem ocorrer.
As infecções por CRE são notoriamente difíceis de tratar, com uma taxa de mortalidade de 40% a 50%. Para tratar sua infecção renal e choque séptico, Roberta foi tratada com diálise, fluidos intravenosos e medicamentos para manter a pressão arterial e evitar a coagulação sanguínea. Ela também iniciou um tratamento agressivo com a administração intravenosa de um novo medicamento chamado tigeciclina, que tem tido sucesso no tratamento de infecções causadas por bactérias resistentes a medicamentos.
Depois de várias semanas na UTI, Roberta se recuperou de sua infecção por CRE. No entanto, as autoridades de saúde pública logo perceberam que o caso de Roberta não foi isolado. Vários pacientes que foram submetidos a procedimentos semelhantes no mesmo hospital também desenvolveram infecções por CRE, alguns morrendo como resultado. Em última análise, a origem da infecção foi atribuída aos duodenoscópios usados nos procedimentos. Apesar de a equipe do hospital seguir meticulosamente os protocolos de desinfecção do fabricante, bactérias, incluindo CRE, permaneceram dentro dos instrumentos e foram apresentadas aos pacientes durante os procedimentos.
Quem é responsável?
Infecções por Enterobacteriaceae resistentes a carbapenêmicos causadas por endoscópios contaminados se tornaram um problema de alto perfil nos últimos anos. Vários surtos de CRE foram atribuídos a endoscópios, incluindo um caso no Ronald Reagan UCLA Medical Center no início de 2015, no qual 179 pacientes podem ter sido expostos a um endoscópio contaminado. Sete dos pacientes desenvolveram infecções e dois morreram mais tarde. Várias ações judiciais foram movidas contra a Olympus, fabricante dos endoscópios. Alguns afirmam que a Olympus não obteve a aprovação do FDA para mudanças no projeto que podem ter levado à contaminação, e outros afirmam que o fabricante ocultou intencionalmente informações dos hospitais sobre defeitos nos endoscópios.
Ações judiciais como essas levantam questões difíceis de responder sobre responsabilidade. Procedimentos invasivos são inerentemente arriscados, mas os resultados negativos podem ser minimizados pela adesão estrita aos protocolos estabelecidos. Quem é responsável, no entanto, quando os resultados negativos ocorrem devido a protocolos defeituosos ou equipamentos defeituosos? Hospitais ou profissionais de saúde podem ser responsabilizados se tiverem seguido rigorosamente um procedimento defeituoso? Os fabricantes devem ser responsabilizados — e talvez expulsos do mercado — se seus equipamentos salva-vidas falharem ou forem encontrados com defeito? Qual é o papel do governo em garantir que o uso e a manutenção de equipamentos e protocolos médicos sejam à prova de falhas?
Os protocolos para limpeza ou esterilização de equipamentos médicos geralmente são desenvolvidos por agências governamentais como o FDA e outros grupos, como a AOAC, uma organização científica sem fins lucrativos que estabelece muitos protocolos para uso padrão em todo o mundo. Esses procedimentos e protocolos são então adotados pelos fabricantes de dispositivos e equipamentos médicos. Em última análise, os usuários finais (hospitais e seus funcionários) são responsáveis por seguir esses procedimentos e podem ser responsabilizados se ocorrer uma violação e os pacientes adoecerem devido à limpeza inadequada do equipamento.
Infelizmente, os protocolos não são infalíveis e, às vezes, são necessários resultados negativos para revelar suas falhas. Em 2008, o FDA aprovou um protocolo de desinfecção para endoscópios, usando glutaraldeído (em menor concentração quando misturado com fenol), o-ftalaldeído, peróxido de hidrogênio, ácido peracético e uma mistura de peróxido de hidrogênio com ácido peracético. No entanto, surtos subsequentes de CRE devido ao uso de endoscópio mostraram que esse protocolo por si só era inadequado.
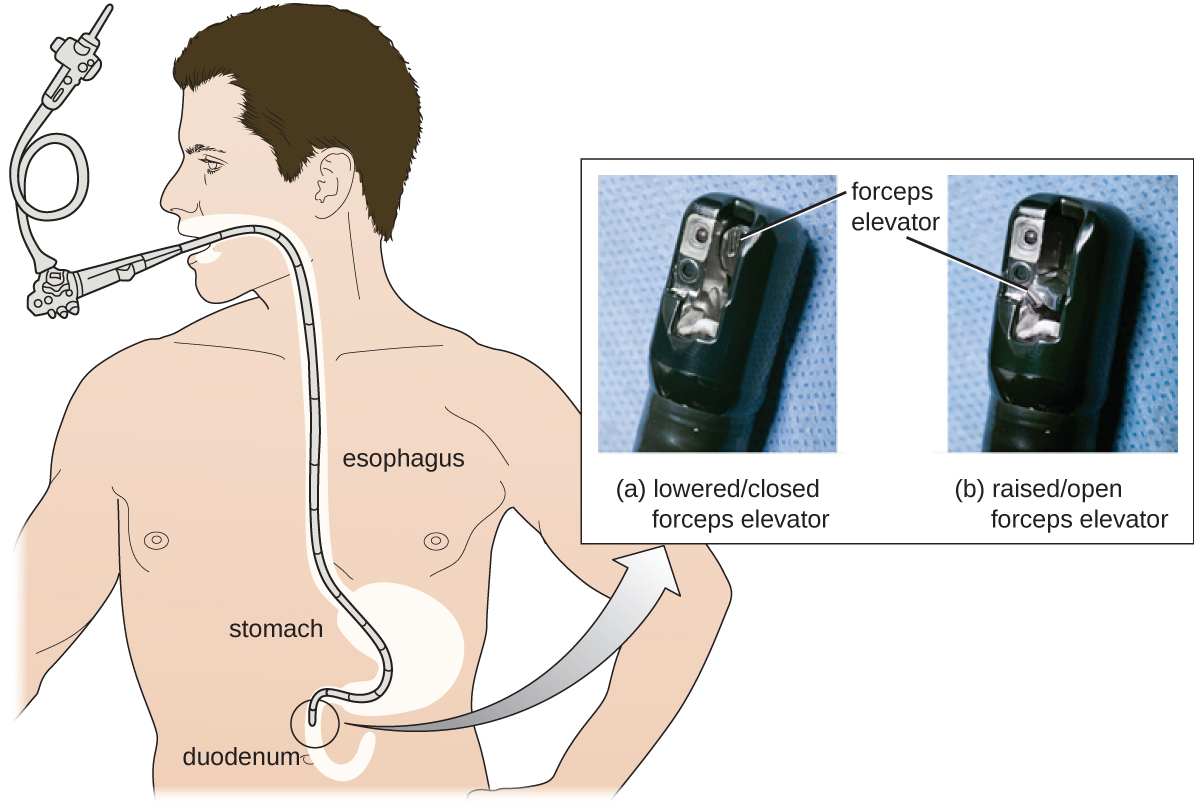
Como resultado de surtos de CRE, hospitais, fabricantes e o FDA estão investigando soluções. Muitos hospitais estão instituindo procedimentos de limpeza mais rigorosos do que os exigidos pelo FDA. Os fabricantes estão procurando maneiras de redesenhar os duodenoscópios para minimizar as fendas de difícil acesso, onde as bactérias podem escapar dos desinfetantes, e o FDA está atualizando seus protocolos. Em fevereiro de 2015, o FDA adicionou novas recomendações para a limpeza cuidadosa das mãos do mecanismo elevador do duodenoscópio (o local onde os micróbios têm maior probabilidade de escapar da desinfecção) e emitiu uma documentação mais cuidadosa sobre o controle de qualidade dos protocolos de desinfecção (Figura\(\PageIndex{4}\)).
Não há garantia de que novos procedimentos, protocolos ou equipamentos eliminem completamente o risco de infecção associado aos endoscópios. No entanto, esses dispositivos são usados com sucesso em 500.000 a 650.000 procedimentos anualmente nos Estados Unidos, muitos deles salvando vidas. Em que ponto os riscos superam os benefícios desses dispositivos e quem deve ser responsabilizado quando ocorrem resultados negativos?
Conceitos principais e resumo
- Os desinfetantes químicos são agrupados pelos tipos de micróbios e agentes infecciosos contra os quais são eficazes. Germicidas de alto nível matam células vegetativas, fungos, vírus e endosporos e podem, em última instância, levar à esterilização. Germicidas de nível intermediário não podem matar todos os vírus e são menos eficazes contra os endosporos. Germicidas de baixo nível matam células vegetativas e alguns vírus envelopados, mas são ineficazes contra os endosporos.
- A eficácia de um desinfetante é influenciada por vários fatores, incluindo o tempo de exposição, a concentração do desinfetante, a temperatura e o pH.
- Historicamente, a eficácia de um desinfetante químico foi comparada com a do fenol em matar Staphylococcus aureus e Salmonella enterica serovar Typhi, e um coeficiente de fenol foi calculado.
- O método de difusão em disco é usado para testar a eficácia de um desinfetante químico contra um micróbio específico.
- O teste de uso-diluição determina a eficácia de um desinfetante em uma superfície. Os testes em uso podem determinar se as soluções desinfetantes estão sendo usadas corretamente em ambientes clínicos.


