13.2: Usando métodos físicos para controlar microorganismos
- Page ID
- 181159
Objetivos de
- Compreenda e compare vários métodos físicos para controlar o crescimento microbiano, incluindo aquecimento, refrigeração, congelamento, tratamento de alta pressão, dessecação, liofilização, irradiação e filtração
Por milhares de anos, os humanos usaram vários métodos físicos de controle microbiano para preservação de alimentos. Os métodos de controle comuns incluem a aplicação de altas temperaturas, radiação, filtração e dessecação (secagem), entre outros. Muitos desses métodos matam células de forma não específica, rompendo as membranas, alterando a permeabilidade da membrana ou danificando proteínas e ácidos nucléicos por desnaturação, degradação ou modificação química. Vários métodos físicos usados para controle microbiano são descritos nesta seção.
Calor
O aquecimento é uma das formas mais comuns — e mais antigas — de controle microbiano. É usado em técnicas simples, como cozinhar e enlatar. O calor pode matar micróbios alterando suas membranas e desnaturando proteínas. O ponto de morte térmica (TDP) de um microrganismo é a temperatura mais baixa na qual todos os micróbios são mortos em uma exposição de 10 minutos. Diferentes microrganismos responderão de forma diferente às altas temperaturas, com alguns (por exemplo, formadores de endosporos, como C. botulinum) sendo mais tolerantes ao calor. Um parâmetro similar, o tempo de morte térmica (TDT), é o tempo necessário para matar todos os microrganismos em uma amostra a uma determinada temperatura. Esses parâmetros são frequentemente usados para descrever procedimentos de esterilização que usam alta temperatura, como autoclavagem. A ebulição é um dos métodos mais antigos de controle de umidade e calor de micróbios e normalmente é bastante eficaz para matar células vegetativas e alguns vírus. No entanto, a ebulição é menos eficaz para matar os endosporos; alguns endosporos são capazes de sobreviver até 20 horas de fervura. Além disso, a ebulição pode ser menos eficaz em altitudes mais altas, onde o ponto de ebulição da água é menor e, portanto, o tempo de ebulição necessário para matar micróbios é maior. Por esses motivos, a ebulição não é considerada uma técnica de esterilização útil no laboratório ou no ambiente clínico.
Muitos protocolos de aquecimento diferentes podem ser usados para esterilização no laboratório ou na clínica, e esses protocolos podem ser divididos em duas categorias principais: esterilização por calor seco e esterilização por calor úmido. A técnica asséptica em laboratório normalmente envolve alguns protocolos de esterilização por calor seco usando aplicação direta de alta temperatura, como circuitos de inoculação esterilizantes (Figura\(\PageIndex{1}\)). A incineração em temperaturas muito altas destrói todos os microrganismos. O calor seco também pode ser aplicado por períodos relativamente longos (pelo menos 2 horas) em temperaturas de até 170 °C usando um esterilizador de calor seco, como um forno. No entanto, a esterilização por calor úmido é normalmente o protocolo mais eficaz porque penetra melhor nas células do que o calor seco.

Autoclaves
As autoclaves dependem da esterilização por calor úmido. Eles são usados para elevar as temperaturas acima do ponto de ebulição da água para esterilizar itens como equipamentos cirúrgicos de células vegetativas, vírus e especialmente endosporos, que são conhecidos por sobreviver à temperatura de ebulição, sem danificar os itens. Charles Chamberland (1851-1908) projetou a autoclave moderna em 1879 enquanto trabalhava no laboratório de Louis Pasteur. A autoclave ainda é considerada o método mais eficaz de esterilização (Figura\(\PageIndex{2}\)). Fora dos ambientes laboratoriais e clínicos, grandes autoclaves industriais chamadas retortas permitem a esterilização por calor úmido em grande escala.
Em geral, o ar na câmara de uma autoclave é removido e substituído por quantidades crescentes de vapor retido dentro da câmara fechada, resultando em aumento da pressão interna e das temperaturas acima do ponto de ebulição da água. Os dois principais tipos de autoclaves diferem na forma como o ar é removido da câmara. Nas autoclaves de deslocamento por gravidade, o vapor é introduzido na câmara pela parte superior ou lateral. O ar, que é mais pesado que o vapor, afunda no fundo da câmara, onde é forçado a sair por uma abertura. O deslocamento completo do ar é difícil, especialmente em cargas maiores, portanto, ciclos mais longos podem ser necessários para essas cargas. Nos esterilizadores a vácuo, o ar é removido completamente usando um vácuo de alta velocidade antes da introdução do vapor na câmara. Como o ar é eliminado de forma mais completa, o vapor pode penetrar mais facilmente nos itens embalados. Muitas autoclaves são capazes de realizar ciclos de gravidade e de pré-vácuo, usando a primeira para a descontaminação de resíduos e esterilização de meios e vidraria não embrulhada, e a segunda para esterilização de instrumentos embalados.
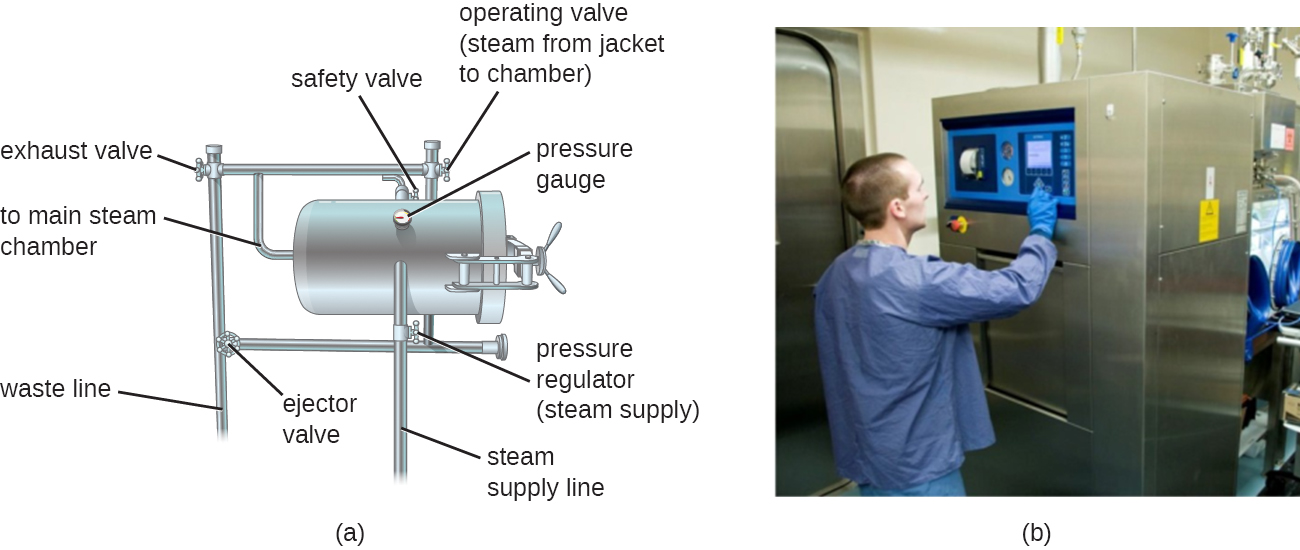
As temperaturas operacionais padrão para autoclaves são 121 °C ou, em alguns casos, 132 °C, normalmente a uma pressão de 15 a 20 libras por polegada quadrada (psi). A duração da exposição depende do volume e da natureza do material que está sendo esterilizado, mas normalmente é de 20 minutos ou mais, com volumes maiores exigindo tempos de exposição mais longos para garantir transferência de calor suficiente para os materiais que estão sendo esterilizados. O vapor deve entrar em contato diretamente com os líquidos ou materiais secos que estão sendo esterilizados, para que os recipientes sejam deixados frouxamente fechados e os instrumentos sejam embrulhados frouxamente em papel ou papel alumínio. A chave para a autoclavagem é que a temperatura deve ser alta o suficiente para matar os endosporos e obter a esterilização completa.
Como a esterilização é muito importante para protocolos médicos e laboratoriais seguros, o controle de qualidade é essencial. As autoclaves podem ser equipadas com gravadores para documentar as pressões e temperaturas alcançadas durante cada corrida. Além disso, indicadores internos de vários tipos devem ser autoclavados junto com os materiais a serem esterilizados para garantir que a temperatura de esterilização adequada seja atingida (Figura\(\PageIndex{3}\)). Um tipo comum de indicador é o uso de fita de autoclave sensível ao calor, que tem listras brancas que ficam pretas quando a temperatura adequada é atingida durante uma operação bem-sucedida da autoclave. Esse tipo de indicador é relativamente barato e pode ser usado durante cada corrida. No entanto, a fita autoclave não fornece nenhuma indicação da duração da exposição, portanto, não pode ser usada como um indicador de esterilidade. Outro tipo de indicador, um teste de esporos com indicador biológico, usa uma tira de papel ou uma suspensão líquida dos endosporos de Geobacillus stearothermophilus para determinar se os endosporos são mortos pelo processo. Os endosporos da bactéria termofílica obrigatória G. stearothermophilus são o padrão-ouro usado para esse fim devido à sua extrema resistência ao calor. Indicadores biológicos de esporos também podem ser usados para testar a eficácia de outros protocolos de esterilização, incluindo óxido de etileno, calor seco, formaldeído, radiação gama e esterilização por plasma com peróxido de hidrogênio usando qualquer um dos G. esporos de stearothermophilus, Bacillus atrophaeus, B. subtilis ou B. pumilus. No caso de validar a função da autoclave, os endosporos são incubados após a autoclavagem para garantir que nenhum endosporo viável permaneça. O crescimento bacteriano subsequente à germinação do endosporo pode ser monitorado por testes de esporos com indicadores biológicos que detectam metabólitos ácidos ou fluorescência produzida por enzimas derivadas do G. stearothermophilus viável. Um terceiro tipo de indicador de autoclave é o tubo Diack, uma ampola de vidro contendo uma pastilha sensível à temperatura que derrete na temperatura de esterilização adequada. Tiras de esporos ou tubos Diack são usados periodicamente para garantir que a autoclave esteja funcionando corretamente.

Pasteurização
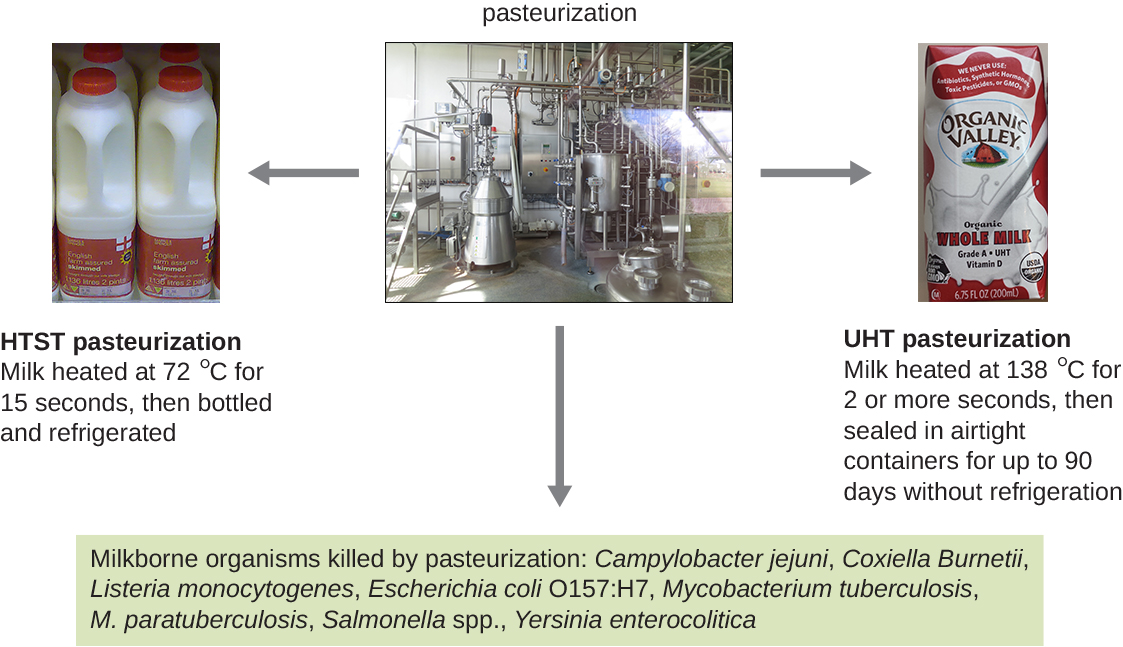
Embora a esterilização completa seja ideal para muitas aplicações médicas, nem sempre é prática para outras aplicações e também pode alterar a qualidade do produto. A ebulição e a autoclavagem não são formas ideais de controlar o crescimento microbiano em muitos alimentos, pois esses métodos podem arruinar a consistência e outras qualidades organolépticas (sensoriais) dos alimentos. A pasteurização é uma forma de controle microbiano de alimentos que usa calor, mas não os torna estéreis. A pasteurização tradicional mata patógenos e reduz o número de micróbios causadores de deterioração, mantendo a qualidade dos alimentos. O processo de pasteurização foi desenvolvido pela primeira vez por Louis Pasteur na década de 1860 como um método para evitar a deterioração da cerveja e do vinho. Hoje, a pasteurização é mais comumente usada para matar patógenos sensíveis ao calor no leite e outros produtos alimentícios (por exemplo, suco de maçã e mel) (Figura\(\PageIndex{4}\)). No entanto, como os alimentos pasteurizados não são estéreis, eles acabarão por se estragar.
Os métodos usados para a pasteurização do leite equilibram a temperatura e a duração do tratamento. Um método, a pasteurização de curta duração em alta temperatura (HTST), expõe o leite a uma temperatura de 72 °C por 15 segundos, o que reduz o número de bactérias e preserva a qualidade do leite. Uma alternativa é a pasteurização em temperatura ultra-alta (UHT), na qual o leite é exposto a uma temperatura de 138 °C por 2 ou mais segundos. O leite pasteurizado UHT pode ser armazenado por muito tempo em recipientes selados sem ser refrigerado; no entanto, as temperaturas muito altas alteram as proteínas do leite, causando pequenas alterações no sabor e no cheiro. Ainda assim, esse método de pasteurização é vantajoso em regiões onde o acesso à refrigeração é limitado.
Exercício\(\PageIndex{1}\)
- Em uma autoclave, como as temperaturas acima da ebulição são alcançadas?
- Como o início da deterioração se compararia entre o leite pasteurizado com HTST e o leite pasteurizado com UHT?
- Por que a ebulição não é usada como método de esterilização em um ambiente clínico?
Refrigeração e congelamento
Assim como altas temperaturas são eficazes para controlar o crescimento microbiano, expor micróbios a baixas temperaturas também pode ser um método fácil e eficaz de controle microbiano, com exceção dos psicrófilos, que preferem temperaturas baixas (consulte Temperatura e crescimento microbiano). Os refrigeradores usados em cozinhas domésticas ou em laboratório mantêm temperaturas entre 0 °C e 7 °C. Essa faixa de temperatura inibe o metabolismo microbiano, retardando significativamente o crescimento de microrganismos e ajudando a preservar produtos refrigerados, como alimentos ou suprimentos médicos. Certos tipos de culturas de laboratório podem ser preservados por refrigeração para uso posterior.
O congelamento abaixo de −2 °C pode impedir o crescimento microbiano e até mesmo matar organismos suscetíveis. De acordo com o Departamento de Agricultura dos EUA (USDA), as únicas formas seguras de descongelar alimentos congelados são na geladeira, imersos em água fria trocada a cada 30 minutos ou no microondas, mantendo os alimentos em temperaturas não propícias ao crescimento bacteriano. 1 Além disso, o crescimento bacteriano interrompido pode recomeçar nos alimentos descongelados, portanto, os alimentos descongelados devem ser tratados como produtos perecíveis frescos.
Culturas bacterianas e amostras médicas que requerem armazenamento ou transporte a longo prazo são frequentemente congeladas em temperaturas ultrabaixas de −70° C ou menos. Essas temperaturas ultrabaixas podem ser alcançadas armazenando amostras em gelo seco em um freezer ultrabaixo ou em tanques especiais de nitrogênio líquido, que mantêm temperaturas abaixo de −196° C (Figura\(\PageIndex{5}\)).

Exercício\(\PageIndex{2}\)
Colocar comida na geladeira mata bactérias nos alimentos?
Pressão
A exposição à alta pressão mata muitos micróbios. Na indústria alimentícia, o processamento de alta pressão (também chamado de pascalização) é usado para matar bactérias, leveduras, fungos, parasitas e vírus nos alimentos, mantendo a qualidade dos alimentos e prolongando a vida útil. A aplicação de alta pressão entre 100 e 800 MPa (a pressão atmosférica ao nível do mar é de cerca de 0,1 MPa) é suficiente para matar as células vegetativas por desnaturação de proteínas, mas os endosporos podem sobreviver a essas pressões. 2 3
Em ambientes clínicos, a oxigenoterapia hiperbárica às vezes é usada para tratar infecções. Nessa forma de terapia, um paciente respira oxigênio puro a uma pressão superior à pressão atmosférica normal, normalmente entre 1 e 3 atmosferas (atm). Isso é conseguido colocando o paciente em uma câmara hiperbárica ou fornecendo o oxigênio pressurizado por meio de um tubo respiratório. A oxigenoterapia hiperbárica ajuda a aumentar a saturação de oxigênio nos tecidos que se tornam hipóxicos devido à infecção e inflamação. Esse aumento da concentração de oxigênio melhora a resposta imune do corpo, aumentando as atividades dos neutrófilos e macrófagos, glóbulos brancos que combatem infecções. O aumento dos níveis de oxigênio também contribui para a formação de radicais livres tóxicos que inibem o crescimento de bactérias sensíveis ao oxigênio ou anaeróbicas, como a Clostridium perfringens, uma causa comum de gangrena gasosa. Nas infecções por C. perfringens, a oxigenoterapia hiperbárica também pode reduzir a secreção de uma toxina bacteriana que causa a destruição do tecido. A oxigenoterapia hiperbárica também parece aumentar a eficácia dos tratamentos com antibióticos. Infelizmente, alguns riscos raros incluem toxicidade do oxigênio e efeitos em tecidos delicados, como olhos, ouvido médio e pulmões, que podem ser danificados pelo aumento da pressão do ar.
O processamento de alta pressão não é comumente usado para desinfecção ou esterilização de fômites. Embora a aplicação de pressão e vapor em uma autoclave seja eficaz para matar os endosporos, é a alta temperatura alcançada, e não a pressão direta, que resulta na morte do endosporo.
Certa segunda-feira, na primavera de 2015, uma mulher de Ohio começou a ter visão dupla e embaçada, dificuldade em engolir e pálpebras caídas. Ela foi levada às pressas para o pronto-socorro de seu hospital local. Durante o exame, ela começou a sentir cólicas abdominais, náuseas, paralisia, boca seca, fraqueza dos músculos faciais e dificuldade para falar e respirar. Com base nesses sintomas, o centro de comando de incidentes do hospital foi ativado e as autoridades de saúde pública de Ohio foram notificadas sobre um possível caso de botulismo. Enquanto isso, outros pacientes com sintomas semelhantes começaram a aparecer em outros hospitais locais. Devido à suspeita de botulismo, a antitoxina foi enviada durante a noite do CDC para essas instalações médicas, para ser administrada aos pacientes afetados. O primeiro paciente morreu de insuficiência respiratória como resultado de paralisia, e cerca de metade das vítimas restantes necessitaram de hospitalização adicional após a administração de antitoxinas, com pelo menos duas necessitando de ventiladores para respirar.
As autoridades de saúde pública investigaram cada um dos casos e determinaram que todos os pacientes haviam comparecido à mesma festa da igreja no dia anterior. Além disso, eles rastrearam a origem do surto até uma salada de batata feita com batatas enlatadas caseiras. É mais do que provável que as batatas tenham sido enlatadas com água fervente, um método que permite que os endosporos de Clostridium botulinum sobrevivam. C. botulinum produz toxina botulínica, uma neurotoxina que geralmente é mortal quando ingerida. De acordo com o CDC, o caso de Ohio foi o maior surto de botulismo nos Estados Unidos em quase 40 anos. 4
Matar os endosporos de C. botulinum requer uma temperatura mínima de 116 °C (240 °F), bem acima do ponto de ebulição da água. Essa temperatura só pode ser alcançada em uma lata de pressão, recomendada para enlatamento caseiro de alimentos com baixo teor de ácido, como carne, peixe, aves e vegetais (Figura\(\PageIndex{6}\)). Além disso, o CDC recomenda ferver alimentos enlatados em casa por cerca de 10 minutos antes do consumo. Como a toxina botulínica é termicamente lábil (o que significa que é desnaturada pelo calor), 10 minutos de fervura tornarão não funcional qualquer toxina botulínica que o alimento possa conter.

Para saber mais sobre as técnicas adequadas de enlatamento caseiro, visite o site do CDC.
Dessecação
A secagem, também conhecida como dessecação ou desidratação, é um método usado há milênios para conservar alimentos como passas, ameixas secas e charque. Funciona porque todas as células, incluindo os micróbios, precisam de água para seu metabolismo e sobrevivência. Embora a secagem controle o crescimento microbiano, ela pode não matar todos os micróbios ou seus endosporos, que podem começar a crescer novamente quando as condições são mais favoráveis e o conteúdo de água é restaurado.
Em alguns casos, os alimentos são secos ao sol, dependendo da evaporação para obter a dessecação. A liofilização, ou liofilização, é outro método de dessecação em que um item é rapidamente congelado (“ultracongelado”) e colocado sob vácuo para que a água seja perdida por sublimação. A liofilização combina a exposição a temperaturas frias e a dessecação, tornando-a bastante eficaz no controle do crescimento microbiano. Além disso, a liofilização causa menos danos a um item do que a dessecação convencional e preserva melhor as qualidades originais do item. Itens liofilizados podem ser armazenados em temperatura ambiente se embalados adequadamente para evitar a aquisição de umidade. A liofilização é usada para preservação na indústria alimentícia e também em laboratório para armazenamento e transporte de longo prazo de culturas microbianas.
O teor de água dos alimentos e materiais, chamado de atividade da água, pode ser reduzido sem secagem física pela adição de solutos, como sais ou açúcares. Em concentrações muito altas de sais ou açúcares, a quantidade de água disponível nas células microbianas é reduzida drasticamente porque a água será retirada de uma área de baixa concentração de soluto (dentro da célula) para uma área de alta concentração de soluto (fora da célula) (Figura\(\PageIndex{7}\)). Muitos microrganismos não sobrevivem a essas condições de alta pressão osmótica. O mel, por exemplo, contém 80% de sacarose, um ambiente no qual poucos microrganismos são capazes de crescer, eliminando assim a necessidade de refrigeração. Carnes e peixes salgados, como presunto e bacalhau, respectivamente, eram alimentos extremamente importantes antes da era da refrigeração. As frutas foram preservadas adicionando açúcar, fazendo geleias e geleias. No entanto, certos micróbios, como bolores e leveduras, tendem a ser mais tolerantes à dessecação e às altas pressões osmóticas e, portanto, ainda podem contaminar esses tipos de alimentos.

Exercício\(\PageIndex{3}\)
Como a adição de sal ou açúcar aos alimentos afeta sua atividade aquática?
Radiação
A radiação em várias formas, da radiação de alta energia à luz solar, pode ser usada para matar micróbios ou inibir seu crescimento. A radiação ionizante inclui raios X, raios gama e feixes de elétrons de alta energia. A radiação ionizante é forte o suficiente para passar para a célula, onde altera as estruturas moleculares e danifica os componentes celulares. Por exemplo, a radiação ionizante introduz quebras de fita dupla nas moléculas de DNA. Isso pode causar diretamente a ocorrência de mutações no DNA, ou mutações podem ser introduzidas quando a célula tenta reparar o dano ao DNA. À medida que essas mutações se acumulam, elas acabam levando à morte celular.
Tanto os raios X quanto os raios gama penetram facilmente no papel e no plástico e, portanto, podem ser usados para esterilizar muitos materiais embalados. No laboratório, a radiação ionizante é comumente usada para esterilizar materiais que não podem ser autoclavados, como placas de Petri de plástico e alças descartáveis de inoculação de plástico. Para uso clínico, a radiação ionizante é usada para esterilizar luvas, tubos intravenosos e outros itens de látex e plástico usados no cuidado do paciente. A radiação ionizante também é usada para a esterilização de outros tipos de materiais delicados e sensíveis ao calor usados clinicamente, incluindo tecidos para transplante, medicamentos e equipamentos médicos.
Na Europa, a irradiação gama para preservação de alimentos é amplamente usada, embora tenha demorado a se popularizar nos Estados Unidos (veja a caixa Micro Conexões sobre este tópico). As especiarias secas embaladas também costumam ser irradiadas por gama. Devido à sua capacidade de penetrar papel, plástico, folhas finas de madeira e metal e tecidos, deve-se tomar muito cuidado ao usar raios X e irradiação gama. Esses tipos de irradiação ionizante não conseguem penetrar camadas espessas de ferro ou chumbo, então esses metais são comumente usados para proteger humanos que podem estar potencialmente expostos.
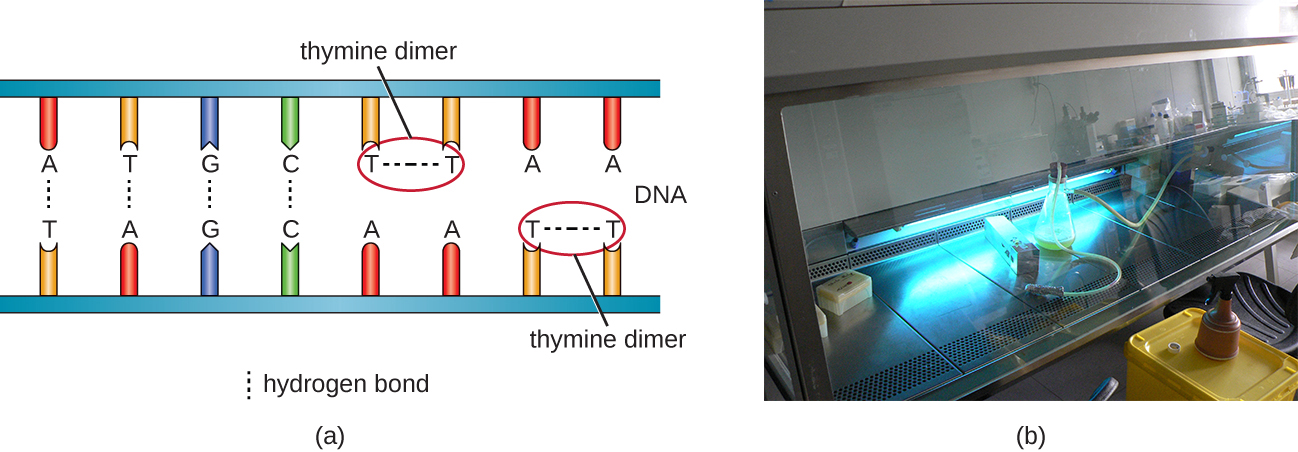
Outro tipo de radiação, a radiação não ionizante, é comumente usada para esterilização e usa menos energia do que a radiação ionizante. Não penetra nas células ou nas embalagens. A luz ultravioleta (UV) é um exemplo; ela faz com que dímeros de timina se formem entre timinas adjacentes dentro de uma única fita de DNA (Figura\(\PageIndex{8}\)). Quando a DNA polimerase encontra o dímero de timina, ela nem sempre incorpora os nucleotídeos complementares apropriados (duas adeninas), o que leva à formação de mutações que podem matar microrganismos.
A luz ultravioleta pode ser usada de forma eficaz tanto pelos consumidores quanto pelo pessoal do laboratório para controlar o crescimento microbiano. As lâmpadas UV agora são comumente incorporadas aos sistemas de purificação de água para uso em residências. Além disso, pequenas luzes UV portáteis são comumente usadas pelos campistas para purificar a água dos ambientes naturais antes de beber. Lâmpadas germicidas também são usadas em salas cirúrgicas, gabinetes de segurança biológica e coifas de transferência, normalmente emitindo luz UV em um comprimento de onda de 260 nm. Como a luz ultravioleta não penetra nas superfícies e não passa por plásticos ou vidro, as células devem ser expostas diretamente à fonte de luz.
A luz solar tem um espectro muito amplo que inclui luz UV e luz visível. Em alguns casos, a luz solar pode ser eficaz contra certas bactérias devido à formação de dímeros de timina pela luz ultravioleta e pela produção de produtos reativos de oxigênio induzidos em pequenas quantidades pela exposição à luz visível.
Exercício\(\PageIndex{4}\)
- Quais são as duas vantagens da radiação ionizante como método de esterilização?
- Como a eficácia da radiação ionizante se compara à da radiação não ionizante?
Comida irradiada: você comeria isso?
De todas as formas de evitar a deterioração dos alimentos e doenças transmitidas por alimentos, a irradiação gama pode ser a menos apetitosa. Embora a irradiação gama seja um método comprovado de eliminar micróbios potencialmente nocivos dos alimentos, o público ainda não acreditou. A maioria de suas preocupações, no entanto, decorre de desinformação e de uma compreensão deficiente dos princípios básicos da radiação.
O método mais comum de irradiação é expor os alimentos ao cobalto-60 ou césio-137, passando-os por uma câmara de radiação em uma correia transportadora. O alimento não entra em contato direto com o material radioativo e não se torna radioativo. Portanto, não há risco de exposição a material radioativo por meio da ingestão de alimentos irradiados por gama. Além disso, os alimentos irradiados não são significativamente alterados em termos de qualidade nutricional, além da perda de certas vitaminas, que também é exacerbada pelo armazenamento prolongado. Alterações no paladar ou no olfato podem ocorrer em alimentos irradiados com alto teor de gordura, como carnes gordurosas e laticínios, mas esse efeito pode ser minimizado com o uso de doses mais baixas de radiação em temperaturas mais baixas.
Nos Estados Unidos, o CDC, a Agência de Proteção Ambiental (EPA) e a Food and Drug Administration (FDA) consideraram a irradiação segura e eficaz para vários tipos de carnes, aves, mariscos, frutas e vegetais frescos, ovos com casca e especiarias e temperos. A irradiação gama de alimentos também foi aprovada para uso em muitos outros países, incluindo França, Holanda, Portugal, Israel, Rússia, China, Tailândia, Bélgica, Austrália e África do Sul. Para ajudar a melhorar a preocupação do consumidor e auxiliar nos esforços educacionais, os alimentos irradiados agora estão claramente rotulados e marcados com o símbolo internacional de irradiação, chamado de “radura” (Figura\(\PageIndex{9}\)). A aceitação do consumidor parece estar aumentando, conforme indicado por vários estudos recentes.

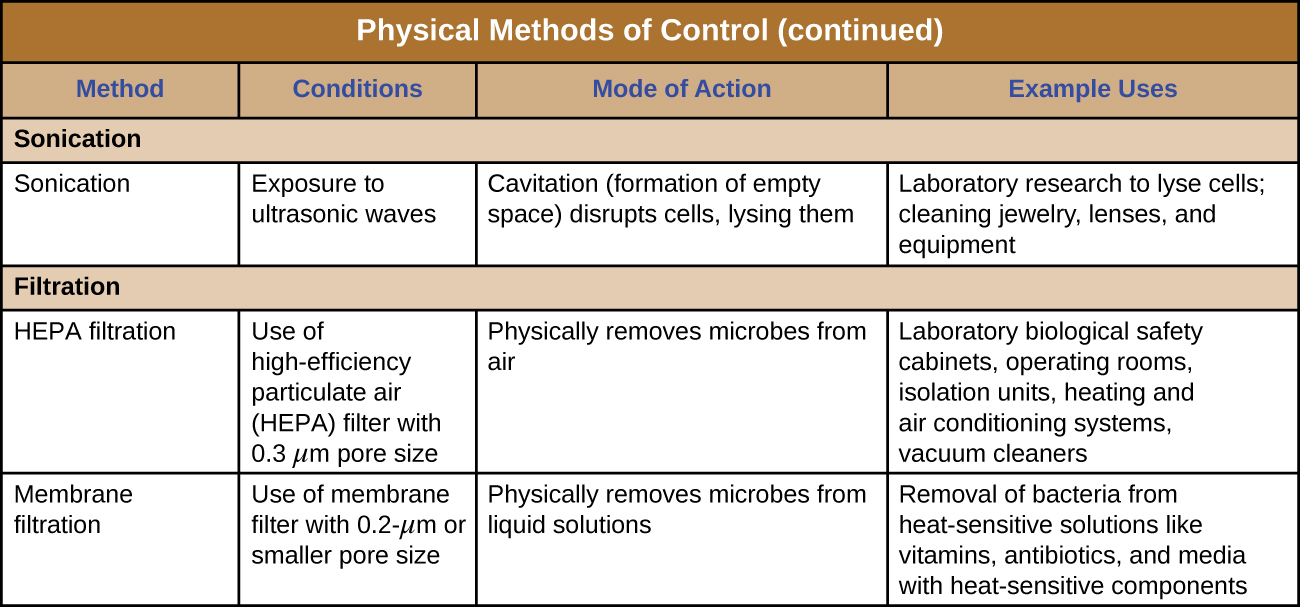
Sonicação
O uso de ondas de ultrassom de alta frequência para interromper as estruturas celulares é chamado de sonicação. A aplicação de ondas de ultrassom causa mudanças rápidas na pressão dentro do líquido intracelular; isso leva à cavitação, a formação de bolhas dentro da célula, que podem interromper as estruturas celulares e, eventualmente, fazer com que a célula se lise ou colapse. A sonicação é útil em laboratório para lisar células de forma eficiente para liberar seu conteúdo para pesquisas futuras; fora do laboratório, a sonicação é usada para limpar instrumentos cirúrgicos, lentes e uma variedade de outros objetos, como moedas, ferramentas e instrumentos musicais.
Filtragem
A filtração é um método de separar fisicamente os micróbios das amostras. O ar geralmente é filtrado por meio de filtros de ar particulado de alta eficiência (HEPA) (Figura\(\PageIndex{10}\)). Os filtros HEPA têm poros efetivos de 0,3 µm, pequenos o suficiente para capturar células bacterianas, endosporos e muitos vírus, à medida que o ar passa por esses filtros, quase esterilizando o ar do outro lado do filtro. Os filtros HEPA têm uma variedade de aplicações e são amplamente usados em ambientes clínicos, em carros e aviões e até mesmo em casa. Por exemplo, eles podem ser encontrados em aspiradores de pó, sistemas de aquecimento e ar condicionado e purificadores de ar.
Gabinetes de segurança biológica
Os gabinetes de segurança biológica são um bom exemplo do uso de filtros HEPA. Os filtros HEPA em gabinetes de segurança biológica (BSCs) são usados para remover partículas no ar que entram no gabinete (entrada de ar), sair do gabinete (exaustão de ar) ou tratar tanto a entrada quanto a exaustão. O uso de um filtro HEPA de entrada de ar evita que contaminantes ambientais entrem no BSC, criando uma área limpa para o manuseio de materiais biológicos. O uso de um filtro HEPA de exaustão de ar evita que patógenos de laboratório contaminem o laboratório, mantendo assim uma área de trabalho segura para o pessoal do laboratório.
Existem três classes de BSCs: I, II e III. Cada classe é projetada para fornecer um nível diferente de proteção para o pessoal do laboratório e o meio ambiente; BSC II e III também são projetados para proteger os materiais ou dispositivos no gabinete. A tabela\(\PageIndex{1}\) resume o nível de segurança fornecido por cada classe de BSC para cada BSL.
| Risco biológico avaliado | Classe BSC | Proteção do pessoal | Proteção do Meio Ambiente | Proteção do produto |
|---|---|---|---|---|
| BSL-1, BSL-2, BSL-3 | EU | sim | sim | Não |
| BSL-1, BSL-2, BSL-3 | II | sim | sim | sim |
| BSL-4 | III; II quando usado em quarto de terno com terno | sim | sim | sim |
Os BSCs de classe I protegem os trabalhadores de laboratório e o meio ambiente de um risco baixo a moderado de exposição a agentes biológicos usados no laboratório. O ar é aspirado para o gabinete e depois filtrado antes de sair pelo sistema de exaustão do prédio. Os BSCs de classe II usam fluxo de ar direcional e sistemas de barreira parcial para conter agentes infecciosos. Os BSCs Classe III são projetados para trabalhar com agentes altamente infecciosos, como aqueles usados em laboratórios BSL-4. Eles são estanques ao gás e os materiais que entram ou saem do gabinete devem passar por um sistema de porta dupla, permitindo que o espaço intermediário seja descontaminado entre os usos. Todo o ar passa por um ou dois filtros HEPA e um sistema de incineração de ar antes de ser expelido diretamente para o exterior (não pelo sistema de exaustão do prédio). O pessoal pode manipular materiais dentro do gabinete Classe III usando luvas longas de borracha seladas no gabinete.
Este vídeo mostra como os BSCs são projetados e explica como eles protegem o pessoal, o meio ambiente e o produto.
Filtragem em hospitais
Os filtros HEPA também são comumente usados em hospitais e salas cirúrgicas para evitar a contaminação e a propagação de micróbios transportados pelo ar por meio de sistemas de ventilação. Os sistemas de filtragem HEPA podem ser projetados para edifícios inteiros ou para salas individuais. Por exemplo, unidades de queimadura, salas de cirurgia ou unidades de isolamento podem exigir sistemas especiais de filtração HEPA para remover patógenos oportunistas do ambiente, pois os pacientes nessas salas são particularmente vulneráveis à infecção.
Filtros de membrana
A filtração também pode ser usada para remover micróbios de amostras líquidas usando filtração por membrana. Os filtros de membrana para líquidos funcionam de forma semelhante aos filtros HEPA para ar. Normalmente, os filtros de membrana usados para remover bactérias têm um tamanho efetivo de poros de 0,2 µm, menor do que o tamanho médio de uma bactéria (1 µm), mas filtros com poros menores estão disponíveis para necessidades mais específicas. A filtração por membrana é útil para remover bactérias de vários tipos de soluções sensíveis ao calor usadas em laboratório, como soluções antibióticas e soluções vitamínicas. Grandes volumes de meios de cultura também podem ser esterilizados por filtro em vez de autoclavados para proteger componentes sensíveis ao calor. Geralmente, ao filtrar pequenos volumes, filtros de seringa são usados, mas filtros de vácuo são normalmente usados para filtrar volumes maiores (Figura\(\PageIndex{11}\)).

Exercício\(\PageIndex{5}\)
- A filtração por membrana com um filtro de 0,2 µm provavelmente removeria vírus de uma solução? Explique.
- Cite pelo menos dois usos comuns da filtragem HEPA em ambientes clínicos ou laboratoriais.
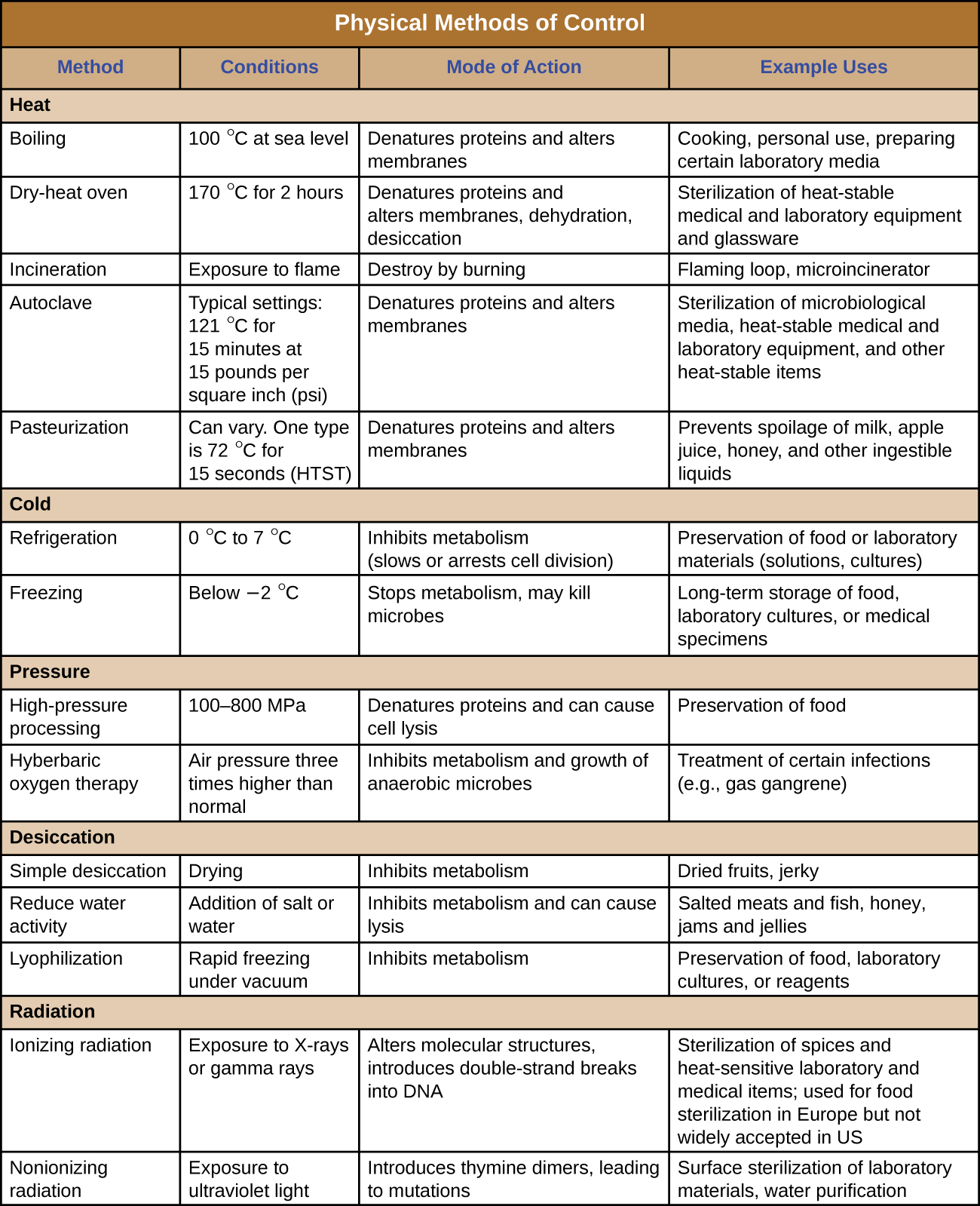
As figuras\(\PageIndex{12}\) e figuras\(\PageIndex{13}\) resumem os métodos físicos de controle discutidos nesta seção.
Conceitos principais e resumo
- O calor é um método amplamente utilizado e altamente eficaz para controlar o crescimento microbiano.
- Os protocolos de esterilização por calor seco são comumente usados em técnicas assépticas em laboratório. No entanto, a esterilização por calor úmido é normalmente o protocolo mais eficaz porque penetra melhor nas células do que o calor seco.
- A pasteurização é usada para matar patógenos e reduzir o número de micróbios que causam a deterioração dos alimentos. A pasteurização em alta temperatura e curta duração é comumente usada para pasteurizar o leite que será refrigerado; a pasteurização em temperatura ultra-alta pode ser usada para pasteurizar o leite para armazenamento de longo prazo sem refrigeração.
- A refrigeração retarda o crescimento microbiano; o congelamento interrompe o crescimento, matando alguns organismos. Amostras médicas e de laboratório podem ser congeladas em gelo seco ou em temperaturas ultrabaixas para armazenamento e transporte.
- O processamento de alta pressão pode ser usado para matar micróbios nos alimentos. A oxigenoterapia hiperbárica para aumentar a saturação de oxigênio também tem sido usada para tratar certas infecções.
- A dessecação é usada há muito tempo para conservar alimentos e é acelerada por meio da adição de sal ou açúcar, que diminuem a atividade da água nos alimentos.
- A liofilização combina exposição ao frio e dessecação para o armazenamento a longo prazo de alimentos e materiais de laboratório, mas os micróbios permanecem e podem ser reidratados.
- A radiação ionizante, incluindo a irradiação gama, é uma forma eficaz de esterilizar materiais sensíveis ao calor e embalados. A radiação não ionizante, como a luz ultravioleta, é incapaz de penetrar nas superfícies, mas é útil para a esterilização da superfície.
- A filtragem HEPA é comumente usada em sistemas de ventilação hospitalar e gabinetes de segurança biológica em laboratórios para evitar a transmissão de micróbios no ar. A filtração por membrana é comumente usada para remover bactérias de soluções sensíveis ao calor.
Notas de pé
- 1 Departamento de Agricultura dos EUA. “Congelamento e segurança alimentar”. 2013. http://www.fsis.usda.gov/wps/portal/...afety/CT_Index. Acessado em 8 de junho de 2016.
- 2 C. Ferstl. “Processamento de alta pressão: insights sobre tecnologia e requisitos regulatórios.” Alimento para pensamento/Livro Branco. Volume da série 10. Livermore, CA: The National Food Lab; julho de 2013.
- 3 Administração de Alimentos e Medicamentos dos EUA. “Cinética da inativação microbiana para tecnologias alternativas de processamento de alimentos: processamento de alta pressão.” 2000. www.fda.gov/Food/Food/FoodSciencer... /ucm101456.htm. Acessado em 19 de julho de 2016.
- 4 CL McCarty e cols.. “Grande surto de botulismo associado a um Church Potluck Meal-Ohio, 2015.” Relatório Semanal de Morbidade e Mortalidade 64, nº 29 (2015) :802—803.
- 5 AM Johnson e cols.. “Aceitação do consumidor de carnes de aves prontas para consumo irradiadas por feixe de elétrons”. Conservação do Processamento de Alimentos, 28 no. 4 (2004) :302—319.


