2.2: Água
- Page ID
- 179214
Você já se perguntou por que os cientistas passam tempo procurando água em outros planetas? É porque a água é essencial para a vida; mesmo pequenos traços dela em outro planeta podem indicar que a vida poderia ou existiu nesse planeta. A água é uma das moléculas mais abundantes nas células vivas e a mais crítica para a vida como a conhecemos. Aproximadamente 60 a 70 por cento do seu corpo é composto de água. Sem isso, a vida simplesmente não existiria.
A água é polar
Os átomos de hidrogênio e oxigênio nas moléculas de água formam ligações polares covalentes. Os elétrons compartilhados passam mais tempo associados ao átomo de oxigênio do que aos átomos de hidrogênio. Não há carga geral em uma molécula de água, mas há uma leve carga positiva em cada átomo de hidrogênio e uma leve carga negativa no átomo de oxigênio. Por causa dessas cargas, os átomos de hidrogênio ligeiramente positivos se repelem e formam a forma única vista na Figura 2.1.6. Cada molécula de água atrai outras moléculas de água por causa das cargas positivas e negativas nas diferentes partes da molécula. A água também atrai outras moléculas polares (como açúcares), formando ligações de hidrogênio. Quando uma substância forma prontamente ligações de hidrogênio com a água, ela pode se dissolver na água e é chamada de hidrofílica (“amante da água”). As ligações de hidrogênio não são facilmente formadas com substâncias não polares, como óleos e gorduras (Figura\(\PageIndex{1}\)). Esses compostos não polares são hidrofóbicos (“temem a água”) e não se dissolvem na água.

A água estabiliza a temperatura
As ligações de hidrogênio na água permitem que ela absorva e libere energia térmica mais lentamente do que muitas outras substâncias. A temperatura é uma medida do movimento (energia cinética) das moléculas. À medida que o movimento aumenta, a energia aumenta e, portanto, a temperatura aumenta. A água absorve uma grande quantidade de energia antes que a temperatura suba. O aumento da energia interrompe as ligações de hidrogênio entre as moléculas de água. Como essas ligações podem ser criadas e interrompidas rapidamente, a água absorve um aumento nas mudanças de energia e temperatura apenas minimamente. Isso significa que a água modera as mudanças de temperatura nos organismos e em seus ambientes. À medida que a entrada de energia continua, o equilíbrio entre a formação e a destruição da ligação de hidrogênio oscila em direção ao lado da destruição. Mais laços são quebrados do que formados. Esse processo resulta na liberação de moléculas individuais de água na superfície do líquido (como um corpo de água, as folhas de uma planta ou a pele de um organismo) em um processo chamado evaporação. A evaporação do suor, que é 90% de água, permite o resfriamento de um organismo, porque a quebra das ligações de hidrogênio requer uma entrada de energia e retira o calor do corpo.
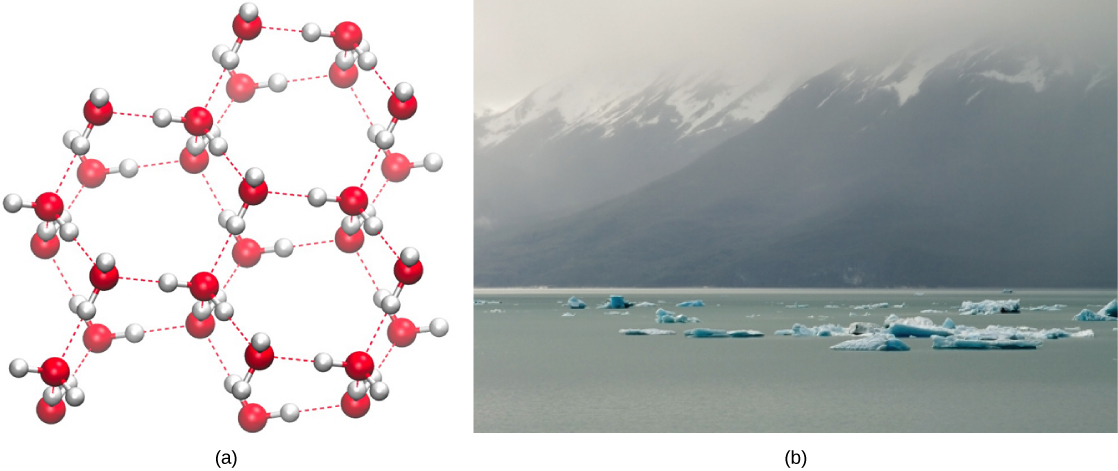
Por outro lado, à medida que o movimento molecular diminui e as temperaturas caem, menos energia está presente para quebrar as ligações de hidrogênio entre as moléculas de água. Essas ligações permanecem intactas e começam a formar uma estrutura rígida semelhante a uma rede (por exemplo, gelo) (Figura\(\PageIndex{2}\) a). Quando congelado, o gelo é menos denso do que a água líquida (as moléculas estão mais afastadas). Isso significa que o gelo flutua na superfície de um corpo de água (Figura\(\PageIndex{2}\) b). Em lagos, lagoas e oceanos, o gelo se formará na superfície da água, criando uma barreira isolante para proteger a vida animal e vegetal abaixo do congelamento na água. Se isso não acontecesse, plantas e animais que vivem na água congelariam em um bloco de gelo e não poderiam se mover livremente, dificultando ou impossibilitando a vida em temperaturas frias.
A água é um excelente solvente
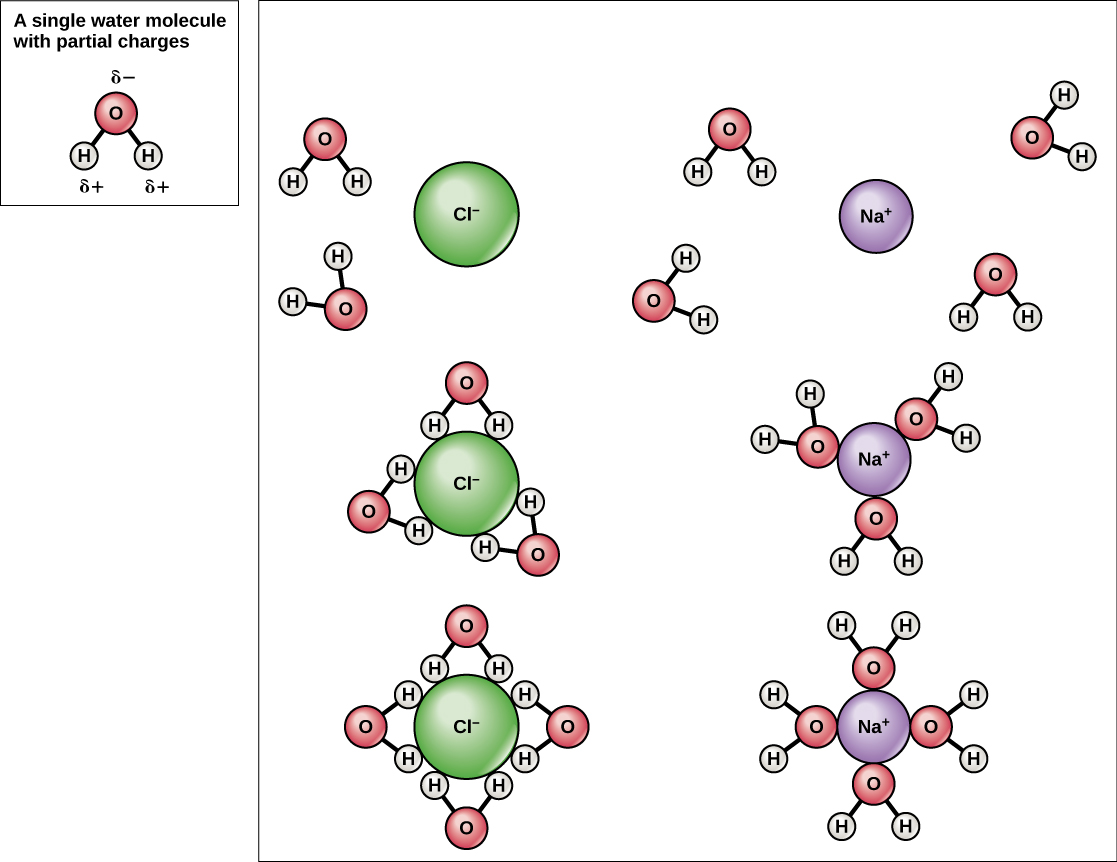
Como a água é polar, com pequenas cargas positivas e negativas, compostos iônicos e moléculas polares podem se dissolver facilmente nela. A água é, portanto, o que chamamos de solvente — uma substância capaz de dissolver outra substância. As partículas carregadas formarão ligações de hidrogênio com uma camada circundante de moléculas de água. Isso é conhecido como uma esfera de hidratação e serve para manter as partículas separadas ou dispersas na água. No caso do sal de cozinha (NaCl) misturado à água (Figura\(\PageIndex{3}\)), os íons sódio e cloreto se separam ou se dissociam na água, e esferas de hidratação são formadas ao redor dos íons. Um íon de sódio com carga positiva é cercado pelas cargas parcialmente negativas dos átomos de oxigênio nas moléculas de água. Um íon cloreto carregado negativamente é cercado pelas cargas parcialmente positivas dos átomos de hidrogênio nas moléculas de água. Essas esferas de hidratação também são chamadas de conchas de hidratação. A polaridade da molécula de água a torna um solvente eficaz e é importante em suas muitas funções nos sistemas vivos.
A água é coesa
Você já encheu um copo de água até o topo e depois adicionou lentamente mais algumas gotas? Antes de transbordar, a água na verdade forma uma cúpula acima da borda do vidro. Essa água pode ficar acima do vidro por causa da propriedade de coesão. Na coesão, as moléculas de água são atraídas umas pelas outras (por causa da ligação de hidrogênio), mantendo as moléculas juntas na interface líquido-ar (gás), embora não haja mais espaço no vidro. A coesão dá origem à tensão superficial, a capacidade de uma substância resistir à ruptura quando colocada sob tensão ou estresse. Quando você joga um pequeno pedaço de papel em uma gota de água, o papel flutua sobre a gota de água, embora o objeto seja mais denso (mais pesado) do que a água. Isso ocorre devido à tensão superficial criada pelas moléculas de água. A coesão e a tensão superficial mantêm as moléculas de água intactas e o item flutuando na parte superior. É até possível “flutuar” uma agulha de aço em cima de um copo de água se você colocá-la suavemente, sem quebrar a tensão superficial (Figura\(\PageIndex{4}\)).

Essas forças coesivas também estão relacionadas à propriedade de adesão da água, ou à atração entre moléculas de água e outras moléculas. Isso é observado quando a água “sobe” por um canudo colocado em um copo d'água. Você notará que a água parece estar mais alta nas laterais do canudo do que no meio. Isso ocorre porque as moléculas de água são atraídas pela palha e, portanto, aderem a ela.
As forças coesivas e adesivas são importantes para sustentar a vida. Por exemplo, devido a essas forças, a água pode fluir das raízes até o topo das plantas para alimentar a planta.
CONCEITO EM AÇÃO
Para saber mais sobre a água, visite a Pesquisa Geológica dos EUA Ciência da Água para Escolas: Tudo sobre Água! site.
Tampões, pH, ácidos e bases
O pH de uma solução é uma medida de sua acidez ou alcalinidade. Você provavelmente já usou papel de tornassol, papel que foi tratado com um corante natural solúvel em água para que possa ser usado como indicador de pH, para testar a quantidade de ácido ou base (alcalinidade) existente em uma solução. Você pode até ter usado alguns para garantir que a água de uma piscina externa seja tratada adequadamente. Em ambos os casos, esse teste de pH mede a quantidade de íons de hidrogênio que existe em uma determinada solução. Altas concentrações de íons de hidrogênio produzem um pH baixo, enquanto baixos níveis de íons de hidrogênio resultam em um pH alto. A concentração geral de íons de hidrogênio está inversamente relacionada ao seu pH e pode ser medida na escala de pH (Figura\(\PageIndex{5}\)). Portanto, quanto mais íons de hidrogênio presentes, menor o pH; inversamente, quanto menos íons hidrogênio, maior o pH.
A escala de pH varia de 0 a 14. Uma mudança de uma unidade na escala de pH representa uma mudança na concentração de íons de hidrogênio por um fator de 10, uma mudança em duas unidades representa uma mudança na concentração de íons de hidrogênio por um fator de 100. Assim, pequenas mudanças no pH representam grandes mudanças nas concentrações de íons hidrogênio. A água pura é neutra. Não é ácido nem básico e tem um pH de 7,0. Qualquer coisa abaixo de 7,0 (variando de 0,0 a 6,9) é ácida e qualquer coisa acima de 7,0 (de 7,1 a 14,0) é alcalina. O sangue nas veias é ligeiramente alcalino (pH = 7,4). O ambiente no estômago é altamente ácido (pH = 1 a 2). O suco de laranja é levemente ácido (pH = aproximadamente 3,5), enquanto o bicarbonato de sódio é básico (pH = 9,0).

Os ácidos são substâncias que fornecem íons de hidrogênio (H +) e menor pH, enquanto as bases fornecem íons hidróxido (OH —) e aumentam o pH. Quanto mais forte o ácido, mais facilmente ele doa H +. Por exemplo, o ácido clorídrico e o suco de limão são muito ácidos e prontamente liberam H + quando adicionados à água. Inversamente, bases são aquelas substâncias que prontamente doam OH -. Os íons OH — se combinam com H + para produzir água, o que aumenta o pH de uma substância. O hidróxido de sódio e muitos produtos de limpeza domésticos são muito alcalinos e liberam OH — rapidamente quando colocados na água, aumentando assim o pH.
A maioria das células do nosso corpo opera dentro de uma janela muito estreita da escala de pH, normalmente variando apenas de 7,2 a 7,6. Se o pH do corpo estiver fora dessa faixa, o sistema respiratório não funcionará, assim como outros órgãos do corpo. As células não funcionam mais adequadamente e as proteínas se decompõem. Desvios fora da faixa de pH podem induzir coma ou até mesmo causar a morte.
Então, como podemos ingerir ou inalar substâncias ácidas ou básicas e não morrer? Os amortecedores são a chave. Os tampões absorvem facilmente o excesso de H + ou OH —, mantendo o pH do corpo cuidadosamente mantido na faixa estreita acima mencionada. O dióxido de carbono faz parte de um sistema tampão proeminente no corpo humano; ele mantém o pH dentro da faixa adequada. Esse sistema tampão envolve ácido carbônico (H 2 CO 3) e ânion bicarbonato (HCO 3 —). Se muito H + entrar no corpo, o bicarbonato se combinará com o H + para criar ácido carbônico e limitar a diminuição do pH. Da mesma forma, se muito OH — for introduzido no sistema, o ácido carbônico se dissociará rapidamente em bicarbonato e íons H +. Os íons H + podem se combinar com os íons OH —, limitando o aumento do pH. Embora o ácido carbônico seja um produto importante nessa reação, sua presença é passageira porque o ácido carbônico é liberado do corpo como gás dióxido de carbono cada vez que respiramos. Sem esse sistema de amortecimento, o pH em nossos corpos flutuaria muito e não conseguiríamos sobreviver.
Resumo
A água tem muitas propriedades que são essenciais para manter a vida. É polar, permitindo a formação de ligações de hidrogênio, que permitem que íons e outras moléculas polares se dissolvam na água. Portanto, a água é um excelente solvente. As ligações de hidrogênio entre as moléculas de água dão à água a capacidade de reter o calor melhor do que muitas outras substâncias. À medida que a temperatura aumenta, as ligações de hidrogênio entre a água se rompem e se reformam continuamente, permitindo que a temperatura geral permaneça estável, embora mais energia seja adicionada ao sistema. As forças coesivas da água permitem a propriedade da tensão superficial. Todas essas propriedades únicas da água são importantes na química dos organismos vivos.
O pH de uma solução é uma medida da concentração de íons de hidrogênio na solução. Uma solução com um alto número de íons de hidrogênio é ácida e tem um baixo valor de pH. Uma solução com um alto número de íons hidróxido é básica e tem um alto valor de pH. A escala de pH varia de 0 a 14, com um pH de 7 sendo neutro. Os tampões são soluções que moderam as mudanças de pH quando um ácido ou base é adicionado ao sistema tampão. Os tampões são importantes em sistemas biológicos devido à sua capacidade de manter condições de pH constantes.
Notas de pé
- 1 Humphrey, W., Dalke, A. e Schulten, K., “VMD — Dinâmica Molecular Visual”, J. Molec. Gráficos, 1996, vol. 14, pp. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Glossário
- ácido
- uma substância que doa íons de hidrogênio e, portanto, reduz o pH
- adesão
- a atração entre moléculas de água e moléculas de uma substância diferente
- base
- uma substância que absorve íons de hidrogênio e, portanto, aumenta o pH
- amortecedor
- uma solução que resiste a uma mudança no pH absorvendo ou liberando íons hidrogênio ou hidróxido
- coesão
- as forças intermoleculares entre as moléculas de água causadas pela natureza polar da água; cria tensão superficial
- evaporação
- a liberação de moléculas de água da água líquida para formar vapor de água
- hidrofílico
- descreve uma substância que se dissolve na água; adora água
- hidrofóbico
- descreve uma substância que não se dissolve na água; teme a água
- papel tornassol
- papel de filtro que foi tratado com um corante natural solúvel em água para que possa ser usado como indicador de pH
- escala de pH
- uma escala que varia de 0 a 14 que mede a concentração aproximada de íons hidrogênio de uma substância
- solvente
- uma substância capaz de dissolver outra substância
- tensão superficial
- a força coesiva na superfície de um corpo de líquido que impede a separação das moléculas
- temperatura
- uma medida do movimento molecular



