2.1: Os blocos de construção das moléculas
- Page ID
- 179202
Em seu nível mais fundamental, a vida é feita de matéria. A matéria ocupa espaço e tem massa. Toda matéria é composta por elementos, substâncias que não podem ser decompostas ou transformadas quimicamente em outras substâncias. Cada elemento é feito de átomos, cada um com um número constante de prótons e propriedades únicas. Um total de 118 elementos foram definidos; no entanto, apenas 92 ocorrem naturalmente e menos de 30 são encontrados em células vivas. Os 26 elementos restantes são instáveis e, portanto, não existem por muito tempo ou são teóricos e ainda não foram detectados.
Cada elemento é designado por seu símbolo químico (como H, N, O, C e Na) e possui propriedades únicas. Essas propriedades exclusivas permitem que os elementos se combinem e se unam entre si de maneiras específicas.
Átomos
Um átomo é o menor componente de um elemento que retém todas as propriedades químicas desse elemento. Por exemplo, um átomo de hidrogênio tem todas as propriedades do elemento hidrogênio, como ele existe como um gás à temperatura ambiente e se liga ao oxigênio para criar uma molécula de água. Os átomos de hidrogênio não podem ser divididos em nada menor, mantendo as propriedades do hidrogênio. Se um átomo de hidrogênio fosse dividido em partículas subatômicas, ele não teria mais as propriedades do hidrogênio.
No nível mais básico, todos os organismos são feitos de uma combinação de elementos. Eles contêm átomos que se combinam para formar moléculas. Em organismos multicelulares, como animais, as moléculas podem interagir para formar células que se combinam para formar tecidos, que compõem os órgãos. Essas combinações continuam até que organismos multicelulares inteiros sejam formados.
Todos os átomos contêm prótons, elétrons e nêutrons (Figura\(\PageIndex{1}\)). A única exceção é o hidrogênio (H), que é feito de um próton e um elétron. Um próton é uma partícula carregada positivamente que reside no núcleo (o núcleo do átomo) de um átomo e tem uma massa de 1 e uma carga de +1. Um elétron é uma partícula carregada negativamente que viaja no espaço ao redor do núcleo. Em outras palavras, ele reside fora do núcleo. Tem uma massa insignificante e uma carga de -1.
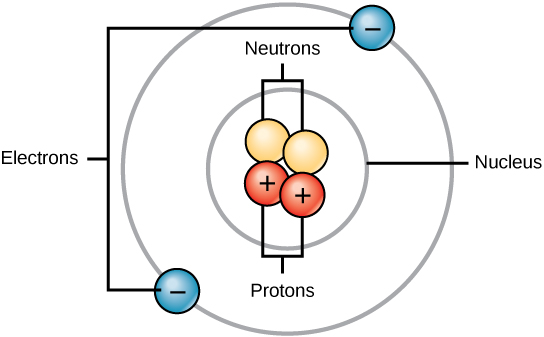
Os nêutrons, como os prótons, residem no núcleo de um átomo. Eles têm uma massa de 1 e nenhuma carga. As cargas positivas (prótons) e negativas (elétrons) se equilibram em um átomo neutro, que tem uma carga líquida zero.
Como prótons e nêutrons têm uma massa de 1, a massa de um átomo é igual ao número de prótons e nêutrons desse átomo. O número de elétrons não influencia a massa geral, porque sua massa é muito pequena.
Conforme mencionado anteriormente, cada elemento tem suas próprias propriedades exclusivas. Cada um contém um número diferente de prótons e nêutrons, dando a ele seu próprio número atômico e número de massa. O número atômico de um elemento é igual ao número de prótons que esse elemento contém. O número de massa, ou massa atômica, é o número de prótons mais o número de nêutrons desse elemento. Portanto, é possível determinar o número de nêutrons subtraindo o número atômico do número de massa.
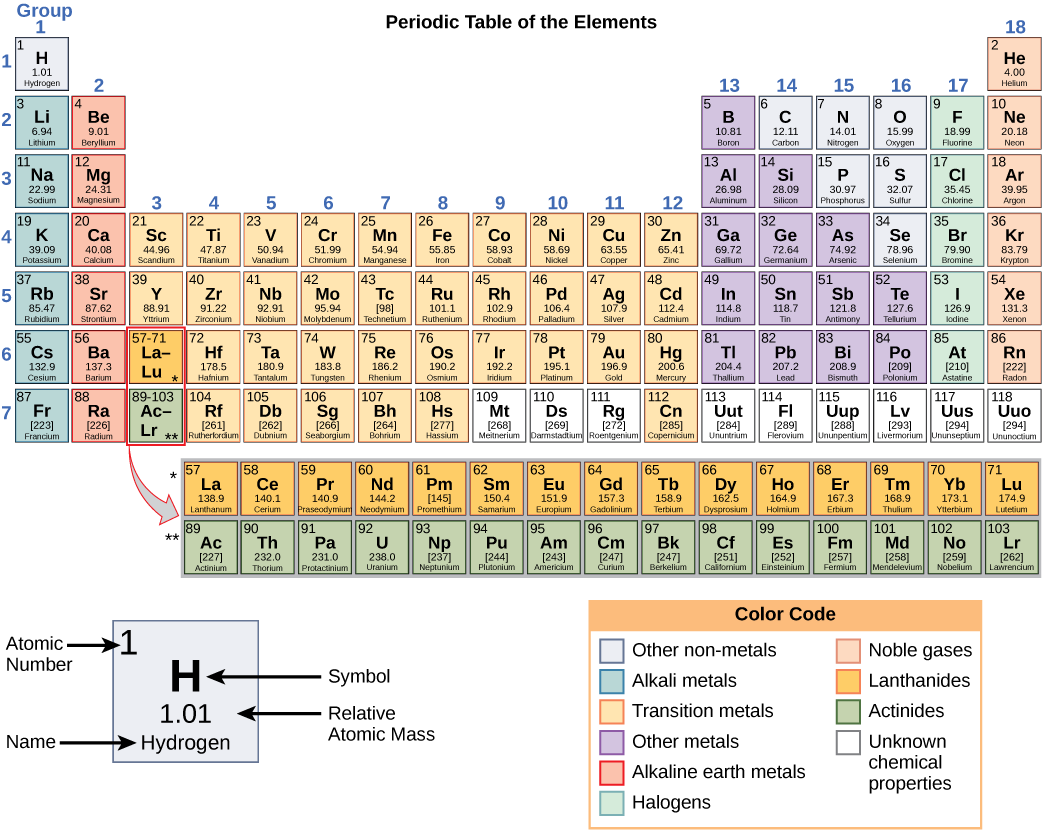
Esses números fornecem informações sobre os elementos e como eles reagirão quando combinados. Elementos diferentes têm diferentes pontos de fusão e ebulição e estão em estados diferentes (líquido, sólido ou gasoso) à temperatura ambiente. Eles também se combinam de maneiras diferentes. Alguns formam tipos específicos de títulos, enquanto outros não. A forma como eles se combinam é baseada no número de elétrons presentes. Por causa dessas características, os elementos são organizados na tabela periódica dos elementos, um gráfico dos elementos que inclui o número atômico e a massa atômica relativa de cada elemento. A tabela periódica também fornece informações importantes sobre as propriedades dos elementos (Figura\(\PageIndex{2}\)), geralmente indicadas pelo código de cores. A disposição da tabela também mostra como os elétrons em cada elemento estão organizados e fornece detalhes importantes sobre como os átomos reagirão uns com os outros para formar moléculas.
Isótopos são formas diferentes do mesmo elemento que têm o mesmo número de prótons, mas um número diferente de nêutrons. Alguns elementos, como carbono, potássio e urânio, têm isótopos naturais. O carbono-12, o isótopo mais comum de carbono, contém seis prótons e seis nêutrons. Portanto, ele tem um número de massa de 12 (seis prótons e seis nêutrons) e um número atômico de 6 (o que o torna carbono). O carbono-14 contém seis prótons e oito nêutrons. Portanto, tem um número de massa de 14 (seis prótons e oito nêutrons) e um número atômico de 6, o que significa que ainda é o elemento carbono. Essas duas formas alternativas de carbono são isótopos. Alguns isótopos são instáveis e perderão prótons, outras partículas subatômicas ou energia para formar elementos mais estáveis. Eles são chamados de isótopos radioativos ou radioisótopos.
CONEXÃO ARTÍSTICA
Quantos nêutrons (K) potássio-39 e potássio-40 têm, respectivamente?
EVOLUÇÃO EM AÇÃO: Datação por carbono
O carbono-14 (14 C) é um radioisótopo natural criado na atmosfera por raios cósmicos. Esse é um processo contínuo, então mais 14 C estão sempre sendo criados. Conforme um organismo vivo se desenvolve, o nível relativo de 14 C em seu corpo é igual à concentração de 14 C na atmosfera. Quando um organismo morre, ele não está mais ingerindo 14 C, então a proporção diminuirá. 14 C decai para 14 N por um processo chamado decaimento beta; ele emite energia nesse processo lento.
Após aproximadamente 5.730 anos, apenas metade da concentração inicial de 14 C terá sido convertida em 14 N. O tempo necessário para que metade da concentração original de um isótopo decaia para sua forma mais estável é chamado de meia-vida. Como a meia-vida de 14 C é longa, ela é usada para envelhecer objetos anteriormente vivos, como fósseis. Usando a razão entre a concentração de 14 C encontrada em um objeto e a quantidade de 14 C detectada na atmosfera, a quantidade do isótopo que ainda não se decompôs pode ser determinada. Com base nessa quantidade, a idade do fóssil pode ser calculada em cerca de 50.000 anos (Figura\(\PageIndex{3}\)). Isótopos com meia-vida mais longa, como o potássio-40, são usados para calcular a idade de fósseis mais antigos. Por meio do uso da datação por carbono, os cientistas podem reconstruir a ecologia e a biogeografia dos organismos que vivem nos últimos 50.000 anos.

CONCEITO EM AÇÃO
Para saber mais sobre átomos e isótopos, e como você pode diferenciar um isótopo de outro, visite este site e execute a simulação.
Ligações químicas
A forma como os elementos interagem uns com os outros depende de como seus elétrons estão dispostos e de quantas aberturas para elétrons existem na região mais externa onde os elétrons estão presentes em um átomo. Os elétrons existem em níveis de energia que formam camadas ao redor do núcleo. A camada mais próxima pode conter até dois elétrons. A concha mais próxima do núcleo é sempre preenchida primeiro, antes que qualquer outra concha possa ser preenchida. O hidrogênio tem um elétron; portanto, ele tem apenas um ponto ocupado dentro da camada mais baixa. O hélio tem dois elétrons; portanto, ele pode preencher completamente a camada mais baixa com seus dois elétrons. Se você observar a tabela periódica, verá que o hidrogênio e o hélio são os únicos dois elementos na primeira linha. Isso ocorre porque eles só têm elétrons em sua primeira camada. Hidrogênio e hélio são os únicos dois elementos que têm a camada mais baixa e nenhuma outra camada.
O segundo e o terceiro níveis de energia podem conter até oito elétrons. Os oito elétrons são organizados em quatro pares e uma posição em cada par é preenchida com um elétron antes que qualquer par seja concluído.
Olhando novamente a tabela periódica (Figura\(\PageIndex{2}\)), você notará que há sete linhas. Essas linhas correspondem ao número de conchas que os elementos dentro dessa linha têm. Os elementos dentro de uma linha específica têm um número crescente de elétrons à medida que as colunas vão da esquerda para a direita. Embora cada elemento tenha o mesmo número de camadas, nem todas estão completamente cheias de elétrons. Se você observar a segunda linha da tabela periódica, encontrará lítio (Li), berílio (Be), boro (B), carbono (C), nitrogênio (N), oxigênio (O), flúor (F) e néon (Ne). Todos eles têm elétrons que ocupam apenas a primeira e a segunda camadas. O lítio tem apenas um elétron em sua camada mais externa, o berílio tem dois elétrons, o boro tem três e assim por diante, até que a camada inteira seja preenchida com oito elétrons, como é o caso do néon.
Nem todos os elementos têm elétrons suficientes para preencher suas camadas mais externas, mas um átomo fica mais estável quando todas as posições dos elétrons na camada mais externa são preenchidas. Por causa dessas vagas nas camadas mais externas, vemos a formação de ligações químicas ou interações entre dois ou mais elementos iguais ou diferentes que resultam na formação de moléculas. Para alcançar maior estabilidade, os átomos tenderão a preencher completamente suas camadas externas e se unirão a outros elementos para atingir esse objetivo compartilhando elétrons, aceitando elétrons de outro átomo ou doando elétrons para outro átomo. Como as camadas mais externas dos elementos com números atômicos baixos (até cálcio, com número atômico 20) podem conter oito elétrons, isso é chamado de regra do octeto. Um elemento pode doar, aceitar ou compartilhar elétrons com outros elementos para preencher sua camada externa e satisfazer a regra do octeto.
Quando um átomo não contém números iguais de prótons e elétrons, ele é chamado de íon. Como o número de elétrons não é igual ao número de prótons, cada íon tem uma carga líquida. Os íons positivos são formados pela perda de elétrons e são chamados de cátions. Os íons negativos são formados pelo ganho de elétrons e são chamados de ânions.
Por exemplo, o sódio tem apenas um elétron em sua camada mais externa. É preciso menos energia para o sódio doar esse elétron do que para aceitar mais sete elétrons para preencher a camada externa. Se o sódio perder um elétron, ele agora tem 11 prótons e apenas 10 elétrons, deixando-o com uma carga geral de +1. Agora é chamado de íon sódio.
O átomo de cloro tem sete elétrons em sua camada externa. Novamente, é mais eficiente em termos energéticos que o cloro ganhe um elétron do que perca sete. Portanto, ele tende a ganhar um elétron para criar um íon com 17 prótons e 18 elétrons, dando a ele uma carga líquida negativa (—1). Agora é chamado de íon cloreto. Esse movimento de elétrons de um elemento para outro é conhecido como transferência de elétrons. Como\(\PageIndex{4}\) ilustra a Figura, um átomo de sódio (Na) tem apenas um elétron em sua camada mais externa, enquanto um átomo de cloro (Cl) tem sete elétrons em sua camada mais externa. Um átomo de sódio doará seu único elétron para esvaziar sua camada, e um átomo de cloro aceitará esse elétron para preencher sua camada, tornando-se cloreto. Ambos os íons agora satisfazem a regra do octeto e têm camadas externas completas. Como o número de elétrons não é mais igual ao número de prótons, cada um agora é um íon e tem uma carga +1 (sódio) ou —1 (cloreto).
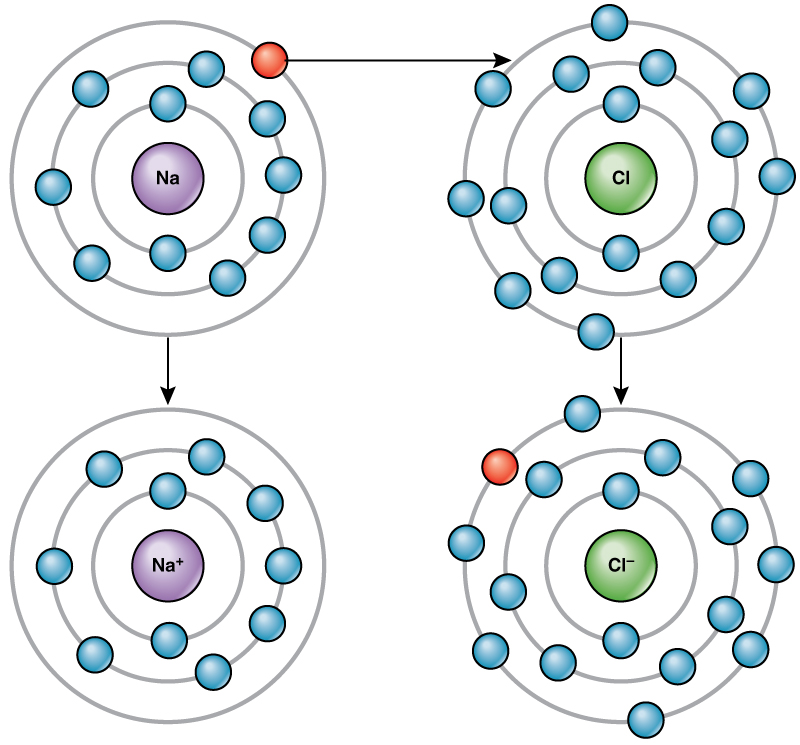
Ligações iônicas
Existem quatro tipos de ligações ou interações: iônicas, covalentes, ligações de hidrogênio e interações de van der Waals. Ligações iônicas e covalentes são interações fortes que requerem uma maior entrada de energia para se separarem. Quando um elemento doa um elétron de sua camada externa, como no exemplo do átomo de sódio acima, um íon positivo é formado. O elemento que aceita o elétron agora está carregado negativamente. Como as cargas positivas e negativas se atraem, esses íons permanecem juntos e formam uma ligação iônica, ou uma ligação entre íons. Os elementos se unem ao elétron de um elemento, permanecendo predominantemente com o outro elemento. Quando os íons Na + e Cl — se combinam para produzir NaCl, um elétron de um átomo de sódio permanece com os outros sete do átomo de cloro, e os íons sódio e cloreto se atraem em uma rede de íons com uma carga líquida zero.
Ligações covalentes
Outro tipo de ligação química forte entre dois ou mais átomos é uma ligação covalente. Essas ligações se formam quando um elétron é compartilhado entre dois elementos e são a forma mais forte e comum de ligação química em organismos vivos. Ligações covalentes se formam entre os elementos que compõem as moléculas biológicas em nossas células. Ao contrário das ligações iônicas, as ligações covalentes não se dissociam na água.
Os átomos de hidrogênio e oxigênio que se combinam para formar moléculas de água são unidos por ligações covalentes. O elétron do átomo de hidrogênio divide seu tempo entre a camada externa do átomo de hidrogênio e a camada externa incompleta do átomo de oxigênio. Para preencher completamente a camada externa de um átomo de oxigênio, dois elétrons de dois átomos de hidrogênio são necessários, daí o subscrito “2” em H 2 O. Os elétrons são compartilhados entre os átomos, dividindo seu tempo entre eles para “preencher” a camada externa de cada um. Esse compartilhamento é um estado de energia mais baixo para todos os átomos envolvidos do que se eles existissem sem suas camadas externas preenchidas.
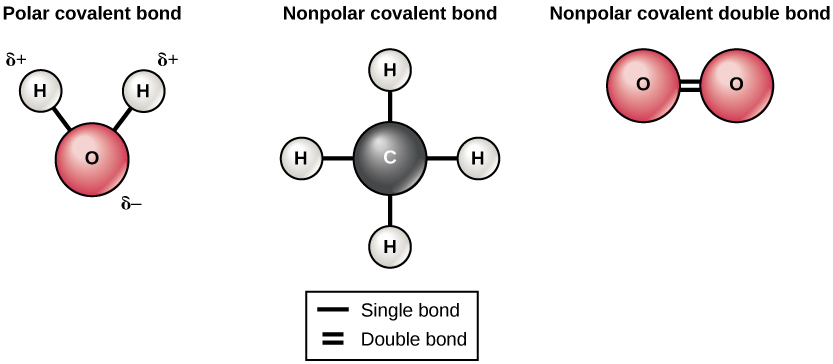
Existem dois tipos de ligações covalentes: polares e não polares. Ligações covalentes não polares se formam entre dois átomos do mesmo elemento ou entre elementos diferentes que compartilham os elétrons igualmente. Por exemplo, um átomo de oxigênio pode se ligar a outro átomo de oxigênio para preencher suas camadas externas. Essa associação é apolar porque os elétrons serão igualmente distribuídos entre cada átomo de oxigênio. Duas ligações covalentes se formam entre os dois átomos de oxigênio porque o oxigênio requer dois elétrons compartilhados para preencher sua camada mais externa. Os átomos de nitrogênio formarão três ligações covalentes (também chamadas de tripla covalente) entre dois átomos de nitrogênio porque cada átomo de nitrogênio precisa de três elétrons para preencher sua camada mais externa. Outro exemplo de ligação covalente não polar é encontrado na molécula de metano (CH 4). O átomo de carbono tem quatro elétrons em sua camada mais externa e precisa de mais quatro para preenchê-lo. Ele obtém esses quatro de quatro átomos de hidrogênio, cada átomo fornecendo um. Todos esses elementos compartilham os elétrons igualmente, criando quatro ligações covalentes não polares (Figura\(\PageIndex{5}\)).
Em uma ligação polar covalente, os elétrons compartilhados pelos átomos passam mais tempo mais perto de um núcleo do que do outro núcleo. Devido à distribuição desigual de elétrons entre os diferentes núcleos, uma carga ligeiramente positiva (δ+) ou levemente negativa (δ—) se desenvolve. As ligações covalentes entre os átomos de hidrogênio e oxigênio na água são ligações polares covalentes. Os elétrons compartilhados passam mais tempo perto do núcleo de oxigênio, dando a ele uma pequena carga negativa, do que perto dos núcleos de hidrogênio, dando a essas moléculas uma pequena carga positiva.
ligações de hidrogênio
Ligações iônicas e covalentes são ligações fortes que requerem energia considerável para serem quebradas. No entanto, nem todas as ligações entre os elementos são ligações iônicas ou covalentes. Laços mais fracos também podem se formar. São atrações que ocorrem entre cargas positivas e negativas que não requerem muita energia para serem quebradas. Duas ligações fracas que ocorrem com frequência são as ligações de hidrogênio e as interações de van der Waals. Essas ligações dão origem às propriedades únicas da água e às estruturas únicas do DNA e das proteínas.
Quando se formam ligações covalentes polares contendo um átomo de hidrogênio, o átomo de hidrogênio nessa ligação tem uma carga ligeiramente positiva. Isso ocorre porque o elétron compartilhado é puxado com mais força para o outro elemento e para longe do núcleo de hidrogênio. Como o átomo de hidrogênio é ligeiramente positivo (δ+), ele será atraído pelas cargas parciais negativas vizinhas (δ—). Quando isso acontece, ocorre uma interação fraca entre a carga δ+ do átomo de hidrogênio de uma molécula e a carga δ— da outra molécula. Essa interação é chamada de ligação de hidrogênio. Esse tipo de ligação é comum; por exemplo, a natureza líquida da água é causada pelas ligações de hidrogênio entre as moléculas de água (Figura\(\PageIndex{6}\)). As ligações de hidrogênio dão à água as propriedades únicas que sustentam a vida. Se não fosse pela ligação de hidrogênio, a água seria um gás e não um líquido à temperatura ambiente.
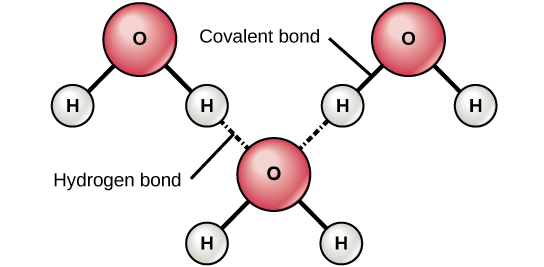
Ligações de hidrogênio podem se formar entre diferentes moléculas e nem sempre precisam incluir uma molécula de água. Átomos de hidrogênio em ligações polares dentro de qualquer molécula podem formar ligações com outras moléculas adjacentes. Por exemplo, as ligações de hidrogênio unem duas longas cadeias de DNA para dar à molécula de DNA sua estrutura característica de fita dupla. As ligações de hidrogênio também são responsáveis por parte da estrutura tridimensional das proteínas.
Interações de van der Waals
Como as ligações de hidrogênio, as interações de van der Waals são atrações fracas ou interações entre moléculas. Eles ocorrem entre átomos polares, ligados covalentemente, em diferentes moléculas. Algumas dessas atrações fracas são causadas por cargas parciais temporárias formadas quando os elétrons se movem ao redor de um núcleo. Essas interações fracas entre as moléculas são importantes nos sistemas biológicos.
CARREIRAS EM AÇÃO: Técnico em Radiografia
Você ou alguém que você conhece já fez uma ressonância magnética (ressonância magnética), uma mamografia ou um raio-X? Esses testes produzem imagens de tecidos moles e órgãos (como em uma ressonância magnética ou mamografia) ou de seus ossos (como acontece em um raio-X) usando ondas de rádio ou isótopos especiais (radiomarcados ou marcados com fluorescência) que são ingeridos ou injetados no corpo. Esses testes fornecem dados para diagnósticos de doenças criando imagens de seus órgãos ou sistema esquelético.
A ressonância magnética funciona submetendo os núcleos de hidrogênio, que são abundantes na água dos tecidos moles, a campos magnéticos flutuantes, que fazem com que eles emitam seu próprio campo magnético. Esse sinal é então lido pelos sensores da máquina e interpretado por um computador para formar uma imagem detalhada.
Alguns tecnólogos e técnicos de radiografia são especializados em tomografia computadorizada, ressonância magnética e mamografia. Eles produzem filmes ou imagens do corpo que ajudam os profissionais médicos a examinar e diagnosticar. Os radiologistas trabalham diretamente com os pacientes, explicando as máquinas, preparando-os para os exames e garantindo que seu corpo ou partes do corpo estejam posicionados corretamente para produzir as imagens necessárias. Médicos ou radiologistas então analisam os resultados do teste.
Técnicos de radiografia podem trabalhar em hospitais, consultórios médicos ou centros de imagem especializados. O treinamento para se tornar um técnico de radiografia acontece em hospitais, faculdades e universidades que oferecem certificados, diplomas de associado ou bacharelado em radiografia.
Resumo
Matéria é qualquer coisa que ocupe espaço e tenha massa. É composto por átomos de diferentes elementos. Todos os 92 elementos que ocorrem naturalmente têm qualidades únicas que permitem que eles se combinem de várias maneiras para criar compostos ou moléculas. Os átomos, que consistem em prótons, nêutrons e elétrons, são as menores unidades de um elemento que retêm todas as propriedades desse elemento. Os elétrons podem ser doados ou compartilhados entre átomos para criar ligações, incluindo ligações iônicas, covalentes e de hidrogênio, bem como interações de van der Waals.
Conexões artísticas
Figura\(\PageIndex{2}\): Quantos nêutrons (K) potássio-39 e potássio-40 têm, respectivamente?
- Resposta
-
O potássio-39 tem vinte nêutrons. O potássio-40 tem vinte e um nêutrons.
Glossário
- ânion
- um íon negativo formado pelo ganho de elétrons
- número atômico
- o número de prótons em um átomo
- catião
- um íon positivo formado pela perda de elétrons
- ligação química
- uma interação entre dois ou mais elementos iguais ou diferentes que resulta na formação de moléculas
- ligação covalente
- um tipo de ligação forte entre dois ou mais elementos iguais ou diferentes; formas quando elétrons são compartilhados entre elementos
- elétron
- uma partícula carregada negativamente que reside fora do núcleo no orbital de elétrons; carece de massa funcional e tem uma carga de -1
- transferência de elétrons
- o movimento dos elétrons de um elemento para outro
- elemento
- uma das 118 substâncias únicas que não podem ser decompostas em substâncias menores e retêm a característica dessa substância; cada elemento tem um número específico de prótons e propriedades únicas
- ligação de hidrogênio
- uma ligação fraca entre átomos de hidrogênio parcialmente carregados positivamente e elementos ou moléculas parcialmente carregados negativamente
- íon
- um átomo ou composto que não contém números iguais de prótons e elétrons e, portanto, tem uma carga líquida
- ligação iônica
- uma ligação química que se forma entre íons de cargas opostas
- isótopo
- uma ou mais formas de um elemento que têm números diferentes de nêutrons
- número de massa
- o número de prótons mais nêutrons em um átomo
- importam
- qualquer coisa que tenha massa e ocupe espaço
- nêutron
- uma partícula sem carga que reside no núcleo de um átomo; tem uma massa de 1
- ligação covalente não polar
- um tipo de ligação covalente que se forma entre os átomos quando os elétrons são compartilhados igualmente entre os átomos, resultando em nenhuma região com cargas parciais, como nas ligações covalentes polares
- núcleo
- (química) o centro denso de um átomo composto de prótons e (exceto no caso de um átomo de hidrogênio) nêutrons
- regra do octeto
- afirma que a camada mais externa de um elemento com um número atômico baixo pode conter oito elétrons
- tabela periódica de elementos
- um organograma dos elementos, indicando o número atômico e o número de massa de cada elemento; também fornece informações importantes sobre as propriedades dos elementos
- ligação covalente polar
- um tipo de ligação covalente na qual os elétrons são puxados em direção a um átomo e se afastam de outro, resultando em regiões levemente positivas e levemente negativas da molécula
- próton
- uma partícula carregada positivamente que reside no núcleo de um átomo; tem uma massa de 1 e uma carga de +1
- isótopo radioativo
- um isótopo que emite espontaneamente partículas ou energia para formar um elemento mais estável
- interação de van der Waals
- uma atração ou interação fraca entre moléculas causada por átomos levemente carregados positivamente ou levemente negativamente carregados


