2.E: Introdução à Teoria Cinética dos Gases (Exercícios)
- Page ID
- 184660
Perguntas conceituais
2.1 Modelo molecular de um gás ideal
1. Duas\(\displaystyle H_2\) moléculas podem reagir com uma (O_2\) molécula para produzir duas\(\displaystyle H_2O\) moléculas. Quantos moles de moléculas de hidrogênio são necessários para reagir com um mol de moléculas de oxigênio?
2. Em que circunstâncias você esperaria que um gás se comportasse de forma significativamente diferente do previsto pela lei do gás ideal?
3. Um termômetro de gás de volume constante contém uma quantidade fixa de gás. Qual propriedade do gás é medida para indicar sua temperatura?
4. Encha um balão em temperatura ambiente. Deixe o balão inflado na geladeira durante a noite. O que acontece com o balão e por quê?
5. No último capítulo, a convecção livre foi explicada como resultado das forças de empuxo em fluidos quentes. Explique o movimento ascendente do ar em chamas com base na lei do gás ideal.
2.2 Pressão, temperatura e velocidade RMS
6. Como o momentum está relacionado à pressão exercida por um gás? Explique no nível molecular, considerando o comportamento das moléculas.
7. Se um tipo de molécula tem o dobro do raio de outra e oito vezes a massa, como seus caminhos livres médios nas mesmas condições se comparam? Como seus tempos livres médios se comparam?
8. Qual é a velocidade média das moléculas de ar na sala onde você está agora?
9. Por que as atmosferas de Júpiter, Saturno, Urano e Netuno, que são muito mais massivas e distantes do Sol do que a Terra, contêm grandes quantidades de hidrogênio e hélio?
10. A mecânica estatística diz que em um gás mantido a uma temperatura constante por meio do contato térmico com um sistema maior (um “reservatório”) nessa temperatura, as flutuações na energia interna são normalmente uma fração\(\displaystyle 1/\sqrt{N}\) da energia interna. Como uma fração da energia interna total de um mol de gás, quão grandes são as flutuações na energia interna? Estamos justificados em ignorá-los?
11. O que é mais perigoso, um armário onde os tanques de nitrogênio são armazenados ou um onde os tanques de dióxido de carbono são armazenados?
2.3 Capacidade térmica e equipartição de energia
12. Experimentalmente, parece que os graus de liberdade vibracional de muitas moléculas poliatômicas podem contribuir, em certa medida, para sua energia à temperatura ambiente. Você esperaria que esse fato aumentasse ou diminuísse sua capacidade de aquecimento a partir do valor R? Explique.
13. Pode-se pensar que a energia interna dos gases diatômicos é dada por\(\displaystyle E_{int}=5RT/2\).. Os gases diatômicos próximos à temperatura ambiente têm mais ou menos energia interna do que isso? Dica: Sua energia interna inclui a energia total adicionada ao elevar a temperatura do ponto de ebulição (muito baixo) para a temperatura ambiente.
14. Você mistura 5 moles de\(\displaystyle H_2\) 300 K com 5 moles de He a 360 K em um calorímetro perfeitamente isolado. A temperatura final é maior ou menor do que 330 K?
2.4 Distribuição de velocidades moleculares
15. Um cilindro contém gás hélio e outro contém gás criptônio na mesma temperatura. Marque cada uma dessas afirmações como verdadeira, falsa ou impossível de determinar a partir das informações fornecidas.
(a) As velocidades rms dos átomos nos dois gases são as mesmas.
(b) As energias cinéticas médias dos átomos nos dois gases são as mesmas.
(c) As energias internas de 1 mol de gás em cada cilindro são as mesmas.
(d) As pressões nos dois cilindros são as mesmas.
16. Repita a pergunta anterior se um gás ainda for hélio, mas o outro for alterado para flúor,\(\displaystyle F_2\).
17. Um gás ideal está a uma temperatura de 300 K. Para dobrar a velocidade média de suas moléculas, para que a temperatura precisa ser alterada?
Problemas
2.1 Modelo molecular de um gás ideal
18. A pressão manométrica nos pneus do seu carro é\(\displaystyle 2.50×10^5N/m^2\) de 35,0° C quando você os dirige para um navio em Los Angeles para ser enviado ao Alasca. Qual é a pressão manométrica em uma noite no Alasca, quando a temperatura caiu para −40,0°C? Suponha que os pneus não tenham ganho ou perdido ar.
19. Suponha que uma lâmpada incandescente cheia de gás seja fabricada de forma que o gás dentro da lâmpada esteja na pressão atmosférica quando a lâmpada tiver uma temperatura de 20,0° C.
(a) Encontre a pressão manométrica dentro dessa lâmpada quando ela estiver quente, assumindo que sua temperatura média seja de 60,0° C (uma aproximação) e negligenciando qualquer alteração no volume devido à expansão térmica ou vazamentos de gás.
(b) A pressão final real da lâmpada será menor do que a calculada na parte (a) porque a lâmpada de vidro se expandirá. Esse efeito é significativo?
20. As pessoas que compram alimentos em sacos selados em altitudes elevadas geralmente percebem que os sacos estão inchados porque o ar interno se expandiu. Um saco de pretzels foi embalado a uma pressão de 1,00 atm e uma temperatura de 22,0° C. Quando aberto em um piquenique de verão em Santa Fé, Novo México, a uma temperatura de 32,0° C, o volume do ar na bolsa é 1,38 vezes o volume original. Qual é a pressão do ar?
21. Quantas toupeiras existem em
(a) 0,0500 g de\(\displaystyle N_2\) gás (m = 28,0 g/mol)?
(b) 10,0 g de\(\displaystyle CO_2\) gás (m = 44,0 g/mol)?
(c) Quantas moléculas estão presentes em cada caso?
22. Um recipiente cúbico de volume de 2,00 L contém 0,500 mol de gás nitrogênio a uma temperatura de 25,0° C. Qual é a força líquida devida ao nitrogênio em uma parede do recipiente? Compare essa força com o peso da amostra.
23. Calcule o número de toupeiras no volume de ar de 2,00 L nos pulmões de uma pessoa média. Observe que o ar está a 37,0° C (temperatura corporal) e que o volume total nos pulmões é várias vezes a quantidade inalada em uma respiração típica, conforme indicado no Exemplo 2.2.
24. Um passageiro\(\displaystyle 100cm^3\) de avião tem ar no estômago pouco antes de decolar de um aeroporto no nível do mar. Qual volume o ar terá na altitude de cruzeiro se a pressão da cabine cair para\(\displaystyle 7.50×10^4N/m^2\)?
25. Uma empresa anuncia que fornece hélio a uma pressão manométrica de\(\displaystyle 1.72×10^7Pa\) um cilindro de volume 43,8 L. Quantos balões podem ser inflados até um volume de 4,00 L com essa quantidade de hélio? Suponha que a pressão dentro dos balões seja 1,01 × 105Pa1,01 × 105Pa e a temperatura no cilindro e nos balões seja 25,0° C25,0° C.
26. De acordo com http://hyperphysics.phy-astr.gsu.edu... /venusenv.html, a atmosfera de Vênus é de aproximadamente\(\displaystyle 96.5%CO_2\) e\(\displaystyle 3.5%N_2\) por volume. Na superfície, onde a temperatura é de cerca de 750 K e a pressão é de cerca de 90 atm, qual é a densidade da atmosfera?
27. Um sistema de vácuo caro pode atingir uma pressão tão baixa quanto\(\displaystyle 1.00×10^{−7}N/m^2\) a 20,0° C. Quantas moléculas existem em um centímetro cúbico nessa pressão e temperatura?
28. A densidade numérica N/V das moléculas de gás em um determinado local no espaço acima do nosso planeta é de aproximadamente\(\displaystyle 1.00×10^{11}m^{−3}\), e a pressão está\(\displaystyle 2.75×10^{−10N}/m^2\) nesse espaço. Qual é a temperatura lá?
29. Um pneu de bicicleta contém 2,00 L de gás a uma pressão absoluta de\(\displaystyle 7.00×10^5N/m^2\) e uma temperatura de 18,0°C. Qual será sua pressão se você soltar uma quantidade de ar com um volume de\(\displaystyle 100cm^3\) pressão atmosférica? Suponha que a temperatura e o volume do pneu perman
30. Em uma demonstração comum, uma garrafa é aquecida e tampada com um ovo cozido que é um pouco maior que o gargalo da garrafa. Quando a garrafa é resfriada, a diferença de pressão entre o interior e o exterior força o ovo a entrar na garrafa. Suponha que a garrafa tenha um volume de 0,500 L e a temperatura interna seja aumentada para 80,0° C, enquanto a pressão permanece constante em 1,00 atm porque a garrafa está aberta.
(a) Quantos moles de ar estão dentro?
(b) Agora o ovo é colocado no lugar, selando a garrafa. Qual é a pressão manométrica interna depois que o ar esfria de volta à temperatura ambiente de 25° C, mas antes que o ovo seja forçado a entrar na garrafa?
31. Um cilindro de gás de alta pressão contém 50,0 L de gás tóxico a uma pressão de\(\displaystyle 1.40×10^7N/m^2\) e uma temperatura de 25,0° C. O cilindro é resfriado até a temperatura do gelo seco (−78,5° C) para reduzir a taxa de vazamento e a pressão para que possa ser reparado com segurança.
(a) Qual é a pressão final no tanque, assumindo uma quantidade insignificante de vazamentos de gás durante o resfriamento e que não há mudança de fase?
(b) Qual é a pressão final se um décimo do gás escapar? (c) A que temperatura o tanque deve ser resfriado para reduzir a pressão para 1,00 atm (supondo que o gás não mude de fase e que não haja vazamento durante o resfriamento)? (d) O resfriamento do tanque como em parte
(c) parecem ser uma solução prática?
32. Determine o número de moles em 2,00 L de gás a 35,0°C e sob\(\displaystyle 7.41×10^7N/m^2\) pressão.
33. Calcule a profundidade na qual o número de bolas de tênis de mesa de Avogadro cobriria a Terra. Cada bola tem um diâmetro de 3,75 cm. Suponha que o espaço entre as bolas acrescente 25,0% extras ao seu volume e suponha que elas não sejam esmagadas por seu próprio peso.
34. a) Qual é a pressão manométrica em um pneu de carro de 25,0° C contendo 3,60 mol de gasolina em um volume de 30,0 L?
(b) Qual será sua pressão manométrica se você adicionar 1,00 L de gás originalmente à pressão atmosférica e 25,0° C? Suponha que a temperatura permaneça em 25,0°C e o volume permaneça constante.
2.2 Pressão, temperatura e velocidade RMS
Nos problemas desta seção, suponha que todos os gases sejam ideais.
35. Uma pessoa bate em uma bola de tênis com uma massa de 0,058 kg contra uma parede. O componente médio da velocidade da bola perpendicular à parede é de 11 m/s, e a bola atinge a parede a cada 2,1 s em média, recuperando com o componente de velocidade perpendicular oposto.
(a) Qual é a força média exercida na parede?
(b) Se a parte da parede que a pessoa atinge tem uma área de\(\displaystyle 3.0m^2\), qual é a pressão média nessa área?
36. Uma pessoa está em uma sala fechada (uma quadra de raquetebol)\(\displaystyle V=453m^3\) batendo uma bola (m=42,0g) (m=42,0g) aleatoriamente, sem pausas. A energia cinética média da bola é de 2,30 J.
(a) Qual é o valor médio de\(\displaystyle v^2_x\)? Importa qual direção você toma para ser x?
(b) Aplicando os métodos deste capítulo, encontre a pressão média nas paredes?
(c) Além da presença de apenas uma “molécula” nesse problema, qual é a principal suposição em Pressão, Temperatura e Velocidade RMS que não se aplica aqui?
37. Cinco ciclistas estão andando nas seguintes velocidades: 5,4 m/s, 5,7 m/s, 5,8 m/s, 6,0 m/s e 6,5 m/s. (a) Qual é a velocidade média deles? (b) Qual é a velocidade de seus rms?
38. Algumas lâmpadas incandescentes são preenchidas com gás argônio. O que é\(\displaystyle v_{rms}\) para átomos de argônio próximos ao filamento, supondo que sua temperatura seja de 2500 K?
39. As velocidades moleculares típicas (\(\displaystyle v_{rms}\)) são grandes, mesmo em baixas temperaturas. O que é\(\displaystyle v_{rms}\) para átomos de hélio a 5,00 K, menos de um grau acima da temperatura de liquefação do hélio?
40. Qual é a energia cinética média em joules de átomos de hidrogênio na superfície de 5500°C do Sol?
(b) Qual é a energia cinética média dos átomos de hélio em uma região da coroa solar onde está a temperatura\(\displaystyle 6.00×10^5K\)?
41. Qual é a razão entre a energia cinética translacional média de uma molécula de nitrogênio a uma temperatura de 300 K e a energia potencial gravitacional de um sistema terrestre com molécula de nitrogênio no teto de uma sala de 3 m de altura em relação ao mesmo sistema com a molécula no chão?
42. Qual é a energia cinética translacional total das moléculas de ar em uma sala de volume\(\displaystyle 23m^3\) se a pressão for\(\displaystyle 9.5×10^4Pa\) (a sala está em uma elevação bastante alta) e a temperatura é de 21°C? Algum item de dados é desnecessário para a solução?
43. O produto da pressão e do volume de uma amostra de gás hidrogênio a 0,00°C é 80,0 J.
(a) Quantos moles de hidrogênio estão presentes?
(b) Qual é a energia cinética translacional média das moléculas de hidrogênio?
(c) Qual é o valor do produto de pressão e volume a 200° C?
44. Qual é a pressão manométrica dentro de um tanque\(\displaystyle 4.86×10^4mol\) de nitrogênio comprimido com um volume de\(\displaystyle 6.56m^3\) se a velocidade rms for de 514 m/s?
45. Se a velocidade rms das moléculas de oxigênio dentro de um refrigerador de volume\(\displaystyle 22.0ft.^3\) for de 465 m/s, qual é a pressão parcial do oxigênio? Existem 5,71 moles de oxigênio na geladeira e a massa molar de oxigênio é de 32,0 g/mol.
46. A velocidade de escape de qualquer objeto da Terra é de 11,1 km/s. A que temperatura as moléculas de oxigênio (a massa molar é igual a 32,0 g/mol) teriam a velocidade quadrada média da raiz\(\displaystyle v_{rms}\) igual à velocidade de escape da Terra de 11,1 km/s?
47. A velocidade de escape da Lua é muito menor do que a da Terra, apenas 2,38 km/s. A que temperatura as moléculas de hidrogênio (massa molar é igual a 2,016 g/mol) teriam uma velocidade quadrada média vrmsvrms igual à velocidade de escape da Lua?
48. A fusão nuclear, a fonte de energia do Sol, bombas de hidrogênio e reatores de fusão, ocorre muito mais facilmente quando a energia cinética média dos átomos é alta, ou seja, em altas temperaturas. Suponha que você queira que os átomos em seu experimento de fusão tenham energias cinéticas médias de\(\displaystyle 6.40×10^{−14}J\). Qual temperatura é necessária?
49. Suponha que a velocidade típica (\(\displaystyle v_{rms}\)) das moléculas de dióxido de carbono (massa molar é 44,0 g/mol) em uma chama seja de 1350 m/s. Que temperatura isso indica?
50. (a) As moléculas de hidrogênio (a massa molar é igual a 2,016 g/mol) têm vrmsvrms igual a 193 m/s. Qual é a temperatura? (b) Grande parte do gás próximo ao Sol é hidrogênio atômico (H em vez de\(\displaystyle H_2\)). Sua temperatura teria que ser\(\displaystyle 1.5×10^7K\) para que a velocidade rms vrmsvrms fosse igual à velocidade de escape do Sol. O que é essa velocidade?
51. Existem dois isótopos importantes de urânio,\(\displaystyle ^{235}U\) e\(\displaystyle ^{238}U\); esses isótopos são quase idênticos quimicamente, mas têm massas atômicas diferentes. Só\(\displaystyle ^{235}U\) é muito útil em reatores nucleares. A separação dos isótopos é chamada de enriquecimento de urânio (e está frequentemente nas notícias até o momento em que este livro foi escrito, devido à preocupação de que alguns países estejam enriquecendo urânio com o objetivo de fabricar armas nucleares). Uma das técnicas de enriquecimento, a difusão de gás, é baseada nas diferentes velocidades moleculares do gás hexafluoreto de urânio,\(\displaystyle UF_6\).
(a) As massas molares de\(\displaystyle ^{235}U\) e\(\displaystyle ^{238}UF_6\) são 349,0 g/mol e 352,0 g/mol, respectivamente. Qual é a proporção de suas velocidades típicas vrmsvrms?
(b) Em que temperatura suas velocidades típicas seriam diferentes em 1,00 m/s?
(c) Suas respostas a esse problema implicam que essa técnica pode ser difícil?
52. A pressão parcial do dióxido de carbono nos pulmões é de cerca de 470 Pa quando a pressão total nos pulmões é de 1,0 atm. Qual porcentagem das moléculas de ar nos pulmões é dióxido de carbono? Compare seu resultado com a porcentagem de dióxido de carbono na atmosfera, cerca de 0,033%.
53. O ar seco consiste em aproximadamente 78% de nitrogênio, 21% de oxigênio e 1% de argônio por mol, com vestígios de outros gases. Um tanque de ar comprimido seco tem um volume de 1,76 pés cúbicos a uma pressão manométrica de 2200 libras por polegada quadrada e uma temperatura de 293 K. Quanto oxigênio ele contém nas toupeiras?
54. (a) Usando dados do problema anterior, encontre a massa de nitrogênio, oxigênio e argônio em 1 mol de ar seco. A massa molar de\(\displaystyle N_2\) é 28,0 g/mol, a de\(\displaystyle O_2\) é 32,0 g/mol e a do argônio é 39,9 g/mol.
(b) O ar seco é misturado com pentano (\(\displaystyle C_5H_{12}\)massa molar 72,2 g/mol), um importante constituinte da gasolina, em uma proporção ar-combustível de 15:1 em massa (aproximadamente típica para motores de automóveis). Determine a pressão parcial do pentano nesta mistura a uma pressão total de 1,00 atm.
55. (a) Dado que o ar é 21% de oxigênio, encontre a pressão atmosférica mínima que forneça uma pressão parcial de oxigênio relativamente segura de 0,16 atm.
(b) Qual é a pressão mínima que fornece uma pressão parcial de oxigênio acima do nível rapidamente fatal de 0,06 atm?
(c) A pressão do ar no cume do Monte Everest (8848 m) é de 0,334 atm. Por que algumas pessoas escalaram sem oxigênio, enquanto outras que tentaram, mesmo tendo treinado em grandes altitudes, tiveram que voltar atrás?
56. (a) Se a pressão parcial do vapor de água for 8,05 torr, qual é o ponto de condensação? (760 torr = 1 ATM = 101.325 PA)
(b) Em um dia quente em que a temperatura do ar é de 35°C e o ponto de orvalho é de 25°C, quais são a pressão parcial da água no ar e a umidade relativa do ar?
2.3 Capacidade térmica e equipartição de energia
57. Para dar a um átomo de hélio um momento angular diferente de zero requer cerca de 21,2 eV de energia (ou seja, 21,2 eV é a diferença entre as energias da energia mais baixa ou do estado fundamental e o estado de menor energia com momento angular). O elétron-volt ou eV é definido como\(\displaystyle 1.60×10^{−19}J.\) Encontre a temperatura T onde essa quantidade de energia é igual\(\displaystyle k_BT/2\). Isso explica por que podemos ignorar a energia rotacional do hélio para a maioria dos propósitos? (Os resultados para outros gases monoatômicos e para gases diatômicos girando em torno do eixo que conecta os dois átomos têm ordens de magnitude comparáveis.)
58. (a) Quanto calor deve ser adicionado para elevar a temperatura de 1,5 mol de ar de 25,0° C para 33,0° C em volume constante? Suponha que o ar seja completamente diatômico.
(b) Repita o problema para o mesmo número de moles de xenônio, Xe.
59. Um recipiente rígido e selado de 0,560 mol de um gás ideal desconhecido a uma temperatura de 30,0° C é resfriado a −40,0° C. No processo, 980 J de calor são removidos do gás. O gás é monoatômico, diatômico ou poliatômico?
60. Uma amostra de gás neon (Ne, massa molar M = 20,2 g/mol) a uma temperatura de 13,0° C é colocada em um recipiente de aço de massa 47,2 g que está a uma temperatura de −40,0° C. A temperatura final é −28,0° C. (Nenhum calor é trocado com o ambiente e você pode negligenciar qualquer alteração no volume do recipiente.) Qual é a massa da amostra de néon?
61. Um recipiente de aço de massa 135 g contém 24,0 g de amônia\(\displaystyle NH_3\),, que tem uma massa molar de 17,0 g/mol. O recipiente e o gás estão em equilíbrio a 12,0°C. Quanto calor precisa ser removido para atingir uma temperatura de −20,0° C? Ignore a mudança no volume do aço.
62. Uma sala selada tem um volume de\(\displaystyle 24m^3\). É preenchido com ar, que pode ser considerado diatômico, a uma temperatura de 24° C e uma pressão de 9,83 × 104 Pa. 9,83 × 104 Pa. Um bloco de gelo de 1,00 kg em seu ponto de fusão é colocado na sala. Suponha que as paredes da sala não transfiram calor. Qual é a temperatura de equilíbrio?
63. O Heliox, uma mistura de hélio e oxigênio, às vezes é administrado a pacientes hospitalares que têm dificuldade em respirar, porque a baixa massa de hélio facilita a respiração do que o ar. Suponha que o hélio a 25° C seja misturado com oxigênio a 35° C para fazer uma mistura de 70% de hélio por mol. Qual é a temperatura final? Ignore qualquer fluxo de calor de ou para os arredores e suponha que o volume final seja a soma dos volumes iniciais.
64. Mergulhadores profissionais às vezes usam heliox, consistindo em 79% de hélio e 21% de oxigênio por toupeira. Suponha que um tanque de mergulho perfeitamente rígido com um volume de 11 L contenha heliox a uma pressão absoluta de 31° C.\(\displaystyle 2.1×10^7Pa\)
(a) Quantos moles de hélio e quantos moles de oxigênio estão no tanque?
(b) O mergulhador desce até um ponto em que a temperatura do mar é de 27° C enquanto usa uma quantidade insignificante da mistura. Quando o gás no tanque atinge essa nova temperatura, quanto calor é removido dele?
65. Nas corridas de carros, uma vantagem de misturar óxido nitroso líquido (\(\displaystyle N_2O\)) com ar é que a ebulição do “nitroso” absorve o calor latente da vaporização e, assim, resfria o ar e, finalmente, a mistura ar-combustível, permitindo que mais mistura ar-combustível entre em cada cilindro. Como uma análise muito aproximada desse processo, suponha que 1,0 mol de gás óxido nitroso em seu ponto de ebulição, −88°C, seja misturado com 4,0 mol de ar (presumivelmente diatômico) a 30°C30°C. Qual é a temperatura final da mistura? Use a capacidade térmica medida de 25\(\displaystyle N_2O\)° C, que é 30,4 J/mol° C. (A principal vantagem do óxido nitroso é que ele consiste em 1/3 de oxigênio, que é mais do que o ar contém, então ele fornece mais oxigênio para queimar o combustível. Outra vantagem é que sua decomposição em nitrogênio e oxigênio libera energia no cilindro.)
2.4 Distribuição de velocidades moleculares
66. Em uma amostra de sulfeto de hidrogênio (M = 34,1 g/mol) a uma temperatura de\(\displaystyle 3.00×10^2K\), estime a razão entre o número de moléculas que têm velocidades muito próximas\(\displaystyle v_{rms}\) ao número que tem velocidades muito próximas\(\displaystyle 2v_{rms}\).
67. Usando a aproximação\(\displaystyle ∫^{v_1+Δv}_{v_1}f(v)dv≈f(v1)Δv\) para Δv pequeno, estime a fração de moléculas de nitrogênio a uma temperatura\(\displaystyle 3.00×10^2K\) que tenha velocidades entre 290 m/s e 291 m/s.
68. Usando o método do problema anterior, estime a fração de moléculas de óxido nítrico (NO) a uma temperatura de 250 K que têm energias entre\(\displaystyle 3.45×10^{−21}J\)\(\displaystyle 3.50×10^{−21}J\) e.
69. Ao contar os quadrados na figura a seguir, estime a fração de átomos de argônio em T= 300K que têm velocidades entre 600 m/s e 800 m/s. A curva está corretamente normalizada. O valor de um quadrado é seu comprimento medido no eixo x vezes sua altura medida no eixo y, com as unidades dadas nesses eixos.
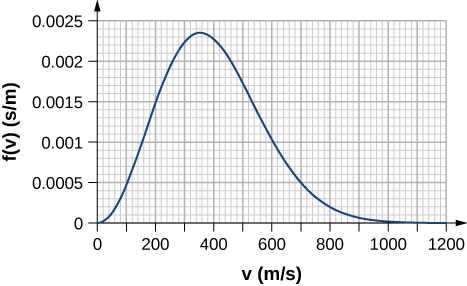
70. Usando um método de integração numérica, como a regra de Simpson, encontre a fração de moléculas em uma amostra de gás oxigênio a uma temperatura de 250 K com velocidades entre 100 m/s e 150 m/s. A massa molar de oxigênio (\(\displaystyle O_2\)) é 32,0 g/mol. A precisão de dois dígitos significativos é suficiente.
71. Encontre (a) a velocidade mais provável,
(b) a velocidade média, e
(c) a velocidade rms para moléculas de nitrogênio a 295 K.
72. Repita o problema anterior para moléculas de nitrogênio a 2950 K.
73. A que temperatura é a velocidade média das moléculas de dióxido de carbono (m = 44,0 g/mol) 510 m/s?
74. A velocidade mais provável para moléculas de um gás a 296 K é 263 m/s. Qual é a massa molar do gás? (Talvez você queira descobrir qual é a probabilidade do gás.)
75. a) Em que temperatura as moléculas de oxigênio têm a mesma velocidade média que os átomos de hélio (M = 4,00g/mol) têm a 300 K?
b) Qual é a resposta para a mesma pergunta sobre as velocidades mais prováveis?
c) Qual é a resposta para a mesma pergunta sobre velocidades rms?
Problemas adicionais
76. No espaço profundo entre as galáxias, a densidade das moléculas (que são principalmente átomos únicos) pode ser tão baixa quanto\(\displaystyle 10^6atoms/m^3\), e a temperatura é de 2,7 K. Qual é a pressão?
(b) Qual volume (in\(\displaystyle m^3\)) é ocupado por 1 mol de gás?
(c) Se esse volume for um cubo, qual é o comprimento de seus lados em quilômetros?
77. (a) Encontre a densidade em unidades SI de ar a uma pressão de 1,00 atm e uma temperatura de 20° C 20° C, assumindo que o ar é\(\displaystyle 78%N_2,21%O_2,\) e\(\displaystyle 1%Ar\)
(b) Encontre a densidade da atmosfera em Vênus, assumindo que é\(\displaystyle 96%CO_2\) e\(\displaystyle 4%N_2\), com uma temperatura de 737 K e uma pressão de 92,0 atm.
78. O ar dentro de um balão de ar quente tem uma temperatura de 370 K e uma pressão de 101,3 kPa, a mesma do ar externo. Usando a composição do ar como\(\displaystyle 78%N_2,21%O_2,\)\(\displaystyle 1%Ar\) areia, encontre a densidade do ar dentro do balão.
79. Quando uma bolha de ar sobe do fundo para o topo de um lago de água doce, seu volume aumenta em 80%. Se as temperaturas no fundo e no topo do lago são 4,0 e 10 ° C, respectivamente, qual é a profundidade do lago?
80. (a) Use a equação do gás ideal para estimar a temperatura na qual 1,00 kg de vapor (massa molar M = 18,0 g/mol) a uma pressão de\(\displaystyle 1.50×10^6Pa\) ocupa um volume de\(\displaystyle 0.220m^3\).
(b) As constantes de van der Waals para água são\(\displaystyle a=0.5537Pa⋅m^6/mol^2\)\(\displaystyle b=3.049×10^{−5}m^3/mol\) e. Use a equação de estado de Van der Waals para estimar a temperatura nas mesmas condições.
(c) A temperatura real é 779 K. Qual estimativa é melhor?
81. Um processo para descafeinar café usa dióxido de carbono (m = 44,0 g/mol) a uma densidade molar de cerca de\(\displaystyle 14,600mol/m^3\) e uma temperatura de cerca de 60° C.
(a) Existe\(\displaystyle CO_2\) um fluido sólido, líquido, gasoso ou supercrítico nessas condições?
(b) As constantes de van der Waals para o dióxido de carbono são\(\displaystyle a=0.3658Pa⋅m^6/mol^2\)\(\displaystyle b=4.286×10^{−5}m^3/mol\) e. Usando a equação de van der Waals, estime a pressão de\(\displaystyle CO_2\) nessa temperatura e densidade.
82. Em um dia de inverno, quando a temperatura do ar é de 0°C, a umidade relativa do ar é de 50%. O ar externo entra e é aquecido a uma temperatura ambiente de 20° C. Qual é a umidade relativa do ar dentro da sala? (Esse problema mostra por que o ar interno é tão seco no inverno?)
83. Em um dia quente, quando a temperatura do ar é de 30° C, uma lata de metal é resfriada lentamente adicionando pedaços de gelo à água líquida nela. A condensação aparece pela primeira vez quando a lata atinge 15°C. Qual é a umidade relativa do ar?
84. (a) As pessoas geralmente pensam que o ar úmido é “pesado”. Compare as densidades do ar com 0% de umidade relativa e 100% de umidade relativa quando ambas estão a 1 atm e 30 °C. Suponha que o ar seco seja um gás ideal composto por moléculas com uma massa molar de 29,0 g/mol e que o ar úmido seja o mesmo gás misturado ao vapor de água.
(b) Conforme discutido no capítulo sobre as aplicações das leis de Newton, a resistência do ar sentida por projéteis como bolas de beisebol e bolas de golfe é de aproximadamente\(\displaystyle F_D=CρAv^2/2\), onde ρ é a densidade de massa do ar, A é a área da seção transversal do projétil e C é o arrasto do projétil coeficiente. Para uma pressão de ar fixa, descreva qualitativamente como o alcance de um projétil muda com a umidade relativa.
(c) Quando chega uma tempestade, geralmente a umidade é alta e a pressão do ar é baixa. Essas condições dão uma vantagem ou desvantagem aos rebatedores do home run?
85. O caminho livre médio para o hélio a uma determinada temperatura e pressão é\(\displaystyle 2.10×10^{−7}m\). O raio de um átomo de hélio pode ser considerado como\(\displaystyle 1.10×10^{−11}m\). Qual é a medida da densidade do hélio nessas condições
(a) em moléculas por metro cúbico e
(b) em moles por metro cúbico?
86. O caminho livre médio do metano a uma temperatura de 269 K e uma pressão de\(\displaystyle 1.11×10^5Pa\) é\(\displaystyle 4.81×10^{−8}m\). Encontre o raio efetivo r da molécula de metano.
87. No capítulo sobre mecânica dos fluidos, a equação de Bernoulli para o fluxo de fluidos incompressíveis foi explicada em termos de mudanças que afetam um pequeno volume dV de fluido. Esses volumes também são uma ideia fundamental no estudo do fluxo de fluidos compressíveis, como gases. Para que as equações da hidrodinâmica se apliquem, o caminho livre médio deve ser muito menor que o tamanho linear desse volume,\(\displaystyle a≈dV^{1/3}\). Para o ar na estratosfera a uma temperatura de 220 K e uma pressão de 5,8 kPa, qual deve ser o tamanho para que ele seja 100 vezes o caminho livre médio? Considere o raio efetivo das moléculas de ar em si\(\displaystyle 1.88×10^{−11}m\), o que é mais ou menos correto para\(\displaystyle N_2\).
88. Encontre o número total de colisões entre moléculas em 1,00 s em 1,00 L de gás nitrogênio em temperatura e pressão padrão (0°C, 1,00 atm). Use\(\displaystyle 1.88×10^{−10}m\) como raio efetivo de uma molécula de nitrogênio. (O número de colisões por segundo é o inverso do tempo de colisão.) Lembre-se de que cada colisão envolve duas moléculas, portanto, se uma molécula colidir uma vez em um determinado período de tempo, a colisão da molécula atingida não pode ser contada.
89. (a) Estime a capacidade térmica específica do sódio a partir da Lei de Dulong e Petit. A massa molar do sódio é 23,0 g/mol.
(b) Qual é o erro percentual de sua estimativa a partir do valor conhecido, 1230J/kg⋅°C?
90. Um recipiente selado e perfeitamente isolado contém 0,630 mol de ar a 20,0° C e uma barra de agitação de ferro de massa de 40,0 g. A barra de agitação é acionada magneticamente para uma energia cinética de 50,0 J e deixada diminuir devido à resistência do ar. Qual é a temperatura de equilíbrio?
91. Encontre a proporção\(\displaystyle f(v_p)/f(v_{rms})\) do gás hidrogênio (M = 2,02 g/mol) a uma temperatura de 77,0 K.
92. Resultados irracionais. (a) Encontre a temperatura de 0,360 kg de água, modelada como um gás ideal, a uma pressão de\(\displaystyle 1.01×10^5Pa\) se tiver um volume de\(\displaystyle 0.615m^3\).
(b) O que é irracional nessa resposta? Como você poderia obter uma resposta melhor?
93. Resultados irracionais. (a) Encontre a velocidade média das moléculas de sulfeto de hidrogênio\(\displaystyle H_2S\),, a uma temperatura de 250 K. Sua massa molar é 31,4 g/mol
(b) O resultado não é muito irracional, mas por que é menos confiável do que aqueles para, digamos, néon ou nitrogênio?
Problemas de desafio
94. Um dispensador hermético para água potável tem 25 cm × 10 cm em dimensões horizontais e 20 cm de altura. Tem uma torneira de volume insignificante que se abre no nível da parte inferior do dispensador. Inicialmente, ele contém água a um nível de 3,0 cm do topo e ar na pressão ambiente, 1,00 atm, de lá até o topo. Quando a torneira é aberta, a água fluirá até que a pressão manométrica na parte inferior do dispensador e, portanto, na abertura da torneira, seja 0. Qual volume de água sai? Suponha que a temperatura seja constante, o dispensador seja perfeitamente rígido e a água tenha uma densidade constante de\(\displaystyle 1000kg/m^3\).
95. Oito carros de choque, cada um com uma massa de 322 kg, estão rodando em uma sala de 21,0 m de comprimento e 13,0 m de largura. Eles não têm motoristas, então eles simplesmente pulam sozinhos. A velocidade rms dos carros é de 2,50 m/s. Repetindo os argumentos de Pressão, Temperatura e Velocidade RMS, determine a força média por unidade de comprimento (análoga à pressão) que os carros exercem nas paredes.
96. Verifique isso\(\displaystyle v_p=\sqrt{\frac{2k_BT}{m}}\).
97. Verifique a equação de normalização\(\displaystyle ∫^∞_0f(v)dv=1\). Ao fazer a integral, primeiro faça a substituição\(\displaystyle u=\sqrt{\frac{m}{2k_BT}}v=\frac{v}{v_p}\). Essa transformação de “escala” fornece todas as características da resposta, exceto a integral, que é um fator numérico adimensional. Você precisará da fórmula\(\displaystyle ∫^∞_0x^2e^{−x^2}dx=\frac{\sqrt{π}}{4}\) encontrar o fator numérico e verificar a normalização.
98. Verifique isso\(\displaystyle \bar{v}=\sqrt{\frac{8}{π}\frac{k_BT}{m}}.\). Faça a mesma transformação de escala do problema anterior.
99. Verifique isso\(\displaystyle v_{rms}=\sqrt{\bar{v^2}=\sqrt{\frac{3k_BT}{m}}\).


