26.4 : Neuromycoses et maladies parasitaires du système nerveux
- Page ID
- 187869
Objectifs d'apprentissage
- Identifier les champignons les plus courants pouvant provoquer des infections du système nerveux
- Comparez les principales caractéristiques de maladies fongiques spécifiques affectant le système nerveux
Les infections fongiques du système nerveux, appelées neuromycoses, sont rares chez les personnes en bonne santé. Cependant, les neuromycoses peuvent être dévastatrices chez les patients immunodéprimés ou âgés. Plusieurs parasites eucaryotes sont également capables d'infecter le système nerveux des hôtes humains. Bien que relativement rares, ces infections peuvent également mettre la vie en danger chez les personnes immunodéprimées. Dans cette section, nous aborderons d'abord les neuromycoses, suivies des infections parasitaires du système nerveux.
Méningite cryptococcique
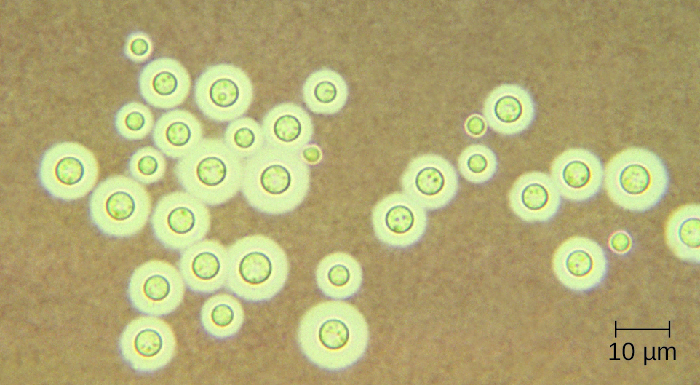
Le Cryptococcus neoformans est un pathogène fongique qui peut provoquer une méningite. Cette levure se trouve couramment dans les sols et est particulièrement associée aux excréments de pigeons. Il possède une capsule épaisse qui constitue un facteur de virulence important, inhibant la clairance par phagocytose. La plupart des cas de C. neoformans se traduisent par des infections respiratoires subcliniques qui, chez les personnes en bonne santé, disparaissent généralement spontanément sans conséquences à long terme (voir Mycoses respiratoires). Chez les patients immunodéprimés ou atteints d'autres maladies sous-jacentes, l'infection peut évoluer et provoquer la formation de méningites et de granulomes dans les tissus cérébraux. Les antigènes du cryptocoque peuvent également servir à inhiber l'immunité à médiation cellulaire et l'hypersensibilité de type retardé.
Le cryptocoque peut être facilement cultivé en laboratoire et identifié sur la base de sa capsule étendue (Figure\(\PageIndex{1}\)). C. neoformans est fréquemment cultivé à partir d'échantillons d'urine de patients atteints d'infections disséminées.
Un traitement prolongé avec des médicaments antifongiques est nécessaire pour traiter les infections cryptococciques. Un traitement combiné avec l'amphotéricine B et la flucytosine est requis pendant au moins 10 semaines. De nombreux médicaments antifongiques ont de la difficulté à traverser la barrière hémato-encéphalique et ont des effets secondaires importants qui nécessitent de faibles doses ; ces facteurs contribuent à la durée du traitement. Les patients atteints du SIDA sont particulièrement vulnérables aux infections à cryptocoques en raison de leur état immunitaire affaibli. Les patients atteints du SIDA atteints de cryptococcose peuvent également être traités avec des médicaments antifongiques, mais ils présentent souvent des rechutes ; des doses de fluconazole à vie peuvent être nécessaires pour prévenir une réinfection.
Exercice\(\PageIndex{1}\)
- Pourquoi les infections à neuromycoses sont-elles rares dans la population générale ?
- Comment se transmet une infection cryptococcique ?
Neuromycoses
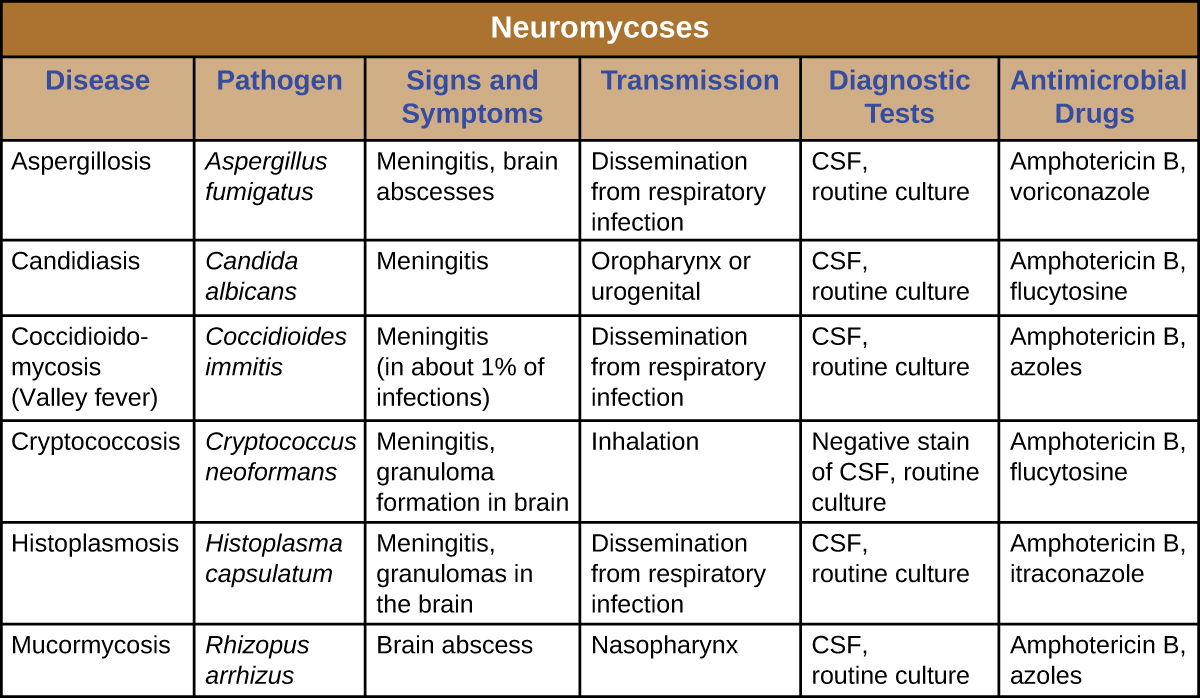
Les neuromycoses ne surviennent généralement que chez les personnes immunodéprimées et n'envahissent généralement le système nerveux qu'après avoir infecté un autre système corporel. À ce titre, de nombreuses maladies qui affectent parfois le système nerveux ont déjà été abordées dans les chapitres précédents. La figure\(\PageIndex{2}\) présente certaines des infections fongiques les plus courantes associées aux maladies neurologiques. Ce tableau inclut uniquement les aspects neurologiques associés à ces maladies ; il n'inclut pas les caractéristiques associées à d'autres systèmes corporels.
Orientation clinique : résolution
La nouvelle prescription de David pour deux médicaments antifongiques, l'amphotéricine B et la flucytosine, s'est révélée efficace et son état a commencé à s'améliorer. Les résultats de culture des échantillons de crachats, de peau et de LCR de David ont confirmé la présence d'une infection fongique. Tous étaient positifs pour C. neoformans. Des tests sérologiques effectués sur ses tissus se sont également révélés positifs pour l'antigène polysaccharidique capsulaire de C. neoformans.
Comme la présence de C. neoformans est connue dans les déjections d'oiseaux, il est probable que David ait été exposé au champignon alors qu'il travaillait dans l'étable. Malgré cette exposition, le médecin de David lui a expliqué que les personnes immunocompétentes contractent rarement une méningite cryptococcique et que son système immunitaire avait probablement été affaibli par les médicaments anti-inflammatoires qu'il prenait pour traiter sa maladie de Crohn. Cependant, afin d'exclure d'autres causes possibles d'immunodéficience, le médecin de David a recommandé qu'il passe un test de dépistage du VIH.
David ayant obtenu un résultat négatif pour le VIH, son médecin lui a retiré le corticostéroïde qu'il utilisait pour traiter sa maladie de Crohn et l'a remplacé par une autre classe de médicaments. Après plusieurs semaines de traitements antifongiques, David a réussi à se rétablir complètement.
Méningite amibienne
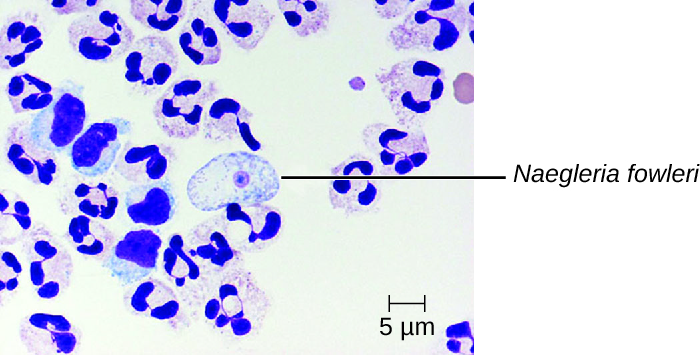
La méningo-encéphalite amibienne primaire (PAM) est causée par Naegleria fowleri. Cet amiboflagellé vit généralement à l'état libre dans les sols et l'eau. Il peut exister sous l'une des trois formes suivantes : la forme de trophozoïte amibien infectieux, une forme flagellée mobile et une forme de kyste au repos. Le PAM est une maladie rare qui a été associée à des personnes jeunes et par ailleurs en bonne santé. Les individus sont généralement infectés par l'amibe lorsqu'ils nagent dans des plans d'eau douce chauds tels que des rivières, des lacs et des sources chaudes. Le trophozoïte pathogène infecte le cerveau en pénétrant d'abord par les voies nasales vers les sinus ; il descend ensuite le long des fibres nerveuses olfactives pour pénétrer dans le plexus nerveux sous-muqueux, envahit la plaque cribriforme et atteint l'espace sous-arachnoïdien. L'espace sous-arachnoïdien est hautement vascularisé et constitue une voie de dissémination des trophozoïtes vers d'autres zones du SNC, y compris le cerveau (Figure\(\PageIndex{3}\)). L'inflammation et la destruction de la matière grise entraînent de graves maux de tête et de la fièvre. En quelques jours, de la confusion et des convulsions apparaissent et évoluent rapidement vers des crises d'épilepsie, un coma et la mort. La progression peut être très rapide et la maladie n'est souvent diagnostiquée qu'à l'autopsie.
Les infections à N. fowleri peuvent être confirmées par l'observation directe du LCR ; les amibes peuvent souvent être observées en mouvement alors que l'on observe au microscope une monture humide de LCR frais. Des formes flagellées peuvent parfois également être trouvées dans le LCR. Les amibes peuvent être colorées avec plusieurs taches à des fins d'identification, notamment Giemsa-Wright ou une teinture trichrome modifiée. La détection d'antigènes par immunofluorescence indirecte ou l'analyse génétique par PCR peuvent être utilisées pour confirmer un diagnostic initial. Les infections à N. fowleri sont presque toujours mortelles ; seuls 3 patients atteints de PAM sur 138 aux États-Unis ont survécu. 1 Un nouveau médicament expérimental appelé miltéfosine semble prometteur pour le traitement de ces infections. Ce médicament est un dérivé de la phosphotidylcholine dont on pense qu'il inhibe la fonction membranaire chez N. fowleri, déclenchant l'apoptose et perturbant les voies de signalisation des cellules dépendantes des lipides. 2 Lorsqu'il est administré au début de l'infection et associé à une hypothermie thérapeutique (abaissement de la température interne du corps pour réduire l'œdème cérébral associé à l'infection), ce médicament a été utilisé avec succès pour traiter l'encéphalite amibienne primaire.
Encéphalite amibienne granulomateuse
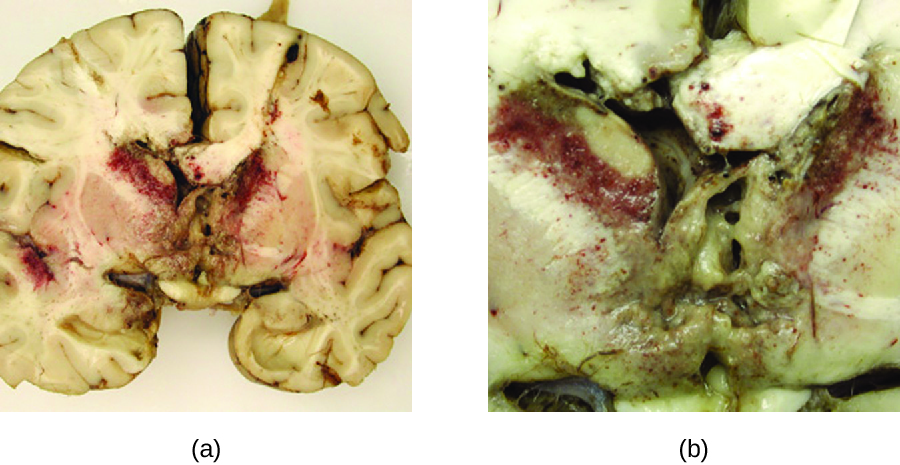
Les espèces d'Acanthamoeba et de Balamuthia sont des amibes libres présentes dans de nombreux plans d'eau douce. Les infections humaines par ces amibes sont rares. Cependant, ils peuvent provoquer une kératite amibienne chez les porteurs de lentilles de contact (voir Infections oculaires à protozoaires et helminthiques), des infections disséminées chez les patients immunodéprimés et une encéphalite amibienne granulomateuse (EAG) dans les cas graves. Comparativement au PAM, les GAE ont tendance à être des infections subaiguës. On pense que le microbe pénètre soit par les sinus nasaux, soit par des fractures de la peau. Il est disséminé par voie hématogène et peut envahir le SNC. Là, les infections entraînent une inflammation, la formation de lésions et le développement de symptômes neurologiques typiques de l'encéphalite (Figure\(\PageIndex{4}\)). Le GAE est presque toujours fatal.
L'EAG n'est souvent diagnostiqué qu'à un stade avancé de l'infection. Les lésions causées par l'infection peuvent être détectées par tomodensitométrie ou IRM. Les amibes vivantes peuvent être détectées directement dans le LCR ou dans des biopsies tissulaires. Des tests sérologiques sont disponibles mais ne sont généralement pas nécessaires pour établir un diagnostic correct, car la présence de l'organisme dans le LCR est définitive. Certains médicaments antifongiques, comme le fluconazole, ont été utilisés pour traiter les infections acanthamoebales. De plus, une association de miltéfosine et de voriconazole (un inhibiteur de la biosynthèse de l'ergostérol) a récemment été utilisée pour traiter avec succès le GAE. Cependant, même avec un traitement, le taux de mortalité des patients atteints de ces infections est élevé.
Exercice\(\PageIndex{2}\)
Comment diagnostique-t-on l'encéphalite amibienne granulomateuse ?
Trypanosomiase humaine africaine
La trypanosomiase humaine africaine (également connue sous le nom de maladie du sommeil en Afrique) est une maladie grave endémique à deux régions distinctes de l'Afrique subsaharienne. Elle est causée par l'hémoflagellé Trypanosoma brucei transmis par les insectes. La sous-espèce Trypanosoma brucei rhodesiense est responsable de la trypanosomiase est-africaine (EAT), et une autre sous-espèce, Trypanosoma brucei gambiense, cause la trypanosomiase ouest-africaine (WAT). Quelques centaines de cas d'EAT sont actuellement signalés chaque année. 3 Le WAT est plus fréquemment signalé et tend à être une maladie plus chronique. Environ 7 000 à 10 000 nouveaux cas de WAT sont identifiés chaque année. 4
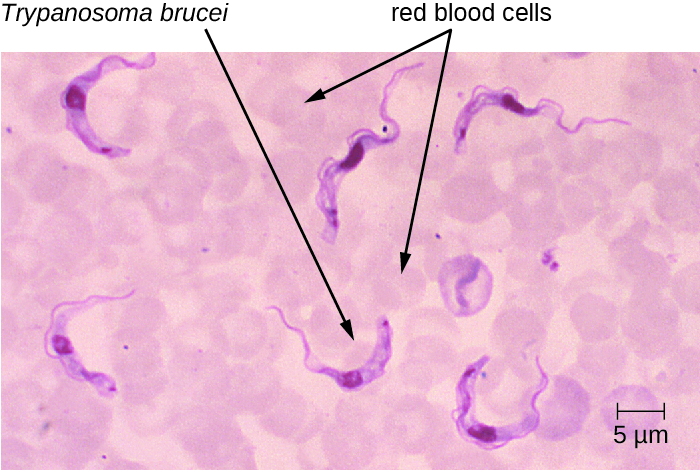
T. brucei est principalement transmis à l'homme par la morsure de la mouche tsé-tsé (Glossina spp.). Peu après la morsure d'une mouche tsé-tsé, un chancre se forme sur le site de l'infection. Les flagellés se propagent ensuite et pénètrent dans le système circulatoire (Figure\(\PageIndex{5}\)). Ces infections systémiques se traduisent par une fièvre ondulante, au cours de laquelle les symptômes persistent pendant deux ou trois jours avec des rémissions d'environ une semaine entre les crises. Lorsque la maladie entre dans sa phase finale, les agents pathogènes passent de la lymphe au SNC. Les symptômes neurologiques incluent la somnolence diurne, l'insomnie et la détérioration mentale. Dans l'EAT, la maladie évolue sur une période de plusieurs semaines, voire de plusieurs mois. En revanche, le WAT survient souvent sur une période de plusieurs mois, voire de plusieurs années.
Bien qu'une forte réponse immunitaire soit exercée contre le trypanosome, elle n'est pas suffisante pour éliminer le pathogène. Grâce à la variation antigénique, les trypanosomes peuvent transformer leurs protéines de surface en plus de 100 types sérologiques. Cette variation conduit à la forme ondulée de la maladie initiale. La septicémie initiale provoquée par l'infection entraîne de fortes fièvres. À mesure que le système immunitaire réagit à l'infection, le nombre d'organismes diminue et les symptômes cliniques s'atténuent. Cependant, une sous-population du pathogène modifie ensuite les antigènes de sa couche superficielle par variation antigénique et échappe à la réponse immunitaire. Ces flagellés prolifèrent rapidement et provoquent une nouvelle crise de maladie. Si elles ne sont pas traitées, ces infections sont généralement mortelles.
Les symptômes cliniques peuvent être utilisés pour reconnaître les premiers signes de la trypanosomiase africaine. Il s'agit notamment de la formation d'un chancre sur le site de l'infection et du signe de Winterbottom. Le signe de Winterbottom fait référence à l'hypertrophie des ganglions lymphatiques situés à l'arrière du cou, ce qui indique souvent la présence d'infections cérébrales. Le trypanosome peut être observé directement dans des échantillons colorés, notamment du sang, de la lymphe, du LCR et des biopsies cutanées de chancres prélevés sur des patients. Des anticorps contre le parasite sont présents chez la plupart des patients atteints d'une maladie aiguë ou chronique. Les tests sérologiques ne sont toutefois généralement pas utilisés pour le diagnostic, car la détection microscopique du parasite est suffisante. Un diagnostic précoce est important pour le traitement. Avant que le système nerveux ne soit impliqué, des médicaments tels que la pentamidine (un inhibiteur du métabolisme nucléaire) et la suramine (mécanisme peu clair) peuvent être utilisés. Ces médicaments ont moins d'effets secondaires que les médicaments nécessaires pour traiter le deuxième stade de la maladie. Une fois que la phase de la maladie du sommeil a débuté, des médicaments plus agressifs tels que le mélarsoprol (un dérivé de l'arsenic) et l'éflornithine peuvent être efficaces. Après un traitement réussi, les patients doivent encore subir des examens de suivi de leur LCR pendant deux ans afin de détecter d'éventuelles rechutes de la maladie. Le moyen le plus efficace de prévenir ces maladies est de contrôler les populations d'insectes vecteurs.
Exercice\(\PageIndex{3}\)
- Quel est le symptôme d'une infection systémique à trypanosomes ?
- Quels sont les symptômes d'une infection neurologique à trypanosomes ?
- Pourquoi les infections aux trypanosomes sont-elles si difficiles à éradiquer ?
Neurotoxoplasmose
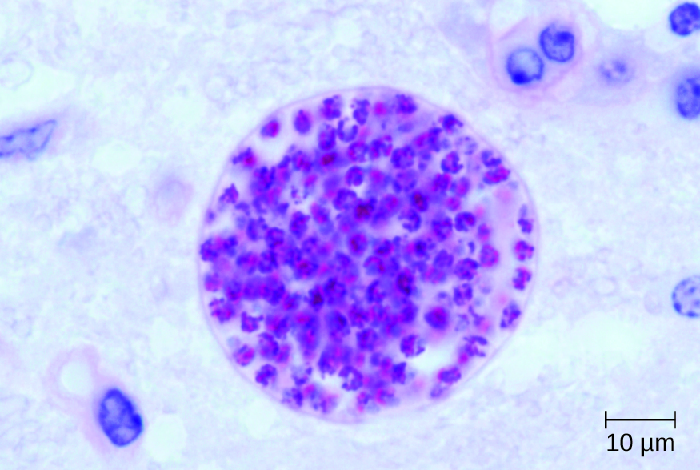
Toxoplasma gondii est un parasite intracellulaire omniprésent qui peut provoquer des infections néonatales. Les chats sont l'hôte définitif et les humains peuvent être infectés après avoir mangé de la viande infectée ou, plus souvent, en ingérant des oocystes excrétés dans les matières fécales des chats (voir Infections parasitaires des systèmes circulatoire et lymphatique). T. gondii pénètre dans le système circulatoire en passant entre les cellules endothéliales des vaisseaux sanguins. 5 La plupart des cas de toxoplasmose sont asymptomatiques. Cependant, chez les patients immunodéprimés, la neurotoxoplasmose causée par des infections à T. gondii est l'une des causes les plus fréquentes d'abcès cérébraux. 6 L'organisme est capable de traverser la barrière hémato-encéphalique en infectant les cellules endothéliales des capillaires du cerveau. Le parasite se reproduit dans ces cellules, étape qui semble nécessaire pour pénétrer dans le cerveau, puis provoque la lyse de la cellule endothéliale, libérant ainsi la progéniture dans les tissus cérébraux. Ce mécanisme est très différent de la méthode qu'il utilise pour pénétrer dans la circulation sanguine. 7
Les lésions cérébrales associées à la neurotoxoplasmose peuvent être détectées par radiographie par IRM ou par tomodensitométrie (Figure\(\PageIndex{6}\)). Le diagnostic peut être confirmé par l'observation directe de l'organisme dans le LCR. Les tests RT-PCR peuvent également être utilisés pour détecter T. gondii au moyen de marqueurs génétiques.
Le traitement de la neurotoxoplasmose causée par des infections à T. gondii nécessite six semaines de traitement multimédicamenteux à base de pyriméthamine, de sulfadiazine et d'acide folinique. Des doses d'entretien à long terme sont souvent nécessaires pour prévenir les récidives.
Exercice\(\PageIndex{4}\)
- Dans quelles conditions l'infection à toxoplasme est-elle grave ?
- Comment le toxoplasme contourne-t-il la barrière hémato-encéphalique ?
Neurocysticercose
La cysticercose est une infection parasitaire causée par la forme larvaire du ténia du porc, Taenia solium. Lorsque les larves envahissent le cerveau et la moelle épinière, on parle de neurocysticercose. Cette maladie touche des millions de personnes dans le monde et constitue la principale cause d'épilepsie chez l'adulte dans les pays en développement. 8
Le cycle de vie de T. solium est discuté dans Infections helminthiques du tractus gastro-intestinal. Après ingestion, les œufs éclosent dans l'intestin pour former des larves appelées cysticerques. Les ténias adultes se forment dans l'intestin grêle et produisent des œufs qui sont excrétés dans les matières fécales. Ces œufs peuvent infecter d'autres personnes par la contamination fécale des aliments ou d'autres surfaces. Les œufs peuvent également éclore dans l'intestin du patient initial et entraîner une auto-infection continue. Les cystercerci peuvent migrer vers le sang et envahir de nombreux tissus du corps, y compris le SNC.
La neurocysticercose est généralement diagnostiquée par des techniques non invasives. Les informations épidémiologiques peuvent être utilisées comme dépistage initial ; la cysticercose est endémique en Amérique centrale et du Sud, en Afrique et en Asie. L'imagerie radiologique (IRM et tomodensitométrie) est la principale méthode utilisée pour diagnostiquer la neurocysticercose ; l'imagerie peut être utilisée pour détecter les kystes d'un à deux centimètres qui se forment autour des parasites (Figure\(\PageIndex{7}\)). Des taux élevés d'éosinophiles dans le sang peuvent également indiquer une infection parasitaire. L'EIA et l'ELISA sont également utilisés pour détecter les antigènes associés au pathogène.
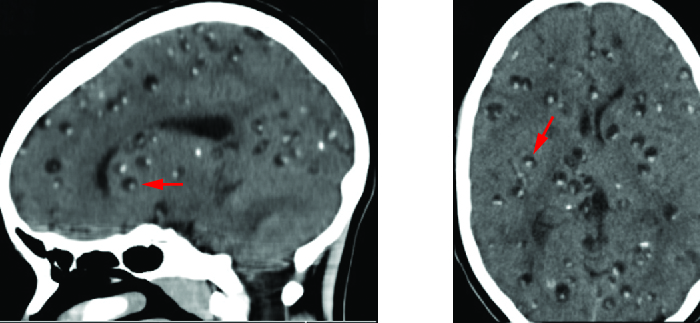
Le traitement de la neurocysticercose dépend de la localisation, du nombre, de la taille et du stade des cysticerques présents. La chimiothérapie antihelminthique comprend l'albendazole et le praziquantel. Comme ces médicaments tuent les kystes viables, ils peuvent aggraver les symptômes de façon aiguë en provoquant une réponse inflammatoire provoquée par la libération des antigènes de Taenia cysticerci, car les kystes sont détruits par les médicaments. Pour atténuer cette réponse, des corticostéroïdes qui traversent la barrière hémato-encéphalique (par exemple, la dexaméthasone) peuvent être utilisés pour atténuer ces effets. Une intervention chirurgicale peut être nécessaire pour éliminer les kystes intraventriculaires.
Maladies parasitaires du système nerveux
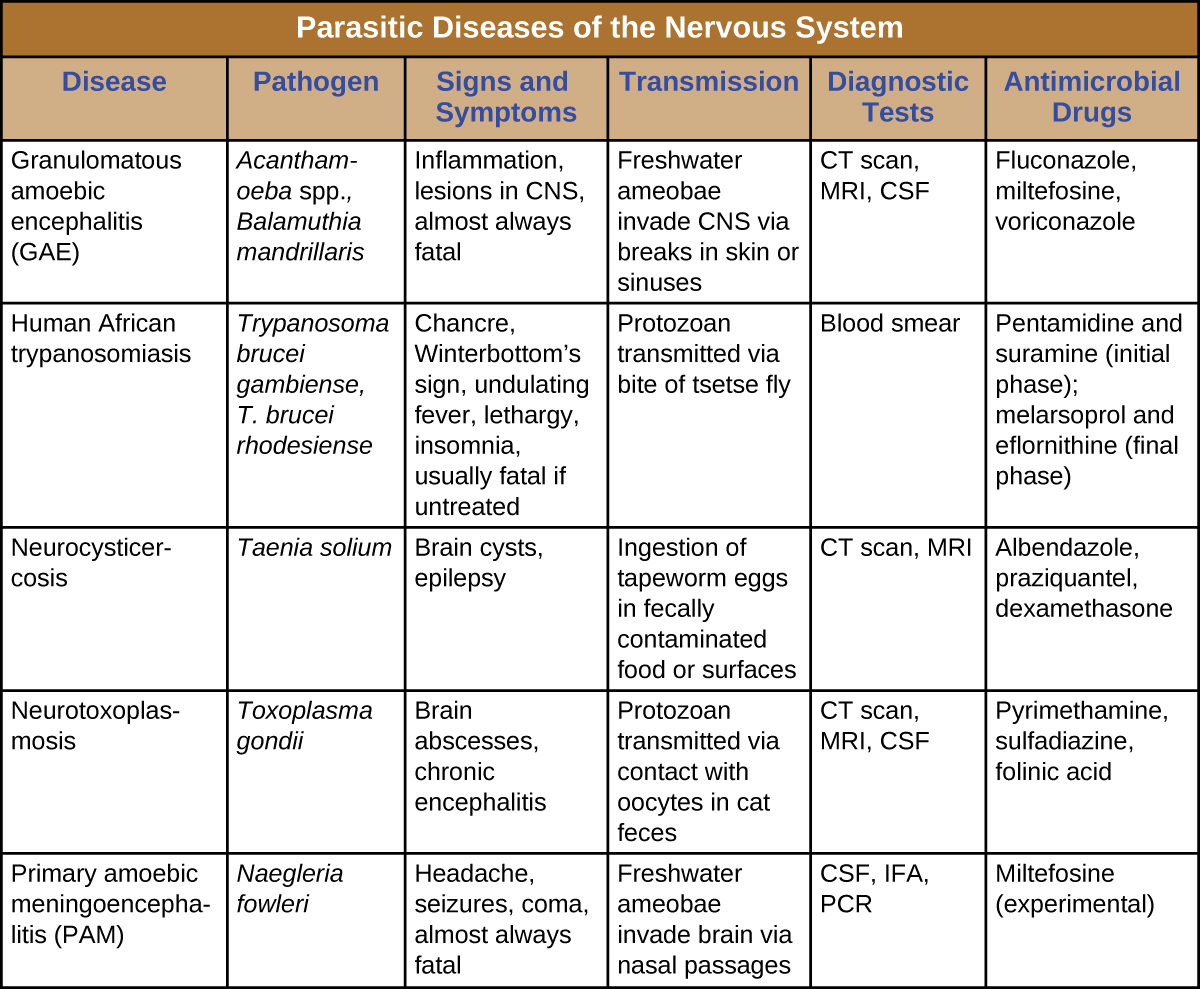
Les parasites qui réussissent à envahir le système nerveux peuvent provoquer un large éventail de signes et de symptômes neurologiques. Souvent, ils infligent des lésions qui peuvent être visualisées par imagerie radiologique. Certaines de ces infections sont mortelles, mais certaines peuvent être traitées (avec plus ou moins de succès) par des médicaments antimicrobiens (Figure\(\PageIndex{8}\)).
Exercice\(\PageIndex{5}\)
- Quelle affection neurologique est associée à la neurocysticercose ?
- Comment est diagnostiquée la neurocysticercose ?
Concepts clés et résumé
- Les neuromycoses sont rares chez les personnes immunocompétentes, mais les personnes immunodéprimées atteintes d'infections fongiques présentent des taux de mortalité élevés. Le traitement des neuromycoses nécessite un traitement prolongé avec des médicaments antifongiques à faibles doses afin d'éviter les effets secondaires et de surmonter l'effet de la barrière hémato-encéphalique.
- Certaines infections protistes du système nerveux sont mortelles si elles ne sont pas traitées, notamment la méningite amibienne primaire, l'encéphalite amibienne granulomateuse, la trypanosomiase humaine africaine et la neurotoxoplasmose.
- Les différentes formes d'encéphalite amibienne causées par les différentes infections amibiennes sont généralement mortelles même après traitement, mais elles sont rares.
- La trypanosomiase africaine est une maladie grave mais traitable endémique à deux régions distinctes de l'Afrique subsaharienne causée par l'hémoflagellé Trypanosoma brucei transmis par les insectes.
- La neurocysticercose est traitée à l'aide d'antihelminthiques ou d'une intervention chirurgicale pour enlever les gros kystes du SNC.
Notes
- 1 Centres américains pour le contrôle et la prévention des maladies, « Naegleria fowleri — Méningoencéphalite amibienne primaire (PAM) —Encéphalite amibienne », 2016. Consulté le 30 juin 2016. http://www.cdc.gov/parasites/naegleria/treatment.html.
- 2 Dorlo, Thomas PC, Manica Balasegaram, Jos H. Beijnen et Peter J. de Vries, « La miltéfosine : examen de sa pharmacologie et de son efficacité thérapeutique dans le traitement de la leishmaniose », Journal of Antimicrobial Chemotherapy 67, n° 11 (2012) : 2576-97.
- 3 Centres américains pour le contrôle et la prévention des maladies, « Parasites — Trypanosomiase africaine (également connue sous le nom de maladie du sommeil), FAQ sur la trypanosomiase en Afrique de l'Est », 2012. Consulté le 30 juin 2016. www.cdc.gov/parasites/sleepin... faqs-east.html.
- 4 Centres américains pour le contrôle et la prévention des maladies, « Parasites — Trypanosomiase africaine (également connue sous le nom de maladie du sommeil), épidémiologie et facteurs de risque », 2012. Consulté le 30 juin 2016. www.cdc.gov/parasites/sleepin... kness/epi.html.
- 5 Carruthers, Vern B., et Yasuhiro Suzuki, « Effets de l'infection à Toxoplasma gondii sur le cerveau », Schizophrenia Bulletin 33, no 3 (2007) : 745-51.
- 6 Uppal, Gulshan, « La toxoplasmose du système nerveux central et le VIH », 2015. Consulté le 30 juin 2016. emedicine.medscape.com/articl... 98-overview #a3.
- 7 Konradt, Christoph, Norikiyo Ueno, David A. Christian, Jonathan H. Delong, Gretchen Harms Pritchard, Jasmin Herz, David J. Bzik et al., « Les cellules endothéliales constituent une niche réplicative pour l'entrée de Toxoplasma gondii dans le système nerveux central », Nature Microbiology 1 (2016) : 16001.
- 8 DeGiorgio, Christopher M., Marco T. Medina, Reyna Durón, Chi Zee et Susan Pietsch Escueta, « Neurocysticercose », Epilepsy Currents 4, n° 3 (2004) : 107-11.


