26.2 : Maladies bactériennes du système nerveux
- Page ID
- 187877
Objectifs d'apprentissage
- Identifiez les bactéries les plus courantes qui peuvent provoquer des infections du système nerveux
- Comparez les principales caractéristiques de maladies bactériennes spécifiques affectant le système nerveux
Les infections bactériennes qui affectent le système nerveux sont graves et peuvent mettre la vie en danger. Heureusement, seules quelques espèces bactériennes sont couramment associées aux infections neurologiques.
Méningite bactérienne
La méningite bactérienne est l'une des formes les plus graves de méningite. Les bactéries responsables de la méningite accèdent souvent au SNC par la circulation sanguine après un traumatisme ou à la suite de l'action de toxines bactériennes. Les bactéries peuvent également se propager à partir de structures des voies respiratoires supérieures, telles que l'oropharynx, le nasopharynx, les sinus et l'oreille moyenne. Les patients présentant des blessures à la tête ou des implants cochléaires (un appareil électronique placé dans l'oreille interne) risquent également de développer une méningite.
La plupart des bactéries qui peuvent provoquer la méningite se trouvent couramment chez les personnes en bonne santé. Les causes les plus fréquentes de méningite bactérienne non néonatale sont Neisseria meningitidis, Streptococcus pneumoniae et Haemophilus influenzae. Ces trois bactéries pathogènes se transmettent d'une personne à l'autre par les sécrétions respiratoires. Chacun peut coloniser et traverser les muqueuses de l'oropharynx et du nasopharynx, et pénétrer dans le sang. Une fois dans le sang, ces agents pathogènes peuvent se disséminer dans tout l'organisme et peuvent à la fois établir une infection et déclencher une inflammation dans n'importe quel site du corps, y compris les méninges (Figure\(\PageIndex{1}\)). Sans traitement antibactérien systémique approprié, le taux de létalité peut atteindre 70 %, et 20 % des survivants peuvent présenter des lésions nerveuses irréversibles ou une destruction des tissus, entraînant une perte auditive, une déficience neurologique ou la perte d'un membre. Les taux de mortalité sont bien inférieurs (jusqu'à 15 %) dans les populations où des médicaments thérapeutiques et des vaccins préventifs appropriés sont disponibles. 1
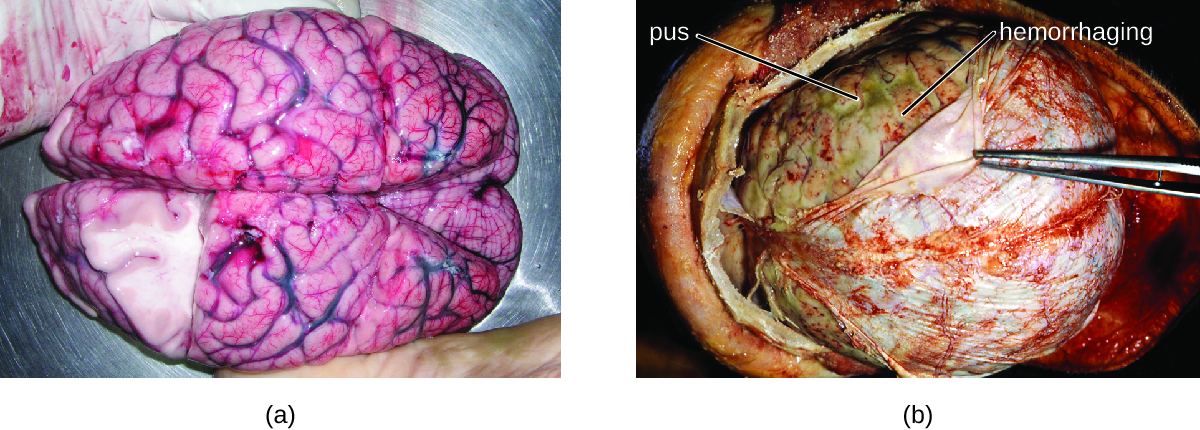
Diverses autres bactéries, dont Listeria monocytogenes et Escherichia coli, peuvent également provoquer une méningite. Ces bactéries provoquent des infections de la matière arachnoïdienne et du LCR après s'être propagées par la circulation sanguine ou par une infection des sinus ou du nasopharynx. Streptococcus agalactiae, que l'on trouve couramment dans le microbiote du vagin et du tractus gastro-intestinal, peut également provoquer une méningite bactérienne chez les nouveau-nés après transmission par la mère avant ou pendant la naissance.
L'inflammation profonde causée par ces microbes peut entraîner des symptômes précoces tels que maux de tête sévères, fièvre, confusion, nausées, vomissements, photophobie et raideur de la nuque. Les réponses inflammatoires systémiques associées à certains types de méningite bactérienne peuvent entraîner des hémorragies et des lésions purpuriques sur la peau, suivies d'affections encore plus graves telles que choc, convulsions, coma et décès, dans certains cas, en l'espace de quelques heures seulement.
Le diagnostic de la méningite bactérienne est mieux confirmé par l'analyse du LCR obtenu par ponction lombaire. Des taux anormaux de neutrophiles polymorphonucléaires (PMN) (> 10 PMNs/mm 3) et de glucose (< 45 mg/dL), and protein (> 45 mg/dL) dans le LCR suggèrent une méningite bactérienne. 2 Les caractéristiques de formes spécifiques de méningite bactérienne sont détaillées dans les sous-sections qui suivent.
Méningite méningococcique
La méningite à méningocoque est une infection grave causée par le coccus Gram négatif N. meningitidis. Dans certains cas, le décès peut survenir quelques heures après l'apparition des symptômes. Les cas non mortels peuvent entraîner des lésions nerveuses irréversibles, entraînant une perte auditive et des lésions cérébrales, ou une amputation des extrémités due à une nécrose tissulaire.
La méningite à méningocoque peut infecter des personnes de tout âge, mais sa prévalence est la plus élevée chez les nourrissons, les adolescents et les jeunes adultes. 3 La méningite à méningocoque était autrefois la cause la plus fréquente des épidémies de méningite chez les populations humaines. C'est toujours le cas dans une partie de l'Afrique subsaharienne connue sous le nom de ceinture de la méningite, mais les épidémies de méningite méningococcique sont devenues rares dans la plupart des autres régions, grâce aux vaccins antiméningococciques. Cependant, des épidémies peuvent encore se produire dans les communautés, les écoles, les collèges, les prisons et d'autres populations où les personnes sont en contact direct étroit.
N. meningitidis a une forte affinité pour les muqueuses de l'oropharynx et du nasopharynx. Le contact avec des sécrétions respiratoires contenant N. meningitidis est un mode de transmission efficace. La pathogénicité de N. meningitidis est renforcée par des facteurs de virulence qui contribuent à la progression rapide de la maladie. Il s'agit notamment de l'endotoxine lipooligosaccharidique (LOS), des pili de type IV destinés à être fixés aux tissus de l'hôte et des capsules de polysaccharides qui aident les cellules à éviter la phagocytose et la destruction induite par le complément. Les autres facteurs de virulence incluent la protéase IgA (qui décompose les anticorps IgA), les facteurs d'invasion Opa, Opc et porine (qui facilitent l'entrée transcellulaire à travers la barrière hémato-encéphalique), les facteurs d'absorption du fer (qui retirent les unités hèmes de l'hémoglobine des cellules hôtes et les utilisent pour la croissance) et le stress protéines qui protègent les bactéries des molécules d'oxygène réactives.
Un signe unique de méningite à méningocoque est la formation d'une éruption pétéchiale sur la peau ou les muqueuses, caractérisée par de minuscules lésions rouges, plates et hémorragiques. Cette éruption cutanée, qui apparaît peu après l'apparition de la maladie, est une réponse à l'endotoxine LOS et aux facteurs de virulence liés à l'adhérence qui perturbent les cellules endothéliales des capillaires et des petites veines de la peau. La perturbation des vaisseaux sanguins déclenche la formation de minuscules caillots sanguins, provoquant une fuite de sang dans les tissus environnants. Au fur et à mesure que l'infection progresse, les niveaux de facteurs de virulence augmentent et les lésions hémorragiques peuvent prendre de l'ampleur à mesure que le sang continue de couler dans les tissus. Des lésions de plus de 1,0 cm surviennent généralement chez les patients en état de choc, car les facteurs de virulence entraînent une augmentation des hémorragies et de la formation de caillots. La septicémie, qui résulte de lésions systémiques causées par des facteurs de virulence méningococciques, peut entraîner une défaillance rapide de plusieurs organes, un choc, une coagulation intravasculaire disséminée et la mort.
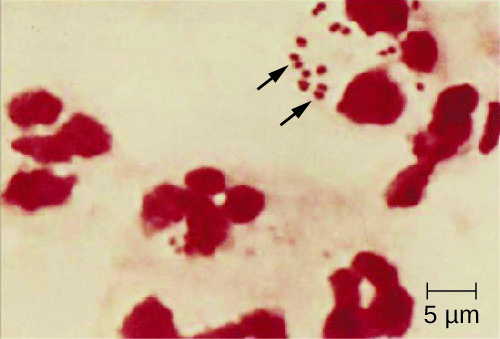
Comme la méningite à méningocoque progresse si rapidement, une plus grande variété d'échantillons cliniques sont nécessaires pour détecter rapidement N. meningitidis. Les prélèvements requis peuvent comprendre du sang, du LCR, des écouvillons naso- et oropharyngés, des écouvillons urétraux et endocervicaux, des aspirats pétéchiaux et des biopsies. Les protocoles de sécurité pour la manipulation et le transport des échantillons soupçonnés de contenir N. meningitidis doivent toujours être respectés, car des cas de méningococcie fatale sont survenus chez des professionnels de santé exposés à des gouttelettes ou à des aérosols provenant d'échantillons prélevés sur des patients. Un diagnostic présomptif rapide de méningite à méningocoque peut être posé lorsque le LCR est directement évalué par coloration de Gram, révélant des diplocoques gram-négatifs extra et intracellulaires présentant une morphologie microscopique caractéristique des grains de café associés aux PMN (Figure\(\PageIndex{2}\)). L'identification peut également être faite directement à partir du LCR par agglutination au latex et par des tests diagnostiques rapides immunochromatographiques spécifiques à N. meningitidis. L'identification des espèces peut également être réalisée à l'aide de schémas de typage basés sur des séquences d'ADN pour les protéines hypervariables de la membrane externe de N. meningitidis, qui ont remplacé le sero (sous) typage.
Les infections méningococciques peuvent être traitées par antibiothérapie, et les céphalosporines de troisième génération sont le plus souvent utilisées. Cependant, comme les résultats peuvent être négatifs même en cas de traitement, la vaccination préventive est la meilleure forme de traitement. En 2010, les pays de la ceinture africaine de la méningite ont commencé à utiliser un nouveau vaccin conjugué contre le méningocoque du sérogroupe A. Ce programme a permis de réduire considérablement le nombre de cas de méningite à méningocoque en conférant une immunité individuelle et collective.
Douze sérotypes capsulaires différents de N. meningitidis sont connus. Les sérotypes A, B, C, W, X et Y sont les plus répandus dans le monde. Les CDC recommandent que les enfants âgés de 11 à 12 ans soient vaccinés avec une dose unique d'un vaccin quadrivalent qui protège contre les sérotypes A, C, W et Y, avec un rappel à 16 ans. 4 Une dose supplémentaire de rappel ou des injections de vaccin antiméningococcique du sérogroupe B peuvent être administrées aux personnes vivant dans des environnements à haut risque (comme des épidémies sur les campus universitaires).
Méningite sur le campus
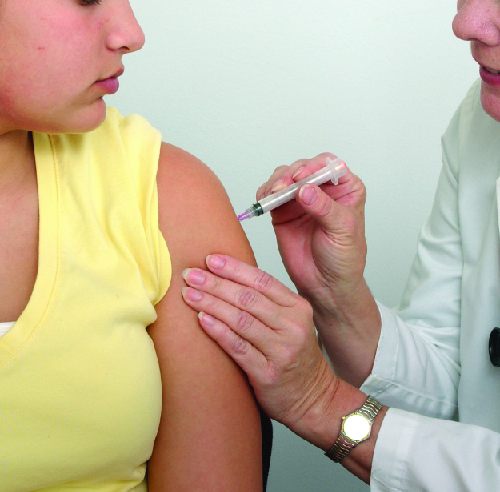
Les étudiants qui vivent dans des dortoirs ou des logements communautaires courent un risque accru de contracter une méningite épidémique. De 2011 à 2015, il y a eu au moins neuf éclosions de méningocoques sur des campus universitaires aux États-Unis. Ces incidents ont impliqué un total de 43 étudiants (dont quatre sont décédés). 5 Malgré un diagnostic rapide et un traitement antimicrobien agressif, plusieurs des survivants ont souffert d'amputations ou de graves problèmes neurologiques.
La vaccination prophylactique des étudiants de première année vivant dans des dortoirs est recommandée par les CDC, et les compagnies d'assurance couvrent désormais la vaccination contre le méningocoque pour les étudiants des dortoirs universitaires. Certains collèges ont rendu obligatoire la vaccination avec le vaccin conjugué contre le méningocoque pour certains étudiants qui entrent à l'université (Figure\(\PageIndex{3}\)).
Méningite pneumococcique
La méningite pneumococcique est causée par la bactérie à Gram positif encapsulée S. pneumoniae (pneumocoque, également appelée pneumocoque streptococcique). Cet organisme est couramment présent dans le microbiote du pharynx de 30 à 70 % des jeunes enfants, selon la méthode d'échantillonnage, tandis que S. pneumoniae peut être détecté chez moins de 5 % des adultes en bonne santé. Bien qu'il soit souvent présent sans symptômes de maladie, ce microbe peut traverser la barrière hémato-encéphalique chez les personnes sensibles. Dans certains cas, cela peut également entraîner une septicémie. Depuis l'introduction du vaccin contre le Hib, S. pneumoniae est devenue la principale cause de méningite chez les humains âgés de 2 mois à l'âge adulte.
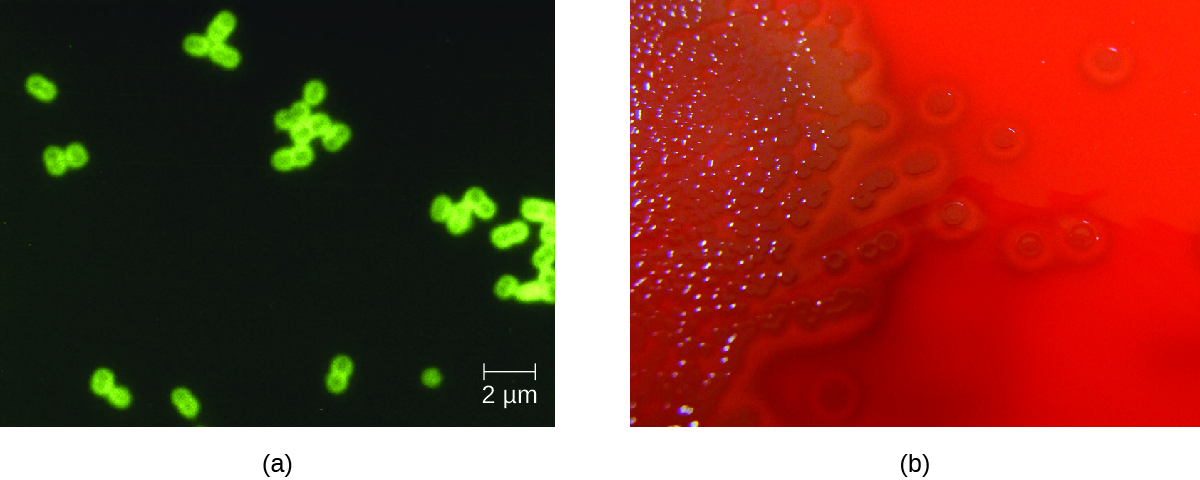
S. pneumoniae peut être identifiée dans des échantillons de LCR à l'aide d'échantillons colorés au gramme, d'une agglutination au latex et d'un TDR immunochromatographique spécifique à S. pneumoniae. Dans les échantillons colorés au gramme, S. pneumoniae apparaît sous forme de diplocoques gram-positifs en forme de lancette (Figure\(\PageIndex{4}\)). L'identification de S. pneumoniae peut également être réalisée à l'aide de cultures de LCR et de sang, et au moins 93 sérotypes distincts peuvent être identifiés sur la base de la réaction d'extinction à des polysaccharides capsulaires uniques. Des tests PCR et RT-PCR sont également disponibles pour confirmer l'identification.
Les principaux facteurs de virulence produits par S. pneumoniae sont la PI-1 piline pour l'adhérence aux cellules hôtes (adhérence pneumococcique) et le facteur de virulence B (PavB) pour la fixation aux cellules des voies respiratoires ; les protéines liant la choline (CBpA) qui se lient aux cellules épithéliales et interfèrent avec les facteurs immunitaires IgA et C3 ; et la pneumolysine, une toxine bactérienne cytoplasmique, qui déclenche une réponse inflammatoire.
Avec l'émergence de souches de S. pneumoniae résistantes aux médicaments, la méningite pneumococcique est généralement traitée avec des antibiotiques à large spectre, tels que la lévofloxacine, le céfotaxime, la pénicilline ou d'autres antibiotiques β-lactamines. Les deux vaccins antipneumococciques disponibles sont décrits dans Infections bactériennes des voies respiratoires.
Haemophilus influenzae de type b
La méningite due au sérotype b (Hib) de H. influenzae, un coccobacille pléomorphe à Gram négatif encapsulé, est aujourd'hui peu courante dans la plupart des pays, en raison de l'utilisation du vaccin efficace contre le Hib. Sans le vaccin anti-Hib, H. influenzae peut être la principale cause de méningite chez les enfants âgés de 2 mois à 5 ans. H. influenzae peut être détecté dans la gorge de personnes en bonne santé, y compris les nourrissons et les jeunes enfants. À l'âge de cinq ans, la plupart des enfants ont développé une immunité contre ce microbe. Les nourrissons âgés de plus de 2 mois ne produisent toutefois pas de réponse immunitaire protectrice suffisante et sont susceptibles de développer une maladie grave. La pression intracrânienne provoquée par cette infection entraîne un taux de mortalité de 5 % et une incidence de 20 % de surdité ou de lésions cérébrales chez les survivants. 6
H. influenzae produit au moins 16 facteurs de virulence différents, dont le LOS, qui déclenche l'inflammation, et le facteur d'adhésion et de pénétration d'Haemophilus (Hap), qui facilite la fixation et l'invasion des cellules épithéliales respiratoires. La bactérie possède également une capsule polysaccharidique qui l'aide à éviter la phagocytose, ainsi que des facteurs tels que la protéase IgA1 et la protéine P2 qui lui permettent d'échapper aux anticorps sécrétés par les muqueuses. De plus, des facteurs tels que la protéine liant l'hémoglobine (Hgp) et la protéine liant la transferrine (Tbp) obtiennent du fer à partir de l'hémoglobine et de la transferrine, respectivement, pour la croissance bactérienne.
Le diagnostic préliminaire des infections à H. influenzae peut être posé par PCR directe et un frottis de LCR. Les frottis colorés révéleront des PMN intracellulaires et extracellulaires présentant de petits coccobacilles pléomorphes à Gram négatif ou des formes filamenteuses caractéristiques de H. influenzae. La confirmation initiale de ce genre peut être basée sur sa croissance fastidieuse sur de la gélose au chocolat. L'identification est confirmée par les exigences relatives aux cofacteurs de croissance biochimiques exogènes NAD et hème (par MALDI-TOF), à l'agglutination au latex et à la RT-PCR.
La méningite causée par H. influenzae est généralement traitée avec de la doxycycline, des fluoroquinolones, des céphalosporines de deuxième et troisième générations et des carbapénèmes. Le meilleur moyen de prévenir l'infection par H. influenza consiste à utiliser le vaccin conjugué à base de polysaccharides anti-Hib. Il est recommandé que tous les enfants reçoivent ce vaccin à l'âge de 2, 4 et 6 mois, avec une dose de rappel finale à l'âge de 12 à 15 mois. 7
Méningite néonatale
S. agalactiae, streptocoque du groupe B (GBS), est une bactérie gram-positive encapsulée qui est la cause la plus fréquente de méningite néonatale, terme désignant la méningite qui touche les bébés de moins de 3 mois. 8 S. agalactiae peut également provoquer une méningite chez des personnes de tous âges et se retrouve dans le microbiote urogénital et gastro-intestinal d'environ 10 à 30 % des humains.
L'infection néonatale se manifeste soit à début précoce soit à apparition tardive. La maladie à début précoce est définie comme survenant chez les nourrissons âgés de moins de 7 jours. Le nourrisson est d'abord infecté par S. agalactiae lors de l'accouchement, lorsque la bactérie peut être transférée du vagin de la mère. L'incidence de la méningite néonatale précoce peut être considérablement réduite en administrant des antibiotiques par voie intraveineuse à la mère pendant l'accouchement.
La méningite néonatale d'apparition tardive survient chez les nourrissons âgés de 1 semaine à 3 mois. Les nourrissons nés de mères atteintes de S. agalactiae dans l'appareil urogénital courent un risque plus élevé de méningite tardive, mais les infections d'apparition tardive peuvent être transmises par des sources autres que la mère ; souvent, la source de l'infection est inconnue. Les nourrissons qui naissent prématurément (avant 37 semaines de grossesse) ou dont la mère développe de la fièvre courent également un risque accru de contracter une méningite néonatale tardive.
Les signes et symptômes de l'apparition précoce de la maladie incluent l'instabilité de la température, l'apnée (arrêt de la respiration), la bradycardie (ralentissement du rythme cardiaque), l'hypotension, la difficulté à s'alimenter, l'irritabilité et la faiblesse. Lorsqu'il dort, le bébé peut avoir du mal à se réveiller. Les symptômes de la maladie à apparition tardive sont plus susceptibles d'inclure des convulsions, une fontanelle renflée (point mou), une raideur de la nuque, une hémiparésie (faiblesse d'un côté du corps) et un opisthoton (corps rigide avec dos cambré et tête tournée vers l'arrière).
S. agalactiae produit au moins 12 facteurs de virulence, dont le FbSA qui se fixe aux protéines de surface des cellules hôtes, le PI-1 piliqui favorise l'invasion des cellules endothéliales humaines, une capsule polysaccharidique qui empêche l'activation de la voie alternative du complément et inhibe la phagocytose, et le facteur CAMP, une toxine, qui forme des pores dans les membranes des cellules hôtes et se lie aux anticorps IgG et IgM.
Le diagnostic de méningite néonatale est souvent, mais pas uniformément, confirmé par des résultats positifs provenant de cultures de LCR ou de sang. Les tests incluent la culture de routine, la détection de l'antigène par dosage immunoenzymatique, le sérotypage de différents types de gélules, la PCR et la RT-PCR. Il est généralement traité avec des antibiotiques β-lactamines tels que la pénicilline par voie intraveineuse ou l'ampicilline associée à la gentamicine. Même avec le traitement, une mortalité d'environ 10 % est observée chez les nouveau-nés infectés. 9
Exercice\(\PageIndex{1}\)
- Quels sont les groupes les plus vulnérables à chacune des méningites bactériennes ?
- Parmi les méningites bactériennes, quelles sont les vaccins actuellement disponibles ?
- Quel organisme peut provoquer une méningite épidémique ?
Maladies associées au clostridium
Les espèces du genre Clostridium sont des bâtonnets à Gram positif formant des endospores qui sont obligatoirement anaérobies. Les endospores de Clostridium spp. sont répandues dans la nature et se trouvent généralement dans le sol, l'eau, les matières fécales, les eaux usées et les sédiments marins. Les Clostridium spp. produisent plus de types d'exotoxines protéiques que tout autre genre bactérien, y compris deux exotoxines à activité protéasique qui sont les toxines biologiques connues les plus puissantes : la neurotoxine botulique (BoNT) et la neurotoxine tétanique (TenT). Ces deux toxines ont des doses létales de 0,2 à 10 ng par kg de poids corporel.
Le BoNT peut être produit par des souches uniques de C. butyricum et de C. baratii ; toutefois, il est principalement associé à C. botulinum et au botulisme. La TenT, qui cause le tétanos, n'est produite que par C. tetani. Ces puissantes exotoxines neurales sont les principaux facteurs de virulence de ces agents pathogènes. Le mode d'action de ces toxines a été décrit dans Facteurs de virulence des agents pathogènes bactériens et viraux et illustré à la Figure 15.3.7.
Le diagnostic du tétanos ou du botulisme repose généralement sur des essais biologiques qui détectent la présence de BoNT et de TenT dans des échantillons fécaux, du sang (sérum) ou des aliments suspects. De plus, C. botulinum et C. tetani peuvent être isolés et cultivés à l'aide de milieux disponibles dans le commerce pour les anaérobies. Des tests ELISA et RT-PCR sont également disponibles.
Tétanos
Le tétanos est une maladie non transmissible caractérisée par des spasmes musculaires incontrôlables (contractions) provoqués par l'action de la TenT. Elle survient généralement lorsque C. tetani infecte une plaie et produit du TenT, qui se lie rapidement au tissu neural, provoquant une intoxication (empoisonnement) des neurones. Selon le site et l'étendue de l'infection, les cas de tétanos peuvent être décrits comme localisés, céphaliques ou généralisés. Le tétanos généralisé qui survient chez un nouveau-né est appelé tétanos néonatal.
Le tétanos localisé survient lorsque la Tent affecte uniquement les groupes musculaires situés à proximité du site de la lésion. Il n'y a pas d'atteinte du SNC et les symptômes sont généralement légers, avec des spasmes musculaires localisés causés par un dysfonctionnement des neurones environnants. Les personnes présentant une immunité partielle, en particulier les personnes déjà vaccinées qui négligent de recevoir les doses de rappel recommandées, sont plus susceptibles de développer un tétanos localisé à la suite de l'infection par C. tetani d'une plaie perforante.
Le tétanos céphalique est une forme rare et localisée de tétanos généralement associée à des blessures à la tête ou au visage. Dans de rares cas, elle est survenue dans des cas d'otite moyenne (infection de l'oreille moyenne). Le tétanos céphalique amène souvent les patients à voir deux images, en raison des spasmes qui affectent les muscles qui contrôlent les mouvements des yeux.
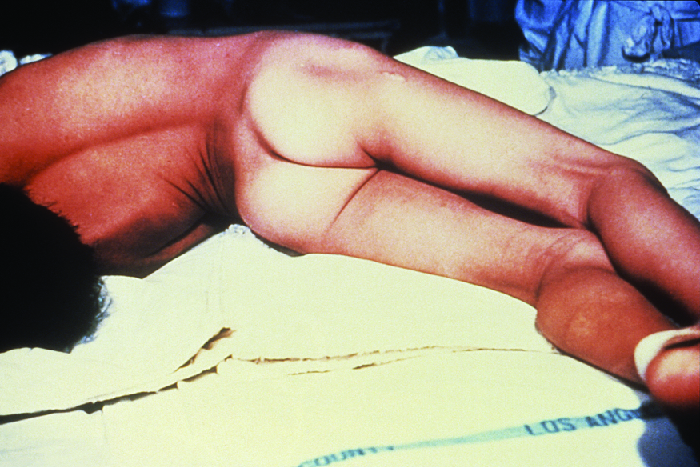
Le tétanos localisé et le tétanos céphalique peuvent évoluer vers un tétanos généralisé, une affection beaucoup plus grave, si le Trent parvient à se propager davantage dans les tissus corporels. Dans le cas du tétanos généralisé, la TenT pénètre dans les neurones du système nerveux central. À partir de là, la TenT se déplace du site de la plaie, généralement à une extrémité du corps, puis rétrograde (vers le haut) vers les neurones inhibiteurs du SNC. Elle y empêche la libération de l'acide gamma-aminobutyrique (GABA), le neurotransmetteur responsable de la relaxation musculaire. Les spasmes musculaires qui en résultent apparaissent souvent d'abord dans les muscles de la mâchoire, entraînant le symptôme caractéristique du trismus (incapacité à ouvrir la bouche). Au fur et à mesure que la toxine continue de bloquer la libération des neurotransmetteurs, d'autres muscles sont impliqués, provoquant des spasmes musculaires soudains et incontrôlables qui sont suffisamment puissants pour provoquer la rupture des tendons et la fracture des os. Des spasmes dans les muscles du cou, du dos et des jambes peuvent provoquer la formation d'une voûte plantaire rigide et raide, une posture appelée opisthotonos (Figure\(\PageIndex{5}\)). Les spasmes du larynx, du diaphragme et des muscles de la poitrine limitent la capacité du patient à avaler et à respirer, entraînant éventuellement la mort par asphyxie (apport insuffisant d'oxygène).
Le tétanos néonatal survient généralement lorsque le moignon du cordon ombilical est contaminé par des spores de C. tetani après l'accouchement. Bien que cette affection soit rare aux États-Unis, le tétanos néonatal est l'une des principales causes de mortalité infantile dans les pays qui ne sont pas vaccinés contre le tétanos chez les mères et où les accouchements se produisent souvent dans des conditions insalubres. À la fin de la première semaine de vie, les nourrissons infectés deviennent irritables, se nourrissent mal et développent une rigidité accompagnée de spasmes. Le tétanos néonatal a un très mauvais pronostic avec un taux de mortalité de 70 % à 100 %. 10
Le traitement des patients atteints du tétanos comprend l'assistance respiratoire par l'utilisation d'un ventilateur, le débridement de la plaie, l'équilibre hydrique et une antibiothérapie au métronidazole ou à la pénicilline pour stopper la croissance de C. tetani. De plus, les patients sont traités avec de l'antitoxine TenT, de préférence sous forme d'immunoglobulines humaines pour neutraliser la toxine non fixée et des benzodiazépines afin de renforcer l'effet du GABA sur la relaxation musculaire et l'anxiété.
Un vaccin antitétanique (TT) est disponible pour la protection et la prévention du tétanos. C'est le composant T de vaccins tels que le DCaT, le Tdap et le Td. Les CDC recommandent aux enfants de recevoir des doses du vaccin DCaT à l'âge de 2, 4, 6 et 15 à 18 mois et une autre dose à l'âge de 4 à 6 ans. Une dose de Td est recommandée pour les adolescents et les adultes à titre de rappel du TT tous les 10 ans. 11
Botulisme
Le botulisme est une maladie rare mais souvent mortelle causée par une intoxication au BoNT. Elle peut survenir soit à la suite d'une infection par C. botulinum, auquel cas les bactéries produisent du BoNT in vivo, soit à la suite d'une introduction directe de BoNT dans les tissus.
L'infection et la production de BoNT in vivo peuvent provoquer le botulisme des plaies, le botulisme infantile et la toxémie intestinale chez l'adulte. Le botulisme se produit généralement lorsque C. botulinum est introduit directement dans une plaie après une blessure traumatique, une perforation profonde ou un site d'injection. Le botulisme infantile, qui survient chez les nourrissons de moins d'un an, et la toxémie intestinale chez l'adulte, qui survient chez les adultes immunodéprimés, résultent de l'ingestion d'endospores de C. botulinum dans les aliments. Les endospores germent dans l'organisme, ce qui entraîne la production de BoNT dans le tractus intestinal.
Les intoxications se produisent lorsque le BoNT est produit à l'extérieur de l'organisme puis introduit directement dans l'organisme par les aliments (botulisme d'origine alimentaire), l'air (botulisme par inhalation) ou par une intervention clinique (botulisme iatrogène). Le botulisme d'origine alimentaire, la forme la plus courante de ces formes, survient lorsque le BoNT est produit dans des aliments contaminés, puis ingéré en même temps que les aliments (rappelez-vous Case in Point : A Streak of Bad Potluck). Le botulisme par inhalation est rare car le BoNT est instable sous forme d'aérosol et n'est pas présent dans la nature. Cependant, il peut être produit en laboratoire et a été utilisé (sans succès) comme arme biologique par des terroristes au Japon dans les années 1990. Quelques cas de botulisme accidentel par inhalation se sont également produits. Le botulisme iatrogène est également rare ; il est associé à des injections de BoNT utilisées à des fins esthétiques (voir Micro Connections : Medicinal Uses of Botulinum Toxin).
Lorsque le BoNT pénètre dans la circulation sanguine par le tractus gastro-intestinal, la plaie ou les poumons, il est transféré aux jonctions neuromusculaires des motoneurones où il se lie de manière irréversible aux membranes présynaptiques et empêche la libération d'acétylcholine du terminal présynaptique des motoneurones dans le neuromusculaire jonction. La prévention de la libération d'acétylcholine a pour conséquence une perte d'activité musculaire, entraînant une relaxation musculaire et éventuellement une paralysie.
Si le BoNT est absorbé par le tractus gastro-intestinal, les premiers symptômes du botulisme incluent une vision trouble, des paupières tombantes, des difficultés à avaler, des crampes abdominales, des nausées, des vomissements, de la constipation ou peut-être de la diarrhée. Cela est suivi d'une paralysie flasque progressive, d'un affaiblissement progressif et d'une perte de contrôle des muscles. L'expérience d'un patient peut être particulièrement terrifiante, car l'ouïe reste normale, la conscience n'est pas perdue et le patient est pleinement conscient de l'évolution de son état. Chez les nourrissons, les signes notables du botulisme incluent des pleurs faibles, une diminution de la capacité de téter et une hypotonie (faiblesse de la tête ou du corps). Le botulisme finit par entraîner la mort à la suite d'une insuffisance respiratoire causée par la paralysie progressive des muscles des voies respiratoires supérieures, du diaphragme et du thorax.
Le botulisme est traité avec une antitoxine spécifique au BoNT. Si elle est administrée à temps, l'antitoxine arrête la progression de la paralysie mais ne l'inverse pas. Une fois l'antitoxine administrée, le patient retrouvera lentement sa fonction neurologique, mais cela peut prendre plusieurs semaines ou plusieurs mois, selon la gravité du cas. Pendant leur convalescence, les patients doivent généralement rester hospitalisés et recevoir une assistance respiratoire grâce à un ventilateur.
Exercice\(\PageIndex{2}\)
- À quelle fréquence la vaccination antitétanique doit-elle être mise à jour chez les adultes ?
- Quelles sont les causes les plus fréquentes du botulisme ?
- Pourquoi le botulisme n'est-il pas traité avec un antibiotique ?
Utilisations médicinales de la toxine botulique
Bien qu'il s'agisse de la matière biologique la plus toxique connue de l'homme, la toxine botulique est souvent injectée intentionnellement à des personnes pour traiter d'autres affections. La toxine botulique de type A est utilisée en cosmétique pour réduire les rides. L'injection de quantités infimes de cette toxine dans le visage provoque la relaxation des muscles du visage, donnant ainsi à la peau un aspect plus lisse. Les contractions des paupières et les yeux croisés peuvent également être traités par des injections de toxine botulique. D'autres utilisations de cette toxine incluent le traitement de l'hyperhidrose (transpiration excessive). En fait, la toxine botulique peut être utilisée pour atténuer les effets de plusieurs autres maladies apparemment non microbiennes impliquant une fonction nerveuse inappropriée. Ces maladies incluent la paralysie cérébrale, la sclérose en plaques et la maladie de Parkinson. Chacune de ces maladies se caractérise par une perte de contrôle des contractions musculaires ; le traitement à la toxine botulique permet de détendre les muscles contractés.
Listériose
La Listeria monocytogenes est un bâtonnet Gram positif non encapsulé, non sporulé et un pathogène d'origine alimentaire responsable de la listériose. Les groupes à risque comprennent les femmes enceintes, les nouveau-nés, les personnes âgées et les personnes immunodéprimées (rappelons les études de cas Clinical Focus sur la croissance microbienne et les mécanismes microbiens de pathogénicité). La listériose entraîne une méningite dans environ 20 % des cas, en particulier chez les nouveau-nés et les patients âgés de plus de 60 ans. Les CDC identifient la listériose comme la troisième cause de décès due à des maladies d'origine alimentaire, avec des taux de mortalité globaux atteignant 16 %. 12 Chez la femme enceinte, la listériose peut également provoquer un avortement spontané chez la femme enceinte en raison de la capacité unique du pathogène à traverser le placenta.
L. monocytogenes est généralement introduit dans les denrées alimentaires par contamination par du sol ou du fumier animal utilisé comme engrais. Les aliments couramment associés à la listériose comprennent les fruits et légumes frais, les légumes surgelés, les viandes transformées, les fromages à pâte molle et le lait cru. 13 Contrairement à la plupart des autres agents pathogènes d'origine alimentaire, la Listeria peut se développer à des températures comprises entre 0 °C et 50 °C et peut donc continuer à croître, même dans les aliments réfrigérés.
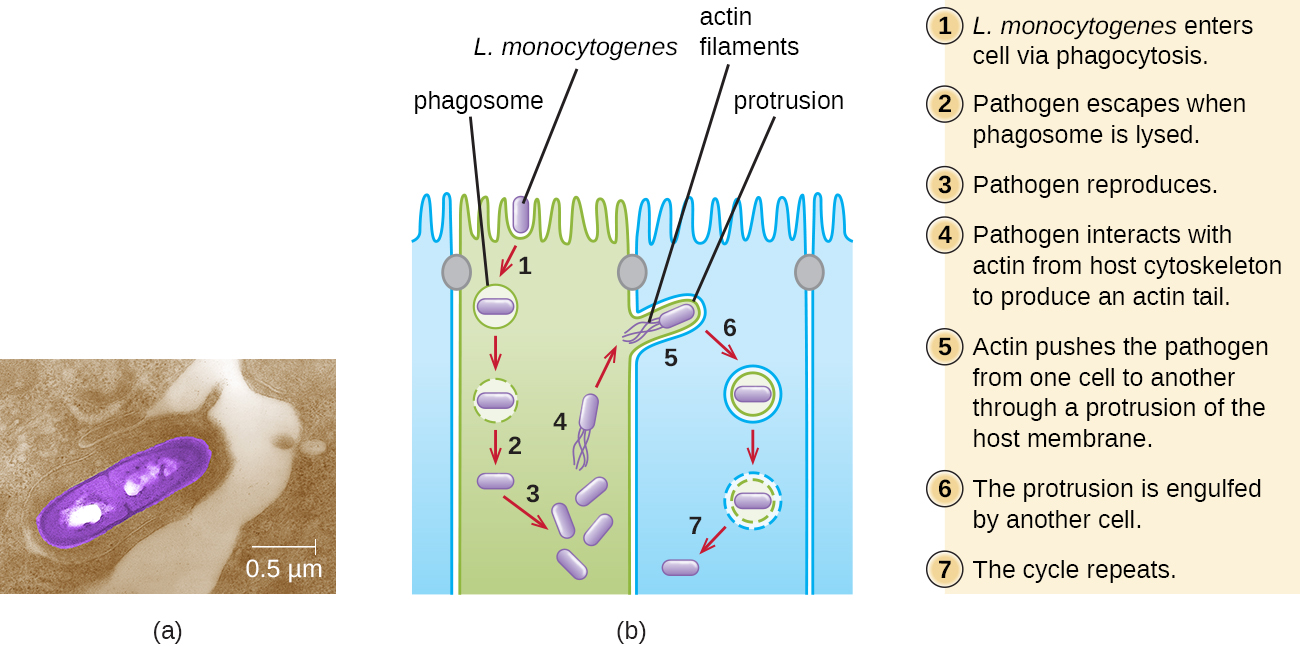
L'ingestion d'aliments contaminés entraîne initialement une infection du tractus gastro-intestinal. Cependant, L. monocytogenes produit plusieurs facteurs de virulence uniques qui lui permettent de traverser la barrière intestinale et de se propager à d'autres systèmes corporels. Les protéines de surface appelées internalines (InLa et InLB) aident L. monocytogenes à envahir les cellules et les tissus non phagocytaires, à pénétrer la paroi intestinale et à se disséminer dans les systèmes circulatoire et lymphatique. Les internalines permettent également à L. monocytogenes de franchir d'autres barrières importantes, notamment la barrière hémato-encéphalique et le placenta. Dans les tissus, L. monocytogenes utilise d'autres protéines appelées listériolysine O et AcTA pour faciliter le mouvement intercellulaire et permettre à l'infection de se propager d'une cellule à l'autre (Figure\(\PageIndex{6}\)).
L. monocytogenes est généralement identifié par la culture d'échantillons provenant d'un site normalement stérile (sang ou LCR, par exemple). La récupération des organismes viables peut être améliorée par l'enrichissement à froid en incubant les échantillons dans un bouillon à 4 °C pendant une semaine ou plus. La distinction des types et des sous-types de L. monocytogenes, étape importante pour le diagnostic et l'épidémiologie, se fait généralement par électrophorèse sur gel à champ pulsé. L'identification peut également être réalisée à l'aide de tests par chimiluminescence par sonde d'ADN et de MALDI-TOF.
Le traitement de la listériose implique une antibiothérapie, le plus souvent avec de l'ampicilline et de la gentamicine. Aucun vaccin n'est disponible.
Exercice\(\PageIndex{3}\)
Comment la Listeria pénétre-t-elle dans le système nerveux ?
La maladie de Hansen (lèpre)
La maladie de Hansen (également connue sous le nom de lèpre) est causée par une bactérie filamenteuse longue et fine en forme de bâtonnet, Mycobacterium leprae, un pathogène intracellulaire obligatoire. M. leprae est classé parmi les bactéries gram-positives, mais il est préférable de le visualiser au microscope à l'aide d'une coloration acido-résistante et est généralement appelé bactérie acido-résistante. La maladie de Hansen affecte le système nerveux central, entraînant des dommages permanents et la perte d'appendices ou d'autres parties du corps.
La maladie de Hansen est transmissible mais peu contagieuse ; environ 95 % de la population humaine ne peut pas être facilement infectée en raison de son immunité naturelle contre M. leprae. La transmission interhumaine se produit par inhalation dans la muqueuse nasale ou par contact prolongé et répété avec de la peau infectée. Les tatous, l'un des cinq seuls mammifères sensibles à la maladie de Hansen, ont également été impliqués dans la transmission de certains cas. 14
Dans le corps humain, M. leprae se développe mieux aux températures plus fraîches des tissus périphériques tels que le nez, les orteils, les doigts et les oreilles. Certains des facteurs de virulence qui contribuent à la pathogénicité de M. leprae se trouvent sur la capsule et la paroi cellulaire de la bactérie. Ces facteurs de virulence lui permettent de se lier aux cellules de Schwann et de les envahir, ce qui entraîne une démyélinisation progressive qui détruit progressivement les neurones du système nerveux central. La perte de la fonction neuronale entraîne une hypoesthésie (engourdissement) dans les lésions infectées. M. leprae est facilement phagocyté par les macrophages, mais il est capable de survivre dans les macrophages, en partie en neutralisant les espèces réactives de l'oxygène produites lors de l'explosion oxydative du phagolysosome. Comme L. monocytogenes, M. leprae peut également se déplacer directement entre les macrophages pour éviter d'être éliminé par des facteurs immunitaires.
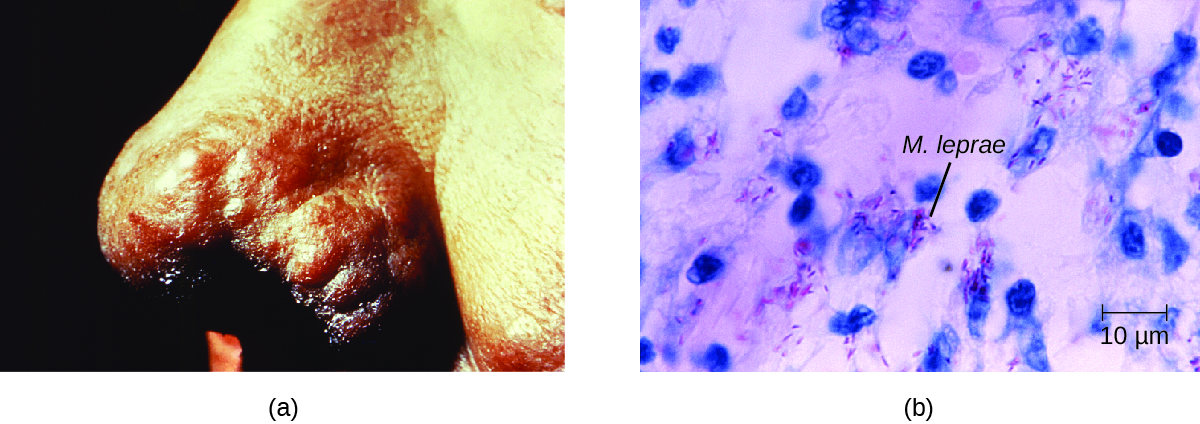
L'étendue de la maladie est liée à la réponse immunitaire du patient. Les premiers symptômes peuvent ne pas apparaître aussi longtemps que 2 à 5 ans après l'infection. Elles commencent souvent par de petites zones blanchies et engourdies de la peau. Chez la plupart des personnes, elles disparaîtront spontanément, mais dans certains cas, elles peuvent évoluer vers une forme plus grave de la maladie. La maladie de Hansen tuberculeuse (paucibacillaire) se caractérise par la présence d'un nombre relativement restreint (trois ou moins) de lésions cutanées plates et blanchies avec de petits nodules sur les bords et peu de bactéries présentes dans la lésion. Bien que ces lésions puissent persister pendant des années, voire des décennies, les bactéries sont contrôlées par une réponse immunitaire efficace, y compris une cytotoxicité à médiation cellulaire. Les personnes incapables de contenir l'infection peuvent développer ultérieurement la maladie de Hansen lépromateuse (multibacillaire). Il s'agit d'une forme progressive de la maladie caractérisée par des nodules remplis de bacilles acido-résistants et de macrophages. Une altération du fonctionnement des cellules de Schwann infectées entraîne des lésions des nerfs périphériques, entraînant une perte sensorielle qui entraîne des ulcères, des déformations et des fractures. L'endommagement du nerf ulnaire (au poignet) par M. leprae est l'une des causes les plus fréquentes de paralysie de la main. Dans certains cas, des lésions tissulaires chroniques peuvent finir par entraîner la perte des doigts ou des orteils. Lorsque les tissus des muqueuses sont également impliqués, des lésions défigurantes du nez et du visage peuvent également survenir (Figure\(\PageIndex{7}\)).
La maladie de Hansen est diagnostiquée sur la base des signes et symptômes cliniques de la maladie, et confirmée par la présence de bacilles acido-résistants sur des frottis cutanés ou dans des échantillons de biopsie cutanée (Figure\(\PageIndex{7}\)). M. leprae ne pousse pas in vitro sur aucun milieu de laboratoire connu, mais il peut être identifié en le cultivant in vivo sur les repose-pieds de souris de laboratoire ou de tatous. Au besoin, la PCR et le génotypage de l'ADN de M. leprae dans les tissus humains infectés peuvent être effectués à des fins de diagnostic et d'épidémiologie.
La maladie de Hansen répond bien au traitement et, si elle est diagnostiquée et traitée à un stade précoce, elle ne cause pas d'invalidité. Aux États-Unis, la plupart des patients atteints de la maladie de Hansen sont traités dans des cliniques de soins ambulatoires des grandes villes par le National Hansen Disease Program, la seule institution aux États-Unis exclusivement dédiée à la maladie de Hansen. Depuis 1995, l'OMS met gratuitement à la disposition de tous les patients du monde entier un traitement multimédicamenteux contre la maladie de Hansen. En conséquence, la prévalence mondiale de la maladie de Hansen a diminué, passant d'environ 5,2 millions de cas en 1985 à environ 176 000 en 2014. 15 Le traitement multimédicamenteux comprend de la dapsone et de la rifampicine pour tous les patients et un troisième médicament, la clofazimine, pour les patients atteints d'une maladie multibacillaire.
Il n'existe actuellement aucun vaccin universellement accepté contre la maladie de Hansen. L'Inde et le Brésil utilisent un vaccin antituberculeux contre la maladie de Hansen, car les deux maladies sont causées par des espèces de Mycobacterium. L'efficacité de cette méthode est toutefois discutable, car il semble que le vaccin fonctionne dans certaines populations mais pas dans d'autres.
Exercice\(\PageIndex{4}\)
- Qu'est-ce qui empêche la progression de la lèpre tuberculeuse à la lèpre lépromateuse ?
- Pourquoi la maladie de Hansen affecte-t-elle généralement les nerfs des extrémités ?
colonies de lépreux
Des maladies mortelles et défigurantes comme la lèpre ont toujours été stigmatisées dans de nombreuses cultures. Avant que la lèpre ne soit comprise, les victimes étaient souvent isolées dans des colonies de lépreux, une pratique fréquemment mentionnée dans des textes anciens, y compris la Bible. Mais les lépreux ne sont pas simplement un artefact du monde antique. À Hawaï, une colonie de lépreux établie à la fin du XIXe siècle a persisté jusqu'au milieu du XXe siècle, ses habitants étant contraints de vivre dans des conditions déplorables. 16 Bien que la lèpre soit une maladie transmissible, elle n'est pas considérée comme contagieuse (facilement transmissible) et elle ne représente certainement pas une menace suffisante pour justifier l'isolement permanent de ses victimes. Aujourd'hui, nous réservons les pratiques d'isolement et de quarantaine aux patients atteints de maladies plus dangereuses, telles que le virus Ebola ou de bactéries multirésistantes comme Mycobacterium tuberculosis et Staphylococcus aureus. L'argument éthique en faveur de cette pratique est que l'isolement des patients infectés est nécessaire pour prévenir la transmission et la propagation de maladies hautement contagieuses, même si cela va à l'encontre de la volonté du patient.
Bien entendu, il est beaucoup plus facile de justifier la pratique de la quarantaine clinique temporaire que de la ségrégation sociale permanente, comme cela s'est produit dans les lépreux. Dans les années 1980, certains groupes ont appelé à créer des camps pour les personnes infectées par le sida. Bien que cette idée n'ait jamais été réellement mise en œuvre, elle soulève la question suivante : où devons-nous tracer la limite ? Les camps ou colonies d'isolement permanents sont-ils justifiables du point de vue médical ou social ? Supposons qu'il y ait une épidémie d'une maladie mortelle et contagieuse pour laquelle il n'existe aucun traitement. Serait-il justifié d'imposer l'isolement social aux personnes atteintes de la maladie ? Comment trouver un équilibre entre les droits des personnes infectées et le risque qu'elles représentent pour les autres ? Dans quelle mesure la société doit-elle s'attendre à ce que les individus mettent leur propre santé en danger pour traiter les autres avec humanité ?
Infections bactériennes du système nerveux
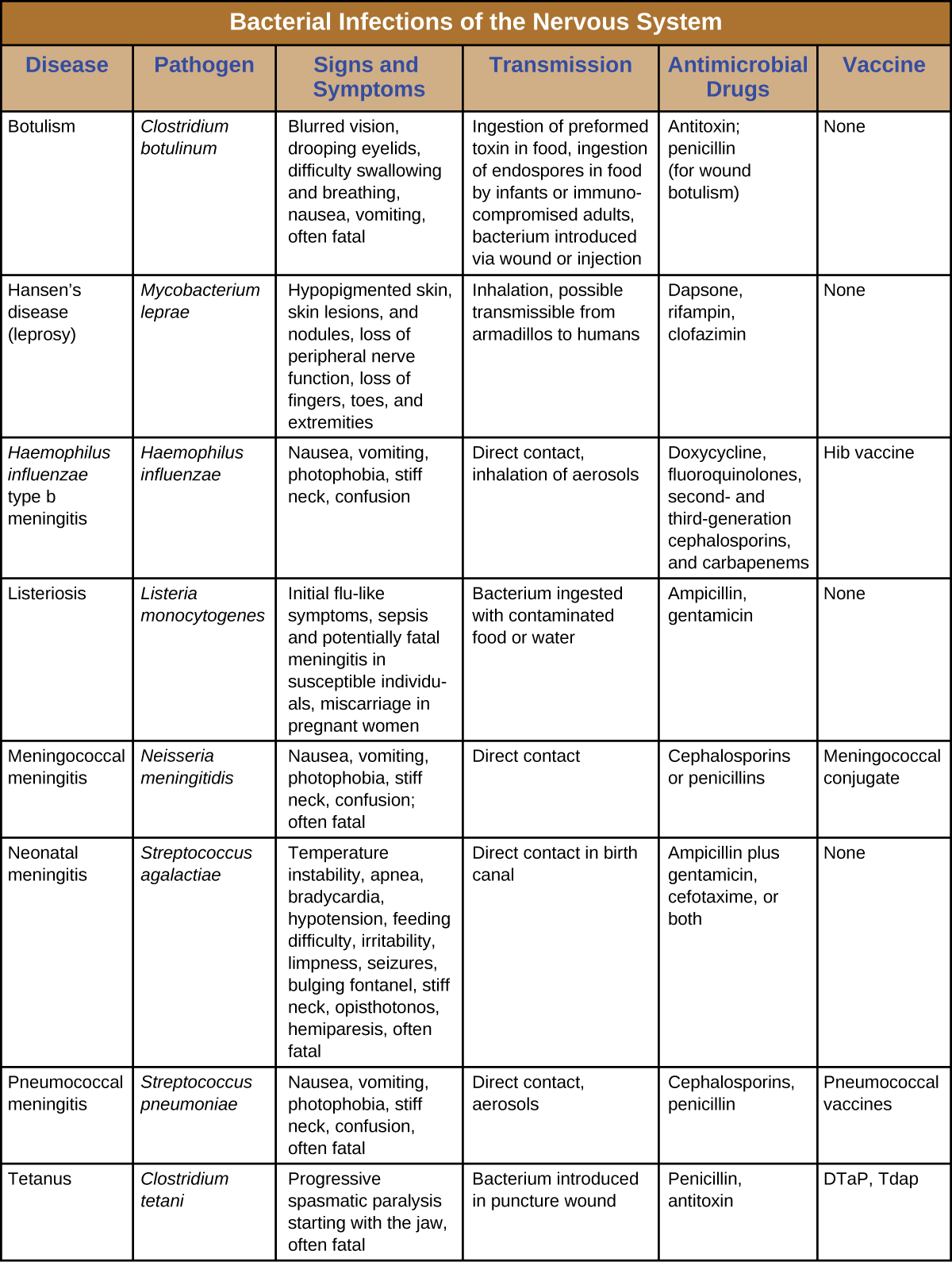
Malgré les formidables défenses qui protègent le système nerveux, un certain nombre de bactéries pathogènes sont connues pour provoquer de graves infections du SNC ou du SNP. Malheureusement, ces infections sont souvent graves et mettent la vie en danger. La figure\(\PageIndex{8}\) résume certaines infections importantes du système nerveux.
Concepts clés et résumé
- La méningite bactérienne peut être causée par plusieurs espèces de bactéries encapsulées, notamment Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae et Streptococcus agalactiae (streptocoques du groupe B). H. influenzae touche principalement les jeunes enfants et les nouveau-nés, N. meningitidis est le seul agent pathogène transmissible et touche principalement les enfants et les jeunes adultes, S. pneumoniae affecte principalement les jeunes enfants et S. agalactiae affecte les nouveau-nés pendant ou peu de temps. après la naissance.
- Les symptômes de la méningite bactérienne incluent fièvre, raideur de la nuque, maux de tête, confusion, convulsions, coma et décès.
- Le diagnostic de la méningite bactérienne se fait par l'observation et la culture d'organismes dans le LCR. La méningite bactérienne est traitée avec des antibiotiques. Des vaccins sont disponibles pour H. influenzae et N. meningitidis.
- Les espèces de Clostridium provoquent des maladies neurologiques, notamment le botulisme et le tétanos, en produisant de puissantes neurotoxines qui interfèrent avec la libération des neurotransmetteurs. Le PNS est généralement affecté. Le traitement de l'infection à Clostridium n'est efficace que par un diagnostic précoce avec administration d'antibiotiques pour contrôler l'infection et d'antitoxines pour neutraliser l'endotoxine avant qu'elle ne pénètre dans les cellules.
- La Listeria monocytogenes est un pathogène d'origine alimentaire qui peut infecter le SNC et provoquer une méningite. L'infection peut se transmettre au foetus par le placenta. Le diagnostic se fait par culture du sang ou du LCR. Le traitement se fait à l'aide d'antibiotiques et il n'existe aucun vaccin.
- La maladie de Hansen (lèpre) est causée par le parasite intracellulaire Mycobacterium leprae. Les infections provoquent une démylénation des neurones, ce qui entraîne une diminution de la sensation dans les appendices périphériques et les sites corporels. Le traitement consiste en une antibiothérapie multimédicamenteuse et il n'existe aucun vaccin universellement reconnu.
Notes
- 1 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., « Méningite bactérienne aux États-Unis, 1998-2007 », New England Journal of Medicine 364, n° 21 (2011) : 2016-25.
- 2 Popovic, T., et coll. Organisation mondiale de la santé, « Manuel de laboratoire pour le diagnostic de la méningite causée par Neisseria meningitidis, Streptococcus pneumoniae et Haemophilus influenza », 1999.
- 3 Centres américains pour le contrôle et la prévention des maladies, « Meningococcique Disease », 5 août 2015. Consulté le 28 juin 2015. www.cdc.gov/meningococcal/sur... nce/index.html.
- 4 Centres américains pour le contrôle et la prévention des maladies, « Calendrier de vaccination recommandé pour les personnes âgées de 0 à 18 ans, États-Unis, 2016 », 1er février 2016. Consulté le 28 juin 2016. www.cdc.gov/vaccines/schedule... dolescent.html.
- 5 Association nationale de la méningite, « Éclosions de méningococcie du sérogroupe B sur les campus universitaires américains », 2016. Consulté le 28 juin 2016. http://www.nmaus.org/disease-prevent...ase/outbreaks/.
- 6 Ministère de la Santé et des Services sociaux des États-Unis, « Hib (Haemophilus Influenzae Type B) », consulté le 28 juin 2016. http://www.vaccines.gov/diseases/hib/ #.
- 7 Centres américains pour le contrôle et la prévention des maladies, « Meningococcique Disease, Disease Trends », 2015. Consulté le 13 septembre 2016. www.cdc.gov/meningococcal/sur... nce/index.html.
- 8 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., « Méningite bactérienne aux États-Unis, 1998-2007 », New England Journal of Medicine 364, n° 21 (2011) : 2016-25.
- 9 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., « Méningite bactérienne aux États-Unis, 1998-2007 », New England Journal of Medicine 364, n° 21 (2011) : 2016-25 ; Heath, Paul T., Gail Balfour, Abbie M. Weisner, Androulla Efstratiou, Theresa L. Lamagni, Helen Tighe, Liam AF O'Connell et al., « La maladie streptococcique du groupe B chez les nourrissons britanniques et irlandais de moins de 90 jours », The Lancet 363, n° 9405 (2004) : 292-4.
- 10 UNFPA, UNICEF OMS, « Élimination du tétanos maternel et néonatal d'ici 2005 », 2000. www.unicef.org/immunization/f... tegy_paper.pdf.
- 11 Centres américains pour le contrôle et la prévention des maladies, « Vaccination contre le tétanos », 2013. Consulté le 29 juin 2016. http://www.cdc.gov/tetanus/vaccination.html.
- 12 Scallan, Elaine, Robert M. Hoekstra, Frederick J. Angulo, Robert V. Tauxe, Marc-Alain Widdowson, Sharon L. Roy, Jeffery L. Jones et Patricia M. Griffin, « Maladies d'origine alimentaire acquises aux États-Unis : principaux agents pathogènes », Emerging Infectious Diseases 17, no 1 (2011) : 7-15.
- 13 Centres américains pour le contrôle et la prévention des maladies, « Listeria Outbreaks », 2016. Consulté le 29 juin 2016. https://www.cdc.gov/listeria/outbreaks/index.html.
- 14 Sharma, Rahul, Pushpendra Singh, W. J. Loughry, J. Mitchell Lockhart, W. Barry Inman, Malcolm S. Duthie, Maria T. Pena et al., « La lèpre zoonotique dans le sud-est des États-Unis », Emerging Infectious Diseases 21, n° 12 (2015) : 2127-34.
- 15 Organisation mondiale de la santé, « Fiche d'information sur la lèpre », 2016. Consulté le 13 septembre 2016. http://www.who.int/mediacentre/factsheets/fs101/en/.
- 16 National Park Service, « A Brief History of Kalaupapa », consulté le 2 février 2016. www.nps.gov/kala/learn/histor... -kalaupapa.htm.


