15.2 : Comment les agents pathogènes provoquent les maladies
- Page ID
- 187687
Objectifs d'apprentissage
- Résumez les postulats de Koch et les postulats moléculaires de Koch, respectivement, et expliquez leur signification et leurs limites
- Expliquer le concept de pathogénicité (virulence) en termes de dose infectieuse et létale
- Distinguer les agents pathogènes primaires des agents pathogènes opportunistes et identifier des exemples spécifiques de chacun
- Résumez les étapes de la pathogenèse
- Expliquer le rôle des portails d'entrée et de sortie dans la transmission des maladies et identifier des exemples spécifiques de ces portails
Pour la plupart des maladies infectieuses, la capacité d'identifier avec précision l'agent pathogène responsable est une étape essentielle pour trouver ou prescrire des traitements efficaces. Les médecins, les patients et les chercheurs d'aujourd'hui ont une grande dette envers le médecin Robert Koch (1843—1910), qui a conçu une approche systématique pour confirmer les relations causales entre les maladies et des agents pathogènes spécifiques.
Les postulats de Koch
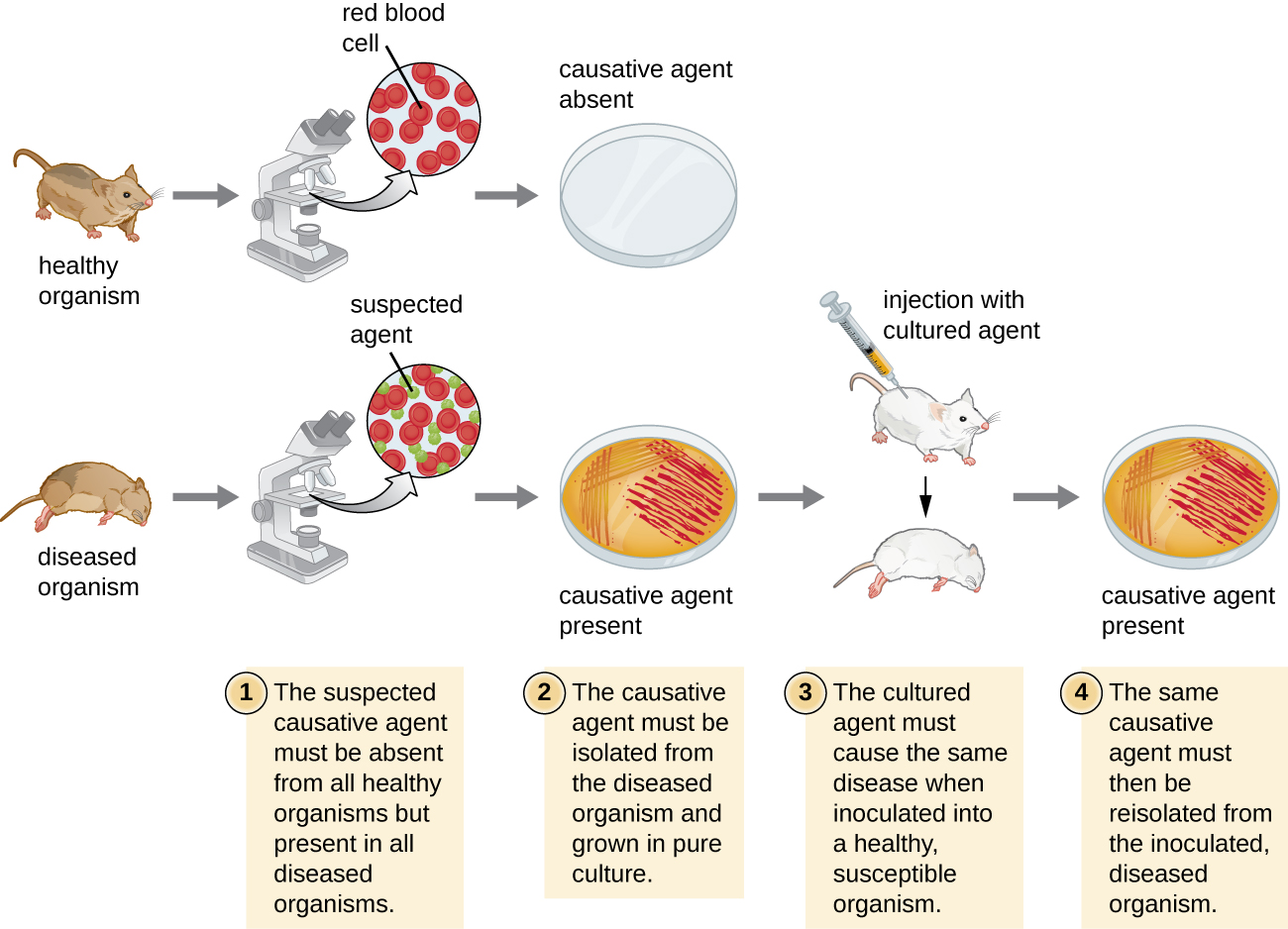
En 1884, Koch a publié quatre postulats résumant sa méthode pour déterminer si un microorganisme particulier était à l'origine d'une maladie particulière. Chacun des postulats de Koch représente un critère qui doit être rempli avant qu'une maladie puisse être liée positivement à un agent pathogène. Afin de déterminer si les critères sont remplis, des tests sont effectués sur des animaux de laboratoire et des cultures d'animaux sains et malades sont comparées (Figure\(\PageIndex{1}\)).
Les postulats de Koch
- L'agent pathogène soupçonné doit être détecté dans tous les cas de maladie et ne pas être détecté chez des personnes en bonne santé.
- L'agent pathogène suspect peut être isolé et cultivé en culture pure.
- Un sujet sain infecté par le pathogène suspecté doit présenter les mêmes signes et symptômes de maladie que ceux observés dans le postulat.
- L'agent pathogène doit être isolé à nouveau du nouvel hôte et doit être identique à l'agent pathogène issu du postulat 2.
À bien des égards, les postulats de Koch sont toujours au cœur de notre compréhension actuelle des causes des maladies. Cependant, les progrès de la microbiologie ont révélé certaines limites importantes des critères de Koch. Koch a émis plusieurs hypothèses dont nous savons maintenant qu'elles sont fausses dans de nombreux cas. Le premier concerne le postulat 1, qui suppose que les agents pathogènes ne se trouvent que chez les personnes malades et non chez les personnes en bonne santé. Ce n'est pas le cas pour de nombreux agents pathogènes. Par exemple, H. pylori, décrit plus haut dans ce chapitre comme un agent pathogène responsable de la gastrite chronique, fait également partie du microbiote normal de l'estomac chez de nombreux humains en bonne santé qui ne développent jamais de gastrite. On estime que plus de 50 % de la population humaine est infectée par H. pylori à un stade précoce et que la plupart d'entre eux le conservent dans le microbiote normal pendant le reste de leur vie sans jamais développer de maladie.
La deuxième hypothèse erronée de Koch était que tous les sujets sains étaient également sensibles à la maladie. Nous savons maintenant que les individus ne sont pas également vulnérables aux maladies. Les individus sont uniques en termes de microbiote et d'état de leur système immunitaire à tout moment. La composition du microbiote résident peut influencer la sensibilité d'une personne à une infection. Les membres du microbiote normal jouent un rôle important dans l'immunité en inhibant la croissance d'agents pathogènes transitoires. Dans certains cas, le microbiote peut empêcher un agent pathogène d'établir une infection ; dans d'autres, il peut ne pas prévenir complètement l'infection mais peut influencer la gravité ou le type de signes et de symptômes. Par conséquent, deux personnes atteintes de la même maladie peuvent ne pas toujours présenter les mêmes signes et symptômes. De plus, certaines personnes ont un système immunitaire plus fort que d'autres. Les personnes dont le système immunitaire est affaibli par l'âge ou une maladie non apparentée sont beaucoup plus vulnérables à certaines infections que les personnes dont le système immunitaire est fort.
Koch a également supposé que tous les agents pathogènes sont des microorganismes pouvant être cultivés en culture pure (postulat 2) et que les animaux pouvaient servir de modèles fiables pour les maladies humaines. Cependant, nous savons aujourd'hui que tous les agents pathogènes ne peuvent pas être cultivés en culture pure et que de nombreuses maladies humaines ne peuvent pas être reproduites de manière fiable chez les animaux hôtes. Les virus et certaines bactéries, dont la rickettsie et la chlamydia, sont des agents pathogènes intracellulaires obligatoires qui ne peuvent se développer que lorsqu'ils se trouvent à l'intérieur d'une cellule hôte. Si un microbe ne peut pas être cultivé, un chercheur ne peut pas dépasser le postulat 2. De même, sans un hôte non humain approprié, un chercheur ne peut pas évaluer le postulat 2 sans infecter délibérément des humains, ce qui soulève des préoccupations éthiques évidentes. Le sida est un exemple d'une telle maladie, car le virus de l'immunodéficience humaine (VIH) ne cause la maladie que chez l'homme.
Exercice\(\PageIndex{1}\)
Résumez brièvement les limites des postulats de Koch.
Les postulats de Molecular Koch
En 1988, Stanley Falkow (1934—) a proposé une forme révisée des postulats de Koch, connue sous le nom de postulats moléculaires de Koch. Ils sont répertoriés dans la colonne de gauche du tableau\(\PageIndex{1}\). Le postulat moléculaire de Koch repose non pas sur la capacité d'isoler un pathogène en particulier, mais plutôt d'identifier un gène susceptible de rendre l'organisme pathogène.
Les modifications apportées par Falkow aux postulats originaux de Koch expliquent non seulement les infections causées par des agents pathogènes intracellulaires, mais également l'existence de souches pathogènes d'organismes généralement non pathogènes. Par exemple, la forme prédominante de la bactérie Escherichia coli fait partie du microbiote normal de l'intestin humain et est généralement considérée comme inoffensive. Cependant, il existe des souches pathogènes d'E. coli telles que E. coli entérotoxinogène (ETEC) et E. coli entérohémorragique (O157:H7) (EHEC). Nous savons maintenant que l'ETEC et l'EHEC existent grâce à l'acquisition de nouveaux gènes par E. coli, autrefois inoffensif, qui, sous la forme de ces souches pathogènes, est maintenant capable de produire des toxines et de provoquer des maladies. Les formes pathogènes sont le résultat de modifications génétiques mineures. La colonne de droite du tableau\(\PageIndex{1}\) montre comment les postulats moléculaires de Koch peuvent être appliqués pour identifier l'EHEC en tant que bactérie pathogène.
| Les postulats de Molecular Koch | Demande à l'EHEC |
|---|---|
| (1) Le phénotype (signe ou symptôme d'une maladie) ne doit être associé qu'aux souches pathogènes d'une espèce. | L'EHEC provoque une inflammation intestinale et des diarrhées, contrairement aux souches non pathogènes d'E. coli. |
| (2) L'inactivation du ou des gènes soupçonnés d'être associés à la pathogénicité devrait entraîner une perte mesurable de pathogénicité. | L'un des gènes de l'EHEC code pour la toxine Shiga, une toxine bactérienne (poison) qui inhibe la synthèse des protéines. L'inactivation de ce gène réduit la capacité de la bactérie à provoquer des maladies. |
| (3) La réversion du gène inactif devrait restaurer le phénotype de la maladie. | En réajoutant le gène qui code la toxine dans le génome (par exemple, à l'aide d'un phage ou d'un plasmide), la capacité de l'EHEC à provoquer des maladies est rétablie. |
Comme pour les postulats originaux de Koch, les postulats moléculaires de Koch ont des limites. Par exemple, la manipulation génétique de certains agents pathogènes n'est pas possible avec les méthodes actuelles de génétique moléculaire. Dans le même ordre d'idées, certaines maladies ne disposent pas de modèles animaux appropriés, ce qui limite l'utilité des postulats originaux et moléculaires.
Exercice\(\PageIndex{2}\)
Expliquez les différences entre les postulats originaux de Koch et les postulats moléculaires de Koch.
Pathogénicité et virulence
La capacité d'un agent microbien à provoquer une maladie est appelée pathogénicité, et le degré de pathogénicité d'un organisme est appelé virulence. La virulence est un continuum. À une extrémité du spectre se trouvent les organismes avirulents (non nocifs) et, à l'autre, les organismes très virulents. Les agents pathogènes hautement virulents entraînent presque toujours un état pathologique lorsqu'ils sont introduits dans l'organisme, et certains peuvent même provoquer une défaillance de plusieurs organes et systèmes corporels chez des personnes en bonne santé. Des agents pathogènes moins virulents peuvent provoquer une infection initiale, mais ils ne peuvent pas toujours provoquer une maladie grave. Les agents pathogènes peu virulents sont plus susceptibles de provoquer des signes et symptômes bénins de la maladie, tels qu'une fièvre légère, des maux de tête ou des douleurs musculaires. Certaines personnes peuvent même être asymptomatiques.
Bacillus anthracis, l'agent pathogène responsable de l'anthrax, est un exemple de microorganisme hautement virulent. B. anthracis peut provoquer différentes formes de maladie, selon la voie de transmission (par exemple, injection cutanée, inhalation, ingestion). La forme la plus grave d'anthrax est l'anthrax par inhalation. Une fois inhalées, les spores de B. anthracis germent. Une infection active se développe et les bactéries libèrent de puissantes toxines qui provoquent un œdème (accumulation de liquide dans les tissus), une hypoxie (une affection empêchant l'oxygène d'atteindre les tissus) et une nécrose (mort cellulaire et inflammation). Les signes et symptômes de l'anthrax par inhalation comprennent une forte fièvre, des difficultés respiratoires, des vomissements et des crachats de sang et de fortes douleurs thoraciques évoquant une crise cardiaque. Avec l'anthrax par inhalation, les toxines et les bactéries pénètrent dans la circulation sanguine, ce qui peut entraîner une défaillance multiviscérale et la mort du patient. Si un ou plusieurs gènes impliqués dans la pathogenèse sont inactivés, les bactéries deviennent moins virulentes ou non pathogènes.
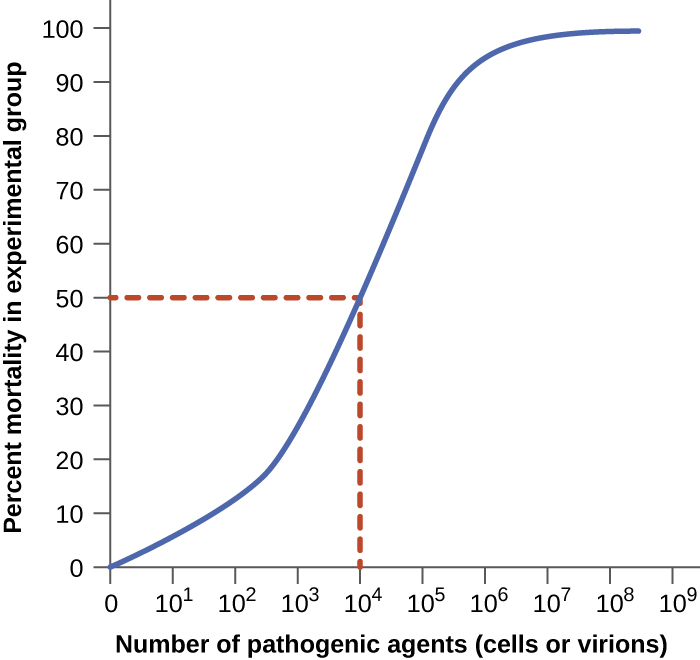
La virulence d'un agent pathogène peut être quantifiée à l'aide d'expériences contrôlées sur des animaux de laboratoire. Deux indicateurs importants de virulence sont la dose infectieuse médiane (ID 50) et la dose létale médiane (DL 50), qui sont généralement déterminées expérimentalement à l'aide de modèles animaux. L'ID 50 est le nombre de cellules pathogènes ou de virions nécessaires pour provoquer une infection active chez 50 % des animaux inoculés. La DL 50 est le nombre de cellules pathogènes, de virions ou de la quantité de toxine nécessaires pour tuer 50 % des animaux infectés. Pour calculer ces valeurs, chaque groupe d'animaux est inoculé avec l'un des nombres connus de cellules ou de virions pathogènes. Dans des graphiques tels que celui de la figure\(\PageIndex{2}\), le pourcentage d'animaux infectés (pour l'ID 50) ou tués (pour la LD 50) est tracé par rapport à la concentration d'agent pathogène inoculé. La figure\(\PageIndex{2}\) représente les données présentées graphiquement à partir d'une expérience hypothétique mesurant la DL 50 d'un agent pathogène. L'interprétation des données de ce graphique indique que la DL 50 du pathogène pour les animaux d'essai est de 10 à 4 cellules ou virions pathogènes (selon le pathogène étudié).
Le tableau\(\PageIndex{2}\) répertorie certains agents pathogènes d'origine alimentaire et leurs valeurs ID 50 chez l'homme (déterminées à partir de données épidémiologiques et d'études sur des volontaires humains). Gardez à l'esprit qu'il s'agit de valeurs médianes. La dose infectieuse réelle pour une personne peut varier considérablement, en fonction de facteurs tels que la voie d'entrée, l'âge, l'état de santé et le statut immunitaire de l'hôte, ainsi que de facteurs environnementaux et spécifiques à l'agent pathogène tels que la sensibilité au pH acide de l'estomac. Il est également important de noter que la dose infectieuse d'un agent pathogène n'est pas nécessairement liée à la gravité de la maladie. Par exemple, une seule cellule du sérotype Typhimurium de Salmonella enterica peut provoquer une infection active. La maladie qui en résulte, la gastro-entérite à Salmonella ou salmonellose, peut provoquer des nausées, des vomissements et de la diarrhée, mais son taux de mortalité est inférieur à 1 % chez les adultes en bonne santé. En revanche, le sérotype Typhi de S. enterica a un ID 50 beaucoup plus élevé, nécessitant généralement jusqu'à 1 000 cellules pour produire une infection. Cependant, ce sérotype provoque la fièvre typhoïde, une maladie beaucoup plus systémique et grave dont le taux de mortalité peut atteindre 10 % chez les personnes non traitées.
| Agent pathogène | ID 50 |
|---|---|
| Virus | |
| virus de l'hépatite A | 10 à 100 |
| Norovirus | 1 à 10 |
| Rotavirus | 10 à 100 |
| bactéries | |
| Escherichia coli, entérohémorragique (EHEC, sérotype O157) | 10 à 100 |
| E. coli, entéroinvasif (EIEC) | 200 à 5 000 |
| E. coli, entéropathogène (EPEC) | 10 000 000 — 10 000 000 000 |
| E. coli, entérotoxinogène (ETEC) | 10 000 000 — 10 000 000 000 |
| Salmonella enterica sérovar Typhi | <1 000> |
| Sérovar Typhimurium de S. enterica | ≥1 |
| Dysenteries de Shigella | 10 à 200 |
| Vibrio cholerae (sérotypes O139, O1) | 1 000 000 |
| V. parahemolyticus | 100 000 000 |
| Protozoaires | |
| Giardia Lamblia | 1 |
| Cryptosporidium parvum | 10 à 100 |
Exercice\(\PageIndex{3}\)
- Quelle est la différence entre la dose infectieuse et la dose létale d'un agent pathogène ?
- Qu'est-ce qui est le plus étroitement lié à la gravité d'une maladie ?
Agents pathogènes primaires et agents pathogènes opportunistes
Les agents pathogènes peuvent être classés comme des agents pathogènes primaires ou des agents pathogènes opportunistes. Un agent pathogène principal peut provoquer une maladie chez un hôte, quel que soit le microbiote ou le système immunitaire qui y résident. Un pathogène opportuniste, en revanche, ne peut provoquer une maladie que dans des situations qui compromettent les défenses de l'hôte, telles que les barrières protectrices de l'organisme, le système immunitaire ou le microbiote normal. Les personnes vulnérables aux infections opportunistes comprennent les très jeunes enfants, les personnes âgées, les femmes enceintes, les patientes sous chimiothérapie, les personnes immunodéficientes (comme le syndrome d'immunodéficience acquise [sida]), les patients qui se remettent d'une intervention chirurgicale et ceux qui ont subi une violation de des barrières de protection (telles qu'une blessure grave ou une brûlure).
L'E. coli entérohémorragique (EHEC), qui produit un facteur de virulence connu sous le nom de toxine Shiga, est un exemple d'agent pathogène principal. Cette toxine inhibe la synthèse des protéines, provoquant une diarrhée sévère et sanglante, une inflammation et une insuffisance rénale, même chez les patients dont le système immunitaire est sain. Staphylococcus epidermidis, quant à lui, est un agent pathogène opportuniste qui figure parmi les causes les plus fréquentes de maladies nosocomiales. 2 S. epidermidis fait partie du microbiote normal de la peau, où elle est généralement avirulente. Cependant, dans les hôpitaux, il peut également se développer dans les biofilms qui se forment sur les cathéters, les implants ou d'autres dispositifs insérés dans le corps lors d'interventions chirurgicales. Une fois à l'intérieur de l'organisme, S. epidermidis peut provoquer des infections graves telles que l'endocardite et produit des facteurs de virulence qui favorisent la persistance de telles infections.
D'autres membres du microbiote normal peuvent également provoquer des infections opportunistes dans certaines conditions. Cela se produit souvent lorsque des microbes qui résident de manière inoffensive dans un endroit du corps se retrouvent dans un système corporel différent, où ils provoquent des maladies. Par exemple, E. coli présent normalement dans le gros intestin peut provoquer une infection des voies urinaires s'il pénètre dans la vessie. Il s'agit de la principale cause d'infections des voies urinaires chez les femmes.
Les membres du microbiote normal peuvent également provoquer des maladies lorsqu'un changement dans l'environnement du corps entraîne la prolifération d'un microorganisme particulier. Par exemple, la levure Candida fait partie du microbiote normal de la peau, de la bouche, de l'intestin et du vagin, mais sa population est contrôlée par d'autres organismes du microbiote. Cependant, si une personne prend des médicaments antibactériens, les bactéries qui inhiberaient normalement la croissance du Candida peuvent être éliminées, ce qui entraîne une croissance soudaine de la population de Candida, qui n'est pas affectée par les médicaments antibactériens car il s'agit d'un champignon. Une prolifération de Candida peut se manifester par un muguet buccal (croissance de la bouche, de la gorge et de la langue), une mycose vaginale ou une candidose cutanée. D'autres scénarios peuvent également offrir des opportunités d'infections à Candida. Un diabète non traité peut entraîner une concentration élevée de glucose dans la salive, ce qui fournit un environnement optimal pour la croissance du Candida, entraînant la formation de muguet. Les immunodéficiences telles que celles observées chez les patients atteints du VIH, du sida et du cancer entraînent également une incidence plus élevée de muguet. Les mycoses vaginales peuvent résulter de la diminution des taux d'œstrogènes pendant les règles ou la ménopause. La quantité de glycogène disponible pour les lactobacilles dans le vagin est contrôlée par les niveaux d'œstrogènes ; lorsque les niveaux d'œstrogènes sont faibles, les lactobacilles produisent moins d'acide lactique. L'augmentation du pH vaginal qui en résulte permet une prolifération de Candida dans le vagin.
Exercice\(\PageIndex{4}\)
- Expliquez la différence entre un pathogène primaire et un pathogène opportuniste.
- Décrivez certaines conditions dans lesquelles une infection opportuniste peut survenir.
Étapes de la pathogenèse
Pour provoquer une maladie, un agent pathogène doit réussir à atteindre quatre étapes ou stades de pathogenèse : exposition (contact), adhésion (colonisation), invasion et infection. L'agent pathogène doit être capable de pénétrer dans l'hôte, de se déplacer jusqu'à un endroit où il peut établir une infection, d'échapper à la réponse immunitaire de l'hôte ou de la surmonter, et de causer des dommages (c'est-à-dire une maladie) à l'hôte. Dans de nombreux cas, le cycle est terminé lorsque l'agent pathogène quitte l'hôte et est transmis à un nouvel hôte.
Exposition
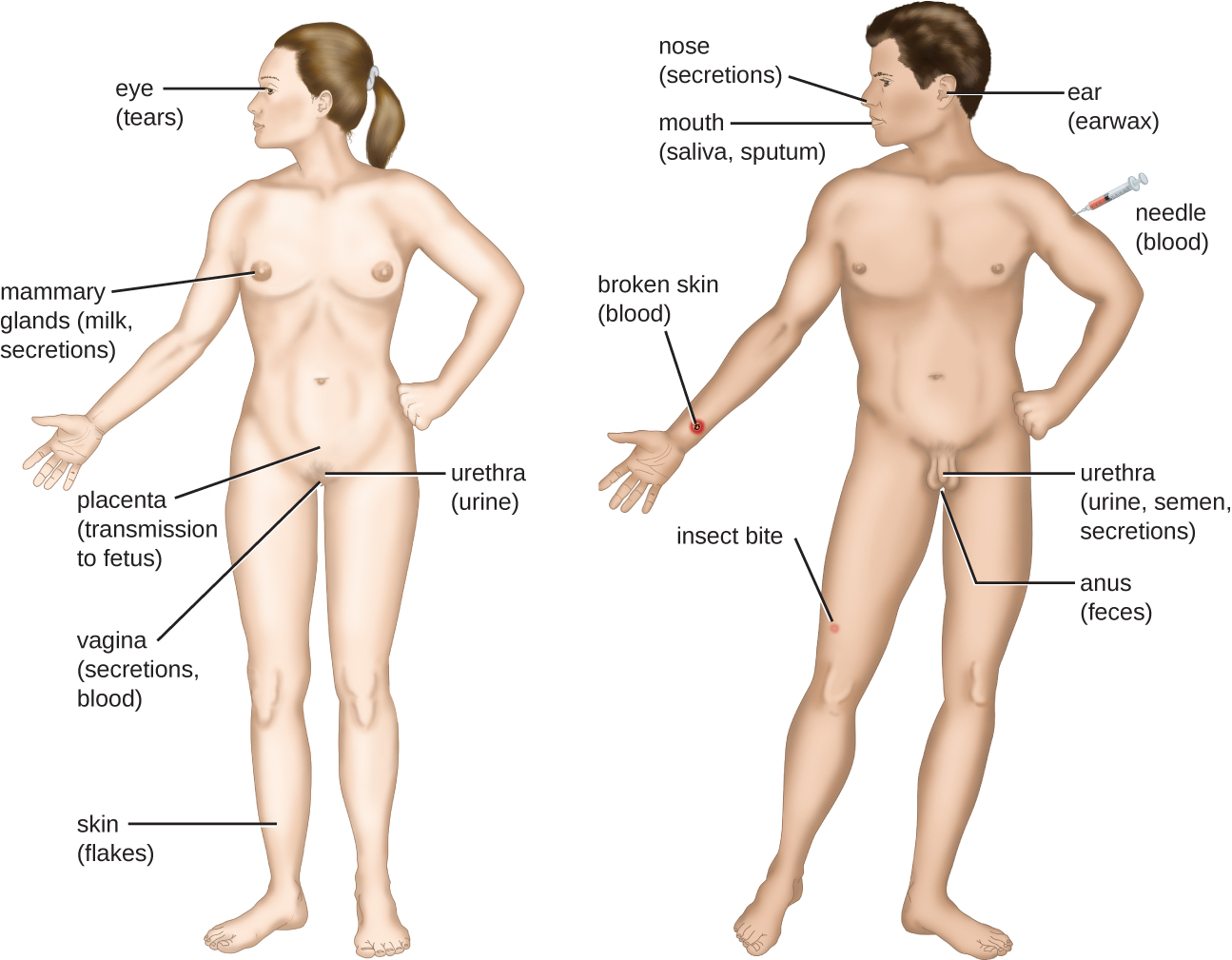
La rencontre avec un agent pathogène potentiel est connue sous le nom d'exposition ou de contact. Les aliments que nous consommons et les objets que nous manipulons sont autant de moyens qui nous permettent d'entrer en contact avec des agents pathogènes potentiels. Pourtant, tous les contacts ne se traduisent pas par une infection ou une maladie. Pour qu'un agent pathogène cause une maladie, il doit pouvoir accéder aux tissus de l'hôte. Un site anatomique par lequel les agents pathogènes peuvent pénétrer dans les tissus de l'hôte est appelé portail d'entrée. Il s'agit d'endroits où les cellules hôtes sont en contact direct avec l'environnement extérieur. Les principaux portails d'entrée sont identifiés dans la figure\(\PageIndex{3}\) et incluent la peau, les muqueuses et les voies parentérales.
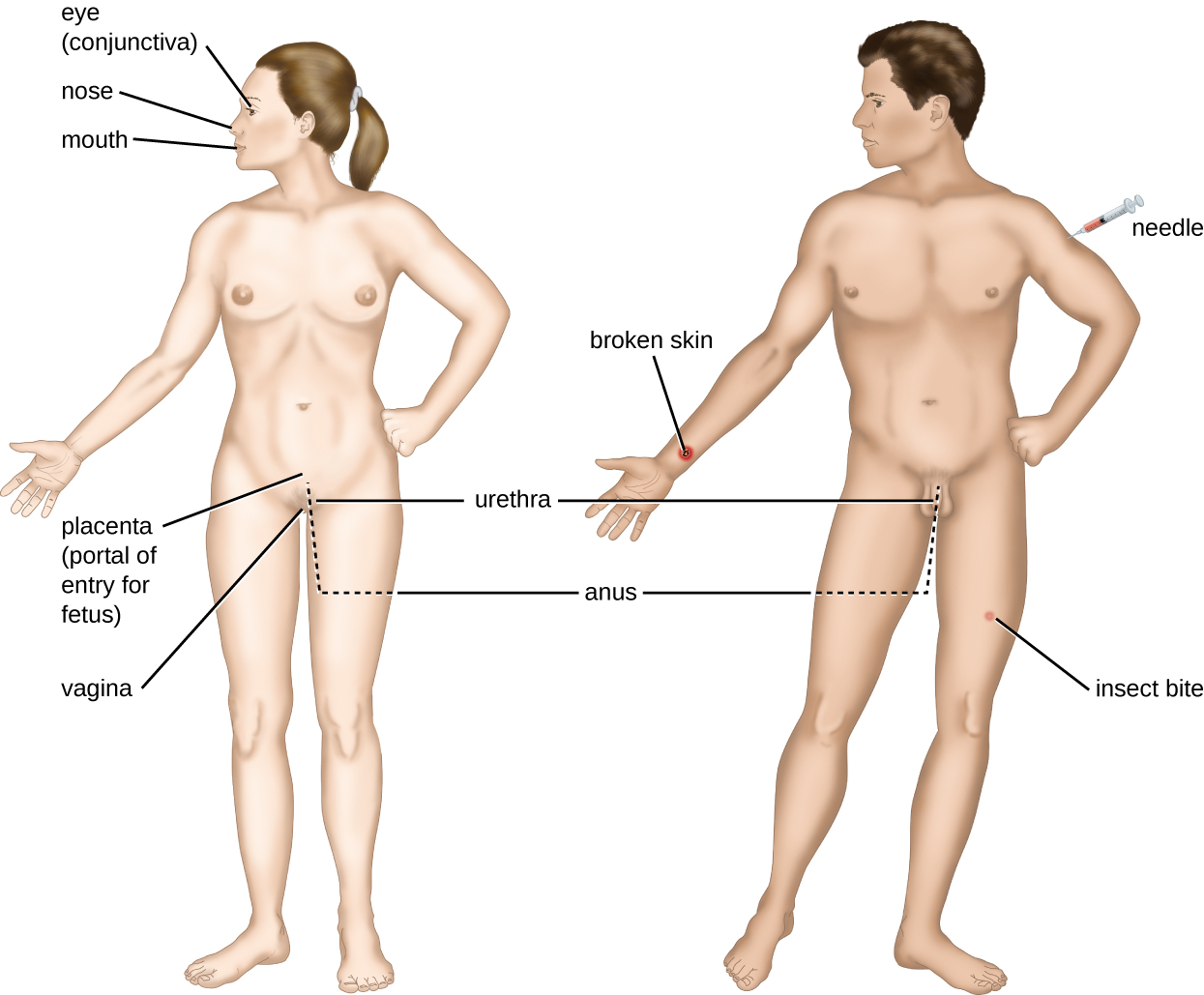
Les surfaces muqueuses sont les voies d'entrée les plus importantes pour les microbes ; il s'agit notamment des muqueuses des voies respiratoires, du tractus gastro-intestinal et des voies génito-urinaires. Bien que la plupart des surfaces des muqueuses se trouvent à l'intérieur du corps, certaines sont contiguës à la peau externe au niveau de diverses ouvertures corporelles, notamment les yeux, le nez, la bouche, l'urètre et l'anus.
La plupart des agents pathogènes sont adaptés à un portail d'entrée particulier. La spécificité portale d'un agent pathogène est déterminée par les adaptations environnementales de l'organisme ainsi que par les enzymes et les toxines qu'il sécrète. Les voies respiratoires et gastro-intestinales sont des voies d'entrée particulièrement vulnérables, car les particules contenant des microorganismes sont constamment inhalées ou ingérées, respectivement.
Les agents pathogènes peuvent également pénétrer par une brèche dans les barrières protectrices de la peau et des muqueuses. On dit que les agents pathogènes qui pénètrent dans l'organisme de cette manière entrent par voie parentérale. Par exemple, la peau constitue une bonne barrière naturelle contre les agents pathogènes, mais les lésions cutanées (blessures, piqûres d'insectes, morsures d'animaux, piqûres d'aiguilles) peuvent constituer une porte d'entrée parentérale pour les microorganismes.
Chez la femme enceinte, le placenta empêche normalement les microorganismes de passer de la mère au fœtus. Cependant, quelques agents pathogènes sont capables de traverser la barrière hémato-placentaire. La bactérie à Gram positif Listeria monocytogenes, responsable de la listériose, une maladie d'origine alimentaire, en est un exemple qui présente un risque grave pour le fœtus et peut parfois entraîner un avortement spontané. Les autres agents pathogènes qui peuvent passer la barrière placentaire pour infecter le fœtus sont connus collectivement sous l'acronyme TORCH (Tableau\(\PageIndex{3}\)).
La transmission de maladies infectieuses de la mère à l'enfant est également préoccupante au moment de la naissance lorsque le bébé passe par le canal génital. Les bébés dont la mère est atteinte d'une infection active à la chlamydia ou à la gonorrhée peuvent être exposés aux agents pathogènes responsables présents dans le vagin, ce qui peut provoquer des infections oculaires pouvant mener à la cécité. Pour éviter cela, il est de pratique courante d'administrer des gouttes antibiotiques sur les yeux des nourrissons peu après la naissance.
| Maladie | Agent pathogène | |
|---|---|---|
| T | Toxoplasmose | Toxoplasma gondii (protozoaire) |
| DE 3 |
La syphilis Varicelle Hépatite B VIH Cinquième maladie (érythème infectieux) |
Treponema pallidum (bactérie) Virus de la varicelle et du zona (herpèsvirus humain 3) Virus de l'hépatite B (hepadnavirus) Rétrovirus Parvovirus B19 |
| R | Rubéole (rougeole allemande) | Togavirus |
| C | Cytomégalovirus | Herpèsvirus humain 5 |
| H | Herpes | Virus de l'herpès simplex (HSV) 1 et 2 |
Orientation clinique : partie 2
À la clinique, un médecin prend note des antécédents médicaux de Michael et lui pose des questions sur ses activités et son alimentation au cours de la semaine écoulée. Lorsqu'il apprend que Michael est tombé malade le lendemain de la fête, le médecin prescrit un test sanguin pour vérifier la présence d'agents pathogènes associés à des maladies d'origine alimentaire. Après que des tests aient confirmé la présence d'un bâtonnet Gram positif dans le sang de Michael, il reçoit une injection d'un antibiotique à large spectre et est envoyé dans un hôpital voisin, où il est admis en tant que patient. Là, il doit recevoir une antibiothérapie intraveineuse supplémentaire et des liquides.
Exercice\(\PageIndex{5}\)
- Cette bactérie présente dans le sang de Michael fait-elle partie du microbiote normal ?
- Quel portail d'entrée la bactérie a-t-elle utilisé pour provoquer cette infection ?
Adhésion
Après l'exposition initiale, l'agent pathogène adhère à la porte d'entrée. Le terme adhésion fait référence à la capacité des microbes pathogènes à se fixer aux cellules du corps à l'aide de facteurs d'adhésion, et différents agents pathogènes utilisent divers mécanismes pour adhérer aux cellules des tissus hôtes.
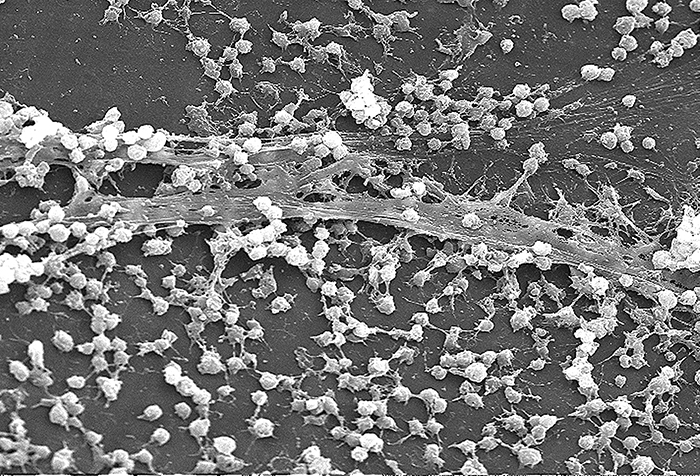
Des molécules (protéines ou glucides) appelées adhésines se trouvent à la surface de certains agents pathogènes et se lient à des récepteurs spécifiques (glycoprotéines) des cellules hôtes. Les adhésines sont présentes sur les fimbriae et les flagelles des bactéries, les cils des protozoaires et les capsides ou membranes des virus. Les protozoaires peuvent également utiliser des crochets et des barbes pour adhérer ; les protéines de pointe présentes sur les virus renforcent également l'adhésion virale. La production de glycocalyces (couches visqueuses et capsules) (Figure\(\PageIndex{4}\)), à forte teneur en sucre et en protéines, peut également permettre à certains agents pathogènes bactériens de se fixer aux cellules.
La croissance du biofilm peut également agir comme facteur d'adhérence. Un biofilm est une communauté de bactéries qui produisent un glycocalyx, connu sous le nom de substance extrapolymère (EPS), qui permet au biofilm de se fixer à une surface. Les infections persistantes à Pseudomonas aeruginosa sont fréquentes chez les patients atteints de mucoviscidose, de brûlures et d'infections de l'oreille moyenne (otite moyenne), car P. aeruginosa produit un biofilm. L'EPS permet à la bactérie d'adhérer aux cellules hôtes et rend plus difficile pour l'hôte d'éliminer physiquement le pathogène. L'EPS permet non seulement la fixation, mais fournit également une protection contre le système immunitaire et les traitements antibiotiques, empêchant ainsi les antibiotiques d'atteindre les cellules bactériennes du biofilm. De plus, les bactéries présentes dans un biofilm ne se développent pas toutes rapidement ; certaines sont en phase stationnaire. Comme les antibiotiques sont les plus efficaces contre les bactéries à croissance rapide, certaines parties des bactéries présentes dans un biofilm sont protégées contre les antibiotiques. 4
invasion
Une fois l'adhésion réussie, l'invasion peut avoir lieu. L'invasion implique la dissémination d'un agent pathogène dans les tissus locaux ou le corps. Les agents pathogènes peuvent produire des exoenzymes ou des toxines, qui servent de facteurs de virulence qui leur permettent de coloniser et d'endommager les tissus de l'hôte lorsqu'ils se propagent plus profondément dans le corps. Les agents pathogènes peuvent également produire des facteurs de virulence qui les protègent contre les défenses du système immunitaire. Les facteurs de virulence spécifiques d'un agent pathogène déterminent le degré de lésion tissulaire qui se produit. La figure\(\PageIndex{5}\) montre l'invasion de H. pylori dans les tissus de l'estomac, provoquant des dommages au fur et à mesure de sa progression.
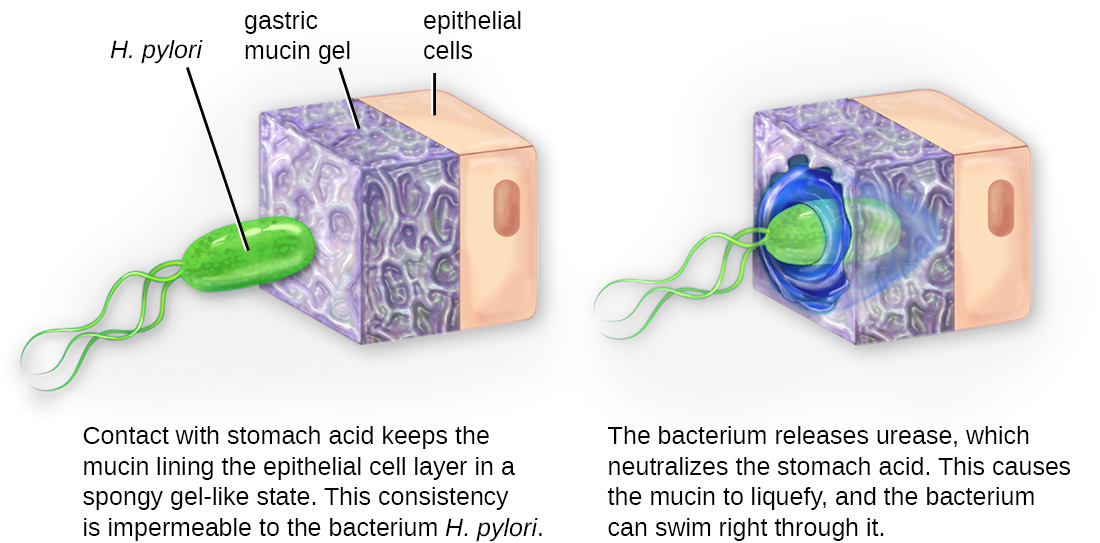
Les agents pathogènes intracellulaires parviennent à envahir les cellules de l'hôte et en se reproduisant. Certains sont des agents pathogènes intracellulaires obligatoires (c'est-à-dire qu'ils ne peuvent se reproduire qu'à l'intérieur des cellules hôtes) et d'autres sont des agents pathogènes intracellulaires facultatifs (c'est-à-dire qu'ils peuvent se reproduire à l'intérieur ou à l'extérieur des cellules hôtes). En pénétrant dans les cellules hôtes, les agents pathogènes intracellulaires peuvent échapper à certains mécanismes du système immunitaire tout en exploitant les nutriments contenus dans la cellule hôte.
L'entrée dans une cellule peut se faire par endocytose. Pour la plupart des types de cellules hôtes, les agents pathogènes utilisent l'un des deux mécanismes d'endocytose et de pénétration. L'un des mécanismes repose sur les protéines effectrices sécrétées par le pathogène ; ces protéines effectrices déclenchent l'entrée dans la cellule hôte. C'est la méthode que Salmonella et Shigella utilisent pour envahir les cellules épithéliales intestinales. Lorsque ces agents pathogènes entrent en contact avec les cellules épithéliales de l'intestin, ils sécrètent des molécules effectrices qui provoquent la formation de protubérances ou de volants membranaires qui font entrer la cellule bactérienne. Ce processus s'appelle l'ébouriffement de la membrane. Le second mécanisme repose sur les protéines de surface exprimées par le pathogène qui se lient aux récepteurs de la cellule hôte, ce qui entraîne leur entrée. Par exemple, Yersinia pseudotuberculosis produit une protéine de surface appelée invasine qui se lie aux intégrines bêta-1 exprimées à la surface des cellules hôtes.
Certaines cellules hôtes, comme les globules blancs et d'autres phagocytes du système immunitaire, endocytent activement les agents pathogènes dans le cadre d'un processus appelé phagocytose. Bien que la phagocytose permette au pathogène de pénétrer dans la cellule hôte, dans la plupart des cas, la cellule hôte tue et dégrade le pathogène en utilisant des enzymes digestives. Normalement, lorsqu'un pathogène est ingéré par un phagocyte, il est enfermé dans un phagosome du cytoplasme ; le phagosome fusionne avec un lysosome pour former un phagolysosome, où les enzymes digestives tuent le pathogène (voir Reconnaissance des agents pathogènes et phagocytose). Cependant, certains agents pathogènes intracellulaires ont la capacité de survivre et de se multiplier dans les phagocytes. Les exemples incluent Listeria monocytogenes et Shigella ; ces bactéries produisent des protéines qui lysent le phagosome avant qu'il ne fusionne avec le lysosome, permettant ainsi aux bactéries de s'échapper dans le cytoplasme du phagocyte où elles peuvent se multiplier. Les bactéries telles que Mycobacterium tuberculosis, Legionella pneumophila et Salmonella utilisent un mécanisme légèrement différent pour éviter d'être digérées par le phagocyte. Ces bactéries empêchent la fusion du phagosome avec le lysosome, restant ainsi vivantes et se divisant au sein du phagosome.
Infection
Après l'invasion, la multiplication réussie du pathogène entraîne une infection. Les infections peuvent être décrites comme locales, focales ou systémiques, selon l'étendue de l'infection. Une infection locale se limite à une petite partie du corps, généralement près de la porte d'entrée. Par exemple, un follicule pileux infecté par une infection à Staphylococcus aureus peut provoquer une ébullition autour du site d'infection, mais la bactérie est en grande partie confinée dans cette petite zone. D'autres exemples d'infections locales impliquant une atteinte tissulaire plus étendue incluent les infections des voies urinaires confinées à la vessie ou les pneumonies confinées aux poumons.
Lors d'une infection focale, un agent pathogène localisé ou les toxines qu'il produit peuvent se propager vers un site secondaire. Par exemple, un hygiéniste dentaire qui entaille la gencive avec un outil tranchant peut provoquer une infection locale de la gencive par la bactérie streptocoque du microbiote buccal normal. Ces Streptococcus spp. peuvent ensuite accéder à la circulation sanguine et se rendre à d'autres endroits du corps, ce qui entraîne une infection secondaire.
Lorsqu'une infection se répand dans tout le corps, on parle d'infection systémique. Par exemple, l'infection par le virus de la varicelle et du zona pénètre généralement par la muqueuse des voies respiratoires supérieures. Elle se propage ensuite dans tout le corps, provoquant les lésions cutanées rouges classiques associées à la varicelle. Comme ces lésions ne sont pas des sites d'infection initiale, elles sont le signe d'une infection systémique.
Parfois, une infection primaire, c'est-à-dire l'infection initiale causée par un agent pathogène, peut entraîner une infection secondaire par un autre agent pathogène. Par exemple, le système immunitaire d'un patient atteint d'une infection primaire par le VIH est affaibli, ce qui rend le patient plus vulnérable à des maladies secondaires telles que le muguet buccal et d'autres maladies causées par des agents pathogènes opportunistes. De même, une infection primaire par le virus de l'influenza endommage et diminue les mécanismes de défense des poumons, rendant les patients plus vulnérables à une pneumonie secondaire causée par un pathogène bactérien comme Haemophilus influenzae ou Streptococcus pneumoniae. Certaines infections secondaires peuvent même se développer à la suite du traitement d'une infection primaire. L'antibiothérapie ciblant le principal pathogène peut provoquer des dommages collatéraux au microbiote normal, ouvrant ainsi la voie à des agents pathogènes opportunistes (voir Exemple : Une mycose secondaire ci-dessous).
Une mycose secondaire
Anita, 36 ans et mère de trois enfants, se rend dans un centre de soins d'urgence pour se plaindre de tensions pelviennes, de mictions fréquentes et douloureuses, de crampes abdominales et parfois d'urines teintées de sang. Soupçonnant une infection des voies urinaires (IVU), le médecin demande un échantillon d'urine et l'envoie au laboratoire pour une analyse d'urine. Comme il faudra environ 24 heures pour obtenir les résultats de la culture, le médecin donne immédiatement à Anita l'antibiotique ciprofloxacine. Le lendemain, le laboratoire de microbiologie confirme la présence d'E. coli dans l'urine d'Anita, ce qui est conforme au diagnostic présomptif. Cependant, le test de sensibilité aux antimicrobiens indique que la ciprofloxacine ne traiterait pas efficacement les infections urinaires d'Anita. Le médecin prescrit donc un antibiotique différent.
Après avoir pris ses antibiotiques pendant une semaine, Anita retourne à la clinique en se plaignant que la prescription ne fonctionne pas. Bien que la douleur à uriner se soit calmée, elle a maintenant des démangeaisons vaginales, des brûlures et des écoulements. Après un bref examen, le médecin explique à Anita que les antibiotiques ont probablement réussi à tuer la bactérie E. coli responsable de son infection urinaire ; toutefois, ils ont également éliminé bon nombre des « bonnes » bactéries présentes dans le microbiote normal d'Anita. Les nouveaux symptômes signalés par Anita sont compatibles avec une infection secondaire à levures causée par Candida albicans, un champignon opportuniste qui se trouve normalement dans le vagin mais qui est inhibé par la bactérie qui se trouve normalement dans le même environnement.
Pour confirmer ce diagnostic, une lame microscopique d'un frottis vaginal direct est préparée à partir de la décharge afin de vérifier la présence de levures. Un échantillon de la décharge accompagne cette lame et est envoyé au laboratoire de microbiologie afin de déterminer s'il y a eu une augmentation de la population de levures responsables de la vaginite. Une fois que le laboratoire de microbiologie confirme le diagnostic, le médecin prescrit un antifongique à Anita afin d'éliminer sa mycose secondaire.
Exercice\(\PageIndex{6}\)
- Pourquoi Candida n'a-t-il pas été tué par les antibiotiques prescrits pour les infections urinaires ?
- Énumérez trois affections pouvant mener à une infection secondaire.
Transmission de maladies
Pour qu'un agent pathogène persiste, il doit se mettre en position d'être transmis à un nouvel hôte, quittant l'hôte infecté par une porte de sortie (Figure\(\PageIndex{6}\)). Comme pour les portails d'entrée, de nombreux agents pathogènes sont adaptés pour utiliser une porte de sortie particulière. À l'instar des portes d'entrée, les portes de sortie les plus courantes sont la peau et les voies respiratoires, urogénitales et gastro-intestinales. La toux et les éternuements peuvent expulser les agents pathogènes des voies respiratoires. Un seul éternuement peut envoyer des milliers de particules virales dans l'air. Les sécrétions et les excrétions peuvent transporter des agents pathogènes hors d'autres voies de sortie. Les matières fécales, l'urine, le sperme, les sécrétions vaginales, les larmes, la sueur et les cellules de la peau excrétées peuvent tous être utilisés par un agent pathogène pour quitter l'organisme. Les agents pathogènes dont la transmission dépend d'insectes vecteurs sortent de l'organisme par le sang extrait par un insecte piqueur. De même, certains agents pathogènes sortent de l'organisme par le sang extrait par des aiguilles.
Concepts clés et résumé
- Les postulats de Koch sont utilisés pour déterminer si un microorganisme particulier est un agent pathogène. Les postulats de Molecular Koch sont utilisés pour déterminer quels gènes contribuent à la capacité d'un agent pathogène à provoquer des maladies.
- La virulence, c'est-à-dire la mesure dans laquelle un agent pathogène peut provoquer une maladie, peut être quantifiée en calculant l'ID 50 ou la DL 50 d'un agent pathogène sur une population donnée.
- Les agents pathogènes primaires peuvent provoquer des changements pathologiques associés à la maladie chez une personne en bonne santé, tandis que les agents pathogènes opportunistes ne peuvent provoquer une maladie que lorsque l'individu est compromis par une rupture des barrières protectrices ou une immunosuppression.
- Les infections et les maladies peuvent être causées par des agents pathogènes présents dans l'environnement ou par des microbes présents dans le microbiote d'une personne.
- Les infections peuvent être classées comme locales, focales ou systémiques selon la mesure dans laquelle l'agent pathogène se propage dans l'organisme.
- Une infection secondaire peut parfois survenir lorsque les défenses de l'hôte ou le microbiote normal sont compromis par une infection primaire ou un traitement antibiotique.
- Les agents pathogènes pénètrent dans l'organisme par des portes d'entrée et en sortent par des portes de sortie. Les stades de la pathogenèse comprennent l'exposition, l'adhésion, l'invasion, l'infection et la transmission.
Notes
- 1 Administration des aliments et des médicaments. « Bad Bug Book, Microorganismes pathogènes d'origine alimentaire et toxines naturelles ». 2e éd. Silver Spring, MD : Administration américaine des produits alimentaires et pharmaceutiques ; 2012.
- 22 M. Otto. « Staphylococcus epidermidis, l'agent pathogène « accidentel ». » Nature Reviews Microbiology 7 no 8 (2009) :555—567.
- 3 Le O dans TORCH signifie « autre ».
- 4 D. Davies. « Comprendre la résistance des biofilms aux agents antibactériens. » Nature Reviews Drug Discovery 2 (2003) :114—122.


