15.3 : Facteurs de virulence
- Page ID
- 187688
Objectifs d'apprentissage
- Expliquer comment les facteurs de virulence contribuent aux signes et aux symptômes des maladies infectieuses
- Différencier les endotoxines des exotoxines
- Décrire et différencier les différents types d'exotoxines
- Décrire les mécanismes utilisés par les virus pour l'adhésion et la variation antigénique
Dans la section précédente, nous avons expliqué que certains agents pathogènes sont plus virulents que d'autres. Cela est dû aux facteurs de virulence uniques produits par les agents pathogènes individuels, qui déterminent l'étendue et la gravité de la maladie qu'ils peuvent provoquer. Les facteurs de virulence d'un agent pathogène sont codés par des gènes qui peuvent être identifiés à l'aide des postulats moléculaires de Koch. Lorsque les gènes codant pour les facteurs de virulence sont inactivés, la virulence du pathogène diminue. Dans cette section, nous examinons différents types et exemples spécifiques de facteurs de virulence et la façon dont ils contribuent à chaque étape de la pathogenèse.
Facteurs de virulence pour l'adhérence
Comme indiqué dans la section précédente, les deux premières étapes de la pathogenèse sont l'exposition et l'adhésion. Rappelons qu'une adhésine est une protéine ou une glycoprotéine présente à la surface d'un agent pathogène qui se fixe aux récepteurs de la cellule hôte. Les adhésines se trouvent sur des agents pathogènes bactériens, viraux, fongiques et protozoaires. Un exemple d'adhésine bactérienne est l'adhésine fimbriale de type 1, une molécule présente à l'extrémité des fimbriae d'E. coli entérotoxigène (ETEC). Rappelons que les fimbriae sont des poils protéinés ressemblant à des poils situés à la surface des cellules. L'adhésine fimbriale de type 1 permet aux fimbriae des cellules ETEC de se fixer aux glycanes de mannose exprimés dans les cellules épithéliales intestinales. Le tableau\(\PageIndex{1}\) répertorie les adhésines courantes présentes dans certains des agents pathogènes dont nous avons parlé ou que nous verrons plus loin dans ce chapitre.
| Agent pathogène | Maladie | Adhésine | Site de pièces jointes | |
|---|---|---|---|---|
| Streptococcus pyogenes | Strep de gorge | Protéine F | Cellules épithéliales respiratoires | |
| Streptococcus mutans | Carie dentaire | Adhésine P1 | Dents | |
| Neisseria gonorrhoeae | Gonorrhée | Pilules de type IV | Cellules épithéliales urétrales | |
| E. coli entérotoxinogène (ETEC) | Diarrhée du voyageur | Fimbriae de type 1 | Cellules épithéliales intestinales | |
| Vibrion cholerae | Choléra | Pilules de N-méthylphénylalanine | Cellules épithéliales intestinales |
Orientation clinique : 3e partie
La présence de bactéries dans le sang de Michael est un signe d'infection, car le sang est normalement stérile. Rien n'indique que la bactérie soit entrée dans le sang à la suite d'une blessure. Il semble plutôt que la voie d'entrée ait été la voie gastro-intestinale. Sur la base des symptômes de Michael, des résultats de son analyse sanguine et du fait que Michael était le seul de la famille à prendre des hot dogs, le médecin soupçonne Michael de souffrir d'un cas de listériose.
La Listeria monocytogenes, l'agent pathogène intracellulaire facultatif responsable de la listériose, est un contaminant courant dans les aliments prêts-à-manger tels que les viandes à déjeuner et les produits laitiers. Une fois ingérées, ces bactéries envahissent les cellules épithéliales intestinales et se déplacent vers le foie, où elles se développent à l'intérieur des cellules hépatiques. La listériose est fatale chez environ une personne en bonne santé sur cinq, et les taux de mortalité sont légèrement plus élevés chez les patients présentant des affections préexistantes qui affaiblissent la réponse immunitaire. Un groupe de gènes de virulence codés sur un îlot de pathogénicité est responsable de la pathogénicité de L. monocytogenes. Ces gènes sont régulés par un facteur transcriptionnel connu sous le nom de facteur de libération de la chaîne peptidique 1 (PrFA). L'un des gènes régulés par la PrFA est le hyl, qui code pour une toxine appelée listériolysine O (LLO), qui permet à la bactérie d'échapper aux vacuoles lorsqu'elle entre dans une cellule hôte. Un deuxième gène régulé par la PrFA est l'AcTA, qui code pour une protéine de surface connue sous le nom de protéine induisant l'assemblage de l'actine (AcTA). L'actA est exprimé à la surface de la Listeria et polymérise l'actine de l'hôte. Cela permet à la bactérie de produire des queues d'actine, de se déplacer dans le cytoplasme de la cellule et de se propager d'une cellule à l'autre sans sortir dans le compartiment extracellulaire.
L'état de Michael a commencé à s'aggraver. Il souffre maintenant d'une raideur de la nuque et d'une hémiparésie (faiblesse d'un côté du corps). Craignant que l'infection ne se propage, le médecin décide de procéder à des tests supplémentaires pour déterminer la cause de ces nouveaux symptômes.
Exercice\(\PageIndex{1}\)
- Quel type d'agent pathogène cause la listériose et quels sont les facteurs de virulence qui contribuent aux signes et symptômes de Michael ?
- Est-il probable que l'infection se propage par le sang de Michael ? Dans l'affirmative, comment cela pourrait-il expliquer ses nouveaux symptômes ?
Exoenzymes bactériennes et toxines comme facteurs de virulence
Après l'exposition et l'adhésion, l'étape suivante de la pathogenèse est l'invasion, qui peut impliquer des enzymes et des toxines. De nombreux agents pathogènes parviennent à envahir la circulation sanguine, un moyen de dissémination efficace, car les vaisseaux sanguins passent à proximité de toutes les cellules du corps. L'inconvénient de ce mécanisme de dispersion est que le sang comprend également de nombreux éléments du système immunitaire. Différents termes se terminant par —emia sont utilisés pour décrire la présence d'agents pathogènes dans le sang. La présence de bactéries dans le sang est appelée bactériémie. La bactériémie impliquant des pyogènes (bactéries formant du pus) est appelée pyémie. Lorsque des virus sont détectés dans le sang, on parle de virémie. Le terme toxémie décrit la maladie caractérisée par la présence de toxines dans le sang. Si des bactéries sont à la fois présentes et se multiplient dans le sang, cette affection est appelée septicémie.
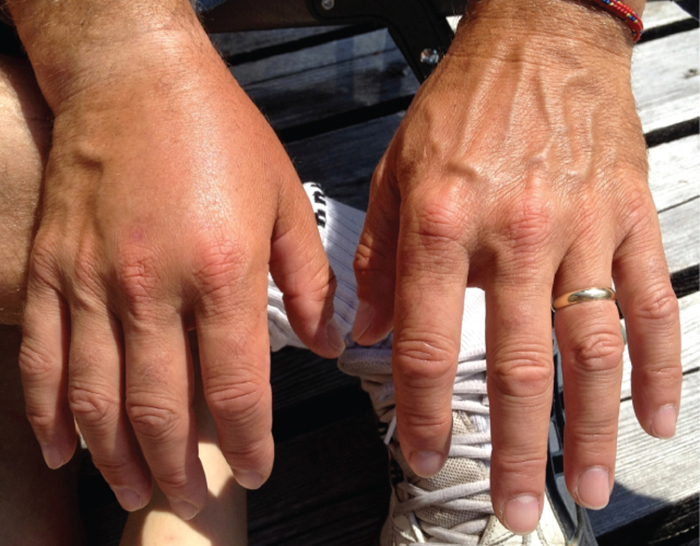
Les patients atteints de septicémie sont décrits comme étant septiques, ce qui peut entraîner un choc, une baisse de la pression artérielle potentiellement mortelle (pression systolique < 90 mm Hg) qui empêche les cellules et les organes de recevoir suffisamment d'oxygène et de nutriments. Certaines bactéries peuvent provoquer un choc en libérant des toxines (facteurs de virulence pouvant endommager les tissus) et provoquer une baisse de la pression artérielle. Les bactéries à Gram négatif sont englouties par les phagocytes du système immunitaire, qui libèrent ensuite le facteur de nécrose tumorale, une molécule impliquée dans l'inflammation et la fièvre. Le facteur de nécrose tumorale se lie aux capillaires sanguins pour augmenter leur perméabilité, permettant aux fluides de sortir des vaisseaux sanguins et de pénétrer dans les tissus, provoquant un gonflement ou un œdème (Figure\(\PageIndex{1}\)). Avec des concentrations élevées de facteur de nécrose tumorale, la réaction inflammatoire est sévère et suffisamment de liquide est perdu dans le système circulatoire pour que la pression artérielle baisse à des niveaux dangereusement bas. Cela peut avoir des conséquences désastreuses, car le cœur, les poumons et les reins dépendent d'une tension artérielle normale pour fonctionner correctement ; ainsi, une défaillance multiviscérale, un choc et la mort peuvent survenir.
Exoenzymes
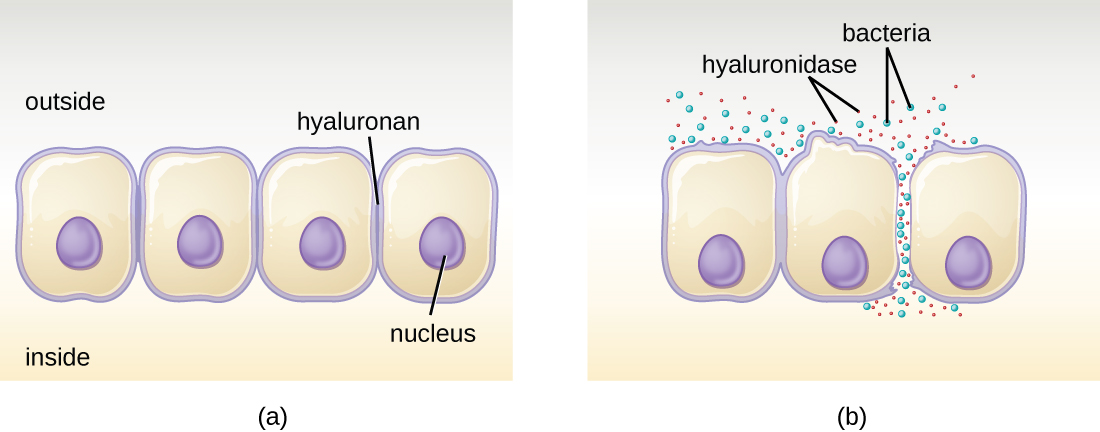
Certains agents pathogènes produisent des enzymes extracellulaires, ou exoenzymes, qui leur permettent d'envahir les cellules hôtes et les tissus plus profonds. Les exoenzymes ont une grande variété de cibles. Certaines classes générales d'exoenzymes et d'agents pathogènes associés sont répertoriées dans le tableau\(\PageIndex{2}\). Chacune de ces exoenzymes fonctionne dans le contexte d'une structure tissulaire particulière pour faciliter l'invasion ou soutenir sa propre croissance et se défendre contre le système immunitaire. Par exemple, la hyaluronidase S, une enzyme produite par des agents pathogènes tels que Staphylococcus aureus, Streptococcus pyogenes et Clostridium perfringens, dégrade le glycoside hylauronane (acide hyaluronique), qui agit comme un ciment intercellulaire entre les cellules adjacentes dans le tissu conjonctif tissu (Figure\(\PageIndex{2}\)). Cela permet au pathogène de traverser les couches tissulaires à la porte d'entrée et de se propager ailleurs dans le corps (Figure\(\PageIndex{2}\)).
| Classe | Exemple | Fonction |
|---|---|---|
| Glycohydrolases | Hyaluronidase S chez Staphylococcus aureus | Dégrade l'acide hyaluronique qui cimente les cellules pour favoriser leur propagation dans les tissus |
| Nucléases | DNase produite par S. aureus | Dégrade l'ADN libéré par les cellules mourantes (bactéries et cellules hôtes) qui peuvent piéger les bactéries, favorisant ainsi leur propagation |
| Phospholipases | Phospholipase C de Bacillus anthracis | Dégrade la bicouche phospholipidique des cellules hôtes, provoquant une lyse cellulaire, et dégrade la membrane des phagosomes pour permettre leur fuite dans le cytoplasme |
| Protéases | Collagénase chez Clostridium perfringens | Dégrade le collagène du tissu conjonctif pour favoriser sa propagation |
Les nucléases produites par des agents pathogènes, telles que la DNase produite par S. aureus, dégradent l'ADN extracellulaire pour s'échapper et se propager dans les tissus. Lorsque les cellules bactériennes et hôtes meurent sur le site de l'infection, elles se lysent et libèrent leur contenu intracellulaire. Le chromosome d'ADN est la plus grande des molécules intracellulaires, et des masses d'ADN extracellulaire peuvent piéger les bactéries et empêcher leur propagation. S. aureus produit une DNase qui dégrade le maillage de l'ADN extracellulaire afin qu'il puisse s'échapper et se propager aux tissus adjacents. Cette stratégie est également utilisée par S. aureus et d'autres agents pathogènes pour dégrader et échapper aux réseaux d'ADN extracellulaire produits par les phagocytes du système immunitaire afin de piéger la bactérie.
Les enzymes qui dégradent les phospholipides des membranes cellulaires sont appelées phospholipases. Leurs actions sont spécifiques en ce qui concerne le type de phospholipides sur lesquels ils agissent et l'endroit où ils clivent les molécules de manière enzymatique. Le pathogène responsable de l'anthrax, B. anthracis, produit de la phospholipase C. Lorsque B. anthracis est ingérée par les cellules phagocytaires du système immunitaire, la phospholipase C dégrade la membrane du phagosome avant qu'elle ne puisse fusionner avec le lysosome, permettant ainsi au pathogène de s'échapper dans le cytoplasme et multipliez. Les phospholipases peuvent également cibler la membrane qui entoure le phagosome au sein des cellules phagocytaires. Comme décrit précédemment dans ce chapitre, il s'agit du mécanisme utilisé par les agents pathogènes intracellulaires tels que L. monocytogenes et Rickettsia pour échapper au phagosome et se multiplier dans le cytoplasme des cellules phagocytaires. Le rôle des phospholipases dans la virulence bactérienne ne se limite pas à l'échappement des phagosomes. De nombreux agents pathogènes produisent des phospholipases qui dégradent les membranes cellulaires et provoquent la lyse des cellules cibles. Ces phospholipases sont impliquées dans la lyse des globules rouges, des globules blancs et des cellules tissulaires.
Les bactéries pathogènes produisent également diverses enzymes de digestion des protéines, ou protéases. Les protéases peuvent être classées selon leur substrat cible (par exemple, les protéases à sérine ciblent les protéines avec l'acide aminé sérine) ou si elles contiennent des métaux dans leur site actif (par exemple, les métalloprotéases de zinc contiennent un ion zinc, nécessaire à l'activité enzymatique).
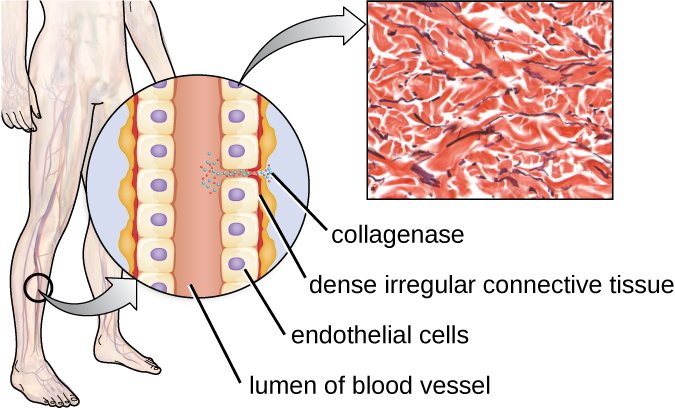
L'exoenzyme collagénase est un exemple de protéase contenant un ion métallique. La collagénase digère le collagène, la protéine dominante du tissu conjonctif. Le collagène se trouve dans la matrice extracellulaire, en particulier près des muqueuses, des vaisseaux sanguins, des nerfs et dans les couches de la peau. Semblable à la hyaluronidase, la collagénase permet à l'agent pathogène de pénétrer et de se propager dans le tissu hôte en digérant cette protéine du tissu conjonctif. La collagénase produite par la bactérie à Gram positif Clostridium perfringens, par exemple, permet à la bactérie de se frayer un chemin à travers les couches tissulaires, puis de pénétrer et de se multiplier dans le sang (septicémie). C. perfringens utilise ensuite des toxines et une phospholipase pour provoquer la lyse et la nécrose cellulaires. Une fois les cellules hôtes mortes, la bactérie produit des gaz en fermentant les glucides musculaires. La nécrose généralisée des tissus et des gaz qui l'accompagnent est caractéristique de la maladie connue sous le nom de gangrène gazeuse (Figure\(\PageIndex{3}\)).
Des toxines
Outre les exoenzymes, certains agents pathogènes sont capables de produire des toxines, des poisons biologiques qui les aident à envahir et à endommager les tissus. La capacité d'un agent pathogène à produire des toxines pour endommager les cellules hôtes est appelée toxigénicité.
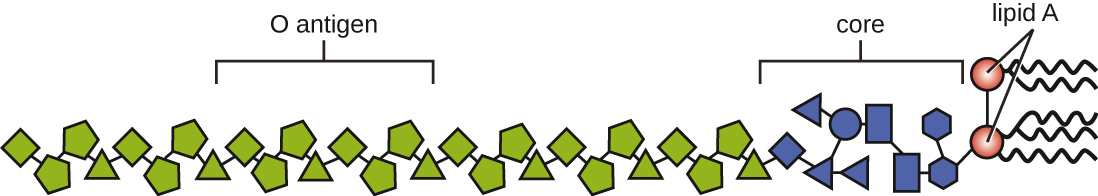
Les toxines peuvent être classées en endotoxines ou en exotoxines. Le lipopolysaccharide (LPS) présent sur la membrane externe des bactéries gram-négatives est appelé endotoxine (Figure\(\PageIndex{4}\)). Au cours d'une infection ou d'une maladie, les bactéries pathogènes gram-négatives libèrent de l'endotoxine soit lorsque la cellule meurt, entraînant la désintégration de la membrane, soit lorsque la bactérie subit une fission binaire. Le composant lipidique de l'endotoxine, le lipide A, est responsable des propriétés toxiques de la molécule LPS. Le lipide A est relativement conservé dans différents genres de bactéries gram-négatives ; par conséquent, les propriétés toxiques du lipide A sont similaires quel que soit le pathogène à Gram négatif. De la même manière que le facteur de nécrose tumorale, le lipide A déclenche la réponse inflammatoire du système immunitaire (voir Inflammation et fièvre). Si la concentration d'endotoxine dans le corps est faible, la réponse inflammatoire peut fournir à l'hôte une défense efficace contre l'infection ; en revanche, des concentrations élevées d'endotoxines dans le sang peuvent provoquer une réponse inflammatoire excessive, entraînant une chute sévère de la pression artérielle, multi-organes échec et mort.
Une méthode classique de détection des endotoxines consiste à utiliser le test du lysat d'amibocytes de Limulus (LAL). Dans cette procédure, les cellules sanguines (amibocytes) du crabe fer à cheval (Limulus polyphemus) sont mélangées au sérum d'un patient. Les amibocytes réagiront à la présence de toute endotoxine. Cette réaction peut être observée soit par chromogénie (couleur), soit en recherchant la présence d'une coagulation (réaction de coagulation) dans le sérum. Une autre méthode qui a été utilisée est un test immunoenzymatique (ELISA) qui utilise des anticorps pour détecter la présence d'endotoxines.
Contrairement au lipide toxique A de l'endotoxine, les exotoxines sont des molécules de protéines produites par une grande variété de bactéries pathogènes vivantes. Bien que certains agents pathogènes à Gram négatif produisent des exotoxines, la majorité sont produits par des agents pathogènes à Gram positif. Les exotoxines diffèrent des endotoxines par plusieurs autres caractéristiques clés, résumées dans le tableau\(\PageIndex{3}\). Contrairement à l'endotoxine, qui stimule une réponse inflammatoire systémique générale lorsqu'elle est libérée, les exotoxines sont beaucoup plus spécifiques dans leur action et dans les cellules avec lesquelles elles interagissent. Chaque exotoxine cible des récepteurs spécifiques sur des cellules spécifiques et endommage ces cellules par des mécanismes moléculaires uniques. L'endotoxine reste stable à des températures élevées et doit être chauffée à 121 °C (250 °F) pendant 45 minutes pour être inactivée. En revanche, la plupart des exotoxines sont thermolabiles en raison de leur structure protéique, et nombre d'entre elles sont dénaturées (inactivées) à des températures supérieures à 41 °C (106 °F). Comme indiqué précédemment, l'endotoxine peut stimuler une réponse inflammatoire létale à de très fortes concentrations et a une DL 50 mesurée de 0,24 mg/kg. En revanche, de très faibles concentrations d'exotoxines peuvent être mortelles. Par exemple, la toxine botulique, responsable du botulisme, a une DL 50 de 0,000001 mg/kg (240 000 fois plus létale que l'endotoxine).
| Caractéristique | Endotoxine | Exotoxine |
|---|---|---|
| Source | Bactéries gram-négatives | Bactéries à Gram positif (principalement) et à Gram négatif |
| Composition | Lipide A, composant du lipopolysaccharide | protéine |
| Effet sur l'hôte | Symptômes systémiques généraux d'inflammation et de fièvre | Dommages spécifiques causés aux cellules en fonction du ciblage des cellules par les récepteurs et de mécanismes d'action spécifiques |
| Stabilité thermique | Résistant à la chaleur | La plupart sont thermolabiles, mais certains sont thermostables |
| LD 50 | Haut | Faible |
Les exotoxines peuvent être regroupées en trois catégories en fonction de leur cible : ciblage intracellulaire, perturbation des membranes et superantigènes. Le tableau\(\PageIndex{4}\) fournit des exemples de toxines bien caractérisées dans chacune de ces trois catégories.
| Catégorie | Exemple | Agent pathogène | Mécanisme et maladie |
|---|---|---|---|
| Toxines ciblant le système intracellulaire | Toxine cholérique | Vibrion cholerae | Activation de l'adénylate cyclase dans les cellules intestinales, provoquant une augmentation des taux d'adénosine monophosphate cyclique (AMPc) et la sécrétion de liquides et d'électrolytes hors des cellules, provoquant une diarrhée |
| Toxine tétanique | Clostridium teta in | Inhibe la libération de neurotransmetteurs inhibiteurs dans le système nerveux central, provoquant une paralysie spastique | |
| Toxine botulique | Clostridium botulinum | Inhibe la libération du neurotransmetteur acétylcholine par les neurones, entraînant une paralysie flasque | |
| Toxine diphtérique | Corynebacterium diphtheriae | Inhibition de la synthèse des protéines, provoquant la mort cellulaire | |
| Toxines perturbant la membrane | Streptolysine | Streptococcus pyogenes | Protéines qui s'assemblent dans les pores des membranes cellulaires, perturbant leur fonction et tuant la cellule |
| Pneumolysine | Streptococcus pneumoniae | ||
| Toxine alpha | Staphylocoque doré | ||
| Toxine alpha | Clostridium perfringens | Phospholipases qui dégradent les phospholipides de la membrane cellulaire, perturbent le fonctionnement de la membrane et tuent la cellule | |
| Phospholipase C | Pseudomonas aeruginosa | ||
| Toxine bêta | Staphylocoque doré | ||
| Superantigènes | Toxine du syndrome de choc | Staphylocoque doré | Stimule l'activation excessive des cellules du système immunitaire et la libération de cytokines (médiateurs chimiques) par les cellules du système immunitaire. Il en résulte une fièvre, une inflammation et un choc potentiellement mortels. |
| Exotoxine mitogène streptococcique | Streptococcus pyogenes | ||
| Toxines pyrogènes streptococciques | Streptococcus pyogenes |
Les toxines de ciblage intracellulaire comprennent deux composants : A pour l'activité et B pour la liaison. Ainsi, ces types de toxines sont connus sous le nom d'exotoxines A-B (Figure\(\PageIndex{5}\)). Le composant B est responsable de la spécificité cellulaire de la toxine et assure la fixation initiale de la toxine à des récepteurs de surface cellulaires spécifiques. Une fois que la toxine A-B se lie à la cellule hôte, elle y est introduite par endocytose et piégée dans une vacuole. Les sous-unités A et B se séparent lorsque la vacuole s'acidifie. La sous-unité A pénètre ensuite dans le cytoplasme cellulaire et interfère avec la fonction cellulaire interne spécifique qu'elle cible.
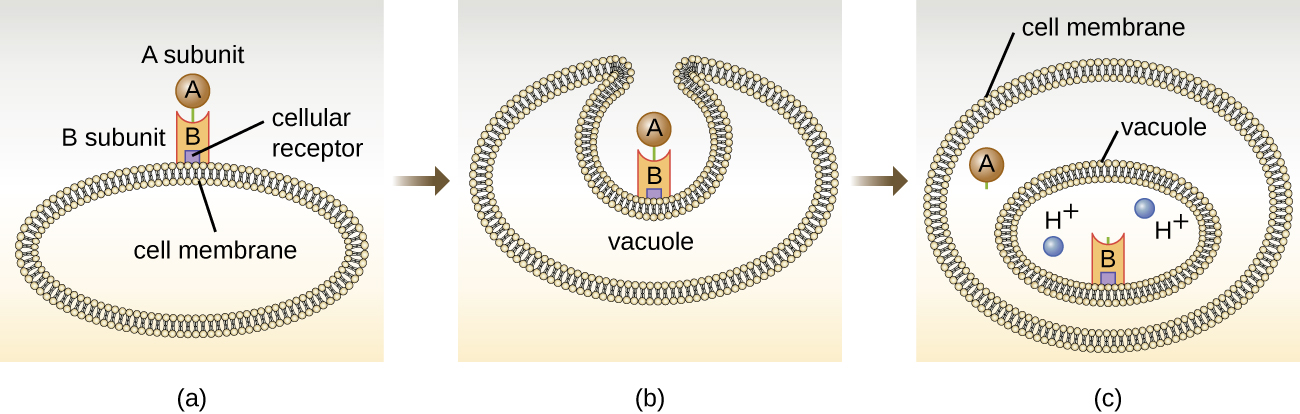
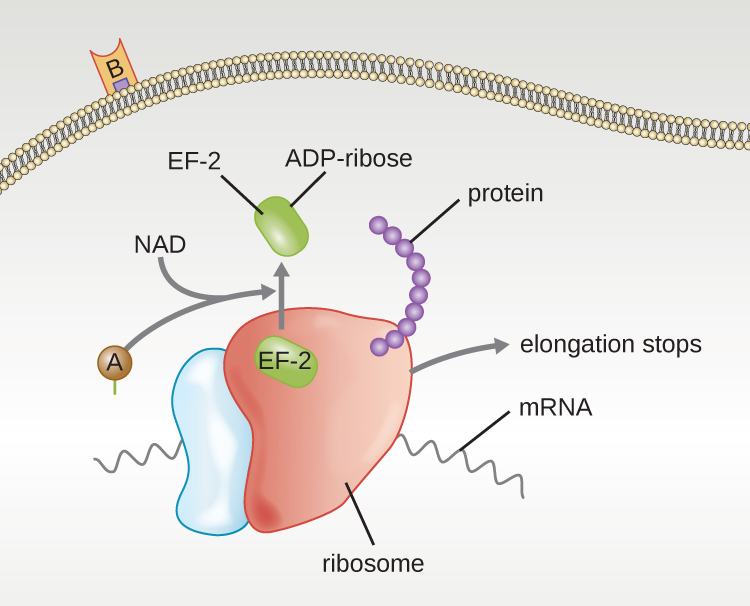
Quatre exemples uniques de toxines A-B sont les toxines diphtérique, cholérique, botulique et tétanique. La toxine diphtérique est produite par la bactérie gram-positive Corynebacterium diphtheriae, l'agent responsable de la diphtérie nasopharyngée et cutanée. Une fois que la sous-unité A de la toxine diphtérique s'est séparée et a accédé au cytoplasme, elle facilite le transfert de l'adénosine diphosphate (ADP) -ribose sur une protéine facteur d'élongation (EF-2) nécessaire à la synthèse des protéines. Ainsi, la toxine diphtérique inhibe la synthèse des protéines dans la cellule hôte, ce qui finit par tuer la cellule (Figure\(\PageIndex{6}\)).
La toxine cholérique est une entérotoxine produite par la bactérie gram-négative Vibrio cholerae et se compose d'une sous-unité A et de cinq sous-unités B. Le mécanisme d'action de la toxine cholérique est complexe. Les sous-unités B se lient aux récepteurs de la cellule épithéliale intestinale de l'intestin grêle. Après avoir pénétré dans le cytoplasme de la cellule épithéliale, la sous-unité A active une protéine G intracellulaire. La protéine G activée, à son tour, entraîne l'activation de l'enzyme adényl cyclase, qui commence à produire une augmentation de la concentration d'AMP cyclique (une molécule messagère secondaire). L'augmentation de l'AMPc perturbe la physiologie normale des cellules épithéliales intestinales et les amène à sécréter des quantités excessives de liquide et d'électrolytes dans la lumière du tractus intestinal, provoquant une grave diarrhée « selles de riz » caractéristique du choléra.
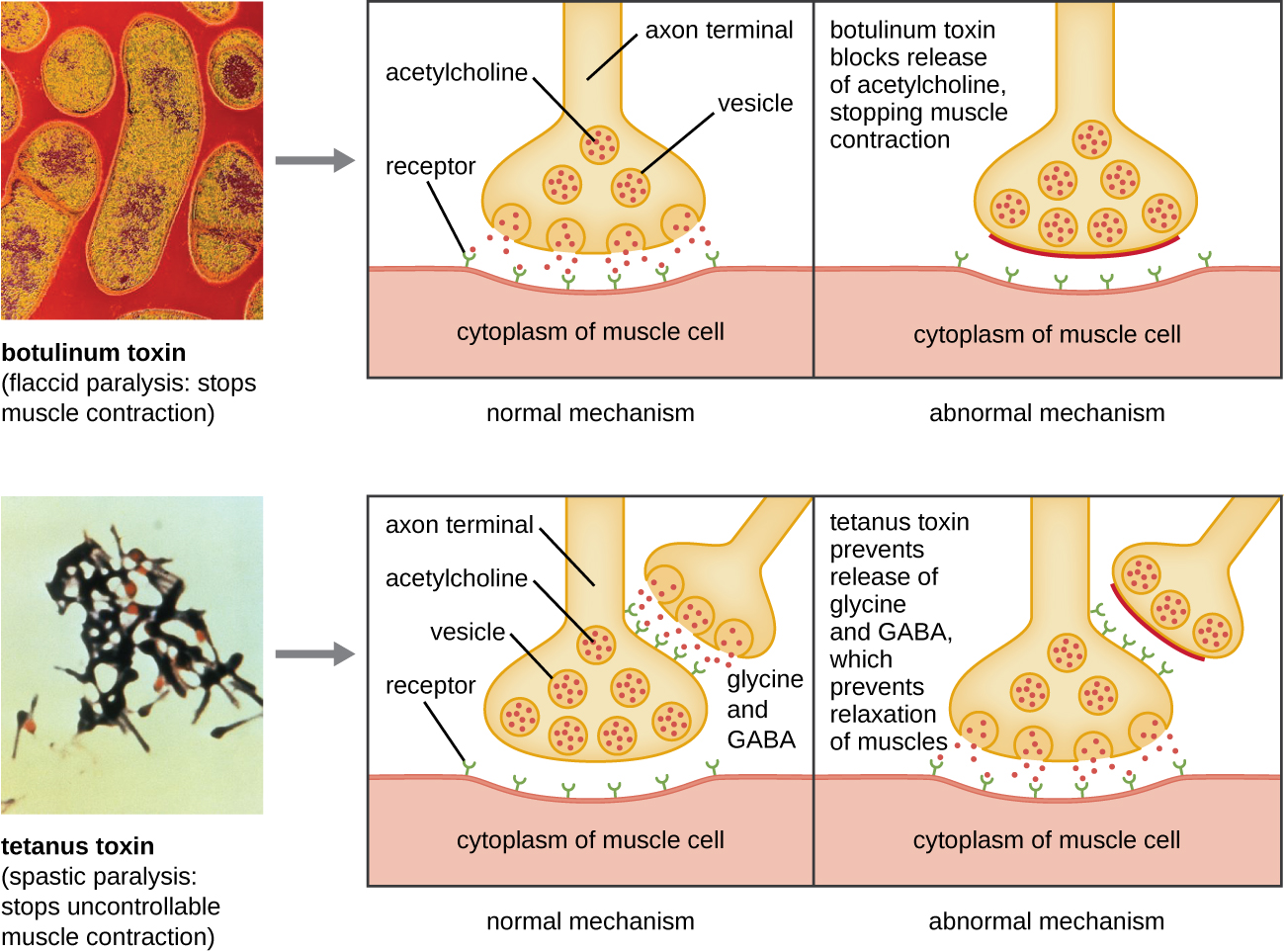
La toxine botulique (également connue sous le nom de botox) est une neurotoxine produite par la bactérie à Gram positif Clostridium botulinum. Il s'agit de la substance la plus toxique aiguë connue à ce jour. La toxine est composée d'une sous-unité A légère et d'une sous-unité de chaîne protéique B lourde. La sous-unité B se lie aux neurones pour permettre à la toxine botulique de pénétrer dans les neurones au niveau de la jonction neuromusculaire. La sous-unité A agit comme une protéase, clivant les protéines impliquées dans la libération par les neurones de l'acétylcholine, une molécule neurotransmettrice. Normalement, les neurones libèrent de l'acétylcholine pour provoquer des contractions des fibres musculaires. La capacité de la toxine à bloquer la libération d'acétylcholine entraîne l'inhibition des contractions musculaires, ce qui entraîne une relaxation musculaire. Cela peut provoquer un arrêt de la respiration et entraîner la mort. En raison de son action, de faibles concentrations de botox sont utilisées pour des interventions cosmétiques et médicales, y compris l'élimination des rides et le traitement de l'hyperactivité vésicale.
Une autre neurotoxine est la toxine tétanique, produite par la bactérie à Gram positif Clostridium tetani. Cette toxine possède également une sous-unité A légère et une sous-unité de chaîne protéique B lourde. Contrairement à la toxine botulique, la toxine tétanique se lie à des interneurones inhibiteurs, responsables de la libération des neurotransmetteurs inhibiteurs glycine et acide gamma-aminobutyrique (GABA). Normalement, ces neurotransmetteurs se lient aux neurones au niveau de la jonction neuromusculaire, ce qui inhibe la libération d'acétylcholine. La toxine tétanique inhibe la libération de glycine et de GABA par l'interneurone, ce qui entraîne une contraction musculaire permanente. Le premier symptôme est généralement une raideur de la mâchoire (trismus). De violents spasmes musculaires s'ensuivent dans d'autres parties du corps, qui se terminent généralement par une insuffisance respiratoire et la mort. La figure\(\PageIndex{7}\) montre les actions des toxines botuliques et tétaniques.
Les toxines perturbant la membrane affectent le fonctionnement de la membrane cellulaire soit en formant des pores, soit en perturbant la bicouche de phospholipides dans les membranes des cellules hôtes. Deux types d'exotoxines perturbant la membrane sont les hémolysines et les leucocidines, qui forment des pores dans les membranes cellulaires, provoquant une fuite du contenu cytoplasmique et une lyse cellulaire. On pensait à l'origine que ces toxines ciblaient respectivement les globules rouges (érythrocytes) et les globules blancs (leucocytes), mais nous savons maintenant qu'elles peuvent également affecter d'autres cellules. La bactérie Gram positif Streptococcus pyogenes produit des streptolysines, des hémolysines hydrosolubles qui se lient aux fractions du cholestérol présentes dans la membrane de la cellule hôte pour former un pore. Les deux types de streptolysines, O et S, sont classés selon leur capacité à provoquer une hémolyse dans les érythrocytes en l'absence ou en présence d'oxygène. La streptolysine O n'est pas active en présence d'oxygène, alors que la streptolysine S est active en présence d'oxygène. Parmi les autres toxines importantes qui perturbent la membrane porogène, citons la toxine alpha de Staphylococcus aureus et la pneumolysine de Streptococcus pneumoniae.
Les phospholipases bactériennes sont des toxines qui perturbent la membrane et qui dégradent la bicouche phospholipidique des membranes cellulaires au lieu de former des pores. Nous avons déjà discuté des phospholipases associées aux espèces de B. anthracis, L. pneumophila et Rickettsia qui permettent à ces bactéries d'effectuer la lyse des phagosomes. Ces mêmes phospholipases sont également des hémolysines. Les autres phospholipases qui agissent comme des hémolysines incluent la toxine alpha de Clostridium perfringens, la phospholipase C de P. aeruginosa et la toxine bêta de Staphylococcus aureus.
Certaines souches de S. aureus produisent également une leucocidine appelée leucocidine Panton-Valentine (PVL). La PVL se compose de deux sous-unités, S et F. La composante S agit comme la sous-unité B d'une exotoxine A-B en ce sens qu'elle se lie aux glycolipides de la membrane plasmique externe des cellules animales. Le composant F agit comme la sous-unité A d'une exotoxine A-B et est porteur de l'activité enzymatique. La toxine s'insère et s'assemble dans un pore de la membrane. Les gènes codant pour la PVL sont plus fréquemment présents dans les souches de S. aureus qui provoquent des infections cutanées et des pneumonies. 1 La PVL favorise les infections cutanées en provoquant un œdème, un érythème (rougeur de la peau due à la dilatation des vaisseaux sanguins) et une nécrose cutanée. Il a également été démontré que la PVL provoque une pneumonie nécrosante. La PVL favorise les effets pro-inflammatoires et cytotoxiques sur les leucocytes alvéolaires. Cela entraîne la libération d'enzymes par les leucocytes qui, à leur tour, endommagent les tissus pulmonaires.
Les superantigènes constituent la troisième classe d'exotoxines. Il s'agit d'exotoxines qui déclenchent une stimulation excessive et non spécifique des cellules immunitaires pour qu'elles sécrètent des cytokines (messagers chimiques). La production excessive de cytokines, souvent appelée tempête de cytokines, provoque une forte réponse immunitaire et inflammatoire qui peut provoquer de fortes fièvres potentiellement mortelles, une baisse de la pression artérielle, une défaillance multiviscérale, un choc et la mort. Le superantigène prototype est la toxine du syndrome de choc toxique de S. aureus. La plupart des cas de syndrome de choc toxique sont associés à la colonisation vaginale par le S. aureus producteur de toxines chez les femmes qui ont leurs règles ; toutefois, une colonisation d'autres parties du corps peut également se produire. Certaines souches de Streptococcus pyogenes produisent également des superantigènes ; elles sont appelées exotoxines mitogènes streptococciques et toxines pyrogènes streptococciques.
Exercice\(\PageIndex{2}\)
- Décrire comment les exoenzymes contribuent à l'invasion bactérienne.
- Expliquez la différence entre les exotoxines et les endotoxines.
- Nommez les trois classes d'exotoxines.
Facteurs de virulence pour la survie chez l'hôte et l'évasion immunitaire
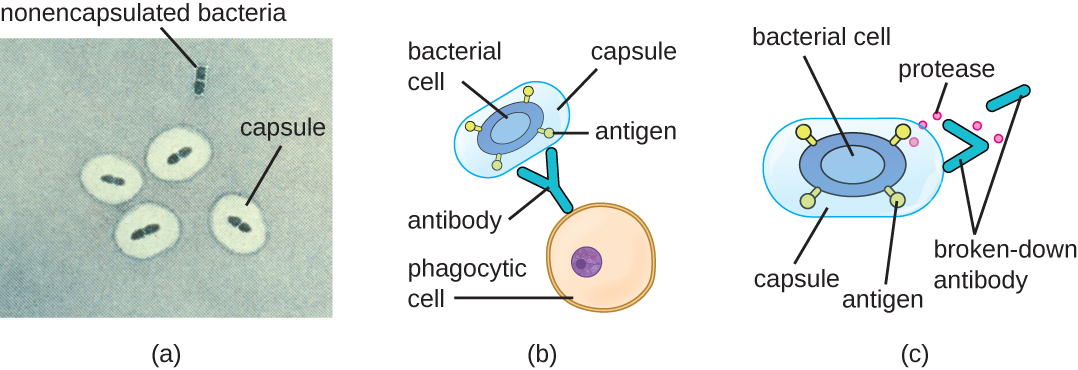
L'évitement du système immunitaire est également important pour l'invasivité. Les bactéries utilisent divers facteurs de virulence pour échapper à la phagocytose causée par les cellules du système immunitaire. Par exemple, de nombreuses bactéries produisent des capsules, qui sont utilisées pour l'adhésion mais qui aident également à l'évasion immunitaire en empêchant l'ingestion par les phagocytes. La composition de la capsule empêche les cellules immunitaires d'adhérer puis de phagocyter la cellule. De plus, la capsule rend la cellule bactérienne beaucoup plus grande, ce qui empêche les cellules immunitaires d'engloutir le pathogène (Figure\(\PageIndex{8}\)). Le pathogène Gram positif Streptococcus pneumoniae est une bactérie productrice de capsules remarquable, qui cause la pneumonie pneumococcique, la méningite, la septicémie et d'autres infections des voies respiratoires. Les souches encapsulées de S. pneumoniae sont plus virulentes que les souches non encapsulées et sont plus susceptibles d'envahir la circulation sanguine et de provoquer une septicémie et une méningite.
Certains agents pathogènes peuvent également produire des protéases pour se protéger contre la phagocytose. Comme décrit dans la section Défenses adaptatives spécifiques de l'hôte, le système immunitaire humain produit des anticorps qui se lient aux molécules de surface présentes sur des bactéries spécifiques (par exemple, capsules, fimbriae, flagelles, LPS). Cette liaison déclenche la phagocytose et d'autres mécanismes de destruction et d'élimination des antibactériens. Les protéases combattent la destruction et la clairance médiées par les anticorps en attaquant et en digérant les molécules d'anticorps (Figure\(\PageIndex{8}\)).
Outre les capsules et les protéases, certains agents pathogènes bactériens produisent d'autres facteurs de virulence qui leur permettent d'échapper au système immunitaire. Les fimbriae de certaines espèces de streptocoques contiennent la protéine M, qui altère la surface du streptocoque et inhibe la phagocytose en bloquant la liaison des molécules du complément qui aident les phagocytes à ingérer des bactéries pathogènes. La bactérie résistante à l'acide Mycobacterium tuberculosis (l'agent causal de la tuberculose) produit une substance cireuse appelée acide mycolique dans son enveloppe cellulaire. Lorsqu'elle est engloutie par des phagocytes dans les poumons, la couche protectrice d'acide mycolique permet à la bactérie de résister à certains des mécanismes de destruction du phagolysosome.
Certaines bactéries produisent des facteurs de virulence qui favorisent l'infection en exploitant les molécules naturellement produites par l'hôte. Par exemple, la plupart des souches de Staphylococcus aureus produisent l'exoenzyme coagulase, qui exploite le mécanisme naturel de la coagulation du sang pour échapper au système immunitaire. Normalement, la coagulation du sang est déclenchée en réponse à une lésion des vaisseaux sanguins ; les plaquettes commencent à obstruer le caillot et une cascade de réactions se produit au cours desquelles le fibrinogène, une protéine soluble produite par le foie, est clivé en fibrine. La fibrine est une protéine insoluble semblable à un fil qui se lie aux plaquettes sanguines, se réticule et se contracte pour former un maillage de plaquettes et de globules rouges agglomérés. Le caillot qui en résulte empêche toute perte de sang supplémentaire provenant des vaisseaux sanguins endommagés. Toutefois, si les bactéries libèrent de la coagulase dans le sang, la cascade fibrinogène-fibrine est déclenchée en l'absence de lésion des vaisseaux sanguins. Le caillot qui en résulte recouvre les bactéries de fibrine, les protégeant ainsi de l'exposition aux cellules immunitaires phagocytaires circulant dans le sang.
Alors que la coagulase provoque la coagulation du sang, les kinases ont l'effet inverse en déclenchant la conversion du plasminogène en plasmine, qui intervient dans la digestion des caillots de fibrine. En digérant un caillot, les kinases permettent aux agents pathogènes piégés dans le caillot de s'échapper et de se propager, de la même manière que la collagénase, la hyaluronidase et la DNase facilitent la propagation de l'infection. Des exemples de kinases incluent les staphylokinases et les streptokinases, produites respectivement par Staphylococcus aureus et Streptococcus pyogenes. Il est curieux que S. aureus puisse produire à la fois de la coagulase pour favoriser la coagulation et de la staphylokinase pour stimuler la digestion des caillots. L'action de la coagulase constitue une barrière protectrice importante contre le système immunitaire, mais lorsque l'apport en nutriments est réduit ou que d'autres conditions indiquent la nécessité pour le pathogène de s'échapper et de se propager, la production de staphylokinase peut déclencher ce processus.
Un dernier mécanisme que les agents pathogènes peuvent utiliser pour se protéger contre le système immunitaire est appelé variation antigénique, c'est-à-dire la modification des protéines de surface de telle sorte qu'un pathogène n'est plus reconnu par le système immunitaire de l'hôte. Par exemple, la bactérie Borrelia burgdorferi, l'agent responsable de la maladie de Lyme, contient une lipoprotéine de surface appelée VLSE. En raison de la recombinaison génétique lors de la réplication et de la réparation de l'ADN, cette protéine bactérienne subit des variations antigéniques. Chaque fois que de la fièvre apparaît, la protéine vLSE présente chez B. burgdorferi peut être tellement différente que les anticorps dirigés contre les séquences précédentes de VLSE ne sont pas efficaces. On pense que cette variation de la VLSE contribue à la capacité de B. burgdorferi à provoquer des maladies chroniques. Neisseria gonorrhoeae, responsable de la gonorrhée, une maladie sexuellement transmissible, est un autre pathogène bactérien humain important qui utilise la variation antigénique pour éviter le système immunitaire. Cette bactérie est bien connue pour sa capacité à subir une variation antigénique de ses pili de type IV afin d'éviter les défenses immunitaires.
Exercice\(\PageIndex{3}\)
- Nommez au moins deux façons dont une capsule protège le système immunitaire.
- Outre les capsules, citez deux autres facteurs de virulence utilisés par les bactéries pour échapper au système immunitaire.
Orientation clinique : résolution
Sur la base des symptômes signalés par Michael de raideur de la nuque et d'hémiparésie, le médecin soupçonne que l'infection s'est peut-être propagée à son système nerveux. Le médecin décide de prescrire une ponction lombaire pour rechercher toute bactérie qui aurait pu envahir les méninges et le liquide céphalorachidien (LCR), qui serait normalement stérile. Pour effectuer la ponction lombaire, le bas du dos de Michael est tamponné avec un antiseptique iodé, puis recouvert d'un drap stérile. L'aiguille est retirée de manière aseptique de l'emballage en plastique scellé du fabricant par les mains gantées du clinicien. L'aiguille est insérée et un petit volume de liquide est aspiré dans un tube à échantillon fixé. Le tube est retiré, bouché et une étiquette préparée avec les données de Michael y est apposée. Cet échantillon STAT (analyse urgente ou immédiate requise) est divisé en trois tubes stériles distincts contenant chacun 1 ml de LCR. Ces tubes sont immédiatement transportés au laboratoire de l'hôpital, où ils sont analysés dans les services de chimie clinique, d'hématologie et de microbiologie. Les résultats préliminaires des trois services indiquent qu'une infection cérébrospinale se produit, le service de microbiologie signalant la présence d'un bâtonnet à Gram positif dans le LCR de Michael.
Ces résultats confirment ce que son médecin soupçonnait : les nouveaux symptômes de Michael sont le résultat d'une méningite, une inflammation aiguë des membranes qui protègent le cerveau et la moelle épinière. Comme la méningite peut mettre la vie en danger et que la première antibiothérapie n'a pas été efficace pour prévenir la propagation de l'infection, Michael se voit prescrire une cure agressive de deux antibiotiques, l'ampicilline et la gentamicine, à administrer par voie intraveineuse. Michael reste à l'hôpital pendant plusieurs jours pour recevoir des soins de soutien et être observé. Après une semaine, il est autorisé à rentrer chez lui pour se reposer au lit et prendre des antibiotiques oraux. Après 3 semaines de ce traitement, il se rétablit complètement.
Virulence virale
Bien que les agents pathogènes viraux ne soient pas similaires aux agents pathogènes bactériens en termes de structure, certaines des propriétés qui contribuent à leur virulence sont similaires. Les virus utilisent des adhésines pour faciliter l'adhésion aux cellules hôtes, et certains virus enveloppés dépendent de la variation antigénique pour éviter les défenses immunitaires de l'hôte. Ces facteurs de virulence sont abordés plus en détail dans les sections suivantes.
Adhésines virales
L'une des premières étapes de toute infection virale est l'adhésion du virus à des récepteurs spécifiques à la surface des cellules. Ce processus est médié par des adhésines qui font partie de la capside virale ou de l'enveloppe membranaire. L'interaction des adhésines virales avec des récepteurs cellulaires spécifiques définit le tropisme (ciblage préférentiel) des virus pour des cellules, des tissus et des organes spécifiques du corps. La protéine de pointe hémagglutinine présente sur le virus de l'influenza est un exemple d'adhésine virale ; elle permet au virus de se lier à l'acide sialique sur la membrane des cellules respiratoires et intestinales de l'hôte. Une autre adhésine virale est la glycoprotéine gp20, présente sur le VIH. Pour que le VIH infecte les cellules du système immunitaire, il doit interagir avec deux récepteurs situés à la surface des cellules. La première interaction implique la liaison entre la gp120 et le marqueur cellulaire CD4 présent sur certaines cellules essentielles du système immunitaire. Cependant, avant que le virus ne pénètre dans la cellule, une deuxième interaction entre la gp120 et l'un des deux récepteurs des chimiokines (CCR5 et CXCR4) doit se produire. Le tableau\(\PageIndex{5}\) répertorie les adhésines de certains agents pathogènes viraux courants et les sites spécifiques auxquels ces adhésines permettent aux virus de se fixer.
| Agent pathogène | Maladie | Adhésine | Site de pièces jointes |
|---|---|---|---|
| Influenzavirus | Grippe | Hémagglutinine | Acide sialique des cellules respiratoires et intestinales |
| virus de l'herpès simplex I ou II | Herpès oral et génital | Glycoprotéines gB, gC, gD | Sulfate d'héparane sur les surfaces muqueuses de la bouche et des organes génitaux |
| Virus de l'immunodéficience humaine | VIH | Glycoprotéine gp120 | CD4 et CCR5 ou CXCR4 des cellules du système immunitaire |
Variation antigénique des virus
Une variation antigénique se produit également dans certains types de virus enveloppés, y compris les virus de la grippe, qui présentent deux formes de variation antigénique : la dérive antigénique et le déplacement antigénique (Figure\(\PageIndex{9}\)). La dérive antigénique est le résultat de mutations ponctuelles provoquant de légères modifications des protéines de pointe, à savoir l'hémagglutinine (H) et la neuraminidase (N). D'autre part, le changement antigénique est un changement majeur dans les protéines de pointe en raison du réassortiment génétique. Ce réassortiment pour le changement antigénique se produit généralement lorsque deux virus grippaux différents infectent le même hôte.
Le taux de variation antigénique des virus de la grippe étant très élevé, il est difficile pour le système immunitaire de reconnaître les nombreuses souches différentes du virus de la grippe. Bien que l'organisme puisse développer une immunité contre une souche par exposition naturelle ou par vaccination, la variation antigénique entraîne l'émergence continue de nouvelles souches que le système immunitaire ne reconnaît pas. C'est la principale raison pour laquelle les vaccins contre le virus de la grippe doivent être administrés chaque année. Le vaccin antigrippal de chaque année fournit une protection contre les souches les plus répandues cette année-là, mais des souches nouvelles ou différentes peuvent être plus répandues l'année suivante.
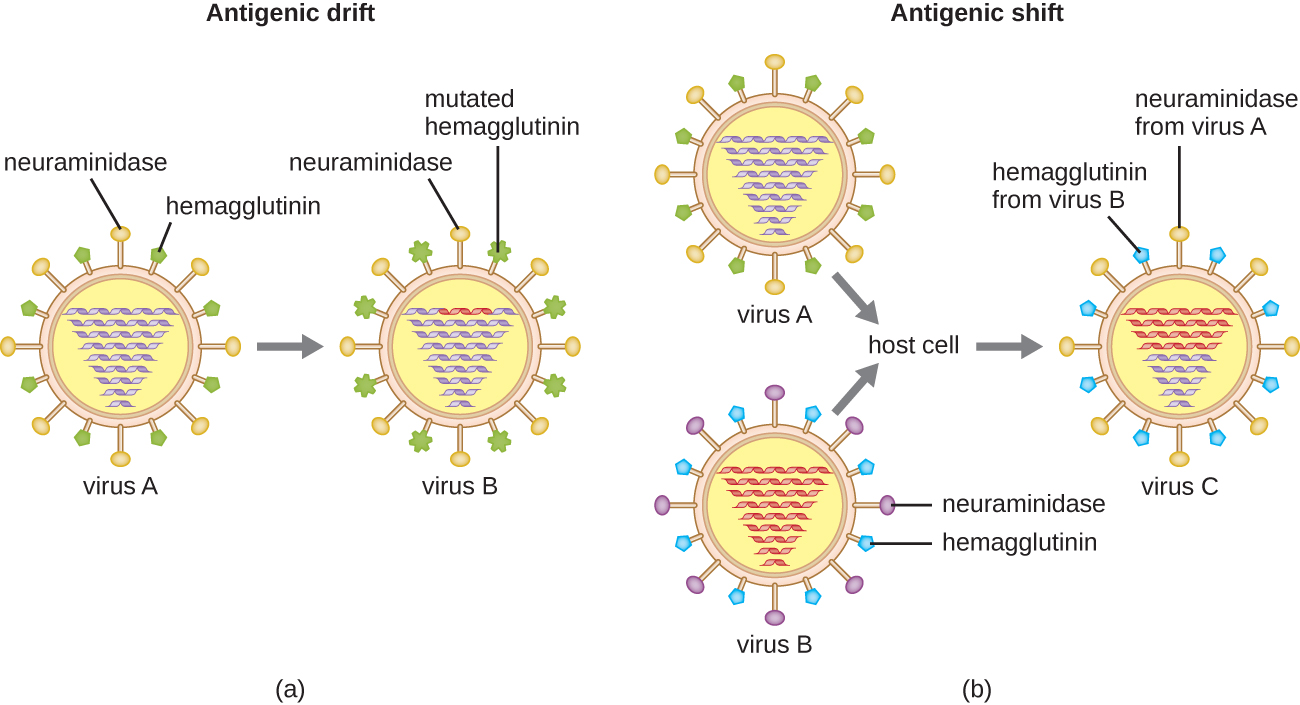
Pour une autre explication de la façon dont se produisent les changements et les dérives antigéniques, regardez cette vidéo.
Exercice\(\PageIndex{4}\)
- Décrire le rôle des adhésines dans le tropisme viral.
- Expliquer la différence entre la dérive antigénique et le déplacement antigénique.
Concepts clés et résumé
Les facteurs de virulence contribuent à la capacité d'un agent pathogène à provoquer des maladies. Les exoenzymes et les toxines permettent aux agents pathogènes d'envahir les tissus de l'hôte et d'endommager les tissus. Les exoenzymes sont classées en fonction de la macromolécule qu'elles ciblent et les exotoxines sont classées en fonction de leur mécanisme d'action. Les toxines bactériennes comprennent les endotoxines et les exotoxines. L'endotoxine est le composant lipidique A du LPS de l'enveloppe cellulaire à Gram négatif. Les exotoxines sont des protéines sécrétées principalement par des bactéries gram-positives, mais également par des bactéries gram-négatives. Les bactéries pathogènes peuvent échapper à la réponse immunitaire de l'hôte en produisant des capsules pour éviter la phagocytose, en survivant dans l'environnement intracellulaire des phagocytes, en dégradant les anticorps ou en subissant des variations antigéniques. Les agents pathogènes viraux utilisent des adhésines pour déclencher des infections et une variation antigénique pour éviter les défenses immunitaires. Les virus de la grippe utilisent à la fois la dérive antigénique et le déplacement antigénique pour éviter d'être reconnus par le système immunitaire.
Notes
- 1 V. Meka. « Leucocidine Panton-Valentine. » http://www.antimicrobe.org/h04c.file...L-S-aureus.asp


