13.4 : Tester l'efficacité des antiseptiques et des désinfectants
- Page ID
- 187588
Objectifs d'apprentissage
- Décrire pourquoi le coefficient de phénol est utilisé
- Comparez et comparez les méthodes de diffusion sur disque, d'utilisation-dilution et d'utilisation en cours d'utilisation pour tester l'efficacité des antiseptiques, des désinfectants et des stérilisants
L'efficacité de divers désinfectants chimiques se reflète dans les termes utilisés pour les décrire. Les désinfectants chimiques sont regroupés en fonction de la puissance de leur activité, chaque catégorie reflétant les types de microbes et de virus contre lesquels les désinfectants composants sont efficaces. Les germicides de haut niveau ont la capacité de tuer les cellules végétatives, les champignons, les virus et les endospores, ce qui entraîne la stérilisation, en cas d'utilisation prolongée. Les germicides de niveau intermédiaire, comme leur nom l'indique, sont moins efficaces contre les endospores et certains virus, et les germicides de faible activité tuent uniquement les cellules végétatives et certains virus enveloppés, et sont inefficaces contre les endospores.
Cependant, plusieurs conditions environnementales influent sur la puissance et l'efficacité d'un agent antimicrobien. Par exemple, la durée de l'exposition est particulièrement importante, une exposition plus longue augmentant l'efficacité. De même, la concentration de l'agent chimique est également importante, les concentrations les plus élevées étant plus efficaces que les plus faibles. La température, le pH et d'autres facteurs peuvent également affecter l'efficacité d'un agent désinfectant.
L'une des méthodes permettant de déterminer l'efficacité d'un agent chimique consiste à prélever des écouvillons sur les surfaces avant et après utilisation afin de confirmer si un champ stérile a été maintenu pendant l'utilisation. Des tests supplémentaires sont décrits dans les sections qui suivent. Ces tests permettent de maintenir des protocoles de désinfection appropriés en milieu clinique, de contrôler la croissance microbienne afin de protéger les patients, les agents de santé et la communauté.
Coefficient de phénol
L'efficacité d'un désinfectant ou d'un antiseptique peut être déterminée de différentes manières. Historiquement, l'efficacité d'un agent chimique était souvent comparée à celle du phénol, le premier agent chimique utilisé par Joseph Lister. En 1903, les chimistes britanniques Samuel Rideal (1863-1929) et J. T. Ainslie Walker (1868-1930) ont établi un protocole pour comparer l'efficacité de divers produits chimiques à celle du phénol, en utilisant comme organismes d'essai Staphylococcus aureus (une bactérie à Gram positif) et Salmonella sérovar entérique Typhi (une bactérie gram-négative). Ils ont exposé les bactéries testées aux solutions chimiques antimicrobiennes diluées dans de l'eau pendant 7,5 minutes. Ils ont ensuite calculé un coefficient de phénol pour chaque produit chimique pour chacune des deux bactéries testées. Un coefficient de phénol de 1,0 signifie que l'agent chimique a à peu près le même niveau d'efficacité que le phénol. Un agent chimique dont le coefficient phénol est inférieur à 1,0 est moins efficace que le phénol. Le formol en est un exemple, avec des coefficients phénoliques de 0,3 (S. aureus) et de 0,7 (sérovar Typhi de S. enterica). Un agent chimique dont le coefficient phénol est supérieur à 1,0 est plus efficace que le phénol, tel que la chloramine, avec des coefficients de phénol de 133 et 100, respectivement. Bien que le coefficient de phénol ait été autrefois une mesure utile de l'efficacité, il n'est plus couramment utilisé car les conditions et les organismes utilisés ont été choisis de manière arbitraire.
Exercice\(\PageIndex{1}\)
Quelles sont les différences entre les trois niveaux d'efficacité des désinfectants ?
Méthode de diffusion sur disque
La méthode de diffusion sur disque consiste à appliquer différents produits chimiques sur des disques de papier filtre stériles séparés (Figure\(\PageIndex{1}\)). Les disques sont ensuite placés sur une plaque de gélose qui a été inoculée avec la bactérie ciblée et les produits chimiques se diffusent hors des disques dans la gélose où les bactéries ont été inoculées. Au fur et à mesure que la « pelouse » des bactéries se développe, des zones d'inhibition de la croissance microbienne sont observées sous forme de zones claires autour des disques. Bien que d'autres facteurs contribuent à la taille des zones d'inhibition (par exemple, si l'agent est soluble dans l'eau et capable de diffuser dans la gélose), les zones plus grandes sont généralement corrélées à une efficacité d'inhibition accrue de l'agent chimique. Le diamètre de chaque zone est mesuré en millimètres.
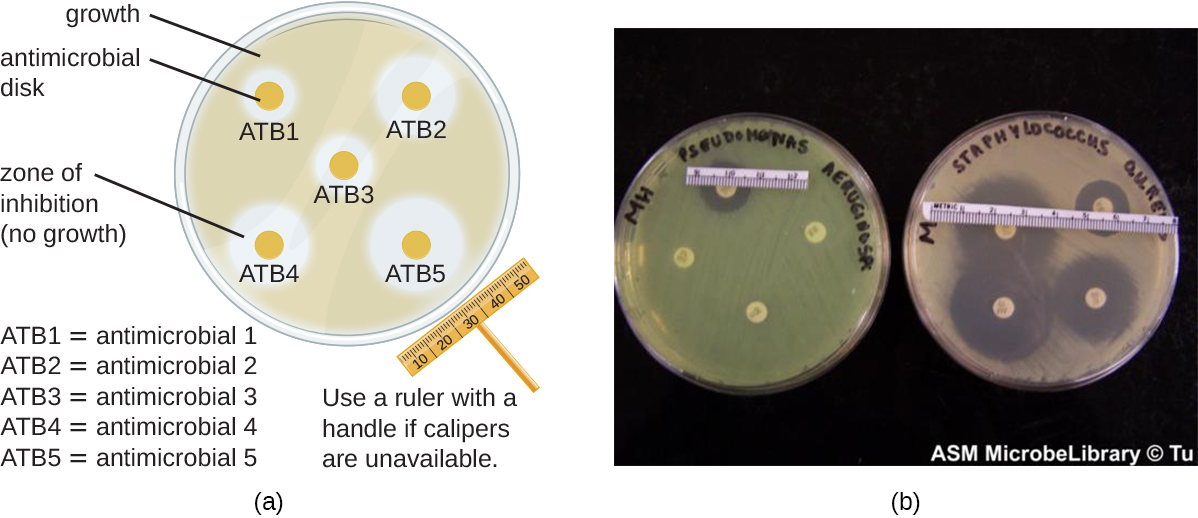
Exercice\(\PageIndex{2}\)
Si l'on compare les activités de deux désinfectants contre le même microbe, en utilisant le test de diffusion sur disque, et en supposant que les deux sont solubles dans l'eau et peuvent facilement se diffuser dans la gélose, un désinfectant plus efficace aurait-il une zone d'inhibition plus grande ou une zone plus petite ?
Test d'utilisation et de dilution
D'autres méthodes sont également utilisées pour mesurer l'efficacité d'un agent chimique en milieu clinique. Le test d'utilisation-dilution est couramment utilisé pour déterminer l'efficacité de désinfection d'un produit chimique sur une surface inanimée. Pour ce test, un cylindre en acier inoxydable est plongé dans une culture du microorganisme ciblé puis séché. Le cylindre est ensuite plongé dans des solutions de désinfectant à différentes concentrations pendant une durée spécifiée. Enfin, le cylindre est transféré dans un nouveau tube à essai contenant un milieu stérile frais ne contenant pas de désinfectant, et ce tube à essai est incubé. La survie des bactéries est démontrée par la présence de turbidité dans le milieu, alors que la destruction de l'organisme cible sur le cylindre par le désinfectant ne produira aucune turbidité.
L'Association of Official Agricultural Chemists International (AOAC), un groupe à but non lucratif qui établit de nombreuses normes protocolaires, a déterminé qu'au moins 59 des 60 répliques ne doivent montrer aucune croissance dans un tel test pour obtenir un résultat satisfaisant, et que les résultats doivent être reproductibles à partir de différents lots de désinfectant et lorsqu'il est effectué à des jours différents. Les fabricants de désinfectants effectuent des tests d'utilisation-dilution pour valider les allégations d'efficacité de leurs produits, tels que désignés par l'EPA.
Exercice\(\PageIndex{3}\)
Le test d'utilisation-dilution est-il réalisé en milieu clinique ? Pourquoi ?
Test en cours d'utilisation
Un test en cours d'utilisation permet de déterminer si une solution de désinfectant utilisée activement en milieu clinique est contaminée par des microbes (Figure\(\PageIndex{2}\)). Un échantillon de 1 ml du désinfectant utilisé est dilué dans 9 ml de bouillon stérile qui contient également un composé destiné à inactiver le désinfectant. Dix gouttes, soit un total d'environ 0,2 ml de ce mélange, sont ensuite inoculées sur chacune des deux plaques de gélose. Une plaque est incubée à 37 °C pendant 3 jours et l'autre est incubée à température ambiante pendant 7 jours. Les plaques sont surveillées pour détecter la croissance de colonies microbiennes. La croissance de cinq colonies ou plus sur l'une ou l'autre des plaques suggère que des cellules microbiennes viables existaient dans la solution désinfectante et que celle-ci est contaminée. Ces tests en cours d'utilisation surveillent l'efficacité des désinfectants en milieu clinique.
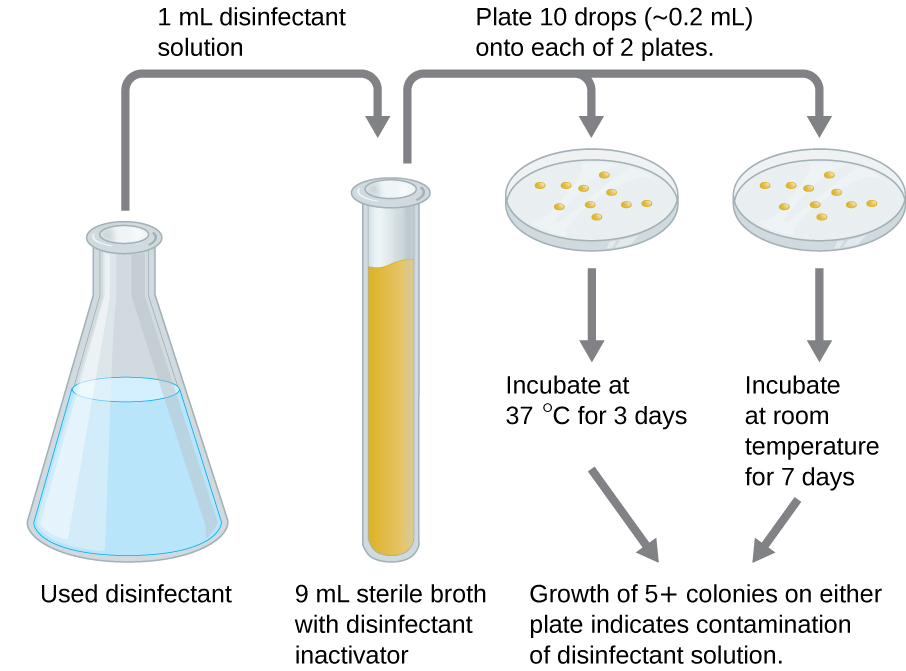
Exercice\(\PageIndex{4}\)
Qu'indique un test positif en cours d'utilisation ?
Orientation clinique : résolution
Malgré un traitement antibiotique, les symptômes de Roberta se sont aggravés. Elle a développé une pyélonéphrite, une grave infection rénale, et a été réhospitalisée à l'unité de soins intensifs (USI). Son état a continué de se détériorer et elle a présenté des symptômes de choc septique. À ce stade, son médecin a prescrit une culture à partir de son urine afin de déterminer la cause exacte de son infection, ainsi qu'un test de sensibilité aux médicaments afin de déterminer quels antibiotiques seraient efficaces contre la bactérie responsable. Les résultats de ce test ont indiqué une résistance à un large éventail d'antibiotiques, y compris les carbapénèmes, une classe d'antibiotiques utilisés en dernier recours pour de nombreux types d'infections bactériennes. Ce résultat était alarmant, suggérant que l'infection de Roberta était causée par une superbactérie, une souche bactérienne qui a développé une résistance à la majorité des antibiotiques couramment utilisés. Dans ce cas, l'agent causal appartenait aux entérobactéries résistantes aux carbapénèmes (CRE), une famille de bactéries résistantes aux médicaments que l'on trouve normalement dans le système digestif (Figure\(\PageIndex{3}\)). Lorsque la CRE est introduite dans d'autres systèmes corporels, comme cela peut se produire par le biais d'instruments chirurgicaux, de cathéters ou d'endoscopes mal nettoyés, des infections agressives peuvent survenir.
Les infections à CRE sont notoirement difficiles à traiter, avec un taux de létalité de 40 à 50 %. Pour traiter son infection rénale et son choc septique, Roberta a été traitée par dialyse, par voie intraveineuse et par des médicaments pour maintenir la tension artérielle et prévenir la coagulation sanguine. Elle a également commencé à suivre un traitement agressif par administration intraveineuse d'un nouveau médicament appelé tigécycline, qui a réussi à traiter les infections causées par des bactéries résistantes aux médicaments.
Après plusieurs semaines aux soins intensifs, Roberta s'est rétablie de son infection à la CRE. Cependant, les responsables de la santé publique ont rapidement remarqué que le cas de Roberta n'était pas isolé. Plusieurs patients ayant subi des interventions similaires dans le même hôpital ont également développé des infections à CRE, dont certains sont décédés. En fin de compte, la source de l'infection a été attribuée aux duodénoscopes utilisés dans les procédures. Bien que le personnel de l'hôpital ait suivi méticuleusement les protocoles de désinfection du fabricant, des bactéries, y compris la CRE, sont restées dans les instruments et ont été présentées aux patients au cours des interventions.
Qui est responsable ?
Les infections à entérobactériacées résistantes aux carbapénèmes causées par des endoscopes contaminés sont devenues un problème très médiatisé ces dernières années. Plusieurs épidémies de CRE ont été attribuées à des endoscopes, notamment un cas survenu au centre médical Ronald Reagan UCLA début de 2015 au cours duquel 179 patients pourraient avoir été exposés à un endoscope contaminé. Sept des patients ont développé des infections et deux sont décédés plus tard. Plusieurs poursuites ont été intentées contre Olympus, le fabricant des endoscopes. Certains affirment qu'Olympus n'a pas obtenu l'approbation de la FDA pour les modifications de conception qui auraient pu entraîner une contamination, tandis que d'autres affirment que le fabricant a sciemment caché aux hôpitaux des informations concernant des défauts des endoscopes.
De tels procès soulèvent des questions difficiles à répondre au sujet de la responsabilité. Les procédures invasives sont intrinsèquement risquées, mais les résultats négatifs peuvent être minimisés par le strict respect des protocoles établis. Mais qui est responsable lorsque des résultats négatifs se produisent en raison de protocoles défectueux ou d'équipements défectueux ? Les hôpitaux ou les agents de santé peuvent-ils être tenus responsables s'ils ont strictement suivi une procédure défectueuse ? Les fabricants devraient-ils être tenus responsables, voire évincés de leurs activités, si leur équipement de sauvetage tombe en panne ou s'avère défectueux ? Quel est le rôle du gouvernement pour garantir la sécurité intégrée de l'utilisation et de la maintenance des équipements et des protocoles médicaux ?
Les protocoles de nettoyage ou de stérilisation des équipements médicaux sont souvent développés par des agences gouvernementales telles que la FDA et d'autres groupes, comme l'AOAC, une organisation scientifique à but non lucratif qui établit de nombreux protocoles pour une utilisation standard à l'échelle mondiale. Ces procédures et protocoles sont ensuite adoptés par les fabricants de dispositifs et d'équipements médicaux. En fin de compte, les utilisateurs finaux (les hôpitaux et leur personnel) sont responsables du respect de ces procédures et peuvent être tenus responsables en cas de violation et de maladie des patients à cause d'un équipement mal nettoyé.
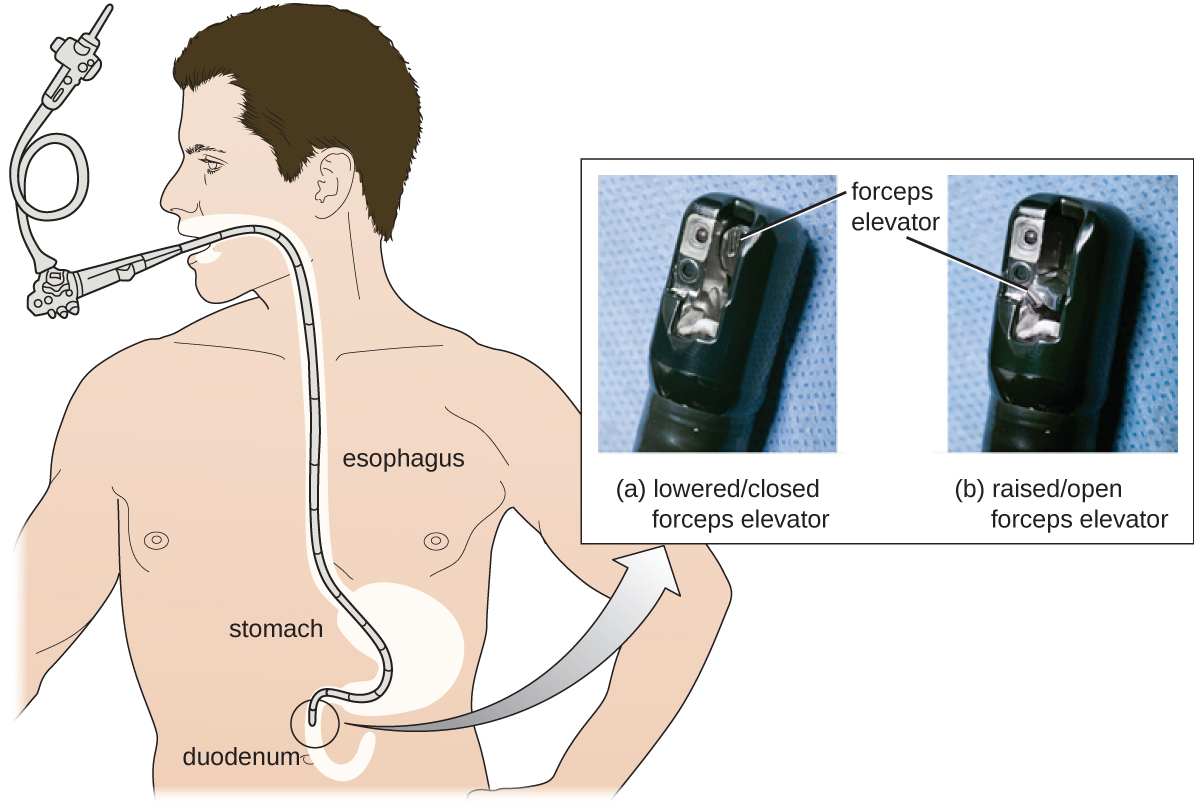
Malheureusement, les protocoles ne sont pas infaillibles et il faut parfois des résultats négatifs pour révéler leurs défauts. En 2008, la FDA avait approuvé un protocole de désinfection pour les endoscopes, utilisant du glutaraldéhyde (à une concentration plus faible lorsqu'il est mélangé avec du phénol), de l'o-phtalaldéhyde, du peroxyde d'hydrogène, de l'acide peracétique et un mélange de peroxyde d'hydrogène et d'acide peracétique. Cependant, des épidémies de CRE consécutives à l'utilisation d'un endoscope ont montré que ce protocole à lui seul était inadéquat.
À la suite des épidémies de CRE, les hôpitaux, les fabricants et la FDA étudient des solutions. De nombreux hôpitaux mettent en place des procédures de nettoyage plus rigoureuses que celles prescrites par la FDA. Les fabricants cherchent des moyens de reconcevoir les duodénoscopes afin de minimiser les crevasses difficiles d'accès où les bactéries peuvent échapper aux désinfectants, et la FDA met à jour ses protocoles. En février 2015, la FDA a ajouté de nouvelles recommandations pour un nettoyage soigneux des mains du mécanisme élévateur du duodénoscope (l'endroit où les microbes sont le plus susceptibles d'échapper à la désinfection) et a publié une documentation plus rigoureuse sur le contrôle de la qualité des protocoles de désinfection (Figure\(\PageIndex{4}\)).
Rien ne garantit que les nouvelles procédures, protocoles ou équipements élimineront complètement le risque d'infection associé aux endoscopes. Pourtant, ces appareils sont utilisés avec succès dans 500 000 à 650 000 interventions par an aux États-Unis, dont beaucoup sauvent des vies. À quel moment les risques l'emportent-ils sur les avantages de ces dispositifs, et qui doit être tenu responsable en cas de résultats négatifs ?
Concepts clés et résumé
- Les désinfectants chimiques sont regroupés selon les types de microbes et d'agents infectieux contre lesquels ils sont efficaces. Les germicides de haute activité tuent les cellules végétatives, les champignons, les virus et les endospores, et peuvent finalement mener à la stérilisation. Les germicides de niveau intermédiaire ne peuvent pas tuer tous les virus et sont moins efficaces contre les endospores. Les germicides à faible concentration tuent les cellules végétatives et certains virus enveloppés, mais sont inefficaces contre les endospores.
- L'efficacité d'un désinfectant est influencée par plusieurs facteurs, notamment la durée de l'exposition, la concentration du désinfectant, la température et le pH.
- Historiquement, l'efficacité d'un désinfectant chimique a été comparée à celle du phénol pour tuer Staphylococcus aureus et Salmonella enterica sérovar Typhi, et un coefficient de phénol a été calculé.
- La méthode de diffusion sur disque est utilisée pour tester l'efficacité d'un désinfectant chimique contre un microbe particulier.
- Le test d'utilisation-dilution permet de déterminer l'efficacité d'un désinfectant sur une surface. Les tests en cours d'utilisation peuvent déterminer si les solutions désinfectantes sont utilisées correctement en milieu clinique.


