13.3 : Utilisation de produits chimiques pour contrôler les microorganismes
- Page ID
- 187590
Objectifs d'apprentissage
- Comprendre et comparer les différents produits chimiques utilisés pour contrôler la croissance microbienne, y compris leurs utilisations, leurs avantages et leurs inconvénients, leur structure chimique et leur mode d'action
Outre les méthodes physiques de contrôle microbien, des produits chimiques sont également utilisés pour contrôler la croissance microbienne. Une grande variété de produits chimiques peuvent être utilisés comme désinfectants ou antiseptiques. Au moment de choisir lequel utiliser, il est important de prendre en compte le type de microbe ciblé, le degré de propreté de l'article, l'effet du désinfectant sur l'intégrité de l'article, sa sécurité pour les animaux, les humains et l'environnement, son coût et sa facilité d'utilisation. Cette section décrit les divers produits chimiques utilisés comme désinfectants et antiseptiques, y compris leurs mécanismes d'action et leurs utilisations courantes.
Phénoliques
Dans les années 1800, les scientifiques ont commencé à expérimenter divers produits chimiques pour la désinfection. Dans les années 1860, le chirurgien britannique Joseph Lister (1827—1912) a commencé à utiliser l'acide phénique, connu sous le nom de phénol, comme désinfectant pour le traitement des plaies chirurgicales (voir Fondements de la théorie cellulaire moderne). En 1879, les travaux de Lister ont inspiré le chimiste américain Joseph Lawrence (1836—1909) à développer la Listerine, un mélange à base d'alcool de plusieurs composés apparentés qui est encore utilisé aujourd'hui comme antiseptique oral. De nos jours, l'acide phénique n'est plus utilisé comme désinfectant chirurgical parce qu'il est irritant pour la peau, mais les composés chimiques présents dans les bains de bouche antiseptiques et les pastilles pour la gorge sont appelés phénoliques.
Chimiquement, le phénol est constitué d'un cycle benzénique avec un groupe —OH, et les composés phénoliques sont des composés dont ce groupe fait partie de leur structure chimique (Figure\(\PageIndex{1}\)). Les composés phénoliques tels que le thymol et l'eucalyptus sont naturellement présents dans les plantes. D'autres composés phénoliques peuvent être dérivés de la créosote, un composant du goudron de houille. Les composés phénoliques ont tendance à être stables, persistants sur les surfaces et moins toxiques que le phénol. Ils inhibent la croissance microbienne en dénaturant les protéines et en perturbant les membranes.
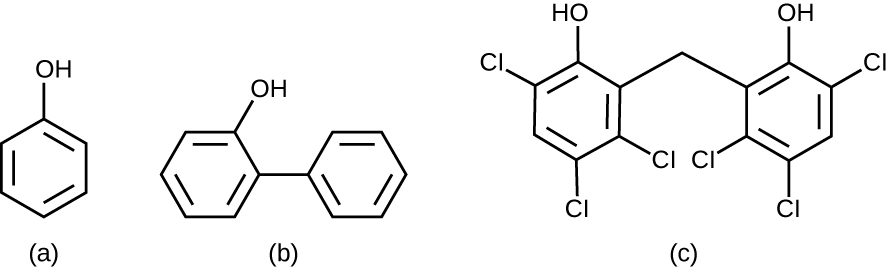
Depuis l'époque de Lister, plusieurs composés phénoliques ont été utilisés pour contrôler la croissance microbienne. Des composés phénoliques tels que les crésols (phénols méthylés) et l'o-phénylphénol étaient des ingrédients actifs dans diverses formulations de Lysol depuis son invention en 1889. L'o-phénylphénol était également couramment utilisé en agriculture pour contrôler la croissance bactérienne et fongique sur les cultures récoltées, en particulier les agrumes, mais son utilisation aux États-Unis Le nombre d'États est désormais bien plus limité. Le bisphénol hexachlorophène, un désinfectant, est l'ingrédient actif de PhisoHex, un détergent topique largement utilisé pour le lavage des mains en milieu hospitalier. PhisoHex est particulièrement efficace contre les bactéries à Gram positif, y compris celles qui causent des infections cutanées staphylococciques et streptococciques. PhisoHex était autrefois utilisée pour le bain des nourrissons, mais cette pratique a été abandonnée car il a été démontré que l'exposition à l'hexachlorophène peut entraîner des problèmes neurologiques.
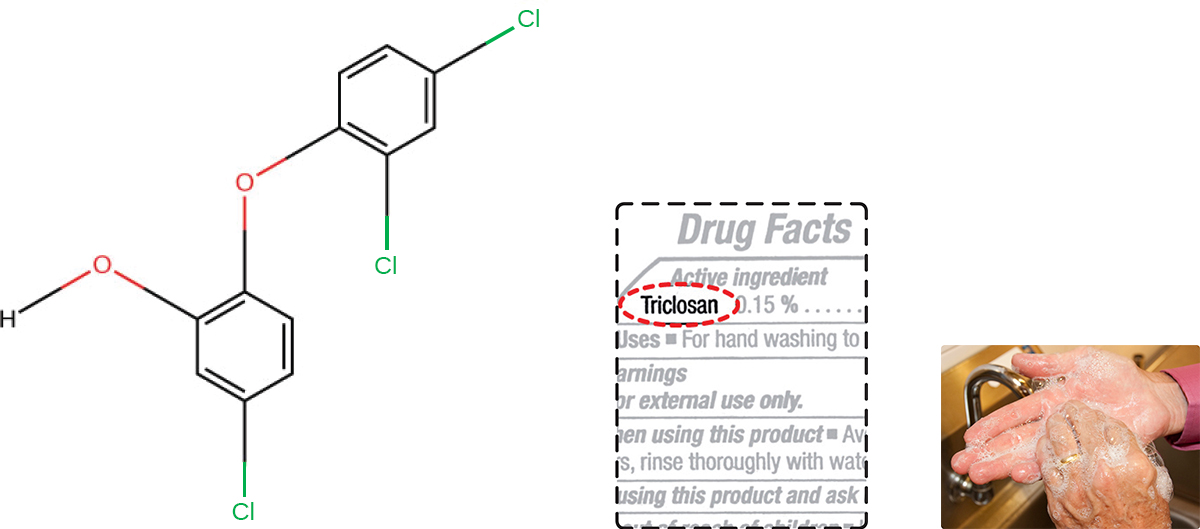
Le triclosan est un autre composé bisphénol largement utilisé dans les produits antibactériens au cours des dernières décennies. Initialement utilisé dans les dentifrices, le triclosan est maintenant couramment utilisé dans les savons pour les mains et est fréquemment imprégné dans une grande variété d'autres produits, y compris des planches à découper, des couteaux, des rideaux de douche, des vêtements et du béton, pour les rendre antimicrobiens. Il est particulièrement efficace contre les bactéries gram-positives présentes sur la peau, ainsi que certaines bactéries gram-négatives et les levures. 1
Le triclosan : un excès d'antibactérien ?
Les savons pour les mains et autres produits de nettoyage sont souvent commercialisés en tant qu' « antibactériens », ce qui suggère qu'ils offrent un niveau de propreté supérieur à celui des savons et des nettoyants classiques. Mais les ingrédients antibactériens de ces produits sont-ils vraiment sûrs et efficaces ?
Environ 75 % des savons liquides antibactériens pour les mains et 30 % des savons en barre contiennent du triclosan, un composé phénolique, (Figure\(\PageIndex{2}\)). 2 Le triclosan bloque une enzyme de la voie de biosynthèse des acides gras bactériens qui n'est pas présente dans la voie humaine comparable. Bien que l'utilisation du triclosan à la maison ait considérablement augmenté au cours des années 1990, plus de 40 ans de recherches menées par la FDA n'ont révélé aucune preuve concluante que le lavage avec des produits contenant du triclosan présente des avantages accrus pour la santé par rapport au lavage avec du savon traditionnel. Bien que certaines études indiquent que moins de bactéries peuvent rester sur les mains d'une personne après le lavage avec du savon à base de triclosan, par rapport au savon traditionnel, aucune preuve n'indique une réduction de la transmission des bactéries responsables de maladies respiratoires et gastro-intestinales. Bref, les savons contenant du triclosan peuvent éliminer ou tuer quelques germes supplémentaires, mais pas suffisamment pour réduire la propagation des maladies.
Ce qui est peut-être plus inquiétant, c'est que certains risques évidents associés aux savons à base de triclosan sont apparus. L'utilisation généralisée du triclosan a entraîné une augmentation du nombre de souches bactériennes résistantes au triclosan, y compris celles présentant une importance clinique, telles que Salmonella enterica ; cette résistance pourrait rendre le triclosan inutile en tant qu'antibactérien à long terme. 3 4 Les bactéries peuvent facilement acquérir une résistance au triclosan en modifiant un seul gène codant pour l'enzyme ciblée dans la voie de synthèse des acides gras bactériens. D'autres désinfectants ayant un mode d'action moins spécifique sont beaucoup moins susceptibles de créer de la résistance, car cela nécessiterait bien plus qu'une seule modification génétique.
L'utilisation du triclosan au cours des dernières décennies a également entraîné une accumulation de ce produit chimique dans l'environnement. Le triclosan contenu dans le savon pour les mains est directement introduit dans les eaux usées et les réseaux d'égouts à la suite du processus de lavage des mains. Ses propriétés antibactériennes peuvent y inhiber ou tuer les bactéries responsables de la décomposition des eaux usées, provoquant ainsi le colmatage et le refoulement des fosses septiques. Le triclosan contenu dans les eaux usées finit par se retrouver dans les eaux de surface, les cours d'eau, les lacs, les sédiments et les sols, perturbant ainsi les populations naturelles de bactéries qui remplissent des fonctions environnementales importantes, telles que l'inhibition des algues. Le triclosan se retrouve également dans le corps des amphibiens et des poissons, où il peut agir comme un perturbateur endocrinien. Des niveaux détectables de triclosan ont également été trouvés dans divers fluides corporels humains, notamment le lait maternel, le plasma et l'urine. 5 En fait, une étude menée par les CDC a révélé des taux détectables de triclosan dans l'urine de 75 % des 2 517 personnes testées en 2003-2004. 6 Cette constatation est d'autant plus troublante qu'il est prouvé que le triclosan peut affecter la fonction immunitaire chez les humains. 7
En décembre 2013, la FDA a donné aux fabricants de savon jusqu'en 2016 pour prouver que les savons antibactériens offrent un avantage significatif par rapport aux savons traditionnels ; s'ils n'y parviennent pas, les fabricants seront contraints de retirer ces produits du marché.
Exercice\(\PageIndex{1}\)
Pourquoi le triclosan ressemble-t-il davantage à un antibiotique qu'à un désinfectant traditionnel ?
Métaux lourds
Certains des premiers désinfectants et antiseptiques chimiques utilisés étaient des métaux lourds. Les métaux lourds tuent les microbes en se liant aux protéines, inhibant ainsi l'activité enzymatique (Figure\(\PageIndex{3}\)). Les métaux lourds sont oligodynamiques, ce qui signifie que de très faibles concentrations présentent une activité antimicrobienne significative. Les ions de métaux lourds se lient fortement aux acides aminés soufrés et s'accumulent dans les cellules, ce qui permet à ces métaux d'atteindre des concentrations localisées élevées. Cela provoque la dénaturation des protéines.
Les métaux lourds ne sont pas sélectivement toxiques pour les cellules microbiennes. Ils peuvent également se bioaccumuler dans les cellules humaines ou animales, et des concentrations excessives peuvent avoir des effets toxiques sur les humains. Si trop d'argent s'accumule dans le corps, par exemple, cela peut entraîner une affection appelée argyrie, dans laquelle la peau vire de façon irréversible au bleu-gris. L'un des moyens de réduire la toxicité potentielle des métaux lourds consiste à contrôler soigneusement la durée de l'exposition et la concentration du métal lourd.

Mercure
Le mercure est un exemple de métal lourd utilisé depuis de nombreuses années pour contrôler la croissance microbienne. Il a été utilisé pendant de nombreux siècles pour traiter la syphilis. Les composés du mercure tels que le chlorure mercurique sont principalement bactériostatiques et ont un très large spectre d'activité. Diverses formes de mercure se lient aux acides aminés soufrés contenus dans les protéines, inhibant ainsi leurs fonctions.
Au cours des dernières décennies, l'utilisation de tels composés a diminué en raison de la toxicité du mercure. Il est toxique pour les systèmes nerveux central, digestif et rénal à de fortes concentrations et a des effets environnementaux négatifs, y compris la bioaccumulation chez les poissons. Des antiseptiques topiques tels que le mercurochrome, qui contient du mercure en faibles concentrations, et le merthiolate, une teinture (solution de mercure dissous dans de l'alcool) étaient autrefois couramment utilisés. Toutefois, en raison des préoccupations liées à l'utilisation de composés du mercure, ces antiseptiques ne sont plus vendus aux États-Unis.
Argent
L'argent est utilisé depuis longtemps comme antiseptique. Dans l'Antiquité, l'eau potable était stockée dans des cruches en argent. 8 La crème Silvadene est couramment utilisée pour traiter les plaies topiques et est particulièrement utile pour prévenir l'infection des brûlures. Des gouttes de nitrate d'argent étaient autrefois appliquées régulièrement sur les yeux des nouveau-nés pour les protéger contre l'ophtalmie néonatoriale, des infections oculaires pouvant survenir à la suite d'une exposition à des agents pathogènes dans le canal génital, mais les crèmes antibiotiques sont aujourd'hui plus couramment utilisées. L'argent est souvent associé à des antibiotiques, ce qui rend les antibiotiques des milliers de fois plus efficaces. 9 L'argent est également couramment incorporé dans les cathéters et les bandages, ce qui les rend antimicrobiens ; toutefois, des preuves indiquent que les métaux lourds peuvent également améliorer la sélection pour la résistance aux antibiotiques. 10
Cuivre, nickel et zinc
Plusieurs autres métaux lourds présentent également une activité antimicrobienne. Le sulfate de cuivre est un algicide couramment utilisé pour contrôler la croissance des algues dans les piscines et les aquariums. L'utilisation de cuivre métallique pour minimiser la croissance microbienne est également de plus en plus répandue. Les revêtements en cuivre des incubateurs contribuent à réduire la contamination des cultures cellulaires. L'utilisation de pots en cuivre pour le stockage de l'eau dans les pays sous-développés fait l'objet d'études afin de lutter contre les maladies diarrhéiques. Les revêtements en cuivre sont également de plus en plus populaires pour les objets fréquemment manipulés tels que les poignées de porte, la quincaillerie d'armoires et autres accessoires dans les établissements de santé afin de réduire la propagation des microbes.
Les revêtements de nickel et de zinc sont désormais utilisés de la même manière. D'autres formes de zinc, notamment le chlorure de zinc et l'oxyde de zinc, sont également utilisées dans le commerce. Le chlorure de zinc est sans danger pour l'homme et se trouve couramment dans les bains de bouche, ce qui augmente considérablement leur durée d'efficacité. L'oxyde de zinc est présent dans divers produits, y compris les crèmes antiseptiques topiques telles que les lotions à la calamine, les pommades pour couches, les poudres pour bébés et les shampooings antipelliculaires.
Exercice\(\PageIndex{2}\)
Pourquoi de nombreux métaux lourds sont-ils à la fois antimicrobiens et toxiques pour l'homme ?
Halogènes
Les autres produits chimiques couramment utilisés pour la désinfection sont les halogènes, l'iode, le chlore et le fluor. L'iode agit en oxydant les composants cellulaires, y compris les acides aminés, les nucléotides et les acides gras contenant du soufre, et en déstabilisant les macromolécules qui contiennent ces molécules. Il est souvent utilisé comme teinture topique, mais il peut provoquer des taches ou une irritation de la peau. Un iodophore est un composé d'iode complexé avec une molécule organique, augmentant ainsi la stabilité de l'iode et, par conséquent, son efficacité. Un iodophore courant est la povidone iodée, qui contient un agent mouillant qui libère de l'iode relativement lentement. La bétadine est une marque de povidone iodée couramment utilisée comme gommage pour les mains par le personnel médical avant une intervention chirurgicale et pour l'antisepsie topique de la peau d'un patient avant l'incision (Figure\(\PageIndex{4}\)).
Le chlore est un autre halogène couramment utilisé pour la désinfection. Lorsque le chlore gazeux est mélangé à de l'eau, il produit un oxydant puissant appelé acide hypochloreux, qui n'est pas chargé et pénètre facilement dans les cellules. Le chlore gazeux est couramment utilisé dans les usines municipales de traitement de l'eau potable et des eaux usées, l'acide hypochloreux qui en résulte produisant l'effet antimicrobien réel. Les personnes travaillant dans les installations de traitement de l'eau doivent prendre grand soin de minimiser leur exposition personnelle au chlore gazeux. L'hypochlorite de sodium est le composant chimique des agents de blanchiment domestiques courants et il est également utilisé à des fins de désinfection très diverses. Les sels d'hypochlorite, y compris les hypochlorites de sodium et de calcium, sont utilisés pour désinfecter les piscines. Le chlore gazeux, l'hypochlorite de sodium et l'hypochlorite de calcium sont également des désinfectants couramment utilisés dans les industries de la transformation des aliments et de la restauration pour réduire la propagation des maladies d'origine alimentaire. Les travailleurs de ces industries doivent également veiller à utiliser correctement ces produits afin de garantir leur propre sécurité ainsi que celle des consommateurs. Une récente déclaration conjointe publiée par l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO) et l'OMS a indiqué qu'aucune des nombreuses utilisations bénéfiques des produits chlorés dans la transformation des aliments pour réduire la propagation des maladies d'origine alimentaire ne présentait de risque pour les consommateurs. 11
Une autre classe de composés chlorés appelés chloramines est largement utilisée comme désinfectants. Les chloramines sont relativement stables et libèrent du chlore sur de longues périodes. Les chloramines sont des dérivés de l'ammoniac par substitution d'un, de deux ou des trois atomes d'hydrogène par des atomes de chlore (Figure\(\PageIndex{5}\)).
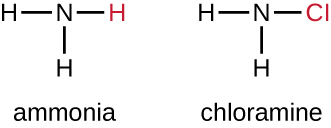
Les chloramines et autres composés de la cholorine peuvent être utilisés pour la désinfection de l'eau potable, et les militaires utilisent fréquemment des comprimés de chloramine à cette fin. Après une catastrophe naturelle ou tout autre événement compromettant l'approvisionnement public en eau, le CDC recommande de désinfecter l'eau du robinet en ajoutant de petites quantités d'eau de javel ordinaire. Des recherches récentes suggèrent que le dichloroisocyanurate de sodium (NaDCC) pourrait également être une bonne alternative pour la désinfection de l'eau potable. Actuellement, les comprimés de NaDCC sont disponibles pour un usage général et pour les militaires, les campeurs ou les personnes ayant des besoins urgents ; pour ces utilisations, le NaDCC est préférable aux comprimés de chloramine. Le dioxyde de chlore, un agent gazeux utilisé pour la fumigation et la stérilisation des espaces clos, est également couramment utilisé pour la désinfection de l'eau.
Bien que les composés chlorés soient des désinfectants relativement efficaces, ils présentent des inconvénients. Certains peuvent irriter la peau, le nez ou les yeux de certaines personnes, et ils peuvent ne pas éliminer complètement certains organismes résistants présents dans l'eau potable contaminée. Le champignon Cryptosporidium, par exemple, possède une enveloppe extérieure protectrice qui le rend résistant aux désinfectants chlorés. Ainsi, il est recommandé de faire bouillir l'eau potable dans les situations d'urgence lorsque cela est possible.
Le fluor halogène est également connu pour ses propriétés antimicrobiennes qui contribuent à la prévention des caries dentaires (caries). 12 Le fluorure est le principal ingrédient actif des dentifrices et est également couramment ajouté à l'eau du robinet pour aider les communautés à maintenir leur santé buccodentaire. Chimiquement, le fluorure peut être incorporé à l'hydroxyapatite de l'émail dentaire, ce qui le rend plus résistant aux acides corrosifs produits par la fermentation des microbes oraux. Le fluorure améliore également l'absorption des ions calcium et phosphate dans l'émail dentaire, favorisant ainsi la reminéralisation. En plus de renforcer l'émail, le fluorure semble également être bactériostatique. Il s'accumule dans les bactéries formant des plaques, interférant avec leur métabolisme et réduisant leur production d'acides responsables de la carie dentaire.
Exercice\(\PageIndex{3}\)
Quel est l'avantage d'une chloramine par rapport à l'hypochlorite pour la désinfection ?
Alcools
Les alcools constituent un autre groupe de produits chimiques couramment utilisés comme désinfectants et antiseptiques. Ils agissent en dénaturant rapidement les protéines, ce qui inhibe le métabolisme cellulaire, et en perturbant les membranes, ce qui entraîne la lyse cellulaire. Une fois dénaturées, les protéines peuvent se replier si suffisamment d'eau est présente dans la solution. Les alcools sont généralement utilisés à des concentrations d'environ 70 % en solution aqueuse et, en fait, ils fonctionnent mieux dans des solutions aqueuses que dans des solutions alcooliques à 100 %. Cela est dû au fait que les alcools coagulent les protéines. À des concentrations d'alcool plus élevées, la coagulation rapide des protéines de surface empêche la pénétration efficace des cellules. Les alcools les plus couramment utilisés pour la désinfection sont l'alcool éthylique (éthanol) et l'alcool isopropylique (isopropanol, alcool à friction) (Figure\(\PageIndex{6}\)).
Les alcools ont tendance à être bactéricides et fongicides, mais ils peuvent également être viricides uniquement pour les virus enveloppés. Bien que les alcools ne soient pas sporicides, ils inhibent les processus de sporulation et de germination. Les alcools sont volatils et sèchent rapidement, mais ils peuvent également irriter la peau car ils déshydratent la peau au site d'application. L'une des utilisations cliniques courantes des alcools consiste à prélever des écouvillons sur la peau pour la dégermer avant l'injection à l'aiguille. Les alcools sont également les ingrédients actifs des désinfectants instantanés pour les mains, qui ont gagné en popularité ces dernières années. L'alcool contenu dans ces désinfectants pour les mains agit à la fois en dénaturant les protéines et en perturbant la membrane cellulaire microbienne, mais il n'agit pas efficacement en présence de saleté visible.
Enfin, les alcools sont utilisés pour fabriquer des teintures contenant d'autres antiseptiques, tels que les teintures iodées décrites précédemment dans ce chapitre. Dans l'ensemble, les alcools sont peu coûteux et très efficaces pour la désinfection d'un large éventail de microbes végétatifs. Cependant, l'un des inconvénients des alcools est leur grande volatilité, limitant leur efficacité juste après l'application.

Exercice\(\PageIndex{4}\)
- Citez au moins trois avantages des alcools en tant que désinfectants.
- Décrire plusieurs applications spécifiques des alcools utilisés dans les produits désinfectants.
Tensioactifs
Les agents tensioactifs, ou tensioactifs, sont un groupe de composés chimiques qui abaissent la tension superficielle de l'eau. Les tensioactifs sont les principaux ingrédients des savons et des détergents. Les savons sont des sels d'acides gras à longue chaîne et possèdent des régions polaires et non polaires, ce qui leur permet d'interagir avec les régions polaires et non polaires d'autres molécules (Figure\(\PageIndex{7}\)). Ils peuvent interagir avec les huiles et les graisses non polaires pour créer des émulsions dans l'eau, détachant et éliminant la saleté et les microbes des surfaces et de la peau. Les savons ne tuent pas et n'inhibent pas la croissance microbienne et ne sont donc pas considérés comme des antiseptiques ou des désinfectants. Cependant, l'utilisation appropriée des savons élimine mécaniquement les microorganismes, dégermant ainsi efficacement une surface. Certains savons contiennent des agents bactériostatiques ajoutés tels que le triclocarban ou le cloflucarban, des composés structurellement apparentés au triclosan, qui confèrent aux savons des propriétés antiseptiques ou désinfectantes.
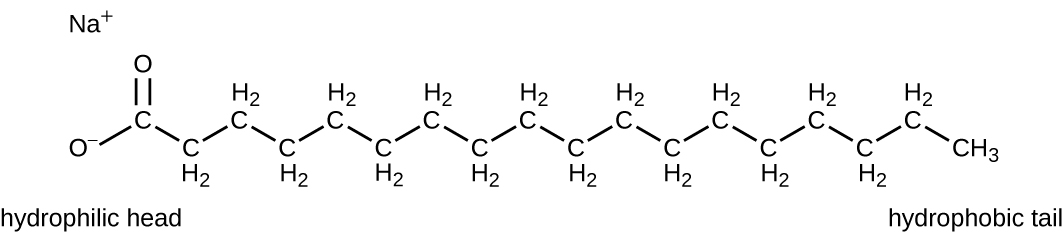
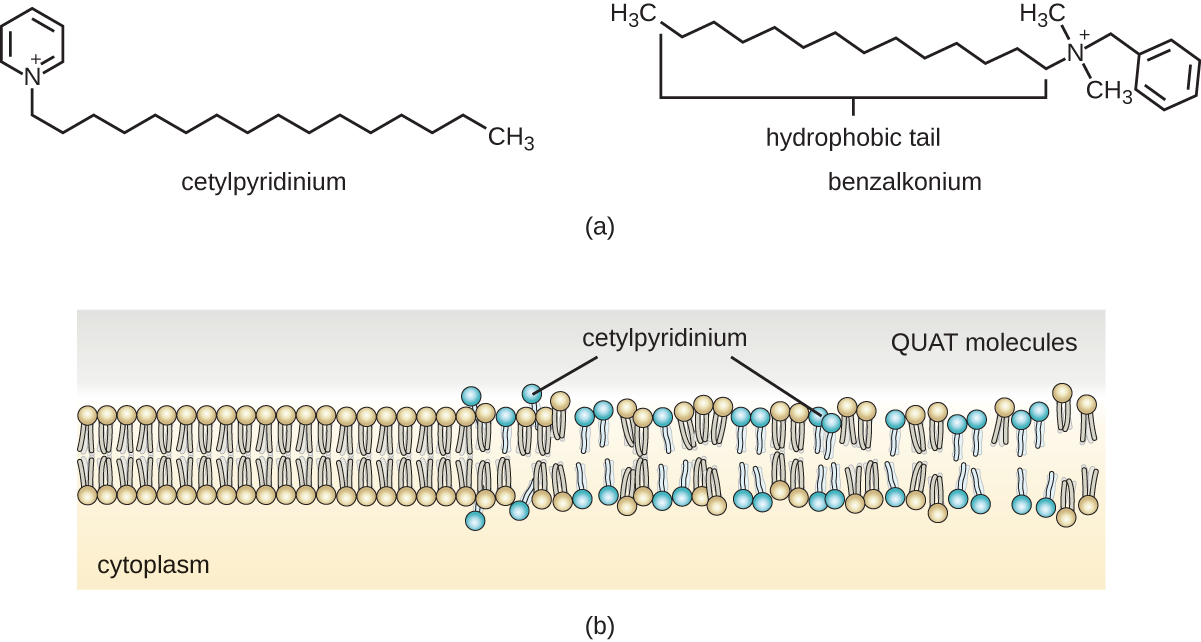
Les savons, cependant, forment souvent des films difficiles à éliminer, en particulier dans l'eau dure, qui contient de fortes concentrations de sels minéraux de calcium et de magnésium. Les détergents contiennent des molécules de tensioactifs synthétiques avec des régions polaires et non polaires qui ont une forte activité nettoyante mais sont plus solubles, même dans l'eau dure, et ne laissent donc aucun dépôt savonneux. Les détergents anioniques, tels que ceux utilisés pour le linge, ont un anion chargé négativement à une extrémité attaché à une longue chaîne hydrophobe, tandis que les détergents cationiques ont un cation chargé positivement à la place. Les détergents cationiques comprennent une classe importante de désinfectants et d'antiseptiques appelés sels d'ammonium quaternaire (quats), nommés d'après l'atome d'azote quaternaire caractéristique qui confère la charge positive (Figure\(\PageIndex{8}\)). Dans l'ensemble, les quats ont des propriétés similaires à celles des phospholipides, avec des extrémités hydrophiles et hydrophobes. Ainsi, les quats ont la capacité de s'insérer dans la bicouche de phospholipides bactériens et de perturber l'intégrité de la membrane. La charge cationique des quats semble conférer leurs propriétés antimicrobiennes, qui sont diminuées lorsqu'ils sont neutralisés. Les quats ont plusieurs propriétés utiles. Ils sont stables, non toxiques, peu coûteux, incolores, inodores et sans goût. Ils ont tendance à être bactéricides en perturbant les membranes. Elles sont également actives contre les champignons, les protozoaires et les virus enveloppés, mais les endospores ne sont pas affectées. En milieu clinique, ils peuvent être utilisés comme antiseptiques ou pour désinfecter des surfaces. Des mélanges de quats sont également couramment présents dans les nettoyants et désinfectants ménagers, y compris de nombreuses formulations actuelles de produits de marque Lysol, qui contiennent des chlorures de benzalkonium comme ingrédients actifs. Les chlorures de benzalkonium, ainsi que le chlorure de quat cétylpyrimidine, sont également présents dans des produits tels que les antiseptiques cutanés, les rinçages oraux et les bains de bouche.
Exercice\(\PageIndex{5}\)
Pourquoi les savons ne sont-ils pas considérés comme des désinfectants ?
Se laver les mains de la bonne façon
Le lavage des mains est essentiel pour la santé publique et doit être mis en avant en milieu clinique. Pour le grand public, les CDC recommandent de se laver les mains avant, pendant et après la manipulation des aliments ; avant de manger ; avant et après avoir interagi avec une personne malade ; avant et après le traitement d'une plaie ; après être allé aux toilettes ou avoir changé les couches ; après avoir toussé, éternué ou mouché ; après avoir manipulé des ordures ; et après avoir interagi avec un animal, sa nourriture ou ses déchets. La figure\(\PageIndex{9}\) illustre les cinq étapes d'un lavage des mains approprié recommandées par le CDC.
Le lavage des mains est encore plus important pour les professionnels de santé, qui doivent se laver soigneusement les mains entre chaque contact avec le patient, après avoir retiré leurs gants, après avoir été en contact avec des fluides corporels et des vecteurs potentiellement infectieux, et avant et après avoir assisté un chirurgien lors d'interventions invasives. Même avec le port d'une tenue chirurgicale appropriée, y compris des gants, le gommage en vue d'une intervention chirurgicale est plus complexe que le lavage des mains de routine. L'objectif du gommage chirurgical est de réduire le microbiote normal à la surface de la peau afin de prévenir l'introduction de ces microbes dans les plaies chirurgicales du patient.
Il n'existe pas de protocole unique largement accepté pour le gommage chirurgical. Les protocoles relatifs à la durée du nettoyage peuvent dépendre de l'antimicrobien utilisé ; les professionnels de santé doivent toujours vérifier les recommandations du fabricant. Selon l'Association des technologues en chirurgie (AST), les gommages chirurgicaux peuvent être effectués avec ou sans brosse (Figure\(\PageIndex{9}\)).
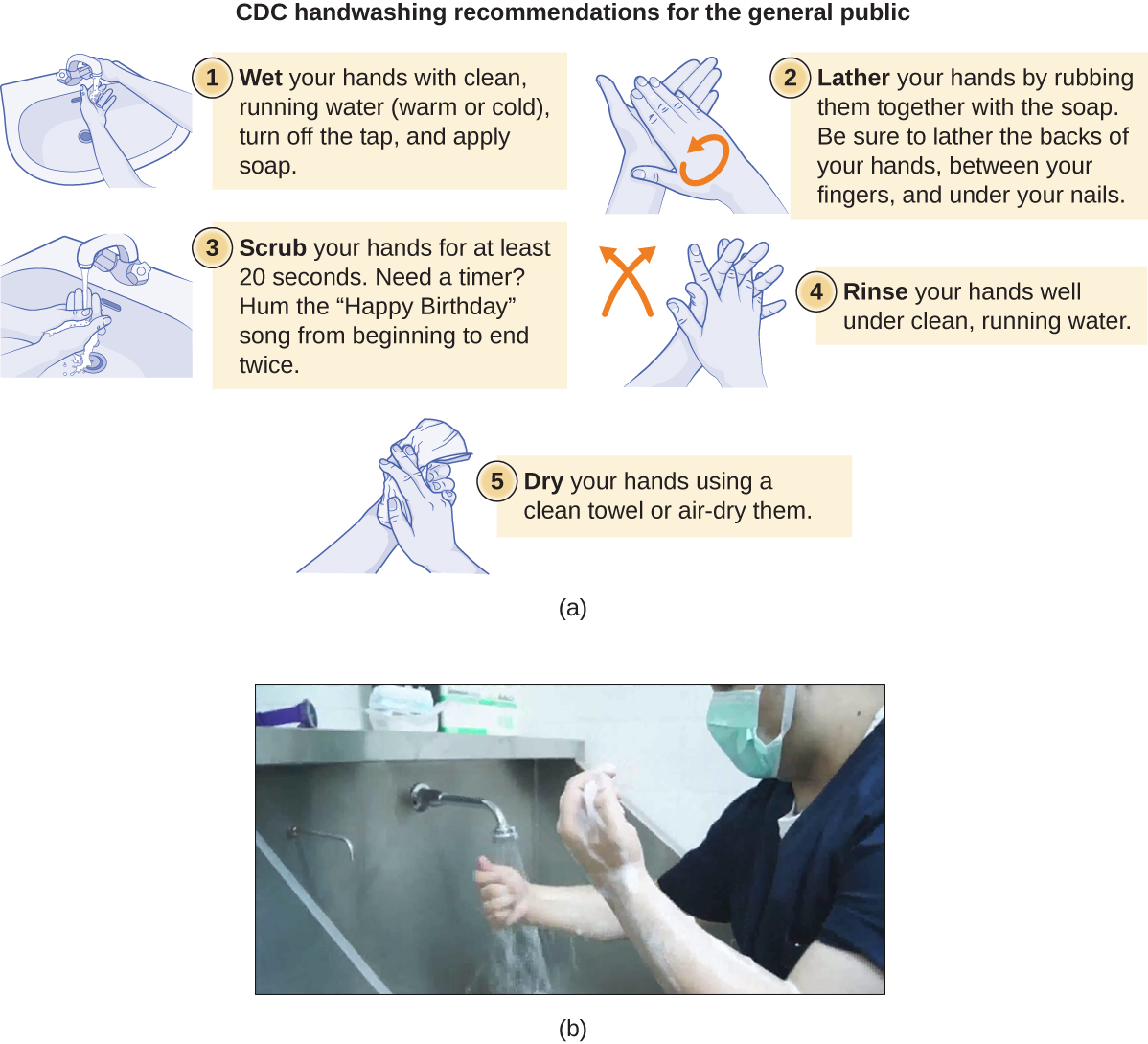
Pour en savoir plus sur le lavage correct des mains, visitez le site Web du CDC.
Bisbiguanides
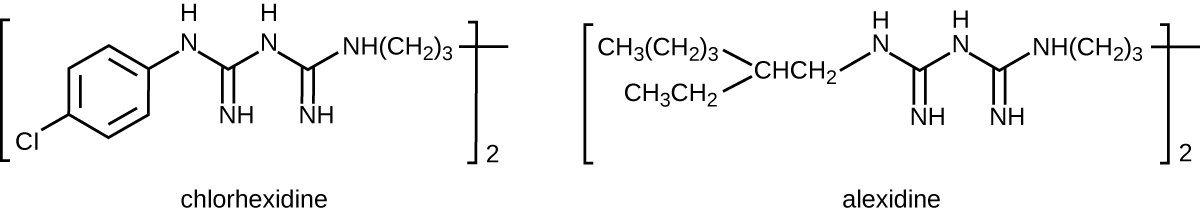
Les bisbiguanides ont été synthétisés pour la première fois au 20e siècle et sont des molécules cationiques (chargées positivement) connues pour leurs propriétés antiseptiques (Figure\(\PageIndex{10}\)). La chlorhexidine est un antiseptique important à base de bisbiguanide. Il possède une activité à large spectre contre les levures, les bactéries gram-positives et les bactéries gram-négatives, à l'exception de Pseudomonas aeruginosa, qui peut développer une résistance lors d'expositions répétées. 13 La chlorhexidine perturbe les membranes cellulaires et est bactériostatique à de faibles concentrations ou bactéricide à des concentrations plus élevées, ce qui provoque en fait la congélation du contenu cytoplasmique des cellules. Il a également une activité contre les virus enveloppés. Cependant, la chlorhexidine est peu efficace contre Mycobacterium tuberculosis et les virus non enveloppés, et elle n'est pas sporicide. La chlorhexidine est généralement utilisée en milieu clinique comme gommage chirurgical et pour d'autres besoins de lavage des mains pour le personnel médical, ainsi que pour l'antisepsie topique des patients avant une intervention chirurgicale ou une injection d'aiguille. Il est plus persistant que les iodophores et possède une activité antimicrobienne durable. Les solutions de chlorhexidine peuvent également être utilisées comme rinçages oraux après des interventions orales ou pour traiter la gingivite. Un autre bisbiguanide, l'alexidine, gagne en popularité en tant que gommage chirurgical et rince-bouche car il agit plus rapidement que la chlorhexidine.
Exercice\(\PageIndex{6}\)
Quels sont les deux effets de la chlorhexidine sur les cellules bactériennes ?
Agents alkylants
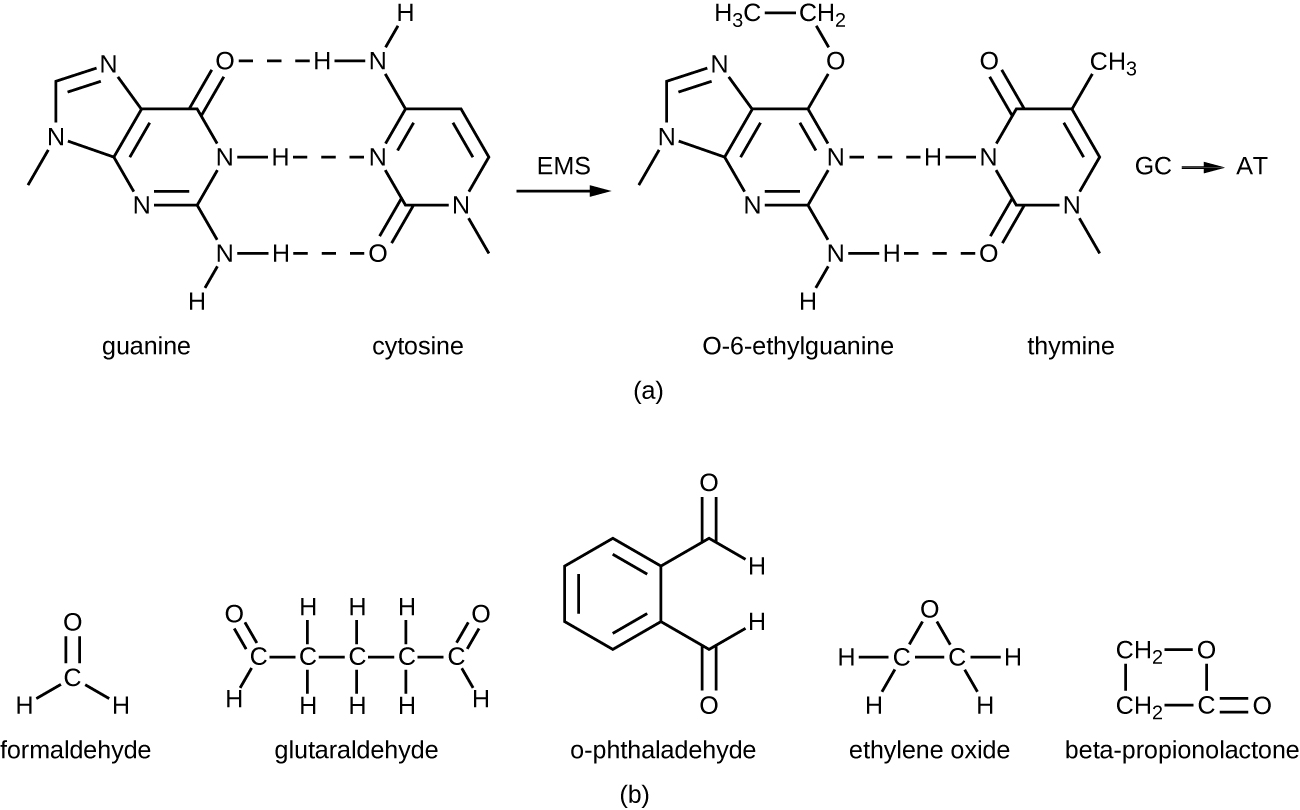
Les agents alkylants sont un groupe de produits chimiques désinfectants puissants qui agissent en remplaçant un atome d'hydrogène au sein d'une molécule par un groupe alkyle (C n H 2n+1), inactivant ainsi les enzymes et les acides nucléiques (Figure\(\PageIndex{11}\)). L'agent alkylant formaldéhyde (CH 2 OH) est couramment utilisé en solution à une concentration de 37 % (connu sous le nom de formol) ou comme désinfectant gazeux et biocide. Il s'agit d'un désinfectant et biocide puissant à large spectre qui a la capacité de tuer les bactéries, les virus, les champignons et les endospores, ce qui entraîne une stérilisation à basse température, ce qui constitue parfois une alternative pratique aux méthodes de stérilisation thermique qui demandent plus de main-d'œuvre. Il permet également de réticuler les protéines et a été largement utilisé comme fixateur chimique. De ce fait, il est utilisé pour le stockage d'échantillons de tissus et comme liquide d'embaumement. Il a également été utilisé pour inactiver les agents infectieux dans la préparation de vaccins. Le formaldéhyde est très irritant pour les tissus vivants et est également cancérigène ; il n'est donc pas utilisé comme antiseptique.
Le glutaraldéhyde a une structure similaire au formaldéhyde mais possède deux groupes aldéhydes réactifs, ce qui lui permet d'agir plus rapidement que le formaldéhyde. Il est couramment utilisé comme solution à 2 % pour la stérilisation et est commercialisé sous la marque Cidex. Il est utilisé pour désinfecter une variété de surfaces et d'équipements chirurgicaux et médicaux. Cependant, comme le formaldéhyde, le glutaraldéhyde irrite la peau et n'est pas utilisé comme antiseptique.
Un nouveau type de désinfectant qui gagne en popularité pour la désinfection des équipements médicaux est l'o-phtalaldéhyde (OPA), que l'on trouve dans certaines nouvelles formulations de Cidex et de produits similaires, en remplacement du glutaraldéhyde. L'o-phtalaldéhyde possède également deux groupes aldéhydes réactifs, mais ils sont liés par un pont aromatique. o -On pense que le phtalaldéhyde agit de la même manière que le glutaraldéhyde et le formaldéhyde, mais il est beaucoup moins irritant pour la peau et les voies nasales, produit une odeur minimale, ne nécessite pas de traitement avant utilisation et est plus efficace contre les mycobactéries.
L'oxyde d'éthylène est un type d'agent alkylant utilisé pour la stérilisation gazeuse. Il est hautement pénétrant et peut stériliser des articles contenus dans des sacs en plastique tels que des cathéters, des articles jetables dans les laboratoires et les cliniques (comme les boîtes de Pétri emballées) et d'autres équipements. L'exposition à l'oxyde d'éthylène est une forme de stérilisation à froid, ce qui la rend utile pour la stérilisation d'articles sensibles à la chaleur. L'utilisation de l'oxyde d'éthylène doit toutefois être très prudente ; il est cancérigène, comme les autres agents alkylants, et est également très explosif. Avec une utilisation prudente et une aération adéquate des produits après le traitement, l'oxyde d'éthylène est très efficace, et les stérilisateurs à oxyde d'éthylène sont couramment utilisés dans les établissements médicaux pour stériliser les matériaux emballés.
La β-propionolactone est un agent alkylant dont la structure chimique est différente de celle des autres agents déjà discutés. Comme les autres agents alkylants, la β-propionolactone se lie à l'ADN, l'inactivant ainsi (Figure\(\PageIndex{11}\)). C'est un liquide clair à forte odeur qui a la capacité de tuer les endospores. À ce titre, il a été utilisé sous forme liquide ou sous forme de vapeur pour la stérilisation d'instruments médicaux et de greffes de tissus, et c'est un composant courant des vaccins, utilisé pour maintenir leur stérilité. Il a également été utilisé pour la stérilisation du bouillon nutritif, ainsi que du plasma sanguin, du lait et de l'eau. Il est rapidement métabolisé par les animaux et les humains en acide lactique. Cependant, il est également irritant et peut entraîner des lésions permanentes des yeux, des reins ou du foie. De plus, il s'est avéré cancérogène chez les animaux ; des précautions sont donc nécessaires pour minimiser l'exposition humaine à la β-propionolactone. 14
Exercice\(\PageIndex{7}\)
- À quelle réaction chimique les agents alkylants participent-ils ?
- Pourquoi les agents alkylants ne sont-ils pas utilisés comme antiseptiques ?
Prions de Diehard
Les prions, les protéines acellulaires mal repliées responsables de maladies incurables et mortelles telles que le kuru et la maladie de Creutzfeldt-Jakob (voir Viroïdes, virusoïdes et prions), sont connus pour être difficiles à détruire. Les prions sont extrêmement résistants à la chaleur, aux produits chimiques et aux radiations. Ils sont également extrêmement infectieux et mortels ; par conséquent, la manipulation et l'élimination des articles infectés par des prions nécessitent une formation approfondie et une extrême prudence.
Les méthodes classiques de désinfection peuvent réduire mais non éliminer l'infectiosité des prions. L'autoclavage n'est pas totalement efficace, pas plus que les produits chimiques tels que le phénol, les alcools, le formol et la β-propiolactone. Même lorsqu'ils sont fixés dans du formol, les tissus du cerveau et de la moelle épinière affectés restent infectieux.
Le personnel qui manipule des échantillons ou des équipements contaminés ou qui travaille avec des patients infectés doit porter un manteau de protection, une protection faciale et des gants résistants aux coupures. Tout contact avec la peau doit être immédiatement lavé avec un détergent et de l'eau chaude sans frotter. La peau doit ensuite être lavée avec du NaOH 1 N ou une dilution d'eau de javel à 1:10 pendant 1 minute. Les déchets contaminés doivent être incinérés ou autoclavés dans une solution basique forte, et les instruments doivent être nettoyés et trempés dans une solution basique forte.
Peroxygènes
Les peroxygènes sont des agents oxydants puissants qui peuvent être utilisés comme désinfectants ou antiseptiques. Le peroxygène le plus utilisé est le peroxyde d'hydrogène (H 2 O 2), qui est souvent utilisé en solution pour désinfecter les surfaces et peut également être utilisé comme agent gazeux. Les solutions de peroxyde d'hydrogène sont des antiseptiques cutanés peu coûteux qui se décomposent en eau et en oxygène gazeux, tous deux sans danger pour l'environnement. Cette décomposition étant accélérée en présence de lumière, les solutions de peroxyde d'hydrogène sont généralement vendues dans des bouteilles brunes ou opaques. L'un des inconvénients de l'utilisation du peroxyde d'hydrogène comme antiseptique est qu'il cause également des dommages à la peau qui peuvent retarder la cicatrisation ou provoquer des cicatrices. Les nettoyants pour lentilles de contact contiennent souvent du peroxyde d'hydrogène comme désinfectant.
Le peroxyde d'hydrogène agit en produisant des radicaux libres qui endommagent les macromolécules cellulaires. Le peroxyde d'hydrogène a une activité à large spectre et agit contre les bactéries gram-positives et gram-négatives (avec une efficacité légèrement supérieure contre les bactéries gram-positives), les champignons, les virus et les endospores. Cependant, les bactéries qui produisent les enzymes détoxifiant l'oxygène, la catalase ou la peroxydase, peuvent avoir une tolérance inhérente à de faibles concentrations de peroxyde d'hydrogène (Figure\(\PageIndex{12}\)). Pour tuer les endospores, il faut augmenter la durée d'exposition ou la concentration des solutions de peroxyde d'hydrogène. Le peroxyde d'hydrogène gazeux a une plus grande efficacité et peut être utilisé comme stérilisant pour les pièces ou les équipements.

Le plasma, un gaz chaud et ionisé, décrit comme le quatrième état de la matière, est utile pour stériliser le matériel car il pénètre les surfaces et tue les cellules végétatives et les endospores. Le peroxyde d'hydrogène et l'acide peracétique, un autre peroxygène couramment utilisé, peuvent chacun être introduits sous forme de plasma. L'acide peracétique peut être utilisé comme stérilisant liquide ou plasmatique dans la mesure où il tue facilement les endospores, est plus efficace que le peroxyde d'hydrogène même à des concentrations relativement faibles et est insensible à l'inactivation par les catalases et les peroxydases. Il se décompose également en composés inoffensifs pour l'environnement ; dans ce cas, l'acide acétique et l'oxygène.
D'autres exemples de peroxygènes incluent le peroxyde de benzoyle et le peroxyde de carbamide. Le peroxyde de benzoyle est un peroxygène utilisé dans les solutions médicamenteuses contre l'acné. Il tue la bactérie Propionibacterium acnes, associée à l'acné. Le peroxyde de carbamide, un ingrédient utilisé dans les dentifrices, est un peroxygène qui combat les biofilms oraux responsables de la décoloration des dents et de l'halitose (mauvaise haleine). 15 Enfin, l'ozone est un peroxygène ayant des propriétés désinfectantes et est utilisé pour purifier l'air ou l'eau. Dans l'ensemble, les peroxygènes sont très efficaces et couramment utilisés, sans danger environnemental associé.
Exercice\(\PageIndex{8}\)
Comment les peroxydes tuent-ils les cellules ?
Fluides supercritiques
Au cours des 15 dernières années, l'utilisation de fluides supercritiques, en particulier de dioxyde de carbone supercritique (ScCO 2), a gagné en popularité pour certaines applications de stérilisation. Lorsque le dioxyde de carbone est amené à environ 10 fois la pression atmosphérique, il atteint un état supercritique dont les propriétés physiques se situent entre celles des liquides et des gaz. Les matériaux placés dans une chambre dans laquelle le dioxyde de carbone est ainsi pressurisé peuvent être stérilisés en raison de la capacité du ScCO 2 à pénétrer les surfaces.
Le dioxyde de carbone supercritique agit en pénétrant dans les cellules et en formant de l'acide carbonique, abaissant ainsi considérablement le pH des cellules. Cette technique est efficace contre les cellules végétatives et est également utilisée en combinaison avec de l'acide peracétique pour tuer les endospores. Son efficacité peut également être augmentée par une augmentation de la température ou par des cycles rapides de pressurisation et de dépressurisation, qui sont plus susceptibles de produire une lyse cellulaire.
Les avantages du ScCO 2 incluent les propriétés non réactives, non toxiques et ininflammables du dioxyde de carbone, et ce protocole est efficace à basse température. Contrairement à d'autres méthodes, telles que la chaleur et l'irradiation, qui peuvent dégrader l'objet à stériliser, l'utilisation du ScCO 2 préserve l'intégrité de l'objet et est couramment utilisé pour traiter les aliments (y compris les épices et les jus) et les dispositifs médicaux tels que les endoscopes. Il gagne également en popularité pour désinfecter les tissus tels que la peau, les os, les tendons et les ligaments avant la transplantation. Le ScCo 2 peut également être utilisé pour la lutte antiparasitaire car il peut tuer les œufs et les larves d'insectes contenus dans les produits.
Exercice\(\PageIndex{9}\)
Pourquoi l'utilisation du dioxyde de carbone supercritique gagne-t-elle en popularité à des fins commerciales et médicales ?
Conservateurs alimentaires chimiques
Les agents de conservation chimiques sont utilisés pour inhiber la croissance microbienne et minimiser la détérioration de certains aliments. Les agents de conservation chimiques couramment utilisés comprennent l'acide sorbique, l'acide benzoïque et l'acide propionique, ainsi que leurs sels les plus solubles, le sorbate de potassium, le benzoate de sodium et le propionate de calcium, qui sont tous utilisés pour contrôler la croissance des moisissures dans les aliments acides. Chacun de ces agents de conservation est non toxique et facilement métabolisé par l'homme. Ils sont également sans saveur, de sorte qu'ils ne compromettent pas la saveur des aliments qu'ils conservent.
Les acides sorbique et benzoïque présentent une efficacité accrue lorsque le pH diminue. On pense que l'acide sorbique agit en inhibant diverses enzymes cellulaires, y compris celles du cycle de l'acide citrique, ainsi que les catalases et les peroxydases. Il est ajouté comme agent de conservation dans une grande variété d'aliments, y compris les produits laitiers, le pain, les fruits et les légumes. L'acide benzoïque se trouve naturellement dans de nombreux types de fruits et de baies, d'épices et de produits fermentés. On pense qu'il agit en diminuant le pH intracellulaire, en interférant avec des mécanismes tels que la phosphorylation oxydative et l'absorption de molécules telles que les acides aminés dans les cellules. Les aliments conservés avec de l'acide benzoïque ou du benzoate de sodium comprennent les jus de fruits, les confitures, les glaces, les pâtisseries, les boissons gazeuses, les gommes à mâcher et les cornichons.
On pense que l'acide propionique inhibe les enzymes et diminue le pH intracellulaire, agissant de la même manière que l'acide benzoïque. Cependant, l'acide propionique est un agent de conservation plus efficace à un pH plus élevé que l'acide sorbique ou l'acide benzoïque. L'acide propionique est produit naturellement par certains fromages pendant leur maturation et est ajouté à d'autres types de fromage et de produits de boulangerie pour prévenir la contamination par les moisissures. Il est également ajouté à la pâte crue pour éviter la contamination par la bactérie Bacillus mesentericus, qui rend le pain tordu.
Les autres agents de conservation chimiques couramment utilisés incluent le dioxyde de soufre et les nitrites. Le dioxyde de soufre empêche le brunissement des aliments et est utilisé pour la conservation des fruits secs ; il est utilisé en vinification depuis l'Antiquité. Le dioxyde de soufre se dissout facilement dans l'eau et forme des sulfites. Bien que les sulfites puissent être métabolisés par l'organisme, certaines personnes sont allergiques aux sulfites, y compris des réactions asthmatiques. De plus, les sulfites dégradent la thiamine, un nutriment important de certains aliments. Le mode d'action des sulfites n'est pas tout à fait clair, mais ils peuvent interférer avec la formation de la liaison disulfure (voir Figure 7.4.5) dans les protéines, inhibant ainsi l'activité enzymatique. Ils peuvent également réduire le pH intracellulaire de la cellule, interférant ainsi avec les mécanismes entraînés par la force motrice des protons.
Des nitrites sont ajoutés aux viandes transformées pour conserver leur couleur et arrêter la germination des endospores de Clostridium botulinum. Les nitrites sont réduits en oxyde nitrique, qui réagit avec les groupes hèmes et les groupes fer-soufre. Lorsque l'oxyde nitrique réagit avec le groupe hème contenu dans la myoglobine des viandes, un produit rouge se forme, donnant à la viande sa couleur rouge. On pense également que lorsque l'acide nitrique réagit avec la ferrédoxine, une enzyme fer-soufre, au sein des bactéries, ce support de chaîne de transport d'électrons est détruit, empêchant ainsi la synthèse de l'ATP. Les nitrosamines sont toutefois cancérigènes et peuvent être produites par exposition à la chaleur pendant la cuisson de viandes conservées au nitrite (par exemple, hot dogs, viande à déjeuner, saucisses à déjeuner, bacon, viande en conserve).
Agents de conservation alimentaires chimiques naturels
La découverte de substances antimicrobiennes naturelles produites par d'autres microbes s'est ajoutée à l'arsenal de conservateurs utilisés dans les aliments. La nisine est un peptide antimicrobien produit par la bactérie Lactococcus lactis et est particulièrement efficace contre les organismes à Gram positif. La nisine agit en perturbant la production des parois cellulaires, ce qui rend les cellules plus sujettes à la lyse. Il est utilisé pour conserver les fromages, les viandes et les boissons.
La natamycine est un antibiotique macrolide antifongique produit par la bactérie Streptomyces natalensis. Il a été approuvé par la FDA en 1982 et est utilisé pour prévenir la croissance fongique dans divers types de produits laitiers, y compris le fromage cottage, le fromage tranché et le fromage râpé. La natamycine est également utilisée pour la conservation de la viande dans des pays autres que les États-Unis.
Exercice\(\PageIndex{10}\)
Quels sont les avantages et les inconvénients de l'utilisation de sulfites et de nitrites comme agents de conservation des aliments ?
Concepts clés et résumé
- Les métaux lourds, notamment le mercure, l'argent, le cuivre et le zinc, sont utilisés depuis longtemps pour la désinfection et la conservation, bien que certains d'entre eux présentent des risques de toxicité et environnementaux.
- Les halogènes, notamment le chlore, le fluor et l'iode, sont également couramment utilisés pour la désinfection. Les composés chlorés, notamment l'hypochlorite de sodium, les chloramines et le dioxyde de chlore, sont couramment utilisés pour la désinfection de l'eau. L'iode, sous forme de teinture et d'iodophore, est un antiseptique efficace.
- Les alcools, y compris l'alcool éthylique et l'alcool isopropylique, sont des antiseptiques couramment utilisés qui agissent en dénaturant les protéines et en perturbant les membranes.
- Les composés phénoliques sont des désinfectants stables à action prolongée qui dénaturent les protéines et perturbent les membranes. On les trouve couramment dans les nettoyants ménagers, les bains de bouche et les désinfectants hospitaliers, et ils sont également utilisés pour préserver les récoltes.
- Le composé phénolique triclosan, présent dans les savons antibactériens, les plastiques et les textiles, est techniquement un antibiotique en raison de son mode d'action spécifique qui inhibe la synthèse des acides gras bactériens..
- Les tensioactifs, y compris les savons et les détergents, abaissent la tension superficielle de l'eau pour créer des émulsions qui éliminent mécaniquement les microbes. Les savons sont des acides gras à longue chaîne, tandis que les détergents sont des tensioactifs synthétiques.
- Les composés d'ammonium quaternaire (quats) sont des détergents cationiques qui perturbent les membranes. Ils sont utilisés dans les nettoyants ménagers, les désinfectants pour la peau, les rinçages oraux et les bains de bouche.
- Les bisbiguanides perturbent les membranes cellulaires, provoquant la gélification du contenu cellulaire. La chlorhexidine et l'alexidine sont couramment utilisées pour les gommages chirurgicaux, pour le lavage des mains en milieu clinique et pour les rinçages oraux sur ordonnance.
- Les agents alkylants stérilisent efficacement les matériaux à basse température, mais ils sont cancérigènes et peuvent également irriter les tissus. Le glutaraldéhyde et l'o-phtalaldéhyde sont utilisés comme désinfectants hospitaliers, mais pas comme antiseptiques. Le formaldéhyde est utilisé pour le stockage d'échantillons de tissus, comme liquide d'embaumement et dans la préparation de vaccins pour inactiver les agents infectieux. L'oxyde d'éthylène est un agent de stérilisation des gaz qui peut pénétrer dans les matériaux conditionnés sensibles à la chaleur, mais il est également explosif et cancérigène.
- Les peroxygènes, notamment le peroxyde d'hydrogène, l'acide peracétique, le peroxyde de benzoyle et l'ozone gazeux, sont des agents oxydants puissants qui produisent des radicaux libres dans les cellules et endommagent leurs macromolécules. Ils sont sans danger pour l'environnement et sont des désinfectants et des antiseptiques très efficaces.
- Le dioxyde de carbone sous pression sous forme de fluide supercritique pénètre facilement dans les matériaux conditionnés et les cellules, formant de l'acide carbonique et abaissant le pH intracellulaire. Le dioxyde de carbone supercritique est non réactif, non toxique, ininflammable et efficace à basse température pour la stérilisation des dispositifs médicaux, des implants et des tissus greffés.
- Des agents de conservation chimiques sont ajoutés à une variété d'aliments. L'acide sorbique, l'acide benzoïque, l'acide propionique et leurs sels les plus solubles inhibent les enzymes ou réduisent le pH intracellulaire.
- Les sulfites sont utilisés dans la vinification et la transformation des aliments pour empêcher le brunissement des aliments.
- Les nitrites sont utilisés pour conserver les viandes et conserver leur couleur, mais la cuisson de viandes conservées au nitrite peut produire des nitrosamines cancérigènes.
- La nisine et la natamycine sont des agents de conservation naturels utilisés dans les fromages et les viandes. La nisine est efficace contre les bactéries gram-positives et la natamycine contre les champignons.
Notes
- 1 Administration américaine des produits alimentaires et pharmaceutiques. « Le triclosan : ce que les consommateurs devraient savoir ». 2015. www.FDA.gov/ForConsumers/Cons... /ucm205999.htm. Consulté le 9 juin 2016.
- 2 J. Stromberg. « Cinq raisons pour lesquelles vous devriez probablement arrêter d'utiliser du savon antibactérien. » SmithSonian.com 3 janvier 2014. www.smithsonianmag.com/scienc... 948078/ ? no-ist. Consulté le 9 juin 2016.
- 3 SP Yazdankhah et coll. « Le triclosan et la résistance aux antimicrobiens chez les bactéries : un aperçu. » Résistance microbienne aux médicaments 12 no 2 (2006) : 83—90.
- 4 L. Birošová, M. Mikulášová. « Développement de la résistance au triclosan et aux antibiotiques chez le sérovar Typhimurium de Salmonella enterica. » Journal de microbiologie médicale 58 n° 4 (2009) :436—441.
- 5 AB Dann, A. Hontela. « Triclosan : exposition environnementale, toxicité et mécanismes d'action ». Journal of Applied Toxicology 31 no 4 (2011) :285—311.
- 6 centres américains pour le contrôle et la prévention des maladies. « Fiche d'information sur le triclosan ». 2013. www.cdc.gov/BioMonitoring/Tri... FactSheet.html. Consulté le 9 juin 2016.
- 7 EM Clayton et coll. « L'impact du bisphénol A et du triclosan sur les paramètres immunitaires de la population américaine, NHANES 2003-2006. » Perspectives de santé environnementale 119 no 3 (2011) :390.
- 8 N. Silvestry-Rodriguez et coll. « L'argent comme désinfectant. » Dans Reviews of Environmental Contamination and Toxicology, p. 23 à 45. Edité par GW Ware et DM Whitacre. New York : Springer, 2007.
- 9 B. Owens. « L'argent rend les antibiotiques des milliers de fois plus efficaces. » Nature 19 juin 2013. http://www.nature.com/news/silver-ma...ective-1.13232
- 10 C. Seiler, TU Berendonk. « Cosélection axée sur les métaux lourds de la résistance aux antibiotiques dans les sols et les plans d'eau impactés par l'agriculture et l'aquaculture. » Frontières de la microbiologie 3 (2012) :399.
- 11 Organisation mondiale de la santé. « Avantages et risques de l'utilisation de désinfectants contenant du chlore dans la production et la transformation des aliments : rapport d'une réunion d'experts conjointe FAO/OMS ». Genève, Suisse : Organisation mondiale de la santé, 2009.
- 12 RE Marquis. « Actions antimicrobiennes du fluor pour les bactéries orales. » Journal canadien de microbiologie 41 no 11 (1995) :955—964.
- 13 L. Thomas et coll. « Développement de la résistance au diacétate de chlorhexidine chez Pseudomonas aeruginosa et effet d'une concentration « résiduelle ». » Journal of Hospital Infection 46 n° 4 (2000) :297—303.
- 14 Institut de médecine. « Effets à long terme sur la santé de la participation au projet SHAD (Shipboard Hazard and Defense) ». Washington, DC : The National Academies Press, 2007.
- 15 Yao, C.S. et coll. « Effet antibactérien in vitro du peroxyde de carbamide sur le biofilm oral. » Journal de microbiologie orale, 12 juin 2013. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3682087/. doi : 10.3402/jom.v5i0.20392.


