13.2 : Utilisation de méthodes physiques pour contrôler les microorganismes
- Page ID
- 187596
Objectifs d'apprentissage
- Comprendre et comparer différentes méthodes physiques de contrôle de la croissance microbienne, notamment le chauffage, la réfrigération, la congélation, le traitement à haute pression, la dessiccation, la lyophilisation, l'irradiation et la filtration
Depuis des milliers d'années, les humains utilisent diverses méthodes physiques de contrôle microbien pour la conservation des aliments. Les méthodes de contrôle courantes incluent l'application de températures élevées, le rayonnement, la filtration et la dessiccation (séchage), entre autres. Bon nombre de ces méthodes tuent les cellules de manière non spécifique en perturbant les membranes, en modifiant la perméabilité des membranes ou en endommageant les protéines et les acides nucléiques par dénaturation, dégradation ou modification chimique. Diverses méthodes physiques utilisées pour le contrôle microbien sont décrites dans cette section.
Chaleur
Le chauffage est l'une des formes de contrôle microbien les plus courantes et les plus anciennes. Il est utilisé dans des techniques simples comme la cuisson et la mise en conserve. La chaleur peut tuer les microbes en altérant leurs membranes et en dénaturant les protéines. Le point de mort thermique (TDP) d'un microorganisme est la température la plus basse à laquelle tous les microbes sont tués au cours d'une exposition de 10 minutes. Différents microorganismes réagissent différemment aux températures élevées, certains (par exemple, les organismes formant des endospores tels que C. botulinum) étant plus tolérants à la chaleur. Un paramètre similaire, le temps de mort thermique (TDT), est le temps nécessaire pour tuer tous les microorganismes d'un échantillon à une température donnée. Ces paramètres sont souvent utilisés pour décrire les procédures de stérilisation qui utilisent une chaleur élevée, comme l'autoclavage. L'ébullition est l'une des plus anciennes méthodes de contrôle de la chaleur humide des microbes, et elle est généralement très efficace pour tuer les cellules végétatives et certains virus. Cependant, l'ébullition est moins efficace pour tuer les endospores ; certaines endospores peuvent survivre jusqu'à 20 heures d'ébullition. De plus, l'ébullition peut être moins efficace à haute altitude, où le point d'ébullition de l'eau est plus bas et le temps d'ébullition nécessaire pour tuer les microbes est donc plus long. Pour ces raisons, l'ébullition n'est pas considérée comme une technique de stérilisation utile en laboratoire ou en clinique.
De nombreux protocoles de chauffage peuvent être utilisés pour la stérilisation en laboratoire ou en clinique, et ces protocoles peuvent être divisés en deux catégories principales : la stérilisation par chaleur sèche et la stérilisation par chaleur humide. La technique aseptique en laboratoire implique généralement certains protocoles de stérilisation à la chaleur sèche utilisant l'application directe de chaleur élevée, tels que la stérilisation des boucles d'inoculation (Figure\(\PageIndex{1}\)). L'incinération à très haute température détruit tous les microorganismes. La chaleur sèche peut également être appliquée pendant des périodes relativement longues (au moins 2 heures) à des températures allant jusqu'à 170 °C en utilisant un stérilisateur à chaleur sèche, tel qu'un four. Cependant, la stérilisation à la chaleur humide est généralement le protocole le plus efficace car elle pénètre mieux dans les cellules que la chaleur sèche.

Autoclaves
Les autoclaves reposent sur la stérilisation à la chaleur humide. Ils sont utilisés pour élever la température au-dessus du point d'ébullition de l'eau afin de stériliser des articles tels que le matériel chirurgical à partir de cellules végétatives, de virus et en particulier d'endospores, qui sont connues pour survivre à des températures d'ébullition, sans endommager les articles. Charles Chamberland (1851-1908) a conçu l'autoclave moderne en 1879 alors qu'il travaillait dans le laboratoire de Louis Pasteur. L'autoclave est toujours considéré comme la méthode de stérilisation la plus efficace (Figure\(\PageIndex{2}\)). En dehors des laboratoires et des cliniques, de grands autoclaves industriels appelés autoclaves permettent la stérilisation par chaleur humide à grande échelle.
En général, l'air contenu dans la chambre d'un autoclave est retiré et remplacé par des quantités croissantes de vapeur emprisonnée dans la chambre fermée, ce qui entraîne une augmentation de la pression intérieure et des températures supérieures au point d'ébullition de l'eau. Les deux principaux types d'autoclaves diffèrent dans la manière dont l'air est retiré de la chambre. Dans les autoclaves à déplacement par gravité, la vapeur est introduite dans la chambre par le haut ou par les côtés. L'air, plus lourd que la vapeur, coule au fond de la chambre, d'où il est expulsé par un évent. Le déplacement complet de l'air étant difficile, en particulier pour les charges plus importantes, des cycles plus longs peuvent être nécessaires pour de telles charges. Dans les stérilisateurs prévide, l'air est complètement éliminé à l'aide d'un aspirateur à grande vitesse avant d'introduire de la vapeur dans la chambre. Comme l'air est plus complètement éliminé, la vapeur peut pénétrer plus facilement dans les articles emballés. De nombreux autoclaves peuvent effectuer à la fois des cycles de gravité et de prévide, utilisant le premier pour la décontamination des déchets et la stérilisation des supports et de la verrerie non emballée, et le second pour la stérilisation d'instruments emballés.
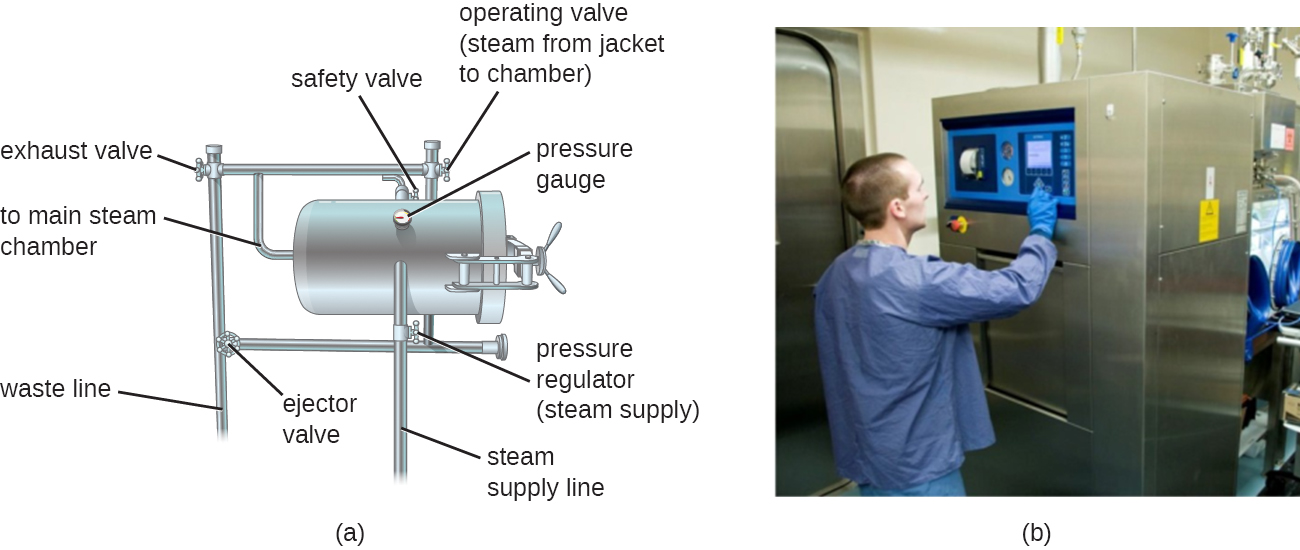
Les températures de fonctionnement standard pour les autoclaves sont de 121 °C ou, dans certains cas, de 132 °C, généralement à une pression de 15 à 20 livres par pouce carré (psi). La durée de l'exposition dépend du volume et de la nature du matériau à stériliser, mais elle est généralement de 20 minutes ou plus, les volumes plus importants nécessitant des temps d'exposition plus longs pour garantir un transfert de chaleur suffisant vers les matériaux à stériliser. La vapeur doit entrer en contact direct avec les liquides ou les matières sèches à stériliser, de sorte que les récipients restent mal fermés et que les instruments sont emballés de manière lâche dans du papier ou du papier d'aluminium. La clé de l'autoclavage est que la température doit être suffisamment élevée pour tuer les endospores afin d'obtenir une stérilisation complète.
La stérilisation étant essentielle à la sécurité des protocoles médicaux et de laboratoire, le contrôle de la qualité est essentiel. Les autoclaves peuvent être équipés d'enregistreurs pour documenter les pressions et les températures atteintes lors de chaque cycle. De plus, les indicateurs internes de différents types doivent être autoclavés en même temps que les matériaux à stériliser pour garantir que la température de stérilisation appropriée a été atteinte (Figure\(\PageIndex{3}\)). Un type d'indicateur courant est l'utilisation d'un ruban autoclave sensible à la chaleur, dont les bandes blanches deviennent noires lorsque la température appropriée est atteinte lors d'un fonctionnement réussi de l'autoclave. Ce type d'indicateur est relativement peu coûteux et peut être utilisé à chaque course. Cependant, le ruban autoclave ne fournit aucune indication sur la durée de l'exposition et ne peut donc pas être utilisé comme indicateur de stérilité. Un autre type d'indicateur, le test des spores indicatrices biologiques, utilise soit une bande de papier, soit une suspension liquide des endospores de Geobacillus stearothermophilus pour déterminer si les endospores sont tuées par le processus. Les endospores de la bactérie thermophile obligatoire G. stearothermophilus constituent l'étalon de référence utilisé à cette fin en raison de leur résistance extrême à la chaleur. Les indicateurs biologiques des spores peuvent également être utilisés pour tester l'efficacité d'autres protocoles de stérilisation, notamment la stérilisation à l'oxyde d'éthylène, à la chaleur sèche, au formaldéhyde, aux rayons gamma et au plasma au peroxyde d'hydrogène à l'aide de l'un ou l'autre de G. spores de stearothermophilus, de Bacillus atrophaeus, de B. subtilis ou de B. pumilus. Dans le cas de la validation de la fonction de l'autoclave, les endospores sont incubées après l'autoclavage pour s'assurer qu'il ne reste aucune endospore viable. La croissance bactérienne consécutive à la germination des endospores peut être surveillée par des tests de spores indicateurs biologiques qui détectent les métabolites acides ou la fluorescence produite par des enzymes dérivées de G. stearothermophilus viable. Un troisième type d'indicateur d'autoclave est le tube Diack, une ampoule en verre contenant une pastille sensible à la température qui fond à la bonne température de stérilisation. Des bandes de spores ou des tubes Diack sont utilisés périodiquement pour garantir le bon fonctionnement de l'autoclave.

Pasteurisation
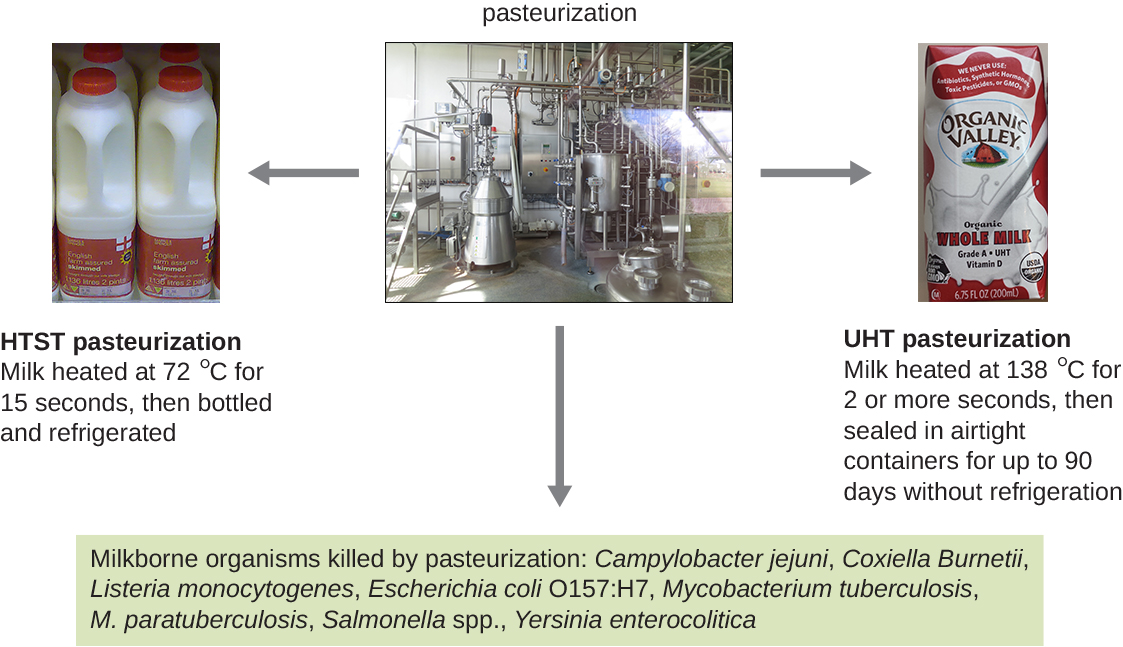
Bien que la stérilisation complète soit idéale pour de nombreuses applications médicales, elle n'est pas toujours pratique pour d'autres applications et peut également altérer la qualité du produit. L'ébullition et l'autoclavage ne sont pas des moyens idéaux pour contrôler la croissance microbienne dans de nombreux aliments, car ces méthodes peuvent nuire à la consistance et à d'autres qualités organoleptiques (sensorielles) des aliments. La pasteurisation est une forme de contrôle microbien des aliments qui utilise de la chaleur mais ne les rend pas stériles. La pasteurisation traditionnelle tue les agents pathogènes et réduit le nombre de microbes responsables de la détérioration tout en préservant la qualité des aliments. Le procédé de pasteurisation a été développé pour la première fois par Louis Pasteur dans les années 1860 pour empêcher la détérioration de la bière et du vin. Aujourd'hui, la pasteurisation est le plus souvent utilisée pour tuer les agents pathogènes sensibles à la chaleur présents dans le lait et d'autres produits alimentaires (par exemple, le jus de pomme et le miel) (Figure\(\PageIndex{4}\)). Toutefois, comme les produits alimentaires pasteurisés ne sont pas stériles, ils finiront par se détériorer.
Les méthodes utilisées pour la pasteurisation du lait permettent d'équilibrer la température et la durée du traitement. L'une des méthodes, la pasteurisation de courte durée à haute température (HTST), expose le lait à une température de 72 °C pendant 15 secondes, ce qui réduit le nombre de bactéries tout en préservant la qualité du lait. Une alternative est la pasteurisation à très haute température (UHT), au cours de laquelle le lait est exposé à une température de 138 °C pendant 2 secondes ou plus. Le lait pasteurisé UHT peut être conservé longtemps dans des récipients hermétiques sans être réfrigéré ; toutefois, les températures très élevées modifient les protéines du lait, provoquant de légères modifications du goût et de l'odeur. Néanmoins, cette méthode de pasteurisation est avantageuse dans les régions où l'accès à la réfrigération est limité.
Exercice\(\PageIndex{1}\)
- Dans un autoclave, comment arrive-t-on à des températures supérieures à l'ébullition ?
- Comment le début de la détérioration se comparerait-il entre le lait pasteurisé HTST et le lait pasteurisé UHT ?
- Pourquoi l'ébullition n'est-elle pas utilisée comme méthode de stérilisation en milieu clinique ?
Réfrigération et congélation
Tout comme les températures élevées sont efficaces pour contrôler la croissance microbienne, l'exposition des microbes à de basses températures peut également être une méthode simple et efficace de contrôle microbien, à l'exception des psychrophiles, qui préfèrent les températures froides (voir Température et croissance microbienne). Les réfrigérateurs utilisés dans les cuisines domestiques ou en laboratoire maintiennent des températures comprises entre 0 °C et 7 °C. Cette plage de températures inhibe le métabolisme microbien, ralentit considérablement la croissance des microorganismes et aide à conserver les produits réfrigérés tels que les aliments ou les fournitures médicales. Certains types de cultures de laboratoire peuvent être conservés par réfrigération pour une utilisation ultérieure.
Le gel à une température inférieure à −2 °C peut arrêter la croissance microbienne et même tuer les organismes sensibles. Selon le ministère américain de l'Agriculture (USDA), les seuls moyens sûrs de décongeler les aliments surgelés sont de les mettre au réfrigérateur, de les immerger dans de l'eau froide changée toutes les 30 minutes ou de les mettre au micro-ondes, afin de conserver les aliments à des températures qui ne favorisent pas la croissance bactérienne. 1 De plus, l'arrêt de la croissance bactérienne peut reprendre dans les aliments décongelés. Les aliments décongelés doivent donc être traités comme des denrées périssables fraîches.
Les cultures bactériennes et les échantillons médicaux nécessitant un stockage ou un transport à long terme sont souvent congelés à des températures très basses de −70 °C ou moins. Ces températures extrêmement basses peuvent être atteintes en stockant les échantillons sur de la neige carbonique dans un congélateur à très basse température ou dans des réservoirs spéciaux d'azote liquide, qui maintiennent des températures inférieures à −196 °C (Figure\(\PageIndex{5}\)).

Exercice\(\PageIndex{2}\)
Le fait de placer des aliments dans un réfrigérateur tue-t-il les bactéries présentes sur les aliments ?
Pression
L'exposition à une pression élevée tue de nombreux microbes. Dans l'industrie alimentaire, le traitement à haute pression (également appelé pascalisation) est utilisé pour tuer les bactéries, les levures, les moisissures, les parasites et les virus présents dans les aliments tout en préservant la qualité des aliments et en prolongeant leur durée de conservation. L'application d'une pression élevée comprise entre 100 et 800 MPa (la pression atmosphérique au niveau de la mer est d'environ 0,1 MPa) est suffisante pour tuer les cellules végétatives par dénaturation des protéines, mais les endospores peuvent survivre à ces pressions. 2 3
En milieu clinique, on a parfois recours à l'oxygénothérapie hyperbare pour traiter les infections. Dans cette forme de thérapie, un patient respire de l'oxygène pur à une pression supérieure à la pression atmosphérique normale, généralement comprise entre 1 et 3 atmosphères (atm). Ceci est réalisé en plaçant le patient dans une chambre hyperbare ou en fournissant de l'oxygène sous pression par un tube respiratoire. L'oxygénothérapie hyperbare aide à augmenter la saturation en oxygène des tissus qui deviennent hypoxiques en raison d'une infection et d'une inflammation. Cette augmentation de la concentration en oxygène renforce la réponse immunitaire de l'organisme en augmentant l'activité des neutrophiles et des macrophages, des globules blancs qui combattent les infections. L'augmentation des niveaux d'oxygène contribue également à la formation de radicaux libres toxiques qui inhibent la croissance de bactéries sensibles à l'oxygène ou anaérobies, comme Clostridium perfringens, une cause fréquente de gangrène gazeuse. Dans les infections à C. perfringens, l'oxygénothérapie hyperbare peut également réduire la sécrétion d'une toxine bactérienne responsable de la destruction des tissus. L'oxygénothérapie hyperbare semble également améliorer l'efficacité des traitements antibiotiques. Malheureusement, certains risques rares incluent la toxicité à l'oxygène et les effets sur les tissus délicats, tels que les yeux, l'oreille moyenne et les poumons, qui peuvent être endommagés par l'augmentation de la pression de l'air.
Le traitement à haute pression n'est pas couramment utilisé pour la désinfection ou la stérilisation des matières volatiles. Bien que l'application de pression et de vapeur dans un autoclave soit efficace pour tuer les endospores, c'est la température élevée atteinte, et non la pression directe, qui entraîne la mort des endospores.
Une série de mauvais repas-partage
Un lundi du printemps 2015, une femme de l'Ohio a commencé à avoir une vision double et floue, des difficultés à avaler et des paupières tombantes. Elle a été transportée d'urgence au service des urgences de son hôpital local. Au cours de l'examen, elle a commencé à ressentir des crampes abdominales, des nausées, une paralysie, une sécheresse de la bouche, une faiblesse des muscles faciaux et des difficultés à parler et à respirer. Sur la base de ces symptômes, le centre de commandement des incidents de l'hôpital a été activé et les autorités de santé publique de l'Ohio ont été informées d'un éventuel cas de botulisme. Entre-temps, d'autres patients présentant des symptômes similaires ont commencé à se présenter dans d'autres hôpitaux locaux. En raison de la suspicion de botulisme, l'antitoxine a été expédiée du jour au lendemain par les CDC à ces établissements médicaux, pour être administrée aux patients atteints. Le premier patient est décédé d'une insuffisance respiratoire à la suite d'une paralysie, et environ la moitié des victimes restantes ont dû être hospitalisées à la suite de l'administration d'antitoxines, et au moins deux d'entre elles ont eu besoin d'un ventilateur pour respirer.
Les responsables de la santé publique ont enquêté sur chacun des cas et ont déterminé que tous les patients avaient assisté au même repas-partage religieux la veille. De plus, ils ont attribué la source de l'épidémie à une salade de pommes de terre préparée avec des pommes de terre en conserve faites maison. Il est plus que probable que les pommes de terre aient été mises en conserve à l'eau bouillante, une méthode qui permet aux endospores de Clostridium botulinum de survivre. C. botulinum produit de la toxine botulique, une neurotoxine souvent mortelle une fois ingérée. Selon les CDC, le cas de l'Ohio était la plus importante épidémie de botulisme aux États-Unis depuis près de 40 ans. 4
La destruction des endospores de C. botulinum nécessite une température minimale de 116 °C (240 °F), bien au-dessus du point d'ébullition de l'eau. Cette température ne peut être atteinte que dans un autocuiseur, ce qui est recommandé pour la mise en conserve à domicile d'aliments peu acides tels que la viande, le poisson, la volaille et les légumes (Figure\(\PageIndex{6}\)). De plus, le CDC recommande de faire bouillir les aliments en conserve faits maison pendant environ 10 minutes avant de les consommer. Comme la toxine botulique est thermolabile (c'est-à-dire qu'elle est dénaturée par la chaleur), 10 minutes d'ébullition rendront non fonctionnelle toute toxine botulique que l'aliment peut contenir.

Pour en savoir plus sur les techniques de mise en conserve maison appropriées, visitez le site Web du CDC.
Dessiccation
Le séchage, également connu sous le nom de dessiccation ou déshydratation, est une méthode utilisée depuis des millénaires pour conserver des aliments tels que les raisins secs, les pruneaux et le jerky. Cela fonctionne parce que toutes les cellules, y compris les microbes, ont besoin d'eau pour leur métabolisme et leur survie. Bien que le séchage contrôle la croissance microbienne, il se peut qu'il ne tue pas tous les microbes ou leurs endospores, qui peuvent recommencer à se développer lorsque les conditions sont plus favorables et que la teneur en eau est rétablie.
Dans certains cas, les aliments sont séchés au soleil, en s'appuyant sur l'évaporation pour obtenir une dessiccation. La lyophilisation est une autre méthode de dessication dans laquelle un article est rapidement congelé (« surgelé ») et placé sous vide de manière à ce que l'eau soit perdue par sublimation. La lyophilisation combine à la fois l'exposition au froid et la dessiccation, ce qui la rend très efficace pour contrôler la croissance microbienne. De plus, la lyophilisation cause moins de dommages à un article que la dessiccation conventionnelle et préserve mieux les qualités d'origine de l'article. Les articles lyophilisés peuvent être conservés à température ambiante s'ils sont emballés de manière appropriée pour empêcher l'accumulation d'humidité. La lyophilisation est utilisée pour la conservation dans l'industrie alimentaire et est également utilisée en laboratoire pour le stockage et le transport à long terme de cultures microbiennes.
La teneur en eau des aliments et des matières, appelée activité de l'eau, peut être réduite sans dessèchement physique en ajoutant des solutés tels que des sels ou des sucres. À de très fortes concentrations de sels ou de sucres, la quantité d'eau disponible dans les cellules microbiennes est considérablement réduite car l'eau sera puisée d'une zone à faible concentration de solutés (à l'intérieur de la cellule) vers une zone à forte concentration de solutés (à l'extérieur de la cellule) (Figure\(\PageIndex{7}\)). De nombreux microorganismes ne survivent pas à ces conditions de pression osmotique élevée. Le miel, par exemple, est composé à 80 % de saccharose, un environnement dans lequel très peu de microorganismes sont capables de se développer, éliminant ainsi le besoin de réfrigération. Les viandes et les poissons salés, comme le jambon et la morue, étaient des aliments essentiels avant l'ère de la réfrigération. Les fruits étaient conservés en ajoutant du sucre, en faisant des confitures et des gelées. Cependant, certains microbes, tels que les moisissures et les levures, ont tendance à être plus tolérants à la dessiccation et aux pressions osmotiques élevées et peuvent donc toujours contaminer ces types d'aliments.

Exercice\(\PageIndex{3}\)
Comment l'ajout de sel ou de sucre aux aliments affecte-t-il leur activité hydrique ?
Radiation
Le rayonnement sous diverses formes, du rayonnement à haute énergie à la lumière solaire, peut être utilisé pour tuer les microbes ou inhiber leur croissance. Les rayonnements ionisants comprennent les rayons X, les rayons gamma et les faisceaux d'électrons à haute énergie. Le rayonnement ionisant est suffisamment puissant pour pénétrer dans la cellule, où il modifie les structures moléculaires et endommage les composants cellulaires. Par exemple, les rayonnements ionisants introduisent des ruptures à double brin dans les molécules d'ADN. Cela peut provoquer directement des mutations de l'ADN, ou des mutations peuvent être introduites lorsque la cellule tente de réparer les dommages causés à l'ADN. À mesure que ces mutations s'accumulent, elles finissent par entraîner la mort cellulaire.
Les rayons X et gamma pénètrent facilement dans le papier et le plastique et peuvent donc être utilisés pour stériliser de nombreux matériaux emballés. En laboratoire, les rayonnements ionisants sont couramment utilisés pour stériliser des matériaux qui ne peuvent pas être autoclavés, tels que les boîtes de Petri en plastique et les boucles d'inoculation jetables en plastique. À des fins cliniques, les rayonnements ionisants sont utilisés pour stériliser les gants, les tubulures intraveineuses et autres articles en latex et en plastique utilisés pour les soins aux patients. Les rayonnements ionisants sont également utilisés pour la stérilisation d'autres types de matériaux délicats et thermosensibles utilisés en clinique, notamment les tissus destinés à la transplantation, les médicaments et les équipements médicaux.
En Europe, l'irradiation gamma pour la conservation des aliments est largement utilisée, bien qu'elle ait mis du temps à se développer aux États-Unis (voir l'encadré Micro Connections à ce sujet). Les épices séchées emballées sont également souvent irradiées aux rayons gamma. En raison de leur capacité à pénétrer le papier, le plastique, les fines feuilles de bois et de métal et les tissus, il faut faire très attention lors de l'utilisation des rayons X et de l'irradiation gamma. Ces types d'irradiation ionisante ne peuvent pas pénétrer dans les couches épaisses de fer ou de plomb. Ces métaux sont donc couramment utilisés pour protéger les humains susceptibles d'être exposés.
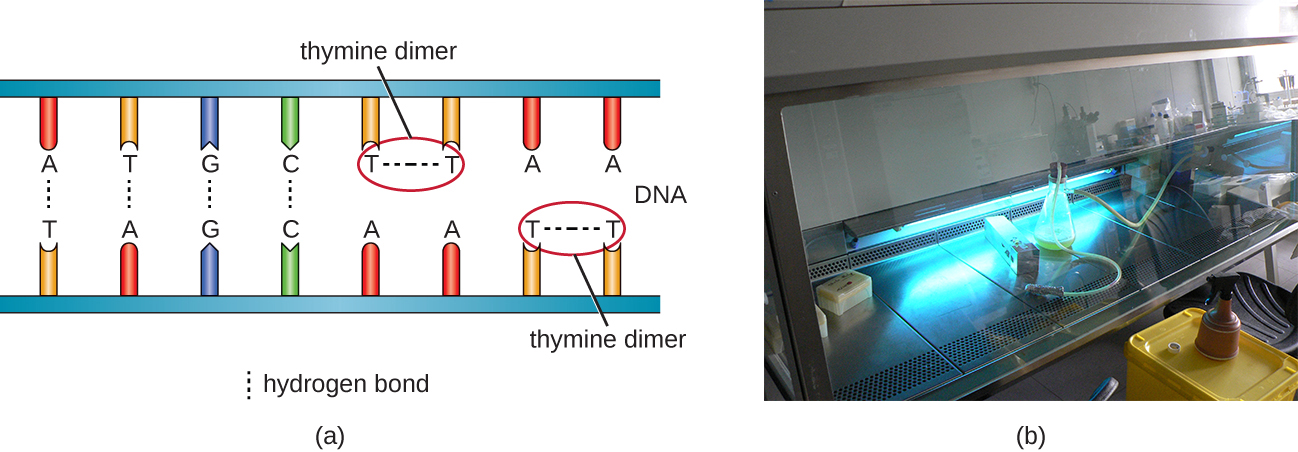
Un autre type de rayonnement, le rayonnement non ionisant, est couramment utilisé pour la stérilisation et consomme moins d'énergie que les rayonnements ionisants. Il ne pénètre pas dans les cellules ou les emballages. La lumière ultraviolette (UV) en est un exemple ; elle provoque la formation de dimères de thymine entre les thymines adjacentes au sein d'un seul brin d'ADN (Figure\(\PageIndex{8}\)). Lorsque l'ADN polymérase rencontre le dimère de la thymine, celle-ci n'incorpore pas toujours les nucléotides complémentaires appropriés (deux adénines), ce qui entraîne la formation de mutations qui peuvent finalement tuer les microorganismes.
La lumière UV peut être utilisée efficacement par les consommateurs et le personnel de laboratoire pour contrôler la croissance microbienne. Les lampes UV sont désormais couramment intégrées aux systèmes de purification de l'eau destinés à être utilisés dans les maisons. De plus, les campeurs utilisent couramment de petites lampes UV portatives pour purifier l'eau des environnements naturels avant de la boire. Les lampes germicides sont également utilisées dans les unités chirurgicales, les armoires de sécurité biologique et les hottes de transfert, émettant généralement de la lumière UV à une longueur d'onde de 260 nm. Comme les rayons UV ne pénètrent pas les surfaces et ne traversent pas le plastique ou le verre, les cellules doivent être exposées directement à la source de lumière.
La lumière du soleil a un spectre très large qui inclut les UV et la lumière visible. Dans certains cas, la lumière solaire peut être efficace contre certaines bactéries en raison de la formation de dimères de thymine par les rayons UV et de la production de produits oxygénés réactifs induits en faibles quantités par l'exposition à la lumière visible.
Exercice\(\PageIndex{4}\)
- Quels sont les deux avantages des rayonnements ionisants en tant que méthode de stérilisation ?
- Comment l'efficacité des rayonnements ionisants se compare-t-elle à celle des rayonnements non ionisants ?
Nourriture irradiée : est-ce que vous mangeriez ça ?
De tous les moyens de prévenir la détérioration des aliments et les maladies d'origine alimentaire, l'irradiation gamma est peut-être la moins appétissante. Bien que l'irradiation gamma soit une méthode éprouvée pour éliminer les microbes potentiellement nocifs des aliments, le public n'a toujours pas accepté. La plupart de leurs préoccupations découlent toutefois de la désinformation et d'une mauvaise compréhension des principes de base des rayonnements.
La méthode d'irradiation la plus courante consiste à exposer les aliments au cobalt 60 ou au césium 137 en les faisant passer dans une chambre à rayonnement sur une bande transporteuse. Les aliments n'entrent pas directement en contact avec les matières radioactives et ne deviennent pas eux-mêmes radioactifs. Il n'y a donc aucun risque d'exposition à des matières radioactives en consommant des aliments irradiés aux rayons gamma. De plus, les aliments irradiés ne sont pas significativement altérés en termes de qualité nutritionnelle, mis à part la perte de certaines vitamines, qui est également aggravée par un stockage prolongé. Des altérations du goût ou de l'odeur peuvent se produire dans les aliments irradiés à forte teneur en matières grasses, tels que les viandes grasses et les produits laitiers, mais cet effet peut être minimisé en utilisant de plus faibles doses de rayonnement à des températures plus froides.
Aux États-Unis, le CDC, l'Agence de protection de l'environnement (EPA) et la Food and Drug Administration (FDA) ont jugé que l'irradiation était sûre et efficace pour divers types de viande, de volaille, de crustacés, de fruits et légumes frais, d'œufs avec coquille, d'épices et d'assaisonnements. L'irradiation gamma des aliments a également été approuvée dans de nombreux autres pays, notamment en France, aux Pays-Bas, au Portugal, en Israël, en Russie, en Chine, en Thaïlande, en Belgique, en Australie et en Afrique du Sud. Afin de répondre aux préoccupations des consommateurs et de contribuer aux efforts d'éducation, les aliments irradiés sont désormais clairement étiquetés et marqués du symbole international d'irradiation, appelé « radura » (Figure\(\PageIndex{9}\)). L'acceptation par les consommateurs semble augmenter, comme l'indiquent plusieurs études récentes.

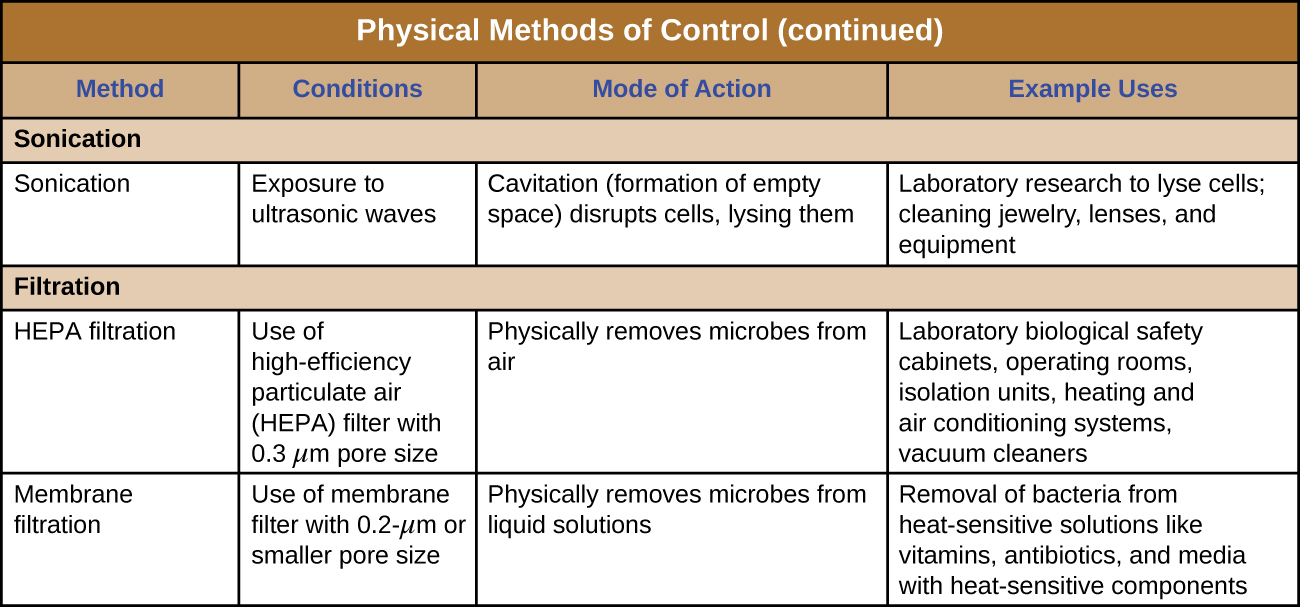
Sonication
L'utilisation d'ondes ultrasonores à haute fréquence pour perturber les structures cellulaires est appelée sonication. L'application d'ondes ultrasonores provoque des changements rapides de pression dans le liquide intracellulaire ; cela entraîne la cavitation, la formation de bulles à l'intérieur de la cellule, qui peuvent perturber les structures cellulaires et provoquer éventuellement la lyse ou l'effondrement de la cellule. La sonication est utile en laboratoire pour lyser efficacement les cellules afin de libérer leur contenu en vue de recherches ultérieures ; en dehors du laboratoire, la sonication est utilisée pour nettoyer les instruments chirurgicaux, les lentilles et divers autres objets tels que les pièces de monnaie, les outils et les instruments de musique.
Filtration
La filtration est une méthode qui permet de séparer physiquement les microbes des échantillons. L'air est généralement filtré par des filtres à particules à haute efficacité (HEPA) (Figure\(\PageIndex{10}\)). Les filtres HEPA ont des pores effectifs de 0,3 µm, suffisamment petits pour capturer les cellules bactériennes, les endospores et de nombreux virus lorsque l'air passe à travers ces filtres, stérilisant ainsi presque l'air de l'autre côté du filtre. Les filtres HEPA ont diverses applications et sont largement utilisés en milieu clinique, dans les voitures et les avions, et même à la maison. Par exemple, ils peuvent être trouvés dans les aspirateurs, les systèmes de chauffage et de climatisation et les purificateurs d'air.
Cabinets de sécurité biologique
Les armoires de sécurité biologique sont un bon exemple de l'utilisation de filtres HEPA. Les filtres HEPA des armoires de sécurité biologique (BSC) sont utilisés pour éliminer les particules présentes dans l'air qui entrent dans l'armoire (entrée d'air), en sortent (évacuation de l'air) ou pour traiter à la fois l'admission et l'échappement. L'utilisation d'un filtre HEPA à prise d'air empêche les contaminants environnementaux de pénétrer dans le BSC, créant ainsi une zone propre pour la manipulation de matières biologiques. L'utilisation d'un filtre HEPA d'échappement d'air empêche les agents pathogènes de laboratoire de contaminer le laboratoire, préservant ainsi un espace de travail sûr pour le personnel de laboratoire.
Il existe trois classes de BSC : I, II et III. Chaque classe est conçue pour fournir un niveau de protection différent au personnel de laboratoire et à l'environnement ; les normes BSC II et III sont également conçues pour protéger les matériaux ou les appareils contenus dans l'armoire. \(\PageIndex{1}\)Le tableau résume le niveau de sécurité fourni par chaque classe de BSC pour chaque BSL.
| Risque biologique évalué | Classe BSC | Protection du personnel | Protection de l'environnement | Protection du produit |
|---|---|---|---|---|
| BSL-1, BSL-2, BSL-3 | JE | Oui | Oui | Non |
| BSL-1, BSL-2, BSL-3 | II | Oui | Oui | Oui |
| BSL-4 | III ; II lorsqu'il est utilisé dans une chambre avec un costume | Oui | Oui | Oui |
Les BSC de classe I protègent les travailleurs de laboratoire et l'environnement contre un risque faible à modéré d'exposition aux agents biologiques utilisés en laboratoire. L'air est aspiré dans l'armoire puis filtré avant d'être évacué par le système d'échappement du bâtiment. Les BSC de classe II utilisent un flux d'air directionnel et des systèmes à barrière partielle pour contenir les agents infectieux. Les BSC de classe III sont conçus pour travailler avec des agents hautement infectieux tels que ceux utilisés dans les laboratoires BSL-4. Ils sont étanches aux gaz et les matériaux entrant ou sortant de l'armoire doivent passer par un système à double porte, ce qui permet de décontaminer l'espace intermédiaire entre les utilisations. Tout l'air passe à travers un ou deux filtres HEPA et un système d'incinération de l'air avant d'être évacué directement vers l'extérieur (et non par le système d'échappement du bâtiment). Le personnel peut manipuler les matériaux à l'intérieur de l'armoire de classe III en utilisant de longs gants en caoutchouc scellés à l'armoire.
Cette vidéo montre comment les BSC sont conçus et explique comment ils protègent le personnel, l'environnement et le produit.
Filtration dans les hôpitaux
Les filtres HEPA sont également couramment utilisés dans les hôpitaux et les salles de chirurgie pour prévenir la contamination et la propagation de microbes en suspension dans l'air par les systèmes de ventilation. Les systèmes de filtration HEPA peuvent être conçus pour des bâtiments entiers ou pour des pièces individuelles. Par exemple, les unités de combustion, les salles d'opération ou les unités d'isolement peuvent nécessiter des systèmes de filtration HEPA spéciaux pour éliminer les agents pathogènes opportunistes de l'environnement, car les patients de ces salles sont particulièrement vulnérables aux infections.
Filtres à membrane
La filtration peut également être utilisée pour éliminer les microbes des échantillons liquides à l'aide de la filtration sur membrane. Les filtres à membrane pour liquides fonctionnent de la même manière que les filtres HEPA pour l'air. Généralement, les filtres à membrane utilisés pour éliminer les bactéries ont une taille de pore effective de 0,2 µm, inférieure à la taille moyenne d'une bactérie (1 µm), mais des filtres avec des pores de plus petite taille sont disponibles pour des besoins plus spécifiques. La filtration membranaire est utile pour éliminer les bactéries de divers types de solutions thermosensibles utilisées en laboratoire, telles que les solutions antibiotiques et les solutions vitaminiques. De grands volumes de milieux de culture peuvent également être stérilisés par filtre plutôt que stérilisés à l'autoclave afin de protéger les composants sensibles à la chaleur. Souvent, lors de la filtration de petits volumes, des filtres à seringue sont utilisés, mais des filtres à vide sont généralement utilisés pour filtrer de plus grands volumes (Figure\(\PageIndex{11}\)).

Exercice\(\PageIndex{5}\)
- Une filtration sur membrane à l'aide d'un filtre de 0,2 µm serait-elle susceptible d'éliminer les virus d'une solution ? Expliquez.
- Nommez au moins deux utilisations courantes de la filtration HEPA en milieu clinique ou en laboratoire.
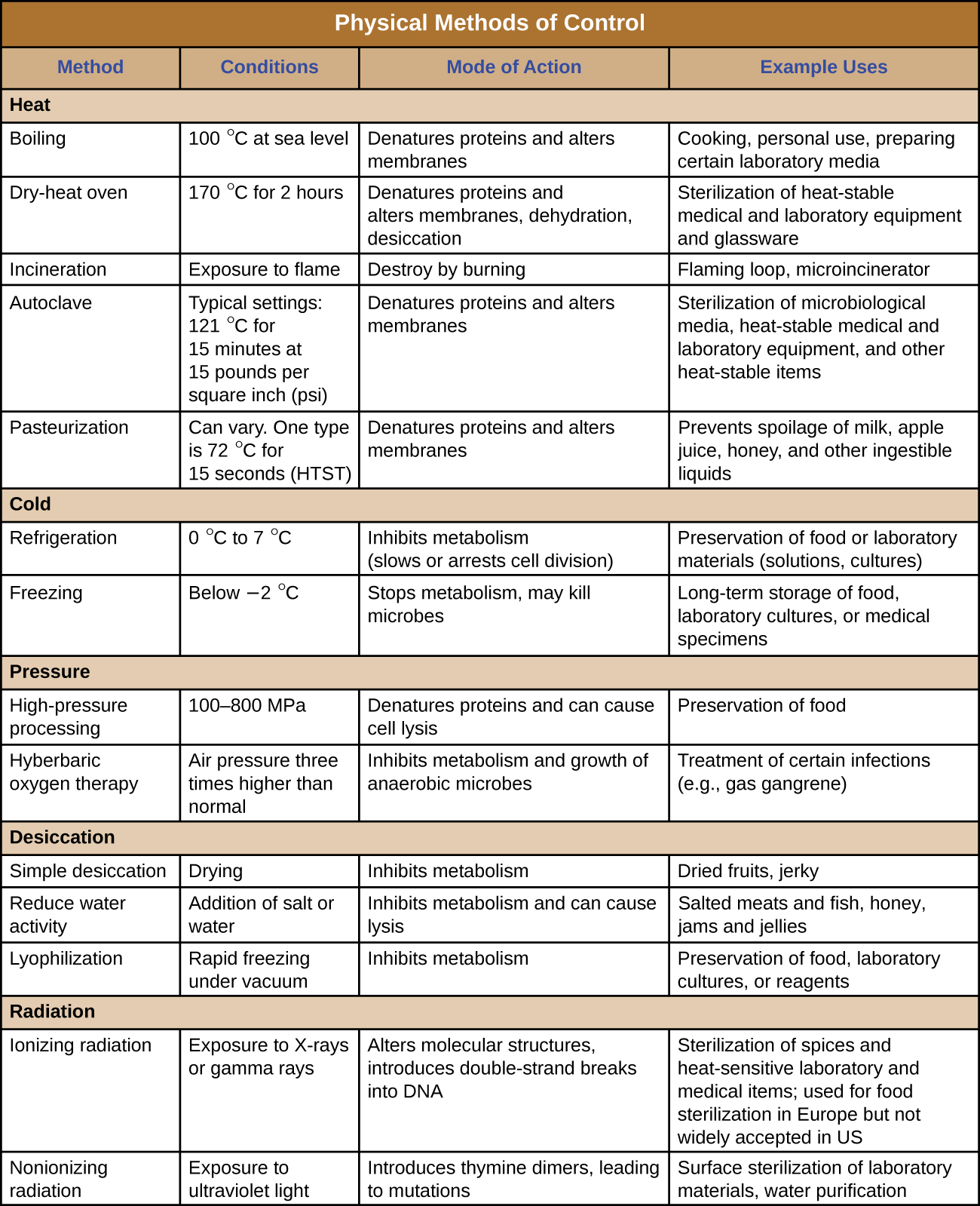
La figure\(\PageIndex{12}\) et la figure\(\PageIndex{13}\) résument les méthodes physiques de contrôle décrites dans cette section.
Concepts clés et résumé
- La chaleur est une méthode largement utilisée et très efficace pour contrôler la croissance microbienne.
- Les protocoles de stérilisation par chaleur sèche sont couramment utilisés dans les techniques aseptiques en laboratoire. Cependant, la stérilisation à la chaleur humide est généralement le protocole le plus efficace car elle pénètre mieux dans les cellules que la chaleur sèche.
- La pasteurisation est utilisée pour tuer les agents pathogènes et réduire le nombre de microbes responsables de la détérioration des aliments. La pasteurisation à haute température et de courte durée est couramment utilisée pour pasteuriser le lait qui sera réfrigéré ; la pasteurisation à très haute température peut être utilisée pour pasteuriser le lait en vue d'un stockage à long terme sans réfrigération.
- La réfrigération ralentit la croissance microbienne ; la congélation arrête la croissance et tue certains organismes. Les échantillons de laboratoire et médicaux peuvent être congelés sur de la glace carbonique ou à des températures très basses pour le stockage et le transport.
- Le traitement à haute pression peut être utilisé pour tuer les microbes présents dans les aliments. L'oxygénothérapie hyperbare visant à augmenter la saturation en oxygène a également été utilisée pour traiter certaines infections.
- La dessiccation est utilisée depuis longtemps pour conserver les aliments et est accélérée par l'ajout de sel ou de sucre, qui diminuent l'activité de l'eau dans les aliments.
- La lyophilisation combine exposition au froid et dessiccation pour le stockage à long terme des aliments et du matériel de laboratoire, mais les microbes restent et peuvent être réhydratés.
- Les rayonnements ionisants, y compris l'irradiation gamma, constituent un moyen efficace de stériliser les matériaux thermosensibles et emballés. Les rayonnements non ionisants, comme les rayons ultraviolets, ne peuvent pas pénétrer les surfaces mais sont utiles pour la stérilisation des surfaces.
- La filtration HEPA est couramment utilisée dans les systèmes de ventilation des hôpitaux et les armoires de sécurité biologique des laboratoires afin de prévenir la transmission de microbes en suspension dans l'air. La filtration sur membrane est couramment utilisée pour éliminer les bactéries des solutions thermosensibles.
Notes
- 1 Département américain de l'Agriculture. « Congélation et sécurité alimentaire ». 2013. http://www.fsis.usda.gov/wps/portal/...afety/CT_Index. Consulté le 8 juin 2016.
- 2 C. Ferstl. « Traitement à haute pression : informations sur la technologie et les exigences réglementaires. » Nourriture pour la pensée/Livre blanc. Série Volume 10. Livermore, Californie : The National Food Lab ; juillet 2013.
- 3 Administration américaine des produits alimentaires et pharmaceutiques. « Cinétique de l'inactivation microbienne pour les technologies alternatives de transformation des aliments : traitement à haute pression ». 2000. www.FDA.gov/Food/FoodSciencer... /ucm101456.htm. Consulté le 19 juillet 2016.
- 4 CL McCarty et coll. « Grande épidémie de botulisme associée à un repas-partage de l'Église en Ohio, 2015. » Rapport hebdomadaire sur la morbidité et la mortalité 64, n° 29 (2015) : 802-803.
- 5 AM Johnson et coll. « Acceptation par les consommateurs des viandes de volaille prêtes à manger irradiées par faisceau d'électrons. » Food Processing Preservation, 28 no. 4 (2004) :302—319.


