13.1 : Contrôle de la croissance microbienne
- Page ID
- 187583
Objectifs d'apprentissage
- Comparez les désinfectants, les antiseptiques et les stérilisants
- Décrire les principes du contrôle de la présence de microorganismes par la stérilisation et la désinfection
- Distinguer les microorganismes présentant différents niveaux de sécurité biologique et expliquer les méthodes utilisées pour manipuler les microbes à chaque niveau
Orientation clinique : 1ère partie
Roberta est une agente immobilière de 46 ans qui a récemment subi une cholécystectomie (chirurgie visant à enlever des calculs biliaires douloureux). L'opération a été réalisée par laparoscopie à l'aide d'un duodénoscope, un endoscope spécialisé qui permet aux chirurgiens de voir l'intérieur du corps à l'aide d'une minuscule caméra. En rentrant de l'hôpital, Roberta a ressenti des douleurs abdominales et une forte fièvre. Elle a également ressenti une sensation de brûlure pendant la miction et a remarqué du sang dans ses urines. Elle a informé son chirurgien de ces symptômes, conformément à ses instructions postopératoires.
Exercice\(\PageIndex{1}\)
Quelles sont les causes possibles des symptômes de Roberta ?
Pour prévenir la propagation des maladies humaines, il est nécessaire de contrôler la croissance et l'abondance de microbes dans ou sur divers objets fréquemment utilisés par les humains. Les objets inanimés, tels que les poignées de porte, les jouets ou les serviettes, qui peuvent héberger des microbes et contribuer à la transmission de maladies, sont appelés vecteurs. Deux facteurs influent fortement sur le niveau de propreté requis pour un parasite donné et, par conséquent, sur le protocole choisi pour atteindre ce niveau. Le premier facteur est l'application pour laquelle l'article sera utilisé. Par exemple, les applications invasives qui nécessitent une insertion dans le corps humain nécessitent un niveau de propreté beaucoup plus élevé que les applications qui n'en nécessitent pas. Le deuxième facteur est le niveau de résistance des agents pathogènes potentiels au traitement antimicrobien. Par exemple, les aliments conservés en conserve sont souvent contaminés par la bactérie Clostridium botulinum, qui produit la neurotoxine responsable du botulisme. Comme le C. botulinum peut produire des endospores capables de résister à des conditions difficiles, des températures et des pressions extrêmes doivent être utilisées pour éliminer les endospores. D'autres organismes peuvent ne pas nécessiter de mesures aussi extrêmes et peuvent être contrôlés par une procédure telle que le lavage du linge dans une machine à laver.
Niveaux de sécurité biologique en laboratoire
Pour les chercheurs ou le personnel de laboratoire travaillant avec des agents pathogènes, les risques associés à des agents pathogènes spécifiques déterminent les niveaux de propreté et de contrôle requis. Les Centers for Disease Control and Prevention (CDC) et les National Institutes of Health (NIH) ont établi quatre niveaux de classification, appelés « niveaux de sécurité biologique » (BSL). Diverses organisations dans le monde, notamment l'Organisation mondiale de la santé (OMS) et l'Union européenne (UE), utilisent un système de classification similaire. Selon les CDC, le BSL est déterminé par l'infectiosité de l'agent, sa facilité de transmission et la gravité potentielle de la maladie, ainsi que par le type de travail effectué avec l'agent. 1
Chaque BSL nécessite un niveau de bioconfinement différent pour empêcher la contamination et la propagation d'agents infectieux au personnel de laboratoire et, en fin de compte, à la communauté. Par exemple, le BSL le plus bas, le BSL-1, nécessite le moins de précautions car il s'applique aux situations présentant le plus faible risque d'infection microbienne.
Les agents BSL-1 sont ceux qui ne provoquent généralement pas d'infection chez les adultes humains en bonne santé. Il s'agit notamment de bactéries non infectieuses, telles que les souches non pathogènes d'Escherichia coli et de Bacillus subtilis, et de virus connus pour infecter les animaux autres que les humains, tels que les baculovirus (virus des insectes). Comme le fait de travailler avec des agents BSL-1 ne présente que très peu de risques, peu de précautions sont nécessaires. Les travailleurs de laboratoire utilisent une technique aseptique standard et peuvent travailler avec ces agents sur un banc ou une table de laboratoire ouverts, en portant un équipement de protection individuelle (EPI) tel qu'une blouse de laboratoire, des lunettes et des gants, selon les besoins. Hormis un évier pour le lavage des mains et des portes pour séparer le laboratoire du reste du bâtiment, aucune modification supplémentaire n'est nécessaire.
Les agents classés comme BSL-2 incluent ceux qui présentent un risque modéré pour le personnel de laboratoire et la communauté, et sont généralement « indigènes », c'est-à-dire qu'ils se trouvent couramment dans cette zone géographique. Il s'agit notamment de bactéries telles que Staphylococcus aureus et Salmonella spp., et de virus tels que les virus de l'hépatite, des oreillons et de la rougeole. Les laboratoires du BSL-2 exigent des précautions supplémentaires en plus de celles du BSL-1, notamment un accès restreint, l'équipement de protection individuelle obligatoire, y compris un écran facial dans certaines circonstances, et l'utilisation d'armoires de sécurité biologique pour les procédures susceptibles de disperser des agents dans l'air (ce que l'on appelle « aérosolisation »). Les laboratoires BSL-2 sont équipés de portes à fermeture automatique, d'une station de lavage oculaire et d'un autoclave, qui est un appareil spécialisé pour stériliser les matériaux à la vapeur sous pression avant utilisation ou élimination. Les laboratoires BSL-1 peuvent également disposer d'un autoclave.
Les agents BSL-3 peuvent provoquer des infections mortelles par inhalation. Ils peuvent être indigènes ou « exotiques », c'est-à-dire qu'ils proviennent d'un pays étranger et comprennent des agents pathogènes tels que Mycobacterium tuberculosis, Bacillus anthracis, le virus du Nil occidental et le virus de l'immunodéficience humaine (VIH). En raison de la gravité des infections causées par les agents BSL-3, les laboratoires qui travaillent avec ces agents ont besoin d'un accès restreint. Les employés de laboratoire font l'objet d'une surveillance médicale et peuvent être vaccinés contre les microbes avec lesquels ils travaillent. Outre les EPI standard déjà mentionnés, le personnel de laboratoire des laboratoires BSL-3 doit également porter un respirateur et travailler avec des microbes et des agents infectieux dans une armoire de sécurité biologique à tout moment. Les laboratoires BSL-3 ont besoin d'un lavabo mains libres, d'une station de lavage oculaire près de la sortie et de deux ensembles de portes à fermeture automatique et verrouillable à l'entrée. Ces laboratoires sont équipés d'un flux d'air directionnel, ce qui signifie que l'air pur est aspiré à travers le laboratoire des zones propres vers les zones potentiellement contaminées. Cet air ne peut pas être recirculé, un apport constant d'air pur est donc nécessaire.
Les agents BSL-4 sont les plus dangereux et souvent mortels. Ces microbes sont généralement exotiques, se transmettent facilement par inhalation et provoquent des infections pour lesquelles il n'existe aucun traitement ni vaccin. Les exemples incluent le virus Ebola et le virus de Marburg, qui provoquent tous deux des fièvres hémorragiques, et le virus de la variole. Il n'existe qu'un petit nombre de laboratoires aux États-Unis et dans le monde équipés de manière appropriée pour travailler avec ces agents. Outre les précautions relatives au BSL-3, le personnel de laboratoire des installations BSL-4 doit également changer de vêtements à l'entrée du laboratoire, prendre une douche à la sortie et décontaminer tout le matériel à la sortie. Lorsqu'ils travaillent en laboratoire, ils doivent soit porter une combinaison de protection complète avec une alimentation en air désignée, soit effectuer tous leurs travaux dans une enceinte de sécurité biologique dotée d'une alimentation en air filtré par particules à haut rendement (HEPA) et d'un système d'échappement doublement filtré par HEPA. Si vous portez une combinaison, la pression de l'air à l'intérieur de la combinaison doit être supérieure à celle à l'extérieur de la combinaison, de sorte qu'en cas de fuite dans la combinaison, l'air de laboratoire susceptible d'être contaminé ne puisse pas être aspiré dans la combinaison (Figure\(\PageIndex{1}\)). Le laboratoire lui-même doit être situé dans un bâtiment séparé ou dans une partie isolée d'un bâtiment et disposer de son propre système d'alimentation et d'évacuation de l'air, ainsi que de son propre système de décontamination. Les BSL sont résumées dans la Figure\(\PageIndex{2}\).

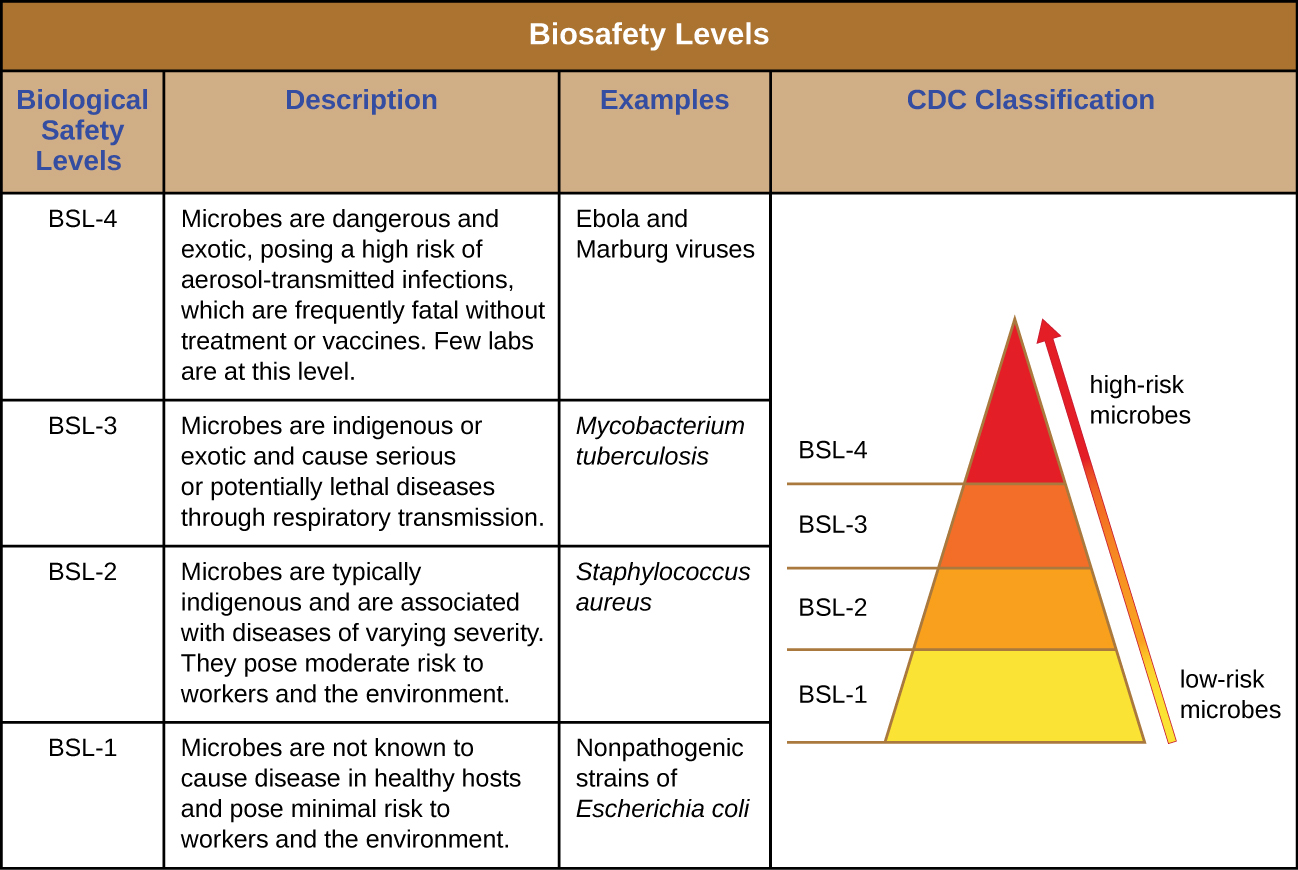
Pour en savoir plus sur les quatre BSL, visitez le site Web du CDC.
Exercice\(\PageIndex{2}\)
Quels sont les facteurs utilisés pour déterminer le BSL nécessaire pour travailler avec un agent pathogène spécifique ?
La stérilisation
Les protocoles les plus extrêmes en matière de contrôle microbien visent à réaliser la stérilisation : élimination complète ou destruction de toutes les cellules végétatives, endospores et virus de l'élément ou de l'environnement ciblé. Les protocoles de stérilisation sont généralement réservés aux environnements de laboratoire, médicaux, manufacturiers et de l'industrie alimentaire, où il peut être impératif que certains articles soient totalement exempts d'agents potentiellement infectieux. La stérilisation peut être réalisée soit par des moyens physiques, tels que l'exposition à une chaleur, une pression ou une filtration à travers un filtre approprié, soit par des moyens chimiques. Les produits chimiques qui peuvent être utilisés pour effectuer la stérilisation sont appelés agents stérilisants. Les stérilisants tuent efficacement tous les microbes et virus et, avec une durée d'exposition appropriée, peuvent également tuer les endospores.
À de nombreuses fins cliniques, une technique aseptique est nécessaire pour éviter la contamination des surfaces stériles. La technique aseptique implique une combinaison de protocoles qui, collectivement, maintiennent la stérilité, ou asepsie, empêchant ainsi la contamination du patient par des microbes et des agents infectieux. Le fait de ne pas pratiquer une technique aseptique lors de nombreux types d'interventions cliniques peut introduire des microbes dans le corps du patient et exposer celui-ci à un risque de septicémie, une réponse inflammatoire systémique à une infection qui se traduit par une forte fièvre, une accélération du rythme cardiaque et respiratoire, un choc et, éventuellement, la mort. Les interventions médicales qui comportent un risque de contamination doivent être effectuées dans un champ stérile, une zone désignée exempte de tous microbes végétatifs, endospores et virus. Les champs stériles sont créés conformément à des protocoles exigeant l'utilisation de matériaux stérilisés, tels que des emballages et des tentures, et à des procédures strictes pour le lavage et l'application de stérilisants. D'autres protocoles sont suivis pour maintenir le champ stérile pendant l'intervention médicale.
Un protocole de stérilisation des aliments, la stérilisation commerciale, utilise de la chaleur à une température suffisamment basse pour préserver la qualité des aliments mais suffisamment élevée pour détruire les agents pathogènes courants responsables des intoxications alimentaires, tels que C. botulinum. Comme le C. botulinum et ses endospores se trouvent couramment dans le sol, ils peuvent facilement contaminer les cultures pendant la récolte, et ces endospores peuvent ensuite germer dans l'environnement anaérobie une fois les aliments mis en conserve. Les boîtes métalliques contenant des aliments contaminés par C. botulinum se gonflent en raison de la production de gaz par le microbe ; les pots contenant des aliments contaminés se gonflent généralement au niveau du couvercle métallique. Pour éliminer le risque de contamination par C. botulinum, les protocoles commerciaux de mise en conserve des aliments sont conçus avec une grande marge d'erreur. Ils supposent une population d'endospores incroyablement importante (10 à 12 par boîte) et visent à réduire cette population à 1 endospore par boîte afin de garantir la sécurité des aliments en conserve. Par exemple, les aliments peu ou moyennement acides sont chauffés à 121 °C pendant au moins 2,52 minutes, soit le temps qu'il faudrait pour réduire une population de 10 à 12 endospores par boîte à une endospore à cette température. Malgré cela, la stérilisation commerciale n'élimine pas la présence de tous les microbes ; elle cible plutôt les agents pathogènes responsables de la détérioration et des maladies d'origine alimentaire, tout en permettant à de nombreux organismes non pathogènes de survivre. Par conséquent, le terme « stérilisation » est un peu erroné dans ce contexte, et la stérilisation commerciale peut être décrite plus précisément comme une « quasi-stérilisation ».
Exercice\(\PageIndex{3}\)
Quelle est la différence entre la stérilisation et la technique aseptique ?
L'Association des technologues en chirurgie publie des normes pour les techniques aseptiques, y compris la création et le maintien d'un champ stérile.
Autres méthodes de contrôle
Les protocoles de stérilisation nécessitent des procédures qui ne sont pas pratiques ou nécessaires dans de nombreux contextes. Diverses autres méthodes sont utilisées en milieu clinique et non clinique pour réduire la charge microbienne sur les objets. Bien que les termes de ces méthodes soient souvent utilisés de manière interchangeable, il existe des distinctions importantes (Figure\(\PageIndex{3}\)).
Le processus de désinfection inactive la plupart des microbes à la surface d'un parasite en utilisant des produits chimiques antimicrobiens ou de la chaleur. Comme certains microbes persistent, l'article désinfecté n'est pas considéré comme stérile. Idéalement, les désinfectants doivent être à action rapide, stables, faciles à préparer, peu coûteux et faciles à utiliser. Le vinaigre est un exemple de désinfectant naturel ; son acidité tue la plupart des microbes. Les désinfectants chimiques, tels que les agents de blanchiment au chlore ou les produits contenant du chlore, sont utilisés pour nettoyer les surfaces non vivantes telles que les bancs de laboratoire, les surfaces cliniques et les lavabos de salle de bains. La désinfection classique ne mène pas à la stérilisation, car les endospores ont tendance à survivre même lorsque toutes les cellules végétatives ont été tuées.
Contrairement aux désinfectants, les antiseptiques sont des produits chimiques antimicrobiens pouvant être utilisés sans danger sur la peau ou les tissus vivants. Le peroxyde d'hydrogène et l'alcool isopropylique sont des exemples d'antiseptiques. Le processus d'application d'un antiseptique s'appelle antisepsie. Outre les caractéristiques d'un bon désinfectant, les antiseptiques doivent également être sélectivement efficaces contre les microorganismes et capables de pénétrer profondément dans les tissus sans provoquer de lésions tissulaires.
Le type de protocole requis pour atteindre le niveau de propreté souhaité dépend de l'article à nettoyer. Par exemple, ceux utilisés cliniquement sont classés dans les catégories critiques, semi-critiques et non critiques. Les articles critiques doivent être stériles car ils seront utilisés à l'intérieur du corps, pénétrant souvent dans des tissus stériles ou dans la circulation sanguine ; les instruments chirurgicaux, les cathéters et les liquides intraveineux sont des exemples d'articles critiques. Les endoscopes gastro-intestinaux et divers types d'appareils destinés aux thérapies respiratoires sont des exemples d'articles semi-critiques ; ils peuvent entrer en contact avec les muqueuses ou la peau non intacte mais ne pénètrent pas dans les tissus. Les articles semi-critiques n'ont généralement pas besoin d'être stérilisés mais nécessitent un niveau élevé de désinfection. Les articles qui peuvent entrer en contact avec la peau intacte sans la pénétrer ne sont pas des articles critiques ; par exemple, le linge de lit, les meubles, les béquilles, les stéthoscopes et les brassards pour la tension artérielle. Ces articles doivent être propres mais pas hautement désinfectés.
Le lavage des mains est un exemple de dégermage, qui permet de réduire considérablement le nombre de microbes en frottant doucement les tissus vivants, le plus souvent la peau, avec un produit chimique doux (par exemple du savon) afin d'éviter la transmission de microbes pathogènes. L'essuyage de la peau à l'aide d'un tampon imbibé d'alcool au site d'injection est un autre exemple de dégermage. Ces méthodes de dégermation éliminent la plupart des microbes (mais pas tous) de la surface de la peau.
Le terme « désinfection » désigne le nettoyage des parasites afin d'éliminer suffisamment de microbes pour atteindre des niveaux considérés comme sûrs pour la santé publique. Par exemple, les lave-vaisselle commerciaux utilisés dans l'industrie de la restauration utilisent généralement de l'eau et de l'air très chauds pour le lavage et le séchage ; les températures élevées tuent la plupart des microbes et désinfectent la vaisselle. Les surfaces des chambres d'hôpital sont généralement désinfectées à l'aide d'un désinfectant chimique afin de prévenir la transmission de maladies entre patients. La figure\(\PageIndex{3}\) résume les protocoles, les définitions, les applications et les agents courants utilisés pour contrôler la croissance microbienne.

Exercice\(\PageIndex{4}\)
- Quelle est la différence entre un désinfectant et un antiseptique ?
- Lequel est le plus efficace pour éliminer les microbes d'un produit : désinfection, dégermage ou stérilisation ? Expliquez.
Orientation clinique : partie 2
Le médecin de Roberta soupçonnait qu'une infection bactérienne était à l'origine de sa forte fièvre soudaine, de douleurs abdominales et de ses urines sanglantes. Sur la base de ces symptômes, le médecin a diagnostiqué une infection des voies urinaires (UTI). Une grande variété de bactéries peuvent provoquer des infections urinaires, qui surviennent généralement lorsque des bactéries du tractus gastro-intestinal inférieur sont introduites dans les voies urinaires. Cependant, la récente opération de calculs biliaires de Roberta a amené le médecin à soupçonner qu'elle avait contracté une infection nosocomiale (contractée à l'hôpital) au cours de son opération. Le médecin a prélevé un échantillon d'urine et a ordonné une culture d'urine pour vérifier la présence de globules blancs, de globules rouges et de bactéries. Les résultats de ce test aideraient à déterminer la cause de l'infection. Le médecin a également prescrit un traitement antibiotique à base de ciprofloxacine, convaincu qu'il éliminerait l'infection de Roberta.
Exercice\(\PageIndex{5}\)
De quelles manières les bactéries ont-elles pu être introduites dans les voies urinaires de Roberta lors de son opération ?
Mesure du contrôle microbien
Les méthodes physiques et chimiques de contrôle microbien qui tuent le microorganisme ciblé sont identifiées par le suffixe -cide (ou -cidal). Le préfixe indique le type de microbe ou d'agent infectieux tué par la méthode de traitement : le bactéricide tue les bactéries, le viricide tue ou inactive les virus et le fongicide tue les champignons. D'autres méthodes ne tuent pas les organismes mais freinent leur croissance, ce qui rend leur population statique ; ces méthodes sont identifiées par le suffixe -stat (ou -static). Par exemple, les traitements bactériostatiques inhibent la croissance des bactéries, tandis que les traitements fongistatiques inhibent la croissance des champignons. Les facteurs qui déterminent si un traitement particulier est -cide ou statique incluent les types de microorganismes ciblés, la concentration du produit chimique utilisé et la nature du traitement appliqué.
Bien que les traitements statiques ne tuent pas réellement les agents infectieux, ils sont souvent moins toxiques pour les humains et les autres animaux et peuvent également mieux préserver l'intégrité de l'article traité. Ces traitements sont généralement suffisants pour contrôler la population microbienne d'un article. La toxicité réduite de certains de ces produits chimiques statiques permet également de les imprégner en toute sécurité dans les plastiques afin d'empêcher la croissance de microbes sur ces surfaces. Ces plastiques sont utilisés dans des produits tels que des jouets pour enfants et des planches à découper pour la préparation des aliments. Lorsqu'ils sont utilisés pour traiter une infection, les traitements statiques sont généralement suffisants chez une personne par ailleurs en bonne santé, empêchant le pathogène de se multiplier et permettant ainsi au système immunitaire de l'individu d'éliminer l'infection.
Le degré de contrôle microbien peut être évalué à l'aide d'une courbe de mort microbienne pour décrire les progrès et l'efficacité d'un protocole particulier. En cas d'exposition à un protocole de contrôle microbien particulier, un pourcentage fixe des microbes de la population mourra. Comme le taux de mortalité reste constant même lorsque la taille de la population varie, le pourcentage de personnes tuées est une information plus utile que le nombre absolu de microbes tués. Les courbes de mort sont souvent tracées sous forme de tracés semi-logarithmiques, tout comme les courbes de croissance microbienne, car la réduction du nombre de microorganismes est généralement logarithmique (Figure\(\PageIndex{4}\)). Le temps nécessaire pour qu'un protocole spécifique produise une diminution d'un ordre de grandeur du nombre d'organismes, ou la mort de 90 % de la population, est appelé temps de réduction décimal (DRT) ou valeur D.
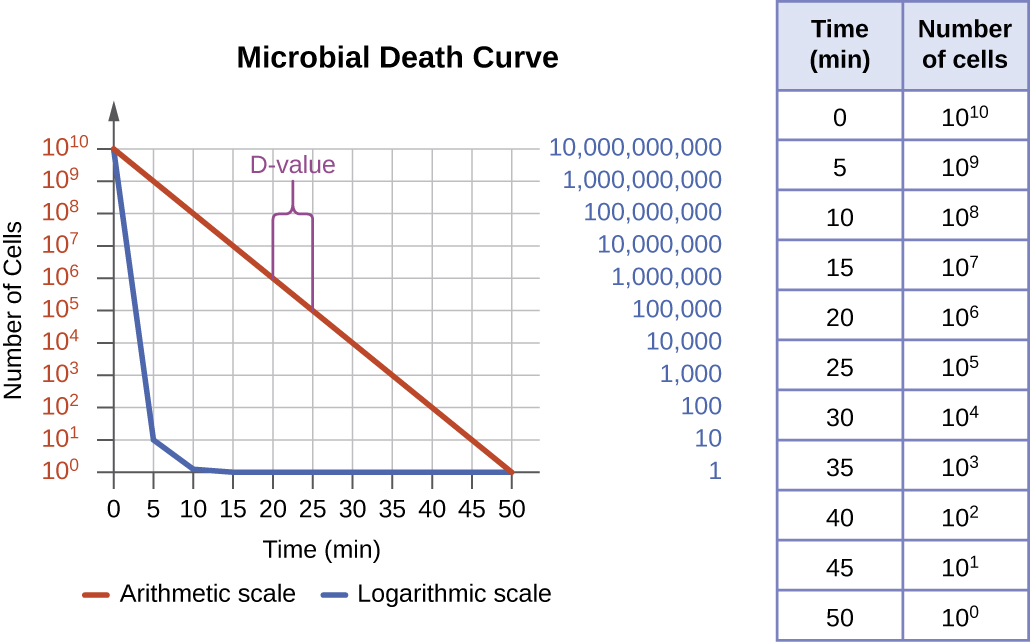
Plusieurs facteurs contribuent à l'efficacité d'un agent désinfectant ou d'un protocole de contrôle microbien. Tout d'abord, comme le montre la figure\(\PageIndex{4}\), la durée de l'exposition est importante. Des temps d'exposition plus longs tuent davantage de microbes Comme la mort microbienne d'une population exposée à un protocole spécifique est logarithmique, il faut plus de temps pour tuer une charge de population élevée qu'une charge de population faible exposée au même protocole. Un temps de traitement plus court (mesuré en multiples de la valeur D) est nécessaire lorsque l'on commence avec un plus petit nombre d'organismes. L'efficacité dépend également de la sensibilité de l'agent à cet agent ou à ce protocole de désinfection. La concentration de l'agent désinfectant ou l'intensité de l'exposition sont également importantes. Par exemple, des températures et des concentrations plus élevées de désinfectants tuent les microbes plus rapidement et plus efficacement. Les conditions qui limitent le contact entre l'agent et les cellules cibles (par exemple, la présence de fluides corporels, de tissus, de débris organiques (par exemple, de la boue ou des matières fécales) ou de biofilms sur les surfaces, augmentent le temps de nettoyage ou l'intensité du protocole de contrôle microbien requis pour atteindre le niveau de propreté souhaité. . Tous ces facteurs doivent être pris en compte lors du choix du protocole approprié pour contrôler la croissance microbienne dans une situation donnée.
Exercice\(\PageIndex{6}\)
- Quelles sont les deux raisons possibles de choisir un traitement bactériostatique plutôt qu'un traitement bactéricide ?
- Nommez au moins deux facteurs qui peuvent compromettre l'efficacité d'un agent désinfectant.
Concepts clés et résumé
- Les objets inanimés qui peuvent héberger des microbes et contribuer à leur transmission sont appelés vecteurs de propagation. Le niveau de propreté requis pour un objet contaminé dépend à la fois de l'utilisation de l'objet et de l'agent infectieux par lequel l'article peut être contaminé.
- Les CDC et les NIH ont établi quatre niveaux de sécurité biologique (BSL) pour les laboratoires effectuant des recherches sur les agents infectieux. Chaque niveau est conçu pour protéger le personnel du laboratoire et la communauté. Ces BSL sont déterminées par l'infectiosité de l'agent, sa facilité de transmission et la gravité potentielle de la maladie, ainsi que par le type de travail effectué avec l'agent.
- La désinfection élimine les agents pathogènes potentiels d'un produit contaminé, tandis que l'antisepsie utilise des produits chimiques antimicrobiens suffisamment sûrs pour les tissus ; dans les deux cas, la charge microbienne est réduite, mais des microbes peuvent subsister à moins que le produit chimique utilisé ne soit suffisamment puissant pour être stérilisant.
- Le degré de propreté (stérilisation par rapport à une désinfection de haut niveau par rapport à une propreté générale) requis pour les articles utilisés en clinique dépend du fait que l'article entrera en contact avec des tissus stériles (élément critique), des muqueuses (article semi-critique) ou intact peau (élément non critique).
- Les interventions médicales présentant un risque de contamination doivent être effectuées dans un champ stérile maintenu par une technique aseptique appropriée afin de prévenir la septicémie.
- La stérilisation est nécessaire pour certaines applications médicales ainsi que dans l'industrie alimentaire, où les endospores de Clostridium botulinum sont détruites par des protocoles de stérilisation commerciaux.
- Les méthodes physiques ou chimiques visant à contrôler la croissance microbienne qui entraîne la mort du microbe sont indiquées par les suffixes -cide ou -cidal (par exemple, comme pour les bactéricides, les viricides et les fongicides), tandis que celles qui inhibent la croissance microbienne sont indiqué par les suffixes -stat ou -static (par exemple, bactériostatique, fongistatique).
- Les courbes de mort microbienne indiquent le déclin logarithmique des microbes vivants exposés à une méthode de contrôle microbien. Le temps nécessaire à un protocole pour obtenir une réduction de 1 log (90 %) de la population microbienne est le temps de réduction décimal, ou valeur D.
- Lors du choix d'un protocole de contrôle microbien, les facteurs à prendre en compte incluent la durée de l'exposition, le type de microbe ciblé, sa sensibilité au protocole, l'intensité du traitement, la présence de substances organiques susceptibles d'interférer avec le protocole et les conditions environnementales susceptibles de modifier efficacité du protocole.
Notes
- 1 Centres américains pour le contrôle et la prévention des maladies. « Reconnaître les niveaux de biosécurité. » http://www.cdc.gov/training/quicklearns/biosafety/. Consulté le 7 juin 2016.


