11.5 : Mutations
- Page ID
- 187674
Objectifs d'apprentissage
- Comparez les mutations ponctuelles et les mutations par décalage de cadre
- Décrire les différences entre le faux sens, l'absurdité et les mutations silencieuses
- Décrire les différences entre la réparation à la lumière et l'obscurité
- Expliquer comment agissent les différents mutagènes
- Expliquer pourquoi le test d'Ames peut être utilisé pour détecter des substances cancérigènes
- Analyser des séquences d'ADN et identifier des exemples de types de mutations
Une mutation est une modification héréditaire de la séquence d'ADN d'un organisme. L'organisme qui en résulte, appelé mutant, peut présenter un changement de phénotype reconnaissable par rapport au type sauvage, qui est le phénotype le plus couramment observé dans la nature. Une modification de la séquence d'ADN est transmise à l'ARNm par transcription et peut entraîner une modification de la séquence d'acides aminés dans une protéine lors de la traduction. Comme les protéines assurent la grande majorité des fonctions cellulaires, une modification de la séquence d'acides aminés d'une protéine peut entraîner une modification du phénotype de la cellule et de l'organisme.
Effets des mutations sur la séquence d'ADN
Il existe plusieurs types de mutations qui sont classées en fonction de la manière dont la molécule d'ADN est modifiée. Un type, appelé mutation ponctuelle, affecte une base unique et se produit le plus souvent lorsqu'une base est substituée ou remplacée par une autre. Les mutations résultent également de l'ajout d'une ou de plusieurs bases, appelé insertion, ou du retrait d'une ou de plusieurs bases, appelé délétion.
Exercice\(\PageIndex{1}\)
Quel type de mutation se produit lorsqu'un gène possède deux nucléotides de moins dans sa séquence ?
Effets des mutations sur la structure et la fonction des protéines
Les mutations ponctuelles peuvent avoir un large éventail d'effets sur la fonction des protéines (Figure\(\PageIndex{1}\)). En raison de la dégénérescence du code génétique, une mutation ponctuelle entraîne généralement l'incorporation du même acide aminé dans le polypeptide obtenu malgré le changement de séquence. Ce changement n'aurait aucun effet sur la structure de la protéine et est donc appelé mutation silencieuse. Une fausse mutation entraîne l'incorporation d'un acide aminé différent dans le polypeptide obtenu. L'effet d'une fausse mutation dépend de la différence chimique entre le nouvel acide aminé et l'acide aminé de type sauvage. La localisation de l'acide aminé modifié au sein de la protéine est également importante. Par exemple, si l'acide aminé modifié fait partie du site actif de l'enzyme, l'effet de la mutation fausse peut être significatif. De nombreuses mutations erronées se traduisent par des protéines qui sont toujours fonctionnelles, du moins dans une certaine mesure. Parfois, les effets de mutations erronées peuvent n'être apparents que dans certaines conditions environnementales ; ces mutations erronées sont appelées mutations conditionnelles. Dans de rares cas, une fausse mutation peut être bénéfique. Dans de bonnes conditions environnementales, ce type de mutation peut conférer un avantage sélectif à l'organisme qui l'héberge. Un autre type de mutation ponctuelle, appelée mutation absurde, convertit un codon codant pour un acide aminé (un codon sensoriel) en un codon stop (un codon absurde). Les mutations absurdes entraînent la synthèse de protéines plus courtes que le type sauvage et généralement non fonctionnelles.
Les suppressions et les insertions provoquent également divers effets. Les codons étant des triplets de nucléotides, les insertions ou les délétions par groupes de trois nucléotides peuvent entraîner l'insertion ou la délétion d'un ou de plusieurs acides aminés et ne pas avoir d'effets significatifs sur la fonctionnalité de la protéine résultante. Cependant, les mutations par décalage de trame, causées par des insertions ou des délétions d'un certain nombre de nucléotides qui ne sont pas un multiple de trois, sont extrêmement problématiques car il en résulte un décalage dans le cadre de lecture (Figure\(\PageIndex{1}\)). Comme les ribosomes lisent l'ARNm dans les codons triplets, les mutations par décalage de cadre peuvent modifier chaque acide aminé après le point de mutation. La nouvelle trame de lecture peut également comprendre un codon d'arrêt avant la fin de la séquence de codage. Par conséquent, les protéines fabriquées à partir de gènes contenant des mutations par décalage de cadre sont presque toujours non fonctionnelles.
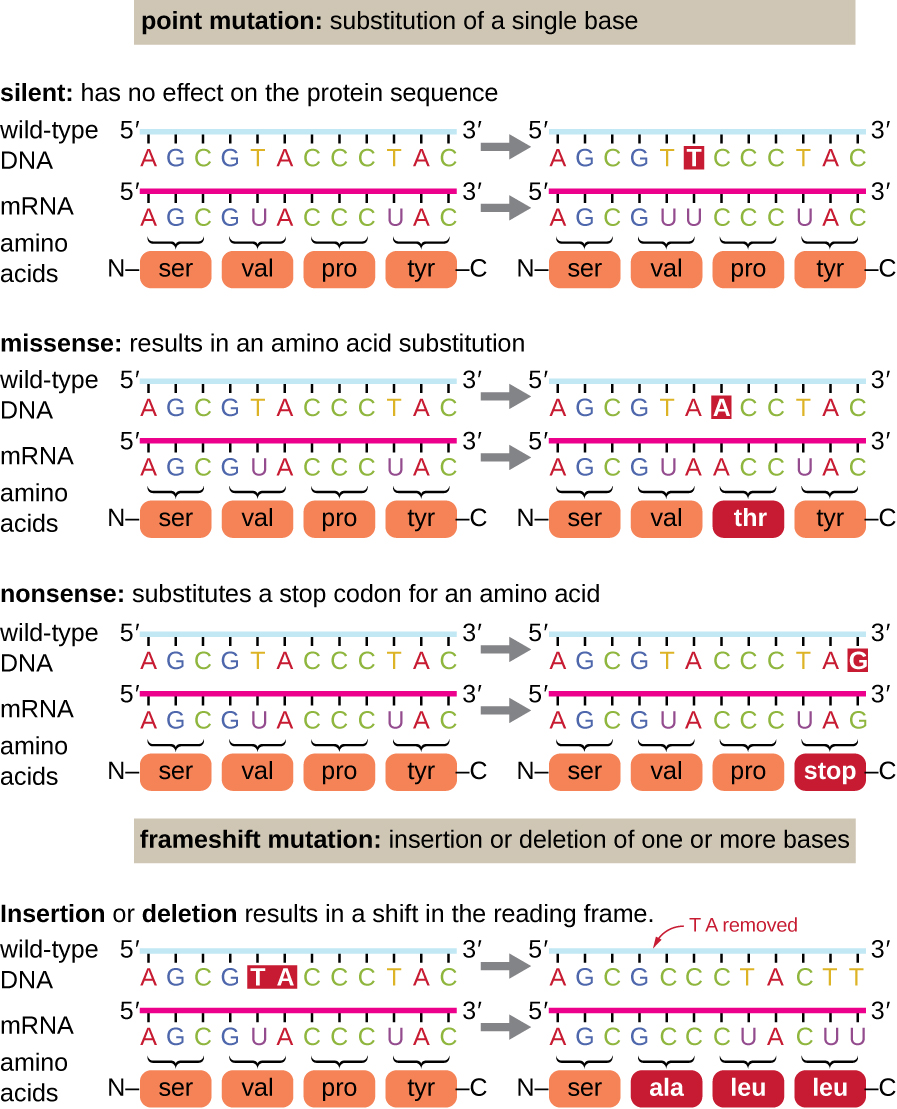
Exercice\(\PageIndex{2}\)
- Quelles sont les raisons pour lesquelles une modification nucléotidique du gène d'une protéine peut ne pas avoir d'effet sur le phénotype de ce gène ?
- Est-il possible d'insérer trois nucléotides ensemble après le cinquième nucléotide dans un gène codant pour une protéine pour produire une protéine plus courte que la normale ? Comment ou pas ?
Une mutation bénéfique
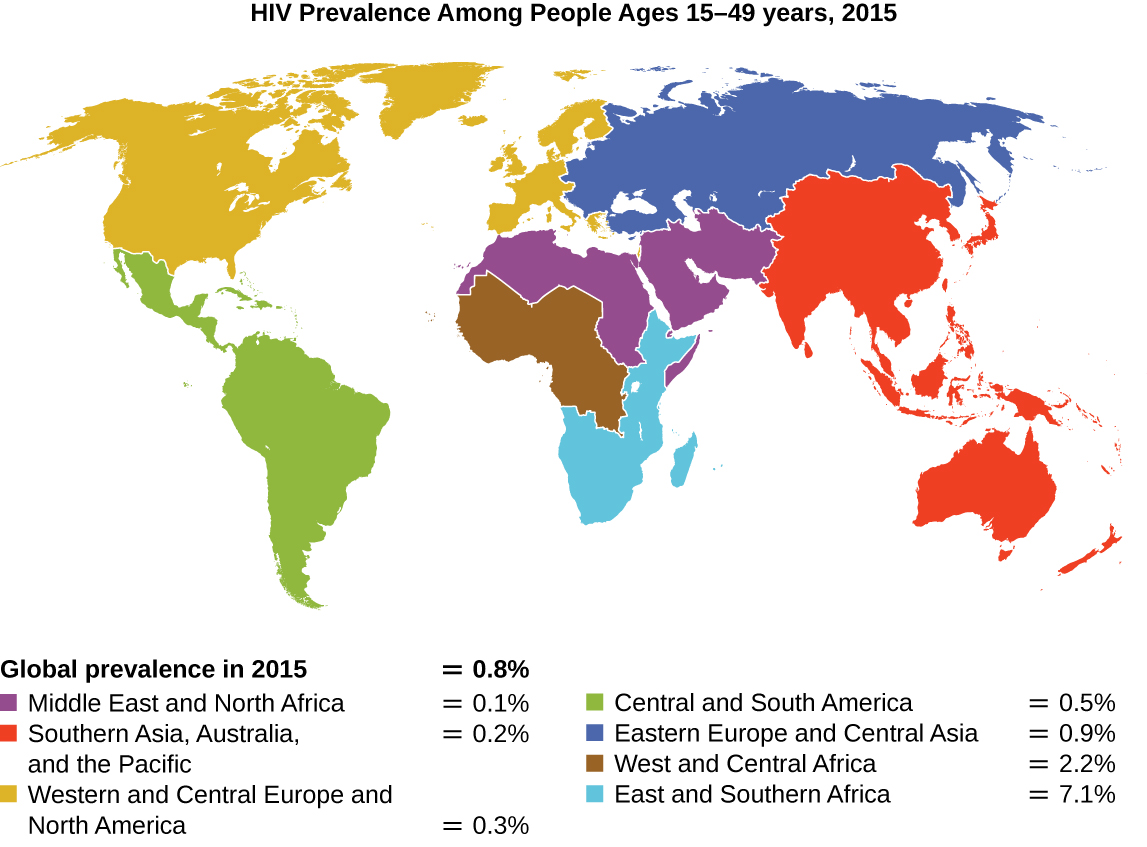
Depuis que le premier cas d'infection par le virus de l'immunodéficience humaine (VIH) a été signalé en 1981, près de 40 millions de personnes sont décédées des suites de l'infection par le VIH 1, le virus responsable du syndrome d'immunodéficience acquise (SIDA). Le virus cible les lymphocytes T auxiliaires qui jouent un rôle clé en comblant la réponse immunitaire innée et adaptative, en infectant et en tuant les cellules normalement impliquées dans la réponse de l'organisme à l'infection. Il n'existe aucun remède contre l'infection par le VIH, mais de nombreux médicaments ont été mis au point pour ralentir ou bloquer la progression du virus. Bien que des individus puissent être infectés dans le monde entier, la prévalence la plus élevée chez les personnes âgées de 15 à 49 ans se trouve en Afrique subsaharienne, où près d'une personne sur 20 est infectée, représentant plus de 70 % des infections dans le monde2 (Figure\(\PageIndex{2}\)). Malheureusement, c'est aussi une région du monde où les stratégies de prévention et les médicaments pour traiter l'infection font le plus défaut.
Ces dernières années, l'intérêt scientifique a été suscité par la découverte de quelques individus du nord de l'Europe résistants à l'infection par le VIH. En 1998, le généticien américain Stephen J. O'Brien des National Institutes of Health (NIH) et ses collègues ont publié les résultats de leur analyse génétique de plus de 4 000 individus. Ces études indiquent que de nombreuses personnes d'origine eurasienne (jusqu'à 14 % dans certains groupes ethniques) présentent une mutation de délétion, appelée CCR5-delta 32, dans le gène codant pour CCR5. Le CCR5 est un corécepteur situé à la surface des lymphocytes T qui est nécessaire à la pénétration de nombreuses souches du virus dans la cellule hôte. La mutation entraîne la production d'un récepteur auquel le VIH ne peut pas se lier efficacement et bloque ainsi l'entrée du virus. Les personnes homozygotes pour cette mutation ont une sensibilité considérablement réduite à l'infection par le VIH, et celles qui sont hétérozygotes bénéficient également d'une certaine protection contre l'infection.
On ne sait pas exactement pourquoi les personnes d'origine nord-européenne, en particulier, sont porteuses de cette mutation, mais sa prévalence semble être la plus élevée dans le nord de l'Europe et diminue régulièrement au fur et à mesure que l'on se déplace vers le sud. Les recherches indiquent que la mutation était présente avant l'apparition du VIH et qu'elle pourrait avoir été sélectionnée dans des populations européennes à la suite d'une exposition à la peste ou à la variole. Cette mutation peut protéger les individus de la peste (causée par la bactérie Yersinia pestis) et de la variole (causée par le virus de la variole) car ce récepteur peut également être impliqué dans ces maladies. L'âge de cette mutation est discutable, mais les estimations suggèrent qu'elle est apparue entre 1875 et 225 ans et qu'elle s'est peut-être propagée depuis le nord de l'Europe à la suite d'invasions vikings.
Cette découverte passionnante a ouvert de nouvelles perspectives dans la recherche sur le VIH, notamment la recherche de médicaments pour bloquer la liaison du CCR5 au VIH chez les personnes dépourvues de la mutation. Bien qu'il soit possible de tester l'ADN pour déterminer quelles personnes sont porteuses de la mutation CCR5-delta 32, il existe des cas documentés de personnes homozygotes pour la mutation qui contractent le VIH. Pour cette raison, les tests ADN pour détecter la mutation ne sont pas largement recommandés par les autorités de santé publique afin de ne pas encourager les comportements à risque chez les porteurs de la mutation. Néanmoins, l'inhibition de la liaison du VIH au CCR5 continue d'être une stratégie valable pour le développement de traitements médicamenteux pour les personnes infectées par le VIH.
Causes des mutations
Des erreurs dans le processus de réplication de l'ADN peuvent provoquer des mutations spontanées. Le taux d'erreur de l'ADN polymérase est d'une base incorrecte par milliard de paires de bases répliquées. L'exposition à des mutagènes peut provoquer des mutations induites, qui sont différents types d'agents chimiques ou de rayonnements (tableau\(\PageIndex{1}\)). L'exposition à un mutagène peut multiplier par plus de 1000 le taux de mutation. Les mutagènes sont souvent également des agents cancérigènes, c'est-à-dire des agents qui causent le cancer. Cependant, alors que presque tous les agents cancérigènes sont mutagènes, tous ne le sont pas nécessairement.
Mutagènes chimiques
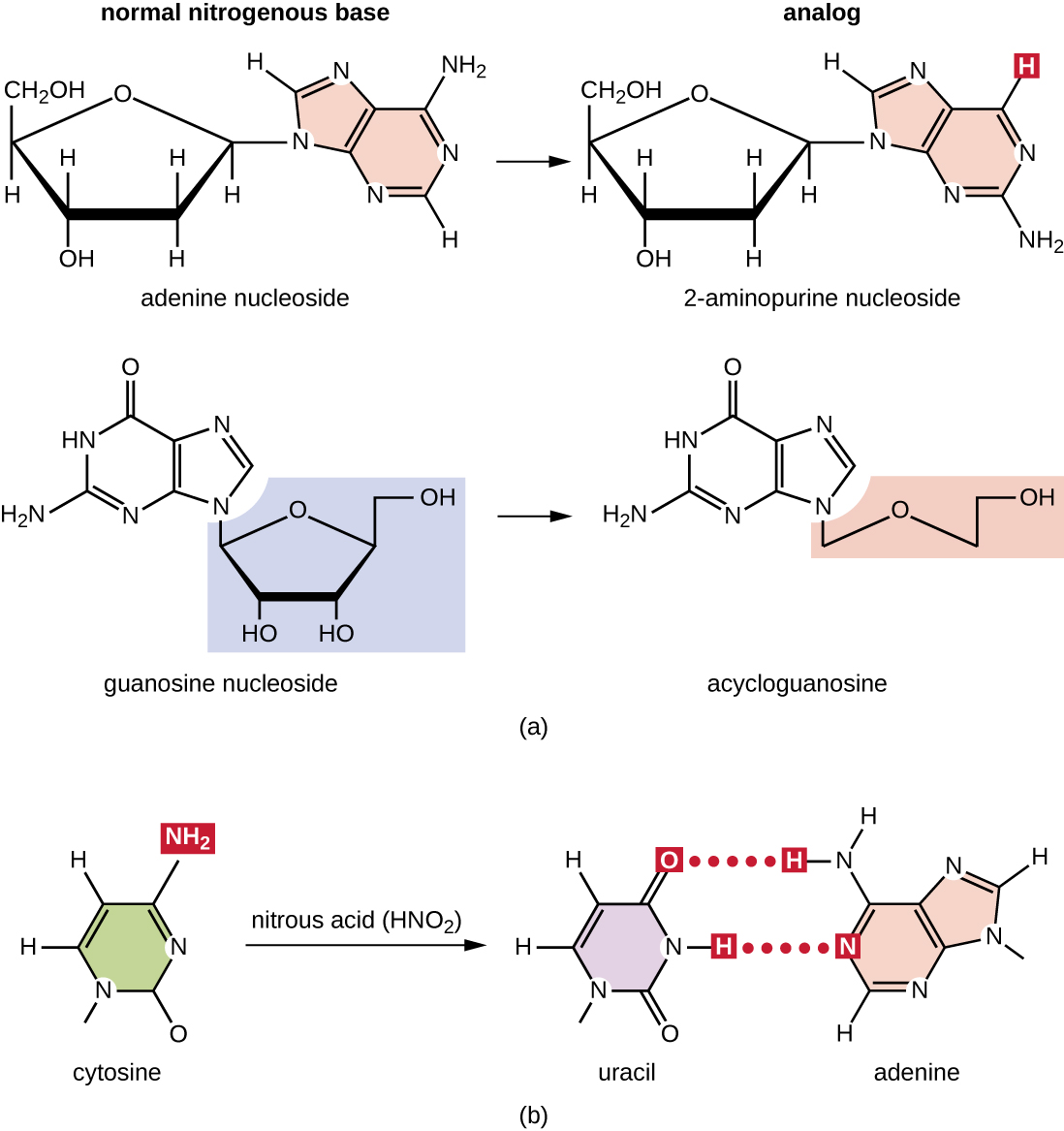
Différents types de mutagènes chimiques interagissent directement avec l'ADN, soit en agissant comme analogues nucléosidiques, soit en modifiant les bases nucléotidiques. Les substances chimiques appelées analogues nucléosidiques ont une structure similaire à celle des bases nucléotidiques normales et peuvent être incorporées dans l'ADN pendant la réplication (Figure\(\PageIndex{3}\)). Ces analogues de base induisent des mutations parce qu'ils ont souvent des règles d'appariement de bases différentes de celles des bases qu'ils remplacent. D'autres mutagènes chimiques peuvent modifier les bases normales de l'ADN, ce qui entraîne différentes règles d'appariement des bases. Par exemple, l'acide nitreux désamine la cytosine et la convertit en uracile. L'uracile s'associe ensuite à l'adénine lors d'un cycle de réplication ultérieur, entraînant la conversion d'une paire de bases GC en une paire de bases AT. L'acide nitreux désamine également l'adénine en hypoxanthine, dont les bases s'associent à la cytosine au lieu de la thymine, ce qui entraîne la conversion d'une paire de bases TA en une paire de bases CG.
Les mutagènes chimiques appelés agents intercalants agissent différemment. Ces molécules glissent entre les bases azotées empilées de la double hélice de l'ADN, déformant la molécule et créant un espacement atypique entre les paires de bases nucléotidiques (Figure\(\PageIndex{4}\)). Par conséquent, lors de la réplication de l'ADN, l'ADN polymérase peut soit ignorer la réplication de plusieurs nucléotides (créant une délétion), soit insérer des nucléotides supplémentaires (création d'une insertion). L'un ou l'autre résultat peut entraîner une mutation par décalage de cadre. Les produits de combustion tels que les hydrocarbures aromatiques polycycliques sont des agents intercalants particulièrement dangereux qui peuvent provoquer des cancers provoqués par des mutations. Les agents intercalants bromure d'éthidium et acridine orange sont couramment utilisés en laboratoire pour colorer l'ADN à des fins de visualisation et sont des mutagènes potentiels.
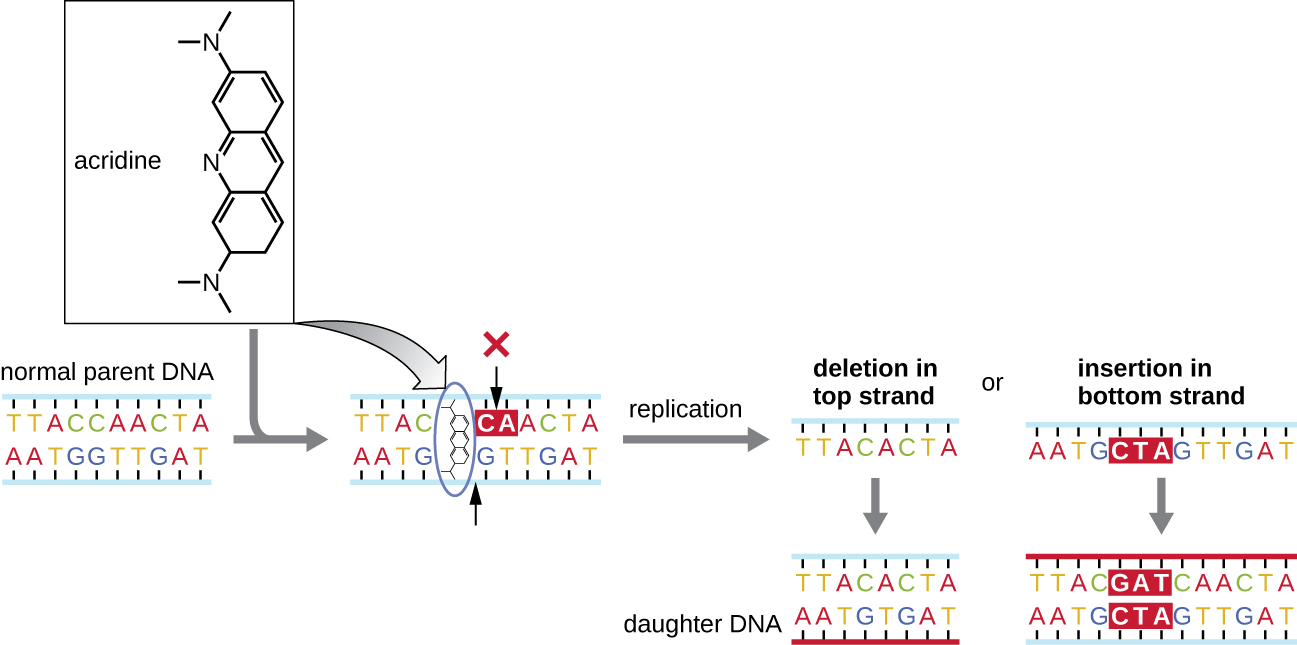
Radiation
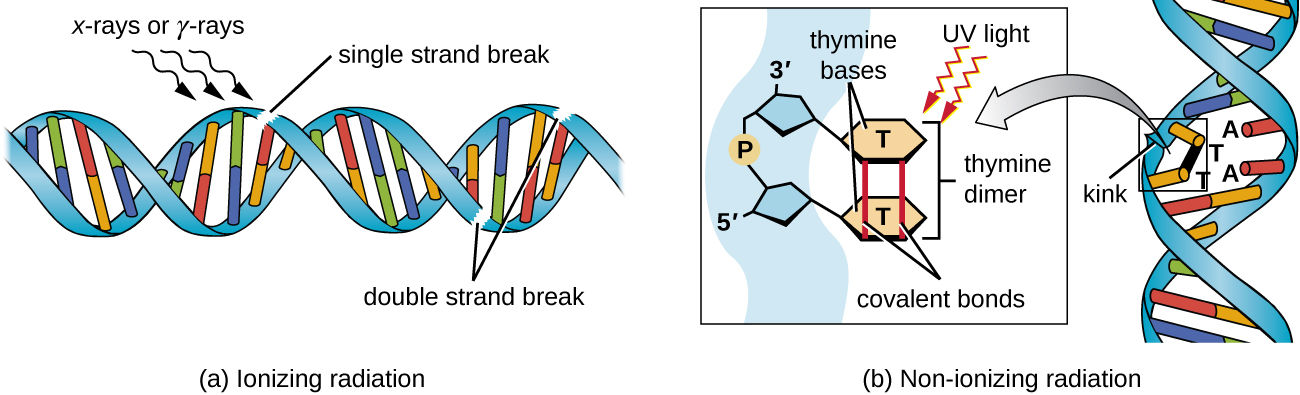
L'exposition à des rayonnements ionisants ou non ionisants peut provoquer des mutations dans l'ADN, bien que par des mécanismes différents. Les rayonnements ionisants puissants tels que les rayons X et les rayons gamma peuvent provoquer des ruptures simples et doubles du squelette de l'ADN en formant des radicaux hydroxyles lors de l'exposition aux rayonnements (Figure\(\PageIndex{5}\)). Les rayonnements ionisants peuvent également modifier les bases ; par exemple, la désamination de la cytosine en uracile, analogue à l'action de l'acide nitreux. 3 L'exposition aux rayonnements ionisants est utilisée pour tuer les microbes afin de stériliser les dispositifs médicaux et les aliments, en raison de son effet non spécifique dramatique sur l'ADN, les protéines et d'autres composants cellulaires (voir Utilisation de méthodes physiques pour contrôler les microorganismes).
Les rayonnements non ionisants, comme la lumière ultraviolette, ne sont pas suffisamment énergétiques pour provoquer ce type de changements chimiques. Cependant, les rayonnements non ionisants peuvent induire la formation de dimères entre deux bases pyrimidiques adjacentes, généralement deux thymines, au sein d'un brin nucléotidique. Au cours de la formation du dimère de thymine, les deux thymines adjacentes se lient de manière covalente et, si elles ne sont pas réparées, la réplication et la transcription de l'ADN sont bloquées à ce stade. L'ADN polymérase peut continuer et répliquer le dimère de manière incorrecte, ce qui peut entraîner un décalage de la trame ou des mutations ponctuelles.
| Agents mutagènes | Mode d'action | Effet sur l'ADN | Type de mutation résultant |
|---|---|---|---|
| Analogues de nucléosides | |||
| 2-aminopurine | Est inséré à la place de A mais la base est associée à C | Convertit AT en paire de base GC | Point |
| 5-bromouracile | Est inséré à la place de T mais la base est associée à G | Convertit AT en paire de base GC | Point |
| Agent de modification des nucléotides | |||
| Oxyde d'azote | Désamine C à U | Convertit GC en paire de base AT | Point |
| Agents d'intercalation | |||
| Orange acridine, bromure d'éthidium, hydrocarbures aromatiques polycycliques | Déforme la double hélice, crée un espacement inhabituel entre les nucléotides | Présente de petites suppressions et insertions | Frameshift |
| Rayonnement ionisant | |||
| Radiographies, rayons gamma | Forme des radicaux hydroxyles | Provoque des cassures de l'ADN simple et double brin | Les mécanismes de réparation peuvent introduire des mutations |
| Radiographies, rayons gamma | Modifie les bases (par exemple, désamine C en U) | Convertit GC en paire de base AT | Point |
| Rayonnement non ionisant | |||
| ultraviolets | Forme des dimères de pyrimidine (généralement de thymine) | Provoque des erreurs de réplication de | Frameshift ou point |
Exercice\(\PageIndex{3}\)
- Comment un analogue de base introduit-il une mutation ?
- Comment un agent intercalant introduit-il une mutation ?
- Quel type de mutagène cause les dimères de thymine ?
Réparation d'ADN
Le processus de réplication de l'ADN est très précis, mais des erreurs peuvent survenir spontanément ou être induites par des mutagènes. Des erreurs non corrigées peuvent avoir de graves conséquences sur le phénotype. Les cellules ont développé plusieurs mécanismes de réparation afin de minimiser le nombre de mutations qui persistent.
Relecture
La plupart des erreurs introduites lors de la réplication de l'ADN sont rapidement corrigées par la plupart des ADN polymérases grâce à une fonction appelée relecture. Lors de la relecture, l'ADN polymérase lit la base nouvellement ajoutée, en s'assurant qu'elle est complémentaire à la base correspondante dans le brin modèle avant d'ajouter la base suivante. Si une base incorrecte a été ajoutée, l'enzyme effectue une coupure pour libérer le mauvais nucléotide et une nouvelle base est ajoutée.
Réparation des défauts d'
Certaines erreurs introduites lors de la réplication sont corrigées peu de temps après le déplacement de la machine de réplication. Ce mécanisme s'appelle la réparation des mésappariements. Les enzymes impliquées dans ce mécanisme reconnaissent le nucléotide ajouté incorrectement, l'excisent et le remplacent par la base correcte. La réparation des mésappariements dirigée par le méthyle chez E. coli en est un exemple. L'ADN est hémiméthylé. Cela signifie que le brin parental est méthylé alors que le brin fille nouvellement synthétisé ne l'est pas. Il faut plusieurs minutes avant que le nouveau brin ne soit méthylé. Les protéines MuTs, MutL et MuTH se lient au site hémiméthylé où se trouve le nucléotide incorrect. MuTH coupe le brin non méthylé (le nouveau brin). Une exonucléase enlève une partie du brin (y compris le nucléotide incorrect). Le vide formé est ensuite comblé par de l'ADN pol III et de la ligase.
Réparation de dimères de thymine
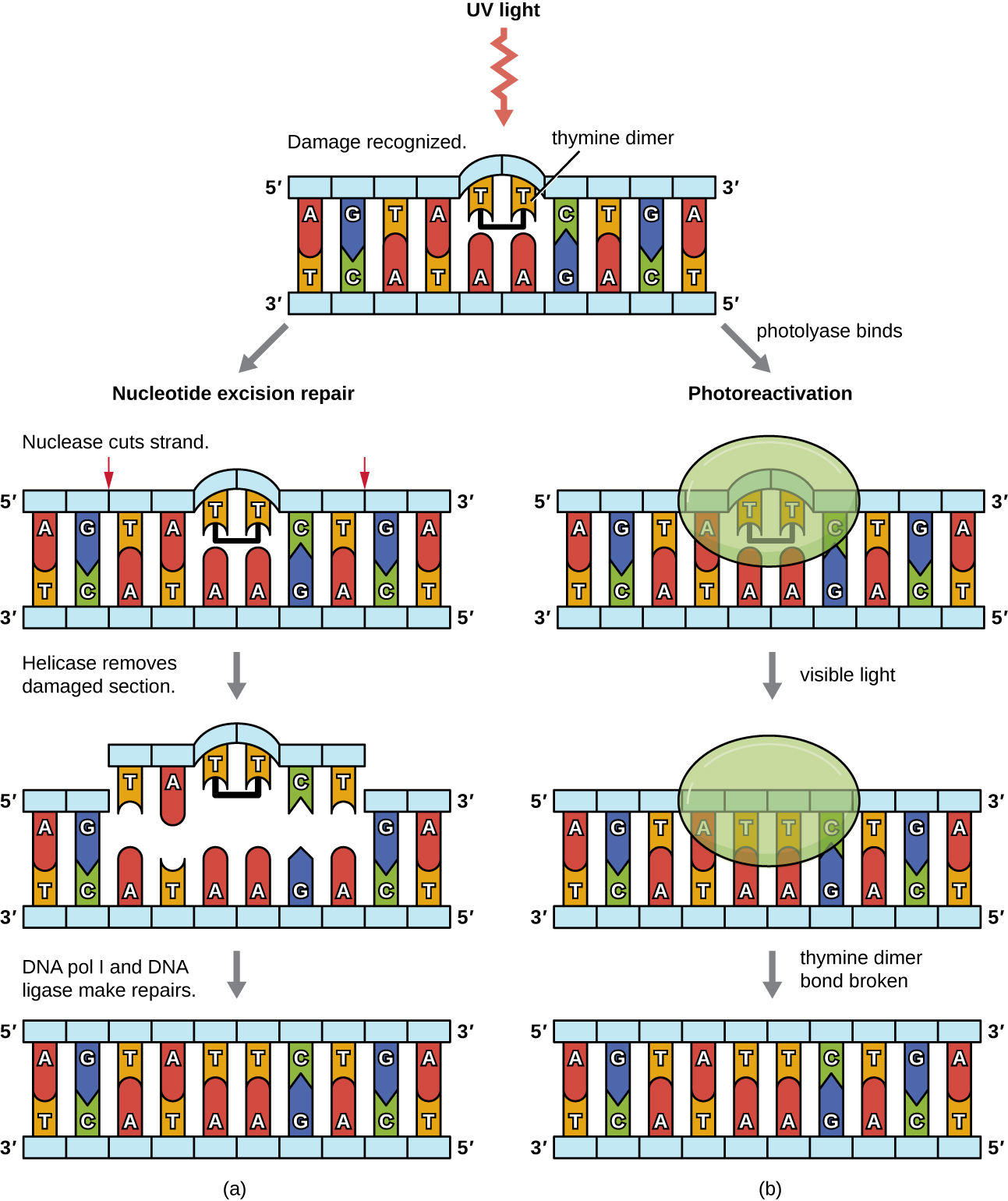
Comme la production de dimères de thymine est courante (de nombreux organismes ne peuvent pas éviter les rayons ultraviolets), des mécanismes ont évolué pour réparer ces lésions. Lors de la réparation par excision des nucléotides (également appelée réparation à l'obscurité), les enzymes éliminent le dimère de pyrimidine et le remplacent par les bons nucléotides (Figure\(\PageIndex{6}\)). Chez E. coli, l'ADN est scanné par un complexe enzymatique. Si une distorsion de la double hélice introduite par le dimère de pyrimidine est découverte, le complexe enzymatique coupe le squelette sucre-phosphate de plusieurs bases en amont et en aval du dimère, et le segment d'ADN entre ces deux coupes est ensuite éliminé par voie enzymatique. L'ADN pol I remplace les nucléotides manquants par les bons et l'ADN ligase comble le vide dans le squelette du phosphate de sucre.
La réparation directe (également appelée réparation par la lumière) des dimères de thymine se fait par le processus de photoréactivation en présence de lumière visible. Une enzyme appelée photolyase reconnaît la distorsion de l'hélice de l'ADN causée par le dimère de thymine et se lie au dimère. Ensuite, en présence de lumière visible, l'enzyme photolyase change de conformation et décompose le dimère de thymine, ce qui permet aux thymines de se baser à nouveau correctement avec les adénines du brin complémentaire. La photoréactivation semble être présente dans tous les organismes, à l'exception des mammifères placentaires, y compris les humains. La photoréactivation est particulièrement importante pour les organismes exposés de façon chronique aux rayons ultraviolets, tels que les plantes, les bactéries photosynthétiques, les algues et les coraux, afin de prévenir l'accumulation de mutations causées par la formation de dimères de thymine.
Exercice\(\PageIndex{4}\)
- Lors de la réparation des mésappariements, comment l'enzyme reconnaît-elle quel est le nouveau brin et quel est l'ancien brin ?
- Quel type de mutation la photolyase répare-t-elle ?
Identification des mutants bactériens
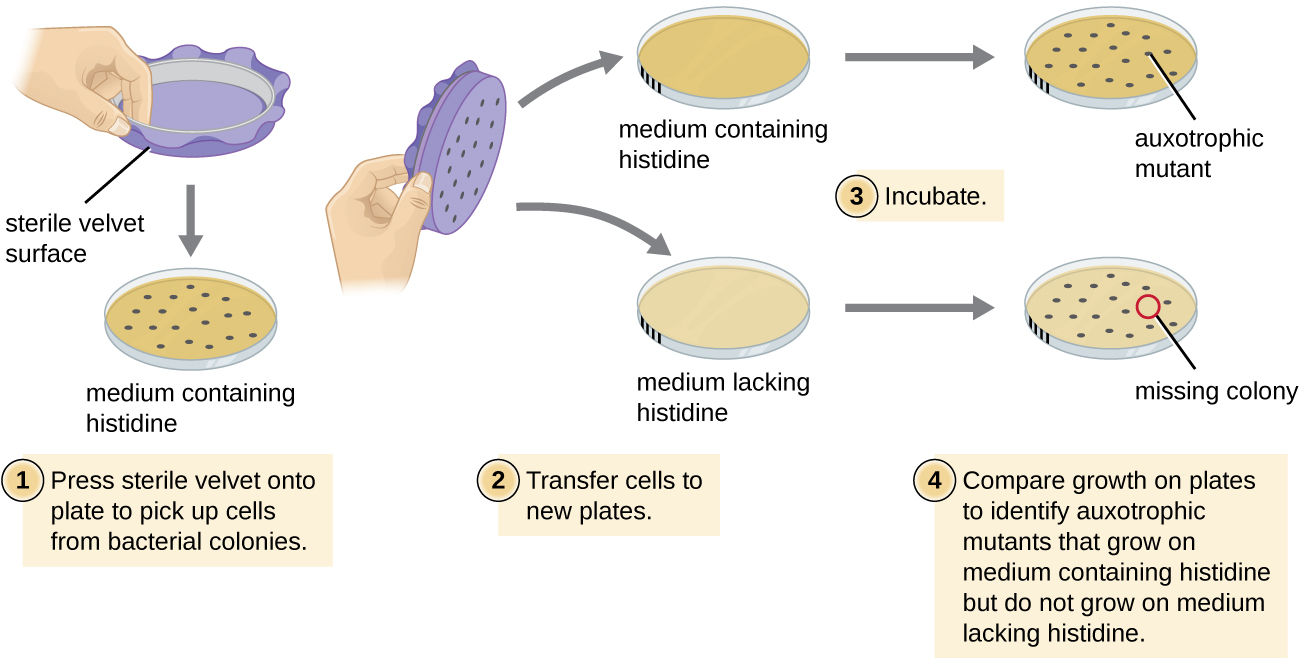
L'une des techniques couramment utilisées pour identifier les mutants bactériens est le placage de répliques. Cette technique est utilisée pour détecter des mutants nutritionnels, appelés auxotrophes, qui présentent une mutation dans un gène codant pour une enzyme dans la voie de biosynthèse d'un nutriment spécifique, tel qu'un acide aminé. Par conséquent, alors que les cellules de type sauvage conservent la capacité de se développer normalement sur un milieu dépourvu du nutriment spécifique, les auxotrophes ne peuvent pas se développer sur un tel milieu. Lors du placage de répliques (Figure\(\PageIndex{7}\)), une population de cellules bactériennes est mutagénisée puis plaquée en tant que cellules individuelles sur une plaque complète sur le plan nutritionnel et laissée croître en colonies. Les cellules de ces colonies sont retirées de cette plaque maîtresse, souvent à l'aide de velours stérile. Ce velours, contenant des cellules, est ensuite pressé dans la même orientation sur des plaques de différents supports. Au moins une plaque doit également être complète sur le plan nutritionnel pour garantir que les cellules sont correctement transférées entre les plaques. Les autres plaques manquent de nutriments spécifiques, ce qui permet au chercheur de découvrir divers mutants auxotrophes incapables de produire des nutriments spécifiques. Les cellules de la colonie correspondante sur la plaque nutritionnellement complète peuvent être utilisées pour récupérer le mutant en vue d'une étude plus approfondie.
Exercice\(\PageIndex{5}\)
Pourquoi les cellules sont-elles placées sur une plaque nutritionnellement complète en plus des plaques carencées en nutriments lorsque vous recherchez un mutant ?
Le test d'Ames
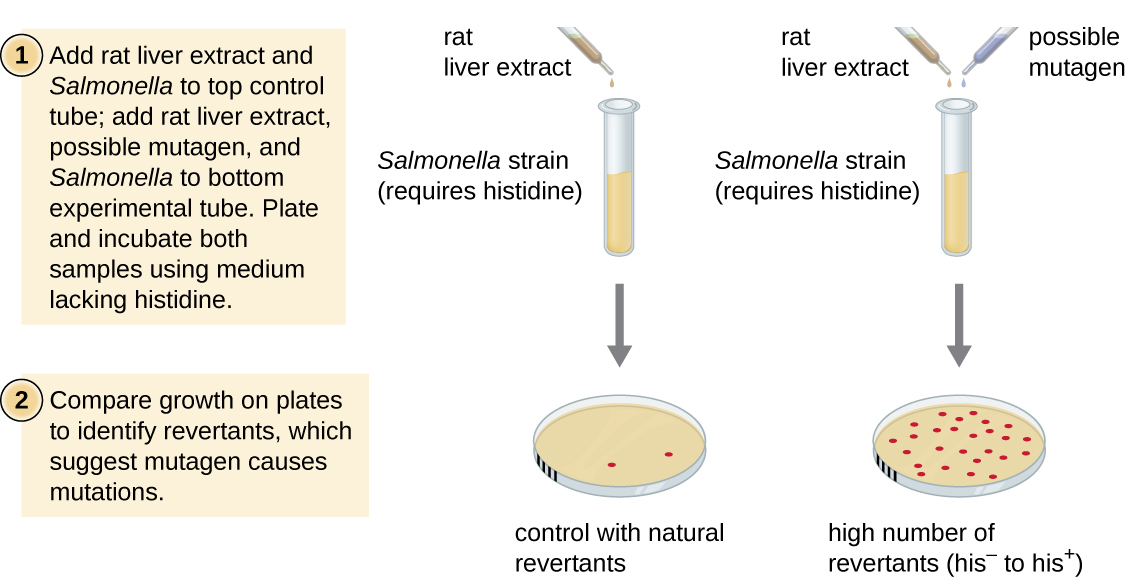
Le test d'Ames, développé par Bruce Ames (1928—) dans les années 1970, est une méthode qui utilise des bactéries pour le dépistage rapide et peu coûteux du potentiel cancérogène de nouveaux composés chimiques. Le test mesure le taux de mutation associé à l'exposition au composé, ce qui, s'il est élevé, peut indiquer que l'exposition à ce composé est associée à un risque accru de cancer. Le test d'Ames utilise comme organisme d'essai une souche de Salmonella typhimurium qui est un auxotrophe de l'histidine, incapable de synthétiser sa propre histidine en raison d'une mutation d'un gène essentiel à sa synthèse. Après exposition à un mutagène potentiel, ces bactéries sont placées sur un milieu dépourvu d'histidine, et le nombre de mutants retrouvant la capacité de synthétiser l'histidine est enregistré et comparé au nombre de mutants de ce type qui apparaissent en l'absence du mutagène potentiel (Figure\(\PageIndex{8}\)). Les produits chimiques plus mutagènes produiront davantage de mutants dont la synthèse de l'histidine sera rétablie lors du test d'Ames. Comme de nombreuses substances chimiques ne sont pas directement mutagènes mais sont métabolisées en formes mutagènes par les enzymes hépatiques, l'extrait de foie de rat est généralement inclus au début de cette expérience pour imiter le métabolisme du foie. Une fois le test d'Ames réalisé, les composés identifiés comme mutagènes sont soumis à des tests supplémentaires pour déterminer leurs propriétés cancérogènes potentielles à l'aide d'autres modèles, y compris des modèles animaux tels que les souris et les rats.
Exercice\(\PageIndex{6}\)
- Quelle mutation est utilisée comme indicateur du taux de mutation dans le test d'Ames ?
- Pourquoi le test d'Ames peut-il fonctionner comme un test de cancérogénicité ?
Concepts clés et résumé
- Une mutation est une modification héréditaire de l'ADN. Une mutation peut entraîner une modification de la séquence d'acides aminés d'une protéine, affectant éventuellement sa fonction.
- Une mutation ponctuelle affecte une seule paire de bases. Une mutation ponctuelle peut provoquer une mutation silencieuse si le codon de l'ARNm code pour le même acide aminé, une mutation fausse si le codon de l'ARNm code pour un autre acide aminé, ou une mutation absurde si le codon de l'ARNm devient un codon stop.
- Les mutations erronées peuvent conserver leur fonction, en fonction de la chimie du nouvel acide aminé et de sa localisation dans la protéine. Les mutations absurdes produisent des protéines tronquées et souvent non fonctionnelles.
- Une mutation par décalage de trame résulte de l'insertion ou de la délétion d'un nombre de nucléotides qui n'est pas un multiple de trois. Le changement de cadre de lecture modifie tous les acides aminés après le point de mutation et entraîne la formation d'une protéine non fonctionnelle.
- Les mutations spontanées se produisent par des erreurs de réplication de l'ADN, tandis que les mutations induites se produisent par exposition à un mutagène
- Les agents mutagènes sont souvent cancérigènes, mais pas toujours. Cependant, presque tous les agents cancérigènes sont mutagènes.
- Les mutagènes chimiques comprennent les analogues de base et les produits chimiques qui modifient les bases existantes. Dans les deux cas, les mutations sont introduites après plusieurs cycles de réplication de l'ADN.
- Les rayonnements ionisants, tels que les rayons X et les rayons γ, entraînent la rupture du squelette phosphodiester de l'ADN et peuvent également modifier chimiquement les bases pour modifier leurs règles d'appariement des bases.
- Les rayonnements non ionisants tels que la lumière ultraviolette peuvent introduire des dimères de pyrimidine (thymine) qui, lors de la réplication et de la transcription de l'ADN, peuvent introduire des mutations ponctuelles ou décalées.
- Les cellules possèdent des mécanismes pour réparer les mutations naturelles. L'ADN polymérase a une activité de relecture. La réparation des mésappariements est un processus visant à réparer les bases mal incorporées une fois la réplication de l'ADN terminée.
- Les dimères de pyrimidine peuvent également être réparés. Lors de la réparation par excision des nucléotides (réparation à l'obscurité), les enzymes reconnaissent la distorsion introduite par le dimère de pyrimidine et remplacent le brin endommagé par les bonnes bases, en utilisant le brin d'ADN non endommagé comme matrice. Les bactéries et autres organismes peuvent également avoir recours à la réparation directe, au cours de laquelle l'enzyme photolyase, en présence de lumière visible, décompose les pyrimidines.
- En comparant la croissance sur la plaque complète et l'absence de croissance sur des milieux dépourvus de nutriments spécifiques, des mutants spécifiques dépourvus de fonctions, appelés auxotrophes, peuvent être identifiés.
- Le test d'Ames est une méthode peu coûteuse qui utilise des bactéries auxotrophes pour mesurer la mutagénicité d'un composé chimique. La mutagénicité est un indicateur du potentiel cancérogène.
Notes
- 1 Organisation mondiale de la santé. « Données de l'Observatoire mondial de la santé (GHO), VIH/sida ». http://www.who.int/gho/hiv/en/. Consulté le 5 août 2016.
- 2 Organisation mondiale de la santé. « Données de l'Observatoire mondial de la santé (GHO), VIH/sida ». http://www.who.int/gho/hiv/en/. Consulté le 5 août 2016.
- 3 K.R. Tindall et coll. « Modifications de la séquence de base de l'ADN induites par la mutagénèse aux rayons gamma du phage Lambda et du Prophage. » Génétique 118 no 4 (1988) :551 à 560.


