11.5 : Colloïdes
- Page ID
- 193935
- Décrire la composition et les propriétés des dispersions colloïdales
- Énumérer et expliquer plusieurs applications technologiques des colloïdes
Lorsque vous étiez enfant, vous avez peut-être fabriqué des suspensions telles que des mélanges de boue et d'eau, de farine et d'eau, ou une suspension de pigments solides dans de l'eau, connue sous le nom de peinture à la détrempe. Ces suspensions sont des mélanges hétérogènes composés de particules relativement grosses visibles (ou visibles à la loupe). Elles sont troubles et les particules en suspension se déposent après mélange. D'autre part, lorsque nous fabriquons une solution, nous préparons un mélange homogène dans lequel aucune sédimentation ne se produit et dans lequel les espèces dissoutes sont des molécules ou des ions. Les solutions présentent un comportement complètement différent de celui des suspensions. Une solution peut être colorée, mais elle est transparente, les molécules ou les ions sont invisibles et ils ne se déposent pas au repos. Un groupe de mélanges appelés colloïdes (ou dispersions colloïdales) présente des propriétés intermédiaires entre celles des suspensions et des solutions (Figure\(\PageIndex{1}\)). Les particules d'un colloïde sont plus grosses que la plupart des molécules simples ; toutefois, les particules colloïdales sont suffisamment petites pour ne pas se déposer au repos.

Les particules d'un colloïde sont suffisamment grosses pour diffuser de la lumière, un phénomène appelé effet Tyndall. Cela peut donner aux mélanges colloïdaux une apparence trouble ou opaque, comme les faisceaux de projecteurs illustrés sur la figure\(\PageIndex{2}\). Les nuages sont des mélanges colloïdaux. Elles sont composées de gouttelettes d'eau qui sont beaucoup plus grosses que les molécules, mais qui sont suffisamment petites pour ne pas se déposer.

Le terme « colloïde », issu des mots grecs kolla, qui signifie « colle », et eidos, qui signifie « similaire », a été utilisé pour la première fois en 1861 par Thomas Graham pour classer des mélanges tels que l'amidon dans l'eau et la gélatine. De nombreuses particules colloïdales sont des agrégats de centaines ou de milliers de molécules, mais d'autres (telles que les protéines et les molécules de polymères) sont constituées d'une seule molécule extrêmement grosse. Les molécules de protéines et de polymères synthétiques qui forment les colloïdes peuvent avoir des masses moléculaires allant de quelques milliers à plusieurs millions d'unités de masse atomique.
À l'instar de l'identification des composants d'une solution en tant que « soluté » et « solvant », les composants d'un colloïde sont également classés en fonction de leurs quantités relatives. Le composant particulaire généralement présent en quantité relativement mineure est appelé phase dispersée et la substance ou la solution dans laquelle la particule est dispersée est appelée milieu de dispersion. Les colloïdes peuvent impliquer pratiquement n'importe quelle combinaison d'états physiques (gaz dans un liquide, liquide dans un solide, solide dans un gaz, etc.), comme l'illustrent les exemples de systèmes colloïdaux donnés dans le tableau\(\PageIndex{1}\).
| Phase dispersée | Milieu de dispersion | Exemples courants | Nom |
|---|---|---|---|
| solide | gaz | fumée, poussière | — |
| solide | liquide | amidon dans l'eau, certaines encres, peintures, lait de magnésie | sol |
| solide | solide | des pierres précieuses colorées, des alliages | — |
| liquide | gaz | nuages, brouillards, brouillards, embruns | aérosol |
| liquide | liquide | lait, mayonnaise, beurre | émulsion |
| liquide | solide | gelées, gels, perles, opales (H 2 O dans SiO 2) | gel |
| gaz | liquide | mousses, crème fouettée, blancs d'œufs battus | mousse |
| gaz | solide | pierre ponce, savons flottants | — |
Préparation de systèmes colloïdaux
Nous pouvons préparer un système colloïdal en produisant des particules de dimensions colloïdales et en répartissant ces particules dans un milieu de dispersion. Les particules de taille colloïdale sont formées par deux méthodes :
- Méthodes de dispersion : c'est-à-dire en décomposant les particules plus grosses. Par exemple, les pigments de peinture sont produits en dispersant de grosses particules par broyage dans des broyeurs spéciaux.
- Méthodes de condensation : c'est-à-dire croissance à partir d'unités plus petites, telles que des molécules ou des ions. Par exemple, les nuages se forment lorsque les molécules d'eau se condensent et forment de très petites gouttelettes.
Quelques substances solides, lorsqu'elles sont mises en contact avec l'eau, se dispersent spontanément et forment des systèmes colloïdaux. La gélatine, la colle, l'amidon et le lait en poudre déshydraté se comportent de cette manière. Les particules sont déjà de taille colloïdale ; l'eau ne fait que les disperser. Les particules de lait en poudre de taille colloïdale sont produites par déshydratation du lait pulvérisé. Certains atomiseurs produisent des dispersions colloïdales d'un liquide dans l'air.
Nous pouvons préparer une émulsion en agitant ensemble ou en mélangeant deux liquides non miscibles. Cela brise un liquide en gouttelettes de taille colloïdale, qui se dispersent ensuite dans l'autre liquide. Les déversements de pétrole dans l'océan peuvent être difficiles à nettoyer, en partie parce que l'action des vagues peut provoquer la formation d'une émulsion entre le pétrole et l'eau. Dans de nombreuses émulsions, cependant, la phase dispersée a tendance à fusionner, à former de grosses gouttes et à se séparer. Par conséquent, les émulsions sont généralement stabilisées par un agent émulsifiant, une substance qui inhibe la coalescence du liquide dispersé. Par exemple, un peu de savon stabilisera une émulsion de kérosène dans l'eau. Le lait est une émulsion de matière grasse butyrique dans de l'eau, dont l'agent émulsifiant est la protéine caséine. La mayonnaise est une émulsion d'huile dans du vinaigre, dont les composants sont le jaune d'œuf comme agents émulsifiants.
Les méthodes de condensation forment des particules colloïdales par agrégation de molécules ou d'ions. Si les particules se développent au-delà de la plage de tailles colloïdales, des gouttes ou des précipités se forment et aucun système colloïdal n'en résulte. Les nuages se forment lorsque les molécules d'eau s'agglomèrent et forment des particules de la taille d' Si ces particules d'eau fusionnent pour former de grosses gouttes d'eau liquide ou des cristaux d'eau solide, elles se déposent du ciel sous forme de pluie, de neige fondue ou de neige. De nombreuses méthodes de condensation impliquent des réactions chimiques. Nous pouvons préparer une suspension colloïdale rouge d'hydroxyde de fer (III) en mélangeant une solution concentrée de chlorure de fer (III) avec de l'eau chaude :
\[\mathrm{Fe^{3+}}_{(aq)}+\mathrm{3Cl^-}_{(aq)}+\mathrm{6H_2O}_{(l)}⟶\mathrm{Fe(OH)}_{3(s)}+\mathrm{H_3O^+}_{(aq)}+\mathrm{3Cl^-}_{(aq)} \label{11.6.1} \]
Un sol d'or colloïdal résulte de la réduction d'une solution très diluée de chlorure d'or (III) par un agent réducteur tel que le formaldéhyde, le chlorure d'étain (II) ou le sulfate de fer (II) :
\[\ce{Au}^{3+}+ \ce{3e}^− \rightarrow \ce{Au} \label{11.6.2} \]
Certains sols d'or préparés en 1857 sont encore intacts (les particules n'ont pas fusionné ni déposé), ce qui illustre la stabilité à long terme de nombreux colloïdes.
Savons et détergents
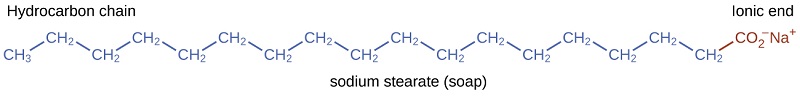
Les pionniers ont fabriqué du savon en faisant bouillir des graisses avec une solution fortement basique obtenue en lessivant du carbonate de potassium à partir de cendres de bois avec de l'eau chaude.\(\ce{K_2CO_3}\) Les graisses animales contiennent des polyesters d'acides gras (acides carboxyliques à longue chaîne). Lorsque les graisses animales sont traitées avec une base telle que le carbonate de potassium ou l'hydroxyde de sodium, du glycérol et des sels d'acides gras tels que les acides palmitique, oléique et stéarique se forment. Les sels d'acides gras sont appelés savons. Le sel de sodium de l'acide stéarique, le stéarate de sodium, a la formule\(\ce{C_{17}H_{35}CO_2Na}\) et contient une chaîne hydrocarbonée non polaire non chargée, l'\(\mathrm{C_{17}H_{35}-}\)unité, et un groupe carboxylate ionique, l'\(-\mathrm{\sideset{ }{_{2}^{-}}{CO}}\)unité (Figure\(\PageIndex{3}\)).
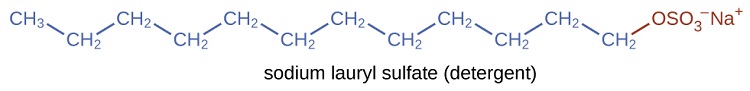
Les détergents (substituts de savon) contiennent également des chaînes hydrocarbonées non polaires\(\mathrm{C_{12}H_{25}—}\), telles que, et un groupe ionique, tel qu'un sulfate\(—\mathrm{\sideset{ }{_{3}^{-}}{OSO}}\) ou un sulfonate\(—\mathrm{\sideset{ }{_{3}^{-}}{SO}}\) (Figure\(\PageIndex{4}\)). Les savons forment des composés de calcium et de magnésium insolubles dans l'eau dure ; les détergents forment des produits hydrosolubles, ce qui constitue un avantage certain pour les détergents.
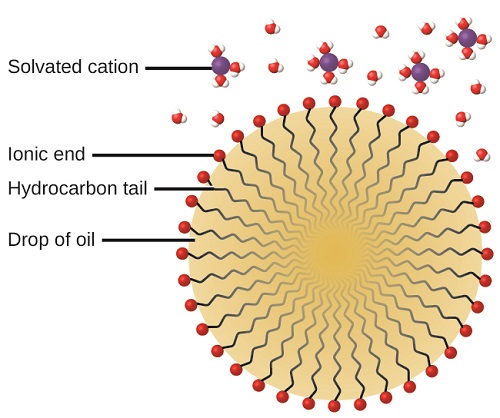
L'action nettoyante des savons et des détergents peut s'expliquer en fonction de la structure des molécules impliquées. L'extrémité hydrocarbonée (non polaire) d'une molécule de savon ou de détergent se dissout dans des substances non polaires telles que l'huile, la graisse ou les particules de saleté, ou est attirée par celles-ci. L'extrémité ionique est attirée par l'eau (polaire), illustrée sur la figure\(\PageIndex{5}\). En conséquence, les molécules de savon ou de détergent s'orientent à l'interface entre les particules de saleté et l'eau, de sorte qu'elles agissent comme une sorte de pont entre deux types de matière, apolaire et polaire. De telles molécules sont dites amphiphiles car elles possèdent à la fois une partie hydrophobe (« craignant l'eau ») et une partie hydrophile (« aimant l'eau »). En conséquence, les particules de saleté se mettent en suspension sous forme de particules colloïdales et sont facilement éliminées.
L'explosion de la plate-forme de forage Deepwater Horizon, le 20 avril 2010, dans le golfe du Mexique, près du Mississippi, a provoqué la plus grande marée noire de l'histoire du pétrole en mer. Au cours des 87 jours qui ont suivi l'éruption, environ 4,9 millions de barils (210 millions de gallons) de pétrole se sont écoulés du puits rompu à 5 000 pieds sous la surface de l'eau. Le puits a finalement été déclaré scellé le 19 septembre 2010.
Le pétrole brut est immiscible et moins dense que l'eau, de sorte que le pétrole déversé est remonté à la surface de l'eau. Des barrages flottants, des navires écumeurs et des brûleurs contrôlés ont été utilisés pour retirer le pétrole de la surface de l'eau afin de protéger les plages et les zones humides le long de la côte du Golfe. Outre l'extraction du pétrole, des tentatives ont également été faites pour réduire son impact environnemental en le rendant « soluble » (au sens large du terme) et en permettant ainsi de le diluer à des niveaux moins nocifs, espérons-le, par le grand volume d'eau de mer. Cette approche a utilisé 1,84 million de gallons de dispersant pétrolier Corexit 9527, dont la majeure partie a été injectée sous l'eau sur le site de la fuite, et de petites quantités ont été pulvérisées sur le dessus du déversement. Le Corexit 9527 contient du 2-butoxyéthanol (C 6 H 14 O 2), une molécule amphiphile dont les extrémités polaires et non polaires sont utiles pour émulsionner l'huile en petites gouttelettes, augmenter la surface de l'huile et la rendre plus accessible aux bactéries marines pour la digestion (Figure \(\PageIndex{6}\)). Bien que cette approche évite de nombreux dangers immédiats que pose le pétrole en vrac pour les écosystèmes marins et côtiers, elle introduit la possibilité d'effets à long terme résultant de l'introduction de composants toxiques complexes et potentiels du pétrole dans la chaîne alimentaire de l'océan. Un certain nombre d'organisations sont impliquées dans la surveillance de l'impact à long terme de cette marée noire, notamment la National Oceanic and Atmospheric Administration.

Propriétés électriques des particules colloïdales
Les particules colloïdales dispersées sont souvent chargées électriquement. Une particule colloïdale d'hydroxyde de fer (III), par exemple, ne contient pas suffisamment d'ions hydroxyde pour compenser exactement les charges positives sur les ions fer (III). Ainsi, chaque particule colloïdale porte une charge positive, et la dispersion colloïdale est constituée de particules colloïdales chargées et de quelques ions hydroxyde libres, qui maintiennent la dispersion électriquement neutre. La plupart des colloïdes d'hydroxydes métalliques ont des charges positives, tandis que la plupart des métaux et des sulfures métalliques forment des dispersions chargées négativement. Toutes les particules colloïdales d'un même système ont des charges du même signe. Cela permet de les disperser, car les particules contenant des charges similaires se repoussent les unes les autres.
Nous pouvons tirer parti de la charge sur les particules colloïdales pour les éliminer de divers mélanges. Si nous plaçons une dispersion colloïdale dans un récipient contenant des électrodes chargées, les particules chargées positivement, telles que les particules d'hydroxyde de fer (III), se déplaceraient vers l'électrode négative. Les particules colloïdales y perdent leur charge et se coagulent sous forme de précipité.
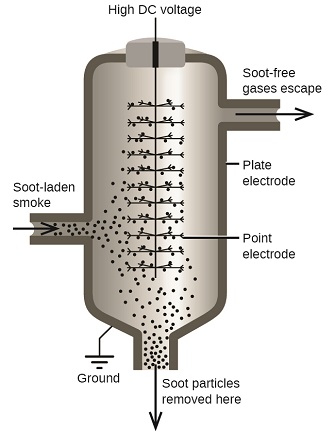
Les particules de carbone et de poussière présentes dans la fumée sont souvent dispersées de manière colloïdale et chargées électriquement. Les particules chargées sont attirées par des électrodes hautement chargées, où elles sont neutralisées et déposées sous forme de poussière (Figure\(\PageIndex{7}\). Il s'agit de l'une des méthodes les plus importantes utilisées pour éliminer la fumée provenant de divers procédés industriels. Le procédé joue également un rôle important dans la récupération de produits précieux contenus dans la fumée et les poussières de combustion des fonderies, des fours et des fours. Il existe également des filtres à air ioniques conçus pour un usage domestique afin d'améliorer la qualité de l'air intérieur.
Gels
Lorsque nous fabriquons de la gélatine, telle que de la gelée O, nous fabriquons un type de colloïde (Figure\(\PageIndex{8}\)). La gélatine se refroidit parce que le mélange aqueux chaud de gélatine coagule lorsqu'il se refroidit et que la masse entière, y compris le liquide, prend forme un corps extrêmement visqueux connu sous le nom de gel, un colloïde dans lequel le milieu dispersant est un solide et la phase dispersée est un liquide. Il apparaît que les fibres du milieu dispersant forment un réseau tridimensionnel complexe, les interstices étant remplis par le milieu liquide ou par une solution diluée du milieu dispersant. Comme la formation d'un gel s'accompagne de l'absorption d'eau ou d'un autre solvant, le gel est dit hydraté ou solvaté.

La pectine, un hydrate de carbone issu des jus de fruits, est une substance gélifiante importante dans la fabrication de gelées. Le gel de silice, une dispersion colloïdale de dioxyde de silicium hydraté, se forme lorsque de l'acide chlorhydrique dilué est ajouté à une solution diluée de silicate de sodium. Canned Heat est un gel fabriqué en mélangeant de l'alcool et une solution aqueuse saturée d'acétate de calcium.
Résumé
Les colloïdes sont des mélanges dans lesquels une ou plusieurs substances sont dispersées sous forme de particules solides ou de gouttelettes liquides relativement grosses dans un milieu solide, liquide ou gazeux. Les particules d'un colloïde restent dispersées et ne se déposent pas sous l'effet de la gravité, et elles sont souvent chargées électriquement. Les colloïdes sont très répandus dans la nature et sont impliqués dans de nombreuses applications technologiques.
Lexique
- amphiphile
- molécules possédant à la fois une partie hydrophobe (non polaire) et une partie hydrophile (polaire)
- colloïde
- (également, dispersion colloïdale) mélange dans lequel des particules solides ou liquides relativement grosses sont dispersées uniformément dans un gaz, un liquide ou un solide
- milieu de dispersion
- solide, liquide ou gaz dans lequel des particules colloïdales sont dispersées
- phase dispersée
- substance présente sous forme de particules solides ou liquides relativement grosses dans un colloïde
- agent émulsifiant
- substance amphiphile utilisée pour stabiliser les particules de certaines émulsions
- émulsion
- colloïde formé à partir de liquides non miscibles
- gel
- dispersion colloïdale d'un liquide dans un solide
- Effet Tyndall
- diffusion de lumière visible par une dispersion colloïdale


