11.E : Solutions et colloïdes (exercices)
- Page ID
- 193939
11.2 : Le processus de dissolution
Q11.2.1
Comment les solutions diffèrent-elles des composés ? À partir d'autres mélanges ?
S11.2.1
La composition d'une solution peut varier, alors que celle d'un composé ne peut pas varier. Les solutions sont homogènes au niveau moléculaire, tandis que les autres mélanges sont hétérogènes.
Q11.2.2
Laquelle des principales caractéristiques des solutions pouvons-nous voir dans les solutions\(\ce{K2Cr2O7}\) présentées dans

Figure : Lorsque le dichromate de potassium (\(\ce{K2Cr2O7}\)) est mélangé à de l'eau, il forme une solution orange homogène. (crédit : modification de l'œuvre de Mark Ott)
11.2.2
Les solutions sont les mêmes partout (la couleur est constante partout), et la composition d'une solution de K 2 Cr 2 O 7 dans l'eau peut varier.
Q11.2.3
Lorsque le KNO 3 est dissous dans l'eau, la solution obtenue est nettement plus froide que l'eau ne l'était à l'origine.
- La dissolution du KNO 3 est-elle un processus endothermique ou exothermique ?
- Quelles conclusions pouvez-vous tirer sur les attraits intermoléculaires impliqués dans ce processus ?
- La solution qui en résulte est-elle idéale ?
ARTICLE 11.2.3
(a) Le processus est endothermique car la solution consomme de la chaleur. (b) L'attraction entre le K + et\(\ce{NO3-}\) les ions est plus forte qu'entre les ions et les molécules d'eau (les interactions ion-ion ont une énergie plus faible et plus négative). Par conséquent, le processus de dissolution augmente l'énergie des interactions moléculaires et consomme l'énergie thermique de la solution pour compenser la différence. (c) Non, une solution idéale est formée sans dégagement ou consommation de chaleur appréciable.
Q11.2.4
Donnez un exemple de chacun des types de solutions suivants :
- un gaz dans un liquide
- un gaz dans un gaz
- un solide dans un solide
ARTICLE 11.2.4
(a) CO 2 dans l'eau ; (b) O 2 dans N 2 (air) ; (c) bronze (solution d'étain ou d'autres métaux dans du cuivre)
Q11.2.5
Indiquez les types d'attractions intermoléculaires les plus importants dans chacune des solutions suivantes :
- La solution présentée dans la figure.
- NO (l) dans CO (l)
- Cl 2 (g) dans Br 2 (l)
- HCl (aq) dans du benzène C 6 H 6 (l)
- Méthanol CH 3 OH (l) dans H 2 O (l)
11.2.5
(a) forces dipolaires ioniques ; (b) forces dipolaires ; (c) forces de dispersion ; (d) forces de dispersion ; (e) liaisons hydrogène
Q11.2.5
Prédire si chacune des substances suivantes serait plus soluble dans l'eau (solvant polaire) ou dans un hydrocarbure tel que l'heptane (C 7 H 16, solvant non polaire) :
- huile végétale (non polaire)
- alcool isopropylique (polaire)
- bromure de potassium (ionique)
11.2.5
a) heptane ; b) eau ; c) eau
Q11.2.6
La chaleur est libérée lorsque certaines solutions se forment ; la chaleur est absorbée lorsque d'autres solutions se forment. Fournissez une explication moléculaire de la différence entre ces deux types de processus spontanés.
11.2.6
La chaleur est libérée lorsque les forces intermoléculaires totales (IMF) entre les molécules du soluté et du solvant sont plus fortes que les IMF totaux dans le soluté pur et dans le solvant pur : le fait de briser les IMF plus faibles et de former des IMF plus forts libère de la chaleur. La chaleur est absorbée lorsque le total des IMF de la solution est plus faible que le total de ceux du soluté pur et du solvant pur : le fait de casser les IMF les plus forts et de former des IMF plus faibles absorbe la chaleur.
Q11.2.7
Des solutions d'hydrogène dans le palladium peuvent être formées en exposant le métal Pd à du gaz H 2. La concentration d'hydrogène dans le palladium dépend de la pression du gaz H 2 appliqué, mais d'une manière plus complexe que ne peut le décrire la loi de Henry. Dans certaines conditions, 0,94 g d'hydrogène gazeux sont dissous dans 215 g de palladium métallique.
- Déterminez la molarité de cette solution (densité de la solution = 1,8 g/cm 3).
- Déterminez la molalité de cette solution (densité de la solution = 1,8 g/cm 3).
- Déterminez le pourcentage en masse d'atomes d'hydrogène dans cette solution (densité de la solution = 1,8 g/cm 3).
11.2.7
http://cnx.org/contents/ MH6AQEGx @2 /Le processus de dissolution
11.3 : Électrolytes
Q11.3.1
Expliquez pourquoi les ions Na + et Cl − sont fortement solvatés dans l'eau, mais pas dans l'hexane, un solvant composé de molécules non polaires.
11.3.2
Les cristaux de NaCl se dissolvent dans l'eau, un liquide polaire avec un très grand moment dipolaire, et les ions individuels deviennent fortement solvatés. L'hexane est un liquide non polaire dont le moment dipolaire est nul et n'interagit donc pas de manière significative avec les ions des cristaux de NaCl.
Q11.3.2
Expliquez pourquoi les solutions de HBr dans le benzène (un solvant non polaire) ne sont pas conductrices, alors que les solutions dans l'eau (un solvant polaire) le sont.
11.3.2
Le HBr étant un acide, ses molécules réagissent avec les molécules d'eau pour former des ions H 3 O + et Br − qui assurent la conductivité de la solution. Bien que le HBr soit soluble dans le benzène, il ne réagit pas chimiquement mais reste dissous sous forme de molécules neutres de HBr. En l'absence d'ions dans la solution de benzène, elle est électriquement non conductrice.
Q11.3.3
Examinez les solutions présentées :
(a) Lequel des croquis suivants représente le mieux les ions dans une solution de Fe (NO 3) 3 (aq) ?
3_img.jpg") " style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
" style="width: 570px; height: 191px;" src="https://chem.libretexts.org/@api/dek...(NO3)3_img.jpg" width="570px" height="191px">
(b) Écrivez une équation chimique équilibrée montrant les produits de la dissolution du Fe (NO 3) 3.
11.3.3
(a) Le Fe (NO 3) 3 est un électrolyte puissant, il doit donc se dissocier complètement en Fe 3+ et en\(\ce{(NO3- )}\) ions. Par conséquent, (z) représente le mieux la solution. (b)\(\ce{Fe(NO3)3}(s)⟶\ce{Fe^3+}(aq)+\ce{3NO3- }(aq)\)
Q11.3.4
Comparez les processus qui se produisent lorsque le méthanol (CH 3 OH), le chlorure d'hydrogène (HCl) et l'hydroxyde de sodium (NaOH) se dissolvent dans l'eau. Rédigez des équations et préparez des croquis montrant la forme sous laquelle chacun de ces composés est présent dans sa solution respective.
11.3.3
Le méthanol se dissout dans l'eau dans toutes les proportions et interagit par liaison hydrogène.\(CH_3OH\)
Méthanol :
\[CH_3OH_{(l)}+H_2O_{(l)}⟶CH_3OH_{(aq)}\]
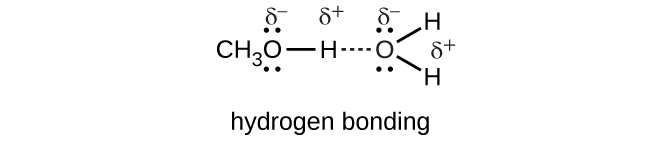
Le chlorure d'hydrogène, HCl, se dissout dans l'eau et réagit avec elle pour produire des cations hydronium et des anions chlorure qui sont solvatés par de fortes interactions ion-dipôle.
Chlorure d'hydrogène
\[HCl{(g)}+H_2O_{(l)} \rightarrow H_3O^+_{(aq)}+Cl^−_{(aq)}\]
Sodium hydroxide, NaOH, dissolves in water and dissociates to yield sodium cations and hydroxide anions that are strongly solvated by ion-dipole interactions and hydrogen bonding, respectively.
Sodium hydroxide:
\[NaOH_{(s)} \rightarrow Na^+_{(aq)} + OH^−_{(aq)}\]
Q11.3.5
Quelle est la conductivité électrique attendue des solutions suivantes ?
- NaOH (aq)
- HCl (aq)
- C 6 H 12 O 6 (aq) (glucose)
- NH 3 (L)
11.3.5
(a) conductivité élevée (le soluté est un composé ionique qui se dissocie lorsqu'il est dissous) ; (b) conductivité élevée (le soluté est un acide fort et s'ionise complètement lorsqu'il est dissous) ; (c) non conducteur (le soluté est un composé covalent, ni acide ni base, non réactif à l'eau) ; (d) faible conductivité (le soluté est un base faible et s'ionise partiellement une fois dissoute)
Q11.3.6
Pourquoi la plupart des composés ioniques solides ne sont-ils pas conducteurs d'électricité, alors que les solutions aqueuses de composés ioniques sont de bons conducteurs ? Vous attendez-vous à ce qu'un composé ionique liquide (fondu) soit électroconducteur ou non conducteur ? Expliquez.
11.3.6
Un support doit contenir des entités chargées et mobiles librement pour être électriquement conducteur. Les ions présents dans un solide ionique typique sont immobilisés dans un réseau cristallin et le solide n'est donc pas en mesure de supporter un courant électrique. Lorsque les ions sont mobilisés, soit en faisant fondre le solide, soit en le dissolvant dans l'eau pour dissocier les ions, le courant peut circuler et ces formes du composé ionique sont conductrices.
Q11.3.7
Indiquez le type d'attraction intermoléculaire le plus important responsable de la solvatation dans chacune des solutions suivantes :
- les solutions présentées dans la figure
- méthanol, CH 3 OH, dissous dans de l'éthanol, C 2 H 5 OH
- méthane, CH 4, dissous dans du benzène, C 6 H 6
- l'halocarbure polaire CF 2 Cl 2 dissous dans l'halocarbure polaire CF 2 ClCFCl 2
- O 2 (l) dans N 2 (l)
11.3.7
(a) dipôle ionique ; (b) liaisons hydrogène ; (c) forces de dispersion ; (d) attractions dipoles-dipôles ; (e) forces de dispersion
11.4 : Solubilité
Q11.4.1
Supposons qu'on vous présente une solution limpide de thiosulfate de sodium, Na 2 S 2 O 3. Comment pouvez-vous déterminer si la solution est insaturée, saturée ou sursaturée ?
ARTICLE 11.4.1
Ajoutez un petit cristal de\(Na_2S_2O_3\). Il se dissoudra dans une solution insaturée, restera apparemment inchangé dans une solution saturée ou initiera une précipitation dans une solution sursaturée.
Q11.4.2
Les solutions sursaturées de la plupart des solides dans l'eau sont préparées en refroidissant des solutions saturées. Les solutions sursaturées de la plupart des gaz présents dans l'eau sont préparées en chauffant des solutions saturées. Expliquez les raisons de la différence entre les deux procédures.
11.4.2
La solubilité des solides diminue généralement lors du refroidissement d'une solution, tandis que la solubilité des gaz diminue généralement lors du chauffage.
Q11.4.3
Suggérer une explication des observations selon lesquelles l'éthanol, C 2 H 5 OH, est complètement miscible à l'eau et que l'éthanethiol, C 2 H 5 SH, n'est soluble que dans la mesure de 1,5 g pour 100 ml d'eau.
11.4.3
Les liaisons hydrogène entre l'eau et le C 2 H 5 OH sont beaucoup plus fortes que les attractions intermoléculaires entre l'eau et le C 2 H 5 SH.
Q11.4.4
Calculer le pourcentage en masse de kBr dans une solution saturée de kBr dans de l'eau à 10 °C à l'aide de la figure suivante pour obtenir des données utiles, et rapporter le pourcentage calculé jusqu'à un chiffre significatif.

Ce graphique montre comment la solubilité de plusieurs solides change en fonction de la température.
11.4.4
À 10 °C, la solubilité du KBr dans l'eau est d'environ 60 g pour 100 g d'eau.
\[\%\; KBr =\dfrac{60\; g\; KBr}{(60+100)\;g\; solution} = 40\%\]
Q11.4.5
Lequel des gaz suivants devrait être le plus soluble dans l'eau ? Expliquez votre raisonnement.
- CH 4
- CCl 4
- CHCl 3
S11.4.5
(c) Le CHCl 3 devrait être le plus soluble dans l'eau. Parmi les trois gaz, seul celui-ci est polaire et peut donc subir une attraction dipole-dipolaire relativement forte pour les molécules d'eau.
Q11.4.6
À 0 °C et à 1,00 atm, jusqu'à 0,70 g d'O 2 peuvent se dissoudre dans 1 L d'eau. À 0 °C et à 4,00 atm, combien de grammes d'O 2 se dissolvent dans 1 L d'eau ?
11.4.6
Ce problème nécessite l'application de la loi de Henry. L'équation déterminante est\(C_g = kP_g\).
\[k=\dfrac{C_g}{P_g}=\dfrac{0.70\;g}{1.00\; atm} =0.70\;g\; atm^{−1}\]
Dans les nouvelles conditions,\(C_g=0.70\;g\;atm^{−1} \times 4.00\; atm = 2.80\; g\).
Q11.4.7
Reportez-vous à la figure suivante pour les trois questions suivantes :

- Comment la concentration de CO 2 dissous dans la boisson a-t-elle évolué lorsque la bouteille a été ouverte ?
- Quelle est la cause de ce changement ?
- La boisson est-elle insaturée, saturée ou sursaturée en CO 2 ?
11.4.7
a) Elle a diminué à mesure qu'une partie du gaz CO 2 quittait la solution (comme en témoigne l'effervescence). (b) L'ouverture de la bouteille a libéré le gaz CO 2 à haute pression au-dessus de la boisson. La pression réduite du gaz CO 2, selon la loi de Henry, réduit la solubilité du CO 2. (c) La concentration de CO 2 dissous continuera de diminuer lentement jusqu'à ce que l'équilibre soit rétabli entre la boisson et la très faible pression de CO 2 dans la bouteille ouverte. Immédiatement après ouverture, la boisson contient donc du CO 2 dissous à une concentration supérieure à sa solubilité, une condition de déséquilibre, et est dite sursaturée.
Q11.4.8
La constante de la loi de Henry pour le CO 2 est de 25\(3.4 \times 10^{−2}\; M/atm\) °C. Quelle pression de dioxyde de carbone est nécessaire pour maintenir une concentration de CO 2 de 0,10 M dans une boîte de soda citron-lime ?
S11.4.8
\[P_g=\dfrac{C_g}{k}=\dfrac{0.10\; M}{3.4 \times 10^{−2}\;M/atm} =2.9\; atm\]
Q11.4.9
La constante de la loi de Henry pour l'O 2 est de 25\(1.3\times 10^{−3}\; M/atm\) °C. Quelle masse d'oxygène serait dissoute dans un aquarium de 40 L à 25 °C, en supposant une pression atmosphérique de 1,00 atm et une pression partielle de O 2 de 0,21 atm ?
S11.4.9
Commencez par la loi d'Henry
\[C_g=kP_g\]
et appliquez-le à\(O_2\)
\[C(O_2)=(1.3 \times 10^{−3}\; M/atm) (0.21\;atm)=2.7 \times 10^{−4}\;mol/L\]
La quantité totale est de \ (2,7 \ fois 10^ {−4} \ ; mol/L) (40 \ ; L=1,08 \ fois 10^ {−2} \ ; mol \]
La masse d'oxygène est\((1.08 \times 10^{−2}\; mol)(32.0\; g/mol)=0.346\;g\)
ou, en utilisant deux chiffres significatifs,\(0.35\; g\).
Q11.4.10
Combien de litres de gaz HCl, mesurés à 30,0 °C et 745 torr, sont nécessaires pour préparer 1,25 L d'une solution d'acide chlorhydrique à 3,20 M ?
S11.4.10
Tout d'abord, calculez les moles de HCl nécessaires. Utilisez ensuite la loi des gaz idéale pour trouver le volume requis.
M = mol L−1
3,20 m = x mol 1,25 L
x = 4,00 mol de HCl
Avant d'utiliser la loi des gaz idéaux, modifiez la pression en atmosphères et convertissez la température de °C en kelvin.
\ [1 \ ; atmx = 760 torr 745 torr
x = 0,9803 atm
V = NrTP = (4 000 molHCl) (0,08206 latmK−1 mol−1) (303,15 K) 0,9803 atm = 102 L de HCl
102 L de HCl
plus http://cnx.org/contents/ 2488FW6W @2 /Solubility
11.5 : Propriétés colligatives
Q11.5.1
Lesquels font partie du domaine macroscopique des solutions et lesquels font partie du domaine microscopique : élévation du point d'ébullition, loi de Henry, liaison hydrogène, attraction ion-dipôle, molarité, composition non électrolytique, composé non stoechiométrique, osmose, ion solvaté ?
Q11.5.2
Quelle est l'explication microscopique du comportement macroscopique illustré dans [lien] ?
11.5.2
La force des liaisons entre des molécules similaires est plus forte que la force entre des molécules différentes. Par conséquent, certaines régions existeront dans lesquelles les molécules d'eau excluront les molécules d'huile et d'autres régions dans lesquelles les molécules de pétrole excluront les molécules d'eau, formant ainsi une région hétérogène.
Q11.5.3
Esquissez un graphique qualitatif de la pression en fonction du temps de la vapeur d'eau au-dessus d'un échantillon d'eau pure et d'une solution sucrée, lorsque les liquides s'évaporent à la moitié de leur volume initial.
Q11.5.4
Une solution de nitrate de potassium, un électrolyte et une solution de glycérine (C 3 H 5 (OH) 3), un non-électrolyte, bouillent toutes deux à 100,3 °C. Quelles autres propriétés physiques des deux solutions sont identiques ?
11.5.4
Les deux forment des solutions homogènes ; leur élévation du point d'ébullition est la même, de même que leur abaissement de la pression de vapeur. La pression osmotique et l'abaissement du point de congélation sont également les mêmes pour les deux solutions.
Q11.5.5
Quelles sont les fractions molaires de H 3 PO 4 et d'eau dans une solution de 14,5 g de H 3 PO 4 dans 125 g d'eau ?
Q11.5.6
Quelles sont les fractions molaires du HNO 3 et de l'eau dans une solution concentrée d'acide nitrique (68,0 % de HNO 3 en masse) ?
11.5.6
- Détermine le nombre de moles de HNO 3 et de H 2 O dans 100 g de solution. Déterminez les fractions molaires des composants.
- La fraction molaire du HNO 3 est de 0,378. La fraction molaire de H 2 O est de 0,622.
Q11.5.7
Calculez la fraction molaire de chaque soluté et solvant :
- 583 g de H 2 SO 4 dans 1,50 kg d'eau, la solution acide utilisée dans une batterie automobile
- 0,86 g de NaCl dans 1,00 × 10 2 g d'eau, une solution de chlorure de sodium pour injection intraveineuse
- 46,85 g de codéine, C 18 H 21 NO 3, dans 125,5 g d'éthanol, C 2 H 5 OH
- 25 g de I 2 dans 125 g d'éthanol, C 2 H 5 OH
11.5.7
un.\(583\:g\:\ce{H2SO4}\times\dfrac{1\:mole\:\ce{H2SO4}}{98.08\:g\:\ce{H2SO4}}=5.94\:mole\:\ce{H2SO4}\)\(\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\:\)\(1.50\:kg\:\ce{H2O}\times\dfrac{1000\:g}{1\:kg}\times\dfrac{1\:mole\:\ce{H2O}}{18.02\:g\:\ce{H2O}}=83.2\:moles\:\ce{H2O}\)
Q11.5.8
Calculez la fraction molaire de chaque soluté et solvant :
- 0,710 kg de carbonate de sodium (soude), Na 2 CO 3, dans 10,0 kg d'eau — une solution saturée à 0 °C
- 125 g de NH 4 NO 3 dans 275 g d'eau, un mélange utilisé pour fabriquer un sac de glace instantané
- 25 g de Cl 2 dans 125 g de dichlorométhane, CH 2 Cl 2
- 0,372 g d'histamine, C 5 H 9 N, dans 125 g de chloroforme, CHCl 3
11.5.8
- \(X_\mathrm{Na_2CO_3}=0.0119\);\(X_\mathrm{H_2O}=0.988\) ;
- \(X_\mathrm{NH_4NO_3}=0.9927\);\(X_\mathrm{H_2O}=0.907\) ;
- \(X_\mathrm{Cl_2}=0.192\);\(X_\mathrm{CH_2CI_2}=0.808\) ;
- \(X_\mathrm{C_5H_9N}=0.00426\);\(X_\mathrm{CHCl_3}=0.997\)
Q11.5.9
Calculer les fractions molaires du méthanol, CH 3 OH ; de l'éthanol, C 2 H 5 OH ; et de l'eau dans une solution composée de 40 % de méthanol, 40 % d'éthanol et 20 % d'eau en masse. (Supposons que les données soient bonnes pour deux chiffres significatifs.)
Q11.5.10
Quelle est la différence entre une solution à 1 M et une solution à 1 m ?
11.5.10
Dans une solution à 1 M, la mole est contenue dans exactement 1 L de solution. Dans une solution à 1 m, la mole est contenue dans exactement 1 kg de solvant.
Q11.5.11
Quelle est la molalité de l'acide phosphorique, H 3 PO 4, dans une solution de 14,5 g de H 3 PO 4 dans 125 g d'eau ?
Q11.5.12
Quelle est la molalité de l'acide nitrique dans une solution concentrée d'acide nitrique (68,0 % de HNO 3 en masse) ?
11.5.12
a) Déterminer la masse molaire du HNO 3. Déterminez le nombre de moles d'acide dans la solution. À partir du nombre de moles et de la masse de solvant, déterminez la molalité. b) 33,7 m
Q11.5.13
Calculez la molalité de chacune des solutions suivantes :
- 583 g de H 2 SO 4 dans 1,50 kg d'eau, la solution acide utilisée dans une batterie automobile
- 0,86 g de NaCl dans 1,00 × 10 2 g d'eau, une solution de chlorure de sodium pour injection intraveineuse
- 46,85 g de codéine, C 18 H 21 NO 3, dans 125,5 g d'éthanol, C 2 H 5 OH
- 25 g de I 2 dans 125 g d'éthanol, C 2 H 5 OH
Q11.5.14
Calculez la molalité de chacune des solutions suivantes :
- 0,710 kg de carbonate de sodium (soude), Na 2 CO 3, dans 10,0 kg d'eau, soit une solution saturée à 0 °C
- 125 g de NH 4 NO 3 dans 275 g d'eau, un mélange utilisé pour fabriquer un sac de glace instantané
- 25 g de Cl 2 dans 125 g de dichlorométhane, CH 2 Cl 2
- 0,372 g d'histamine, C 5 H 9 N, dans 125 g de chloroforme, CHCl 3
11.5.14
a) 6,70 × 10 -1 m ; b) 5,67 m ; c) 2,8 m ; d) 0,0358 m
Q11.5.15
La concentration de glucose, C 6 H 12 O 6, dans le liquide céphalo-rachidien normal est de\(\mathrm{\dfrac{75\:mg}{100\:g}}\). Quelle est la molalité de la solution ?
Q11.5.16
Une solution à 13,0 % de K 2 CO 3 en masse a une densité de 1,09 g/cm 3. Calculez la molalité de la solution.
11.5.16
1,08 m
Q11.5.17
- Pourquoi 1 mol de chlorure de sodium abaisse-t-il le point de congélation d'un kg d'eau presque deux fois plus que 1 mol de glycérine ?
- Quel est le point d'ébullition d'une solution de 115,0 g de saccharose, C 12 H 22 O 11, dans 350,0 g d'eau ?
11.5.17
- Déterminer la masse molaire du saccharose ; déterminer le nombre de moles de saccharose dans la solution ; convertir la masse de solvant en unités de kilogrammes ; à partir du nombre de moles et de la masse de solvant, déterminer la molalité ; déterminer la différence entre le point d'ébullition de l'eau et le point d'ébullition du solution ; déterminez le nouveau point d'ébullition.
- 100.5 °C
Q11.5.18
Quel est le point d'ébullition d'une solution de 9,04 g de I 2 dans 75,5 g de benzène, en supposant que l'I 2 n'est pas volatil ?
Q11.5.19
Quelle est la température de congélation d'une solution de 115,0 g de saccharose, C 12 H 22 O 11, dans 350,0 g d'eau, qui gèle à 0,0 °C lorsqu'elle est pure ?
11.5.19
a) Déterminer la masse molaire du saccharose ; déterminer le nombre de moles de saccharose dans la solution ; convertir la masse de solvant en unités de kilogrammes ; à partir du nombre de moles et de la masse de solvant, déterminer la molalité ; déterminer la différence entre la température de congélation de l'eau et la température de congélation température de la solution ; déterminer la nouvelle température de congélation. (b) −1,8 °C
Q11.5.20
Quel est le point de congélation d'une solution de 9,04 g de I 2 dans 75,5 g de benzène ?
Q11.5.21
Quelle est la pression osmotique d'une solution aqueuse de 1,64 g de Ca (NO 3) 2 dans de l'eau à 25 °C ? Le volume de la solution est de 275 ml.
11.5.21
(a) Déterminer la masse molaire du Ca (NO 3) 2 ; déterminer le nombre de moles de Ca (NO 3) 2 dans la solution ; déterminer le nombre de moles d'ions dans la solution ; déterminer la molarité des ions, puis la pression osmotique. (b) 2,67 atm
Q11.5.2
Quelle est la pression osmotique d'une solution d'insuline bovine (masse molaire, 5700 g mol -1) à 18 °C si 100,0 ml de la solution contiennent 0,103 g d'insuline ?
Q11.5.23
Quelle est la masse molaire d'une solution de 5,00 g d'un composé dans 25,00 g de tétrachlorure de carbone (bp 76,8 °C ; K b = 5,02 °C/ m) qui bout à 81,5 °C à 1 atm ?
S11.5.24
a) Déterminer la concentration molale à partir de la variation du point d'ébullition et de K b ; déterminer les moles de soluté dans la solution à partir de la concentration molale et de la masse de solvant ; déterminer la masse molaire à partir du nombre de moles et de la masse de soluté. (b) 2,1 × 10 2 g mol −1
Q11.5.25
Un échantillon d'un composé organique (un non-électrolyte) pesant 1,35 g a abaissé le point de congélation de 10,0 g de benzène de 3,66 °C. Calculer la masse molaire du composé.
Q11.5.26
Une solution de 1 m de HCl dans du benzène a un point de congélation de 0,4 °C. Le HCl est-il un électrolyte dans le benzène ? Expliquez.
S11.5.26
Non Le benzène pur gèle à 5,5 °C, de sorte que le point de congélation observé de cette solution est abaissé par Δ T f = 5,5 − 0,4 = 5,1 °C. La valeur calculée, en supposant l'absence d'ionisation de HCl, est Δ T f = (1,0 m) (5,14 °C/ m) = 5,1 °C. Concordance entre ces valeurs confirme l'hypothèse selon laquelle le HCl n'est pas ionisé.
Q11.5.27
Une solution contient 5,00 g d'urée, CO (NH 2) 2, un composé non volatil, dissous dans 0,100 kg d'eau. Si la pression de vapeur de l'eau pure à 25 °C est de 23,7 torr, quelle est la pression de vapeur de la solution ?
Q11.5.28
Un échantillon de 12,0 g d'un non-électrolyte est dissous dans 80,0 g d'eau. La solution gèle à −1,94 °C. Calculer la masse molaire de la substance.
S11.5.28
144 g mol -1
Q11.5.29
Disposer les solutions suivantes dans l'ordre selon leur point de congélation décroissant : 0,1 m de Na 3 PO 4, 0,1 m de C 2 H 5 OH, 0,01 m de CO 2, 0,15 m de NaCl et 0,2 m de CaCl 2.
Q11.5.30
Calculer l'élévation du point d'ébullition de 0,100 kg d'eau contenant 0,010 mol de NaCl, 0,020 mol de Na 2 SO 4 et 0,030 mol de MgCl 2, en supposant une dissociation complète de ces électrolytes.
S11.5.30
0.870 °C
Q11.5.31
Comment préparer une solution aqueuse de 3,08 ml de glycérine, C 3 H 8 O 3 ? Quel est le point de congélation de cette solution ?
Q11.5.32
Un échantillon de soufre pesant 0,210 g a été dissous dans 17,8 g de disulfure de carbone, CS 2 (K b = 2,43 °C/ m). Si l'élévation du point d'ébullition était de 0,107 °C, quelle est la formule d'une molécule de soufre dans le disulfure de carbone ?
S11.5.32
S 8
Q11.5.3
Lors d'une expérience significative réalisée il y a de nombreuses années, 5,6977 g d'iodure de cadmium dans 44,69 g d'eau ont augmenté le point d'ébullition de 0,181 °C. Qu'est-ce que cela suggère sur la nature d'une solution de CDi 2 ?
Q11.5.34
Le lysozyme est une enzyme qui clive les parois cellulaires. Un échantillon de 0,100 L d'une solution de lysozyme contenant 0,0750 g de l'enzyme présente une pression osmotique de 1,32 × 10 −3 atm à 25 °C. Quelle est la masse molaire du lysozyme ?
S11.5.34
1,39 × 10 4 g mol −1
Q11.5.35
La pression osmotique d'une solution contenant 7,0 g d'insuline par litre est de 23 torr à 25 °C. Quelle est la masse molaire de l'insuline ?
Q11.5.36
La pression osmotique du sang humain est de 7,6 atm à 37 °C. Quelle masse de glucose, C 6 H 12 O 6, est nécessaire pour préparer 1,00 L de solution aqueuse destinée à l'alimentation par voie intraveineuse si la solution doit avoir la même pression osmotique que le sang à la température corporelle, 37 °C ?
S11.5.36
54 g
Q11.5.37
Quel est le point de congélation d'une solution de dibromobenzène, C 6 H 4 Br 2, dans 0,250 kg de benzène, si la solution bout à 83,5 °C ?
Q11.5.38
Quel est le point d'ébullition d'une solution de NaCl dans l'eau si la solution gèle à −0,93 °C ?
S11.5.38
100.26 °C
Q11.5.39
Le sucre fructose contient 40,0 % de C, 6,7 % de H et 53,3 % d'O en masse. Une solution de 11,7 g de fructose dans 325 g d'éthanol a un point d'ébullition de 78,59 °C. Le point d'ébullition de l'éthanol est de 78,35 °C et K b pour l'éthanol est de 1,20 °C/ m. Quelle est la formule moléculaire du fructose ?
Q11.5.40
La pression de vapeur du méthanol, CH 3 OH, est de 94 torr à 20 °C. La pression de vapeur de l'éthanol, C 2 H 5 OH, est de 44 torr à la même température.
- Calculer la fraction molaire de méthanol et d'éthanol dans une solution de 50,0 g de méthanol et 50,0 g d'éthanol.
- L'éthanol et le méthanol forment une solution qui se comporte comme une solution idéale. Calculer la pression de vapeur du méthanol et de l'éthanol au-dessus de la solution à 20 °C.
- Calculer la fraction molaire de méthanol et d'éthanol dans la vapeur au-dessus de la solution.
S 11.5.40
(a)\(X_\mathrm{CH_3OH}=0.590\) ;\(X_\mathrm{C_2H_5OH}=0.410\) ; (b) Les pressions de vapeur sont les suivantes : CH 3 OH : 55 torr ; C 2 H 5 OH : 18 torr ; (c) CH 3 OH : 0,75 ; C 2 H 5 OH : 0,25
Q11.5.41
Le point triple de l'eau sans air est défini à 273,15 K. Pourquoi est-il important que l'eau soit exempte d'air ?
Q11.5.42
La viande peut être classée comme fraîche (non congelée) même si elle est conservée à −1 °C. Pourquoi la viande ne gèlerait-elle pas à cette température ?
S11.5.42
Les ions et les composés présents dans l'eau du bœuf abaissent le point de congélation du bœuf en dessous de −1 °C.
Q11.5.43
Un composé organique a une composition de 93,46 % de C et de 6,54 % de H en masse. Une solution de 0,090 g de ce composé dans 1,10 g de camphre fond à 158,4 °C. Le point de fusion du camphre pur est de 178,4 °C. K f pour le camphre est de 37,7 °C/ m. Quelle est la formule moléculaire du soluté ? Montrez vos calculs.
Q11.5.4
Un échantillon de HgCl 2 pesant 9,41 g est dissous dans 32,75 g d'éthanol, C 2 H 5 OH (K b = 1,20 °C/ m). L'élévation du point d'ébullition de la solution est de 1,27 °C. Le HgCl 2 est-il un électrolyte dans l'éthanol ? Montrez vos calculs.
S11.5.4
\(\mathrm{Δbp}=K_\ce{b}m=(1.20\:°\ce C/m)\mathrm{\left(\dfrac{9.41\:g×\dfrac{1\:mol\: HgCl_2}{271.496\:g}}{0.03275\:kg}\right)=1.27\:°\ce C}\)
Le changement observé est égal au changement théorique ; par conséquent, aucune dissociation ne se produit.
Q11.5.45
Un sel est connu pour être un fluorure de métal alcalin. Une détermination rapide et approximative du point de congélation indique que 4 g de sel dissous dans 100 g d'eau produisent une solution qui gèle à environ −1,4 °C. Quelle est la formule du sel ? Montrez vos calculs.
11.6 : Colloïdes
Q11.6.1
Identifiez la phase dispersée et le milieu de dispersion dans chacun des systèmes colloïdaux suivants : dispersion d'amidon, fumée, brouillard, perle, crème fouettée, savon flottant, gelée, lait et rubis.
11.6.1
| Système colloïdal | Phase dispersée | Milieu de dispersion |
|---|---|---|
| dispersion d'amidon | amidon | eau |
| fumer | particules solides | air |
| brouillard | eau | air |
| perle | eau | carbonate de calcium (CaCO 3) |
| crème fouettée | air | crème |
| savon flottant | air | savon |
| gelée | jus de fruits | gel de pectine |
| lait | matière grasse | eau |
| rubis | oxyde de chrome (III) (Cr 2 O 3) | oxyde d'aluminium (Al 2 O 3) |
Q11.6.2
Distinguer les méthodes de dispersion des méthodes de condensation pour la préparation de systèmes colloïdaux.
11.6.2
Les méthodes de dispersion utilisent un dispositif de broyage ou un autre moyen pour subdiviser des particules plus grosses. Les méthodes de condensation rassemblent des unités plus petites pour former une unité plus grande. Par exemple, les molécules d'eau à l'état de vapeur se réunissent pour former de très petites gouttelettes que nous voyons sous forme de nuages.
Q11.6.3
En quoi les colloïdes diffèrent-ils des solutions en ce qui concerne la taille des particules dispersées et l'homogénéité ?
11.6.3
Les dispersions colloïdales sont constituées de particules beaucoup plus grosses que les solutés des solutions classiques. Les particules colloïdales sont soit de très grosses molécules, soit des agrégats d'espèces plus petites qui sont généralement assez grosses pour diffuser de la lumière. Les colloïdes sont homogènes à l'échelle macroscopique (visuelle), tandis que les solutions sont homogènes à l'échelle microscopique (moléculaire).
Q11.6.4
Expliquez l'action nettoyante du savon.
11.6.4
Les molécules de savon ont à la fois une extrémité hydrophobe et une extrémité hydrophile. L'extrémité chargée (hydrophile), généralement associée à un ion de métal alcalin, garantit la solubilité dans l'eau. L'extrémité hydrophobe permet d'attirer l'huile, la graisse et d'autres substances non polaires similaires qui, normalement, ne se dissolvent pas dans l'eau mais sont entraînées dans la solution par les molécules de savon.
Q11.6.5
Comment démontrer que les particules colloïdales sont chargées électriquement ?
11.6.5
Si elles sont placées dans une cellule électrolytique, les particules dispersées se déplaceront vers l'électrode qui porte une charge opposée à leur propre charge. Au niveau de cette électrode, les particules chargées seront neutralisées et coaguleront sous forme de précipité.


