11.3 : Solubilité
- Page ID
- 193936
- Décrire les effets de la température et de la pression sur la solubilité
- Énoncez la loi de Henry et utilisez-la dans des calculs impliquant la solubilité d'un gaz dans un liquide
- Expliquer les degrés de solubilité possibles pour les solutions liquides-liquides
Imaginez ajouter une petite quantité de sel dans un verre d'eau, remuer jusqu'à ce que tout le sel soit dissous, puis en ajouter un peu plus. Vous pouvez répéter ce processus jusqu'à ce que la concentration en sel de la solution atteigne sa limite naturelle, limite déterminée principalement par les forces d'attraction du soluté, du solvant soluté et du solvant-solvant décrites dans les deux modules précédents de ce chapitre. Vous pouvez être certain d'avoir atteint cette limite car, peu importe le temps pendant lequel vous mélangez la solution, il reste du sel non dissous. La concentration de sel dans la solution à ce stade est connue sous le nom de solubilité.
La solubilité d'un soluté dans un solvant particulier est la concentration maximale qui peut être atteinte dans des conditions données lorsque le processus de dissolution est à l'équilibre. À propos de l'exemple du sel dans l'eau :
\[\ce{NaCl}(s)⇌\ce{Na+}(aq)+\ce{Cl-}(aq) \label{11.4.1} \]
Lorsque la concentration d'un soluté est égale à sa solubilité, on dit que la solution est saturée avec ce soluté. Si la concentration du soluté est inférieure à sa solubilité, la solution est dite insaturée. Une solution qui contient une concentration relativement faible de soluté est appelée diluée, et une solution présentant une concentration relativement élevée est appelée concentrée.
Si nous ajoutons plus de sel à une solution saturée de sel, nous la voyons tomber au fond et ne semble plus se dissoudre. En fait, le sel ajouté se dissout, comme le montre la direction directe de l'équation de dissolution. En accompagnant ce processus, le sel dissous précipite, comme le montre le sens inverse de l'équation. On dit que le système est en équilibre lorsque ces deux processus réciproques se produisent à des taux égaux, de sorte que la quantité de sel non dissous et dissous reste constante. L'hypothèse selon laquelle les processus de dissolution et de précipitation se produisent simultanément est étayée par le fait que le nombre et la taille des cristaux de sel non dissous évolueront au fil du temps, même si leur masse combinée restera la même.
Des solutions peuvent être préparées dans lesquelles la concentration d'un soluté dépasse sa solubilité. Ces solutions sont dites sursaturées et constituent des exemples intéressants d'états non équilibrés. Par exemple, la boisson gazeuse contenue dans un contenant ouvert qui n'est pas encore « plat » est sursaturée en dioxyde de carbone ; avec le temps, la concentration de CO 2 diminuera jusqu'à atteindre sa valeur d'équilibre.
Solutions de gaz dans les liquides
Dans un module précédent de ce chapitre, l'effet des forces d'attraction intermoléculaires sur la formation de solutions a été discuté. Les structures chimiques du soluté et du solvant dictent les types de forces possibles et, par conséquent, constituent des facteurs importants pour déterminer la solubilité. Par exemple, dans des conditions similaires, la solubilité de l'oxygène dans l'eau est environ trois fois supérieure à celle de l'hélium, mais 100 fois inférieure à la solubilité du chlorométhane, CHCl 3. Compte tenu du rôle de la structure chimique du solvant, notez que la solubilité de l'oxygène dans l'hexane hydrocarboné liquide, le C 6 H 14, est environ 20 fois supérieure à celle de l'eau.
D'autres facteurs influent également sur la solubilité d'une substance donnée dans un solvant donné. La température est l'un de ces facteurs, la solubilité du gaz diminuant généralement à mesure que la température augmente (Figure\(\PageIndex{1}\)). Il s'agit de l'un des impacts majeurs résultant de la pollution thermique des plans d'eau naturels.
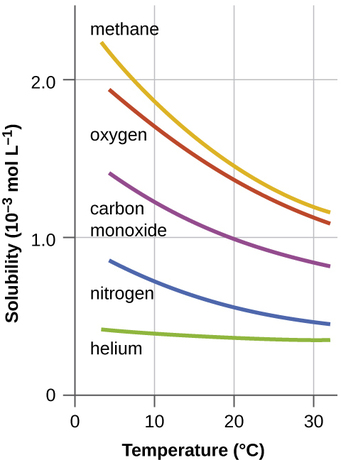
Lorsque la température d'une rivière, d'un lac ou d'un cours d'eau augmente anormalement, généralement en raison du rejet d'eau chaude provenant d'un procédé industriel, la solubilité de l'oxygène dans l'eau diminue. La diminution des niveaux d'oxygène dissous peut avoir de graves conséquences sur la santé des écosystèmes aquatiques et, dans les cas graves, entraîner la mort de poissons à grande échelle (Figure\(\PageIndex{2}\)).

La solubilité d'un soluté gazeux est également affectée par la pression partielle du soluté dans le gaz auquel la solution est exposée. La solubilité du gaz augmente à mesure que la pression du gaz augmente. Les boissons gazeuses illustrent bien cette relation. Le processus de gazéification consiste à exposer la boisson à une pression relativement élevée de dioxyde de carbone, puis à sceller le récipient à boisson, saturant ainsi la boisson en CO 2 à cette pression. Lorsque le contenant de boisson est ouvert, un sifflement familier se fait entendre lorsque la pression du dioxyde de carbone est relâchée, et une partie du dioxyde de carbone dissous est généralement vue laissant la solution sous forme de petites bulles (Figure\(\PageIndex{3}\)). À ce stade, la boisson est sursaturée en dioxyde de carbone et, avec le temps, la concentration de dioxyde de carbone dissous diminuera jusqu'à sa valeur d'équilibre et la boisson deviendra « plate ».

Pour de nombreux solutés gazeux, la relation entre la solubilité et la pression partielle est proportionnelle :\(C_g\)\(P_g\)
\[C_\ce{g}=kP_\ce{g} \nonumber \]
où\(k\) est une constante de proportionnalité qui dépend de l'identité du soluté gazeux et du solvant, ainsi que de la température de la solution. Il s'agit d'un énoncé mathématique de la loi de Henry : la quantité d'un gaz idéal qui se dissout dans un volume défini de liquide est directement proportionnelle à la pression du gaz.
À 20 °C, la concentration d'oxygène dissous dans l'eau exposée à l'oxygène gazeux à une pression partielle de 101,3 kPa (760 torr) est de 1,38 × 10 −3 mol L −1. Utilisez la loi de Henry pour déterminer la solubilité de l'oxygène lorsque sa pression partielle est de 20,7 kPa (155 torr), soit la pression approximative de l'oxygène dans l'atmosphère terrestre.
Solution
Selon la loi de Henry, pour une solution idéale, la solubilité, C g, d'un gaz (1,38 × 10 -3 mol L -1, dans ce cas) est directement proportionnelle à la pression, P g, du gaz non dissous au-dessus de la solution (101,3 kPa, soit 760 torr, dans ce cas). Comme nous connaissons à la fois C g et P g, nous pouvons réarranger cette expression pour résoudre k.
\ [\ begin {align*}
C_ \ ce {g} &=KP_ \ ce {g} \ \ [4 points]
k&= \ dfrac {C_ \ ce {g}} {P_ \ ce {g}} \ \ [4 points]
&= \ mathrm {\ dfrac {1,38 × 10^ {−3} \ :mol \ :L^ {−1} {} 101,3 \ :kPa}} \ \ [4 points]
&= \ mathrm {1,36 × 10^ {−5} \ :mol \ :L^ {−1} \ :kPa^ {−1}} \ \ [4 points]
et \ hspace {15 px} \ mathrm {(1,82 × 10^ {−6} \ :mol \ :L^ {−1} \ :torr^ {−1})}
\ end {align*} \ nonumber \]
Nous pouvons maintenant utiliser k pour trouver la solubilité à la pression inférieure.
\[C_\ce{g}=kP_\ce{g} \nonumber \]
\ [\ mathrm {1,36 × 10^ {−5} \ :mol \ :L^ {−1} \ :kPa^ {−1} ×20,7 \ :kPa \ \ [4 points]
(ou \ :1,82 × 10 ^ {−6} \ :mol \ :L^ {−1} \ :torr^ {−1} × 155 \ :torr) \ \ [4 points]
=2,82 × 10^ {−4} \ :mol \ :L^ {−1}} \ aucun nombre \]
Notez que différentes unités peuvent être utilisées pour exprimer les quantités impliquées dans ce type de calculs. Toute combinaison d'unités qui cède aux contraintes de l'analyse dimensionnelle est acceptable.
L'exposition d'un échantillon de 100,0 ml d'eau à 0 °C à une atmosphère contenant un soluté gazeux à 20,26 kPa (152 torr) a entraîné la dissolution de 1,45 × 10 −3 g du soluté. Utilisez la loi de Henry pour déterminer la solubilité de ce soluté gazeux lorsque sa pression est de 101,3 kPa (760 torr).
- Réponse
-
7,25 × 10 −3 g dans 100,0 ml ou 0,0725 g/L
Le mal de décompression (DCS), ou « les virages », est un effet de la pression accrue de l'air inhalé par les plongeurs lorsqu'ils nagent sous l'eau à des profondeurs considérables. Outre la pression exercée par l'atmosphère, les plongeurs sont soumis à une pression supplémentaire due à l'eau au-dessus d'eux, qui augmente d'environ 1 atm pour 10 m de profondeur. Par conséquent, l'air inhalé par un plongeur lorsqu'il est immergé contient des gaz à la pression ambiante supérieure correspondante, et les concentrations des gaz dissous dans le sang du plongeur sont proportionnellement plus élevées selon la loi de Henry.
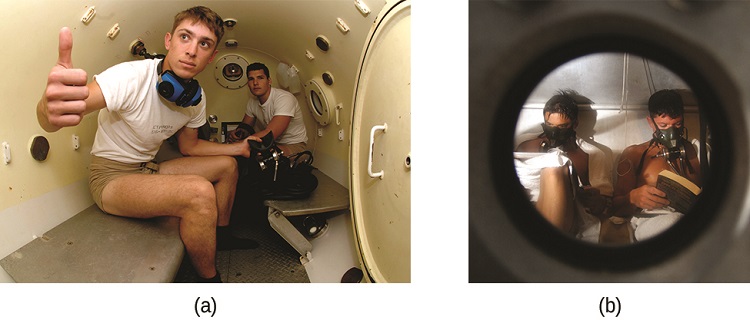
Lorsque le plongeur remonte à la surface de l'eau, la pression ambiante diminue et les gaz dissous deviennent moins solubles. Si l'ascension est trop rapide, les gaz qui s'échappent du sang du plongeur peuvent former des bulles pouvant provoquer divers symptômes, allant d'éruptions cutanées et de douleurs articulaires à la paralysie et à la mort. Pour éviter le DCS, les plongeurs doivent monter depuis des profondeurs à des vitesses relativement lentes (10 ou 20 m/min) ou effectuer plusieurs arrêts de décompression, en faisant une pause de plusieurs minutes à des profondeurs données pendant la montée. Lorsque ces mesures préventives échouent, les plongeurs atteints de DCS reçoivent souvent une oxygénothérapie hyperbare dans des récipients sous pression appelés chambres de décompression (ou de recompression) (Figure\(\PageIndex{4}\)).
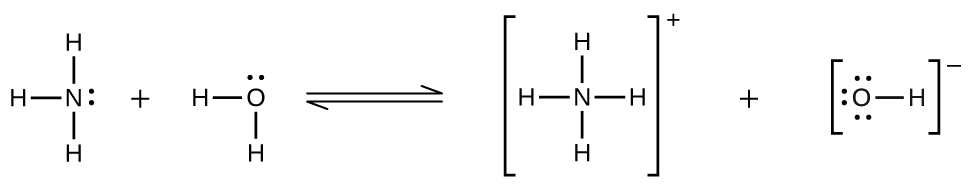
Des écarts par rapport à la loi de Henry sont observés lorsqu'une réaction chimique se produit entre le soluté gazeux et le solvant. Ainsi, par exemple, la solubilité de l'ammoniac dans l'eau n'augmente pas aussi rapidement avec l'augmentation de la pression que le prévoit la loi, car l'ammoniac, en tant que base, réagit dans une certaine mesure avec l'eau pour former des ions ammonium et des ions hydroxyde.
Les gaz peuvent former des solutions sursaturées. Si une solution d'un gaz dans un liquide est préparée à basse température ou sous pression (ou les deux), la solution peut devenir sursaturée à mesure que la solution se réchauffe ou que la pression du gaz diminue. En 1986, plus de 1 700 personnes au Cameroun ont été tuées lorsqu'un nuage de gaz, presque certainement du dioxyde de carbone, a jailli du lac Nyos (Figure\(\PageIndex{5}\)), un lac profond situé dans un cratère volcanique. L'eau du fond du lac Nyos est saturée en dioxyde de carbone par l'activité volcanique sous le lac. On pense que le lac a subi un renouvellement dû à un réchauffement progressif provenant du sous-sol, et que l'eau plus chaude et moins dense saturée de dioxyde de carbone a atteint la surface. En conséquence, d'énormes quantités de CO 2 dissous ont été libérées et le gaz incolore, plus dense que l'air, s'est répandu dans la vallée en contrebas du lac et a asphyxié les humains et les animaux vivant dans la vallée.

Solutions de liquides dans des liquides
Nous savons que certains liquides se mélangent entre eux dans toutes les proportions ; en d'autres termes, ils ont une solubilité mutuelle infinie et sont considérés comme miscibles. L'éthanol, l'acide sulfurique et l'éthylène glycol (couramment utilisés comme antigel, illustrés sur la figure\(\PageIndex{6}\)) sont des exemples de liquides complètement miscibles à l'eau. L'huile moteur à deux temps est miscible à l'essence.

Les liquides qui se mélangent à l'eau dans toutes les proportions sont généralement des substances polaires ou des substances qui forment des liaisons hydrogène. Pour de tels liquides, les attractions dipoles-dipôles (ou liaisons hydrogènes) des molécules de soluté avec les molécules de solvant sont au moins aussi fortes que celles entre les molécules du soluté pur ou du solvant pur. Les deux types de molécules se mélangent donc facilement. De même, les liquides non polaires sont miscibles entre eux car il n'y a pas de différence appréciable dans les forces intermoléculaires soluté-soluté, solvant-solvant et solute-solvant. La solubilité des molécules polaires dans les solvants polaires et des molécules non polaires dans les solvants non polaires est, encore une fois, une illustration de l'axiome chimique « comme se dissout comme ».
Deux liquides qui ne se mélangent pas de manière appréciable sont dits immiscibles. Des couches se forment lorsque nous versons des liquides non miscibles dans le même récipient. L'essence, le pétrole (Figure\(\PageIndex{7}\)), le benzène, le tétrachlorure de carbone, certaines peintures et de nombreux autres liquides non polaires ne sont pas miscibles à l'eau. L'attraction entre les molécules de ces liquides non polaires et les molécules d'eau polaires est inefficacement faible. Les seules attractions fortes d'un tel mélange se situent entre les molécules d'eau, de sorte qu'elles éliminent efficacement les molécules du liquide non polaire. La distinction entre immiscibilité et miscibilité est en fait une distinction de degrés, de sorte que les liquides miscibles ont une solubilité mutuelle infinie, tandis que les liquides dits non miscibles ont une solubilité mutuelle très faible (mais pas nulle).

Deux liquides, tels que le brome et l'eau, qui présentent une solubilité mutuelle modérée sont dits partiellement miscibles. Deux liquides partiellement miscibles forment généralement deux couches lorsqu'ils sont mélangés. Dans le cas du mélange de brome et d'eau, la couche supérieure est de l'eau saturée en brome et la couche inférieure est du brome saturé en eau. Comme le brome n'est pas polaire et donc peu soluble dans l'eau, la couche d'eau n'est que légèrement décolorée par le brome orange vif qui y est dissous. La solubilité de l'eau dans le brome étant très faible, il n'y a aucun effet notable sur la couleur foncée de la couche de brome (Figure\(\PageIndex{8}\)).

Solutions de solides dans des liquides
La dépendance de la solubilité à la température pour un certain nombre de solides inorganiques dans l'eau est illustrée par les courbes de solubilité de la figure\(\PageIndex{9}\). L'examen de ces données indique une tendance générale à l'augmentation de la solubilité avec la température, à quelques exceptions près, comme l'illustre le composé ionique sulfate de cérium.
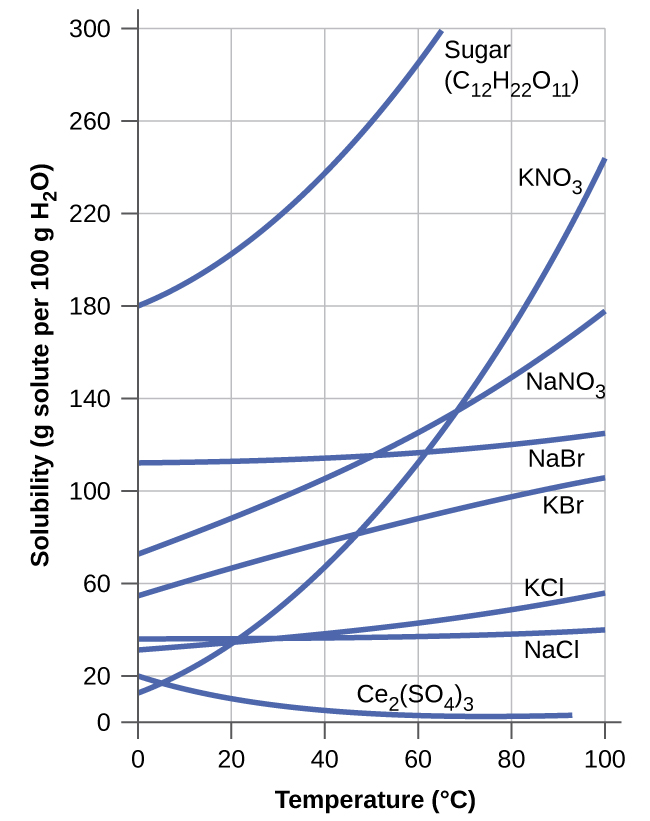
La dépendance de la solubilité à la température peut être exploitée pour préparer des solutions sursaturées de certains composés. Une solution peut être saturée avec le composé à une température élevée (où le soluté est plus soluble) puis refroidie à une température plus basse sans précipiter le soluté. La solution résultante contient du soluté à une concentration supérieure à sa solubilité d'équilibre à basse température (c'est-à-dire qu'elle est sursaturée) et est relativement stable. La précipitation de l'excès de soluté peut être initiée en ajoutant un germe cristallin (voir la vidéo dans le lien vers l'apprentissage plus haut dans ce module) ou en agitant mécaniquement la solution. Certains chauffe-mains, comme celui illustré sur la figure\(\PageIndex{10}\), tirent parti de ce comportement.

Vidéo\(\PageIndex{2}\) : Cette vidéo montre le processus de cristallisation qui se produit dans un chauffe-mains.
Résumé
La mesure dans laquelle une substance se dissoudra dans une autre est déterminée par plusieurs facteurs, notamment les types et les forces relatives des forces d'attraction intermoléculaires qui peuvent exister entre les atomes, les ions ou les molécules des substances. Cette tendance à la dissolution est quantifiée par la solubilité de la substance, sa concentration maximale dans une solution à l'équilibre dans des conditions spécifiées. Une solution saturée contient du soluté à une concentration égale à sa solubilité. Une solution sursaturée est une solution dans laquelle la concentration d'un soluté dépasse sa solubilité, un état de déséquilibre (instable) qui se traduira par une précipitation du soluté lorsque la solution est perturbée de manière appropriée. Les liquides miscibles sont solubles dans toutes les proportions et les liquides non miscibles présentent une très faible solubilité mutuelle. Les solubilités des solubilités des solutés gazeux diminuent avec l'augmentation de la température, tandis que celles de la plupart des solutés solides, mais pas de tous, augmentent avec la température. La concentration d'un soluté gazeux dans une solution est proportionnelle à la pression partielle du gaz auquel la solution est exposée, une relation connue sous le nom de loi de Henry.
Équations clés
- \(C_\ce{g}=kP_\ce{g}\)
Lexique
- Loi d'Henry
- loi établissant la relation proportionnelle entre la concentration de gaz dissous dans une solution et la pression partielle du gaz en contact avec la solution
- immiscible
- d'une solubilité mutuelle négligeable ; fait généralement référence à des substances liquides
- miscible
- mutuellement solubles dans toutes les proportions ; fait généralement référence à des substances liquides
- partiellement miscible
- d'une solubilité mutuelle modérée ; fait généralement référence à des substances liquides
- saturé
- de concentration égale à la solubilité ; contenant la concentration maximale de soluté possible pour une température et une pression données
- solubilité
- la mesure dans laquelle un soluté peut être dissous dans l'eau ou dans tout solvant
- sursaturé
- dont la concentration est supérieure à la solubilité ; état de déséquilibre
- insaturé
- dont la concentration est inférieure à la solubilité


