11.2 : Électrolytes
- Page ID
- 193933
- Définir et donner des exemples d'électrolytes
- Distinguer les changements physiques et chimiques qui accompagnent la dissolution des électrolytes ioniques et covalents
- Associer la résistance de l'électrolyte aux forces d'attraction du soluté
Lorsque certaines substances sont dissoutes dans l'eau, elles subissent un changement physique ou chimique qui produit des ions en solution. Ces substances constituent une classe importante de composés appelés électrolytes. Les substances qui ne produisent pas d'ions lorsqu'elles sont dissoutes sont appelées substances non électrolytes. Si le processus physique ou chimique qui génère les ions est essentiellement efficace à 100 % (la totalité du composé dissous produit des ions), alors la substance est considérée comme un électrolyte puissant. Si seule une fraction relativement faible de la substance dissoute subit le processus de production d'ions, on parle d'électrolyte faible.
Les substances peuvent être identifiées comme fortes, faibles ou non électrolytes en mesurant la conductance électrique d'une solution aqueuse contenant la substance. Pour conduire l'électricité, une substance doit contenir des espèces chargées et mobiles. La plus connue est la conduction de l'électricité à travers des fils métalliques, auquel cas les entités mobiles et chargées sont des électrons. Les solutions peuvent également être conductrices d'électricité si elles contiennent des ions dissous, la conductivité augmentant à mesure que la concentration en ions augmente. L'application d'une tension à des électrodes immergées dans une solution permet d'évaluer la concentration relative des ions dissous, soit quantitativement, en mesurant le flux de courant électrique, soit qualitativement, en observant la luminosité d'une ampoule incluse dans le circuit (Figure\(\PageIndex{1}\)).
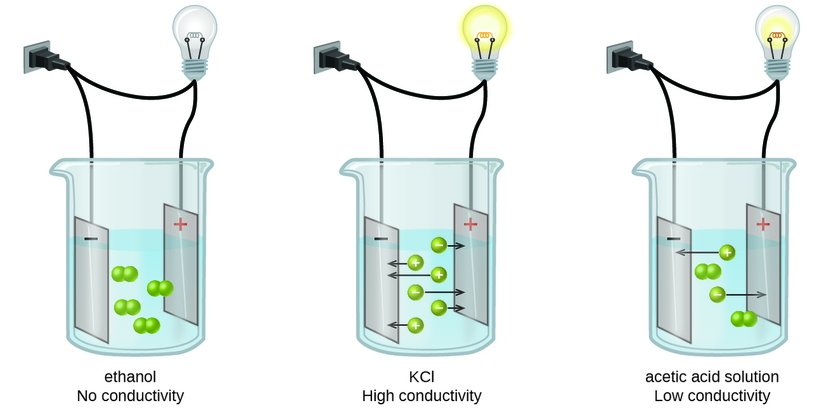
électrolytes ioniques
L'eau et les autres molécules polaires sont attirées par les ions, comme le montre la figure\(\PageIndex{2}\). L'attraction électrostatique entre un ion et une molécule dotée d'un dipôle est appelée attraction ion-dipôle. Ces attractions jouent un rôle important dans la dissolution des composés ioniques dans l'eau.
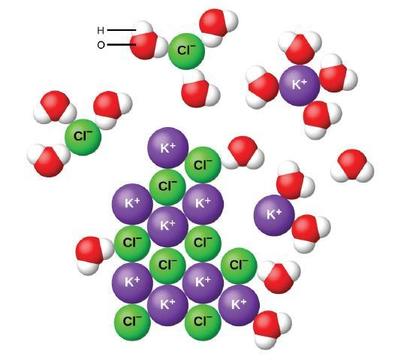
Lorsque les composés ioniques se dissolvent dans l'eau, les ions du solide se séparent et se dispersent uniformément dans la solution, car les molécules d'eau entourent et solvatent les ions, réduisant ainsi les fortes forces électrostatiques entre eux. Ce processus représente un changement physique connu sous le nom de dissociation. Dans la plupart des conditions, les composés ioniques se dissocient presque complètement lorsqu'ils sont dissous, et ils sont donc classés comme des électrolytes forts.
Voyons ce qui se passe au niveau microscopique lorsque nous ajoutons du KCl solide à de l'eau. Les forces dipolaires attirent l'extrémité positive (hydrogène) des molécules d'eau polaires vers les ions chlorure négatifs à la surface du solide, et elles attirent les extrémités négatives (oxygène) vers les ions potassium positifs. Les molécules d'eau pénètrent entre les ions K + et Cl − individuels et les entourent, réduisant ainsi les fortes forces interioniques qui lient les ions entre eux et les laissant se déplacer en solution sous forme d'ions solvatés, comme le montre la figure. La réduction de l'attraction électrostatique permet le mouvement indépendant de chaque ion hydraté dans une solution diluée, ce qui entraîne une augmentation du désordre du système lorsque les ions passent de leurs positions fixes et ordonnées dans le cristal à des états mobiles et beaucoup plus désordonnés en solution. Ce trouble accru est responsable de la dissolution de nombreux composés ioniques, dont le KCl, qui se dissolvent par absorption de chaleur.
Dans d'autres cas, les attractions électrostatiques entre les ions d'un cristal sont si importantes, ou les forces d'attraction dipolaires entre les ions et les molécules d'eau sont si faibles, que l'augmentation du désordre ne peut pas compenser l'énergie requise pour séparer les ions, et le cristal est insoluble. C'est le cas de composés tels que le carbonate de calcium (calcaire), le phosphate de calcium (le composant inorganique des os) et l'oxyde de fer (rouille).
Électrolytes covalents
L'eau pure est un très mauvais conducteur d'électricité parce qu'elle n'est que très légèrement ionisée : environ deux molécules sur un milliard s'ionisent à 25 °C. L'eau s'ionise lorsqu'une molécule d'eau transmet un proton à une autre molécule d'eau, produisant ainsi des ions hydronium et hydroxyde.
\[\ce{H_2O (l)+ H_2O (l) \rightleftharpoons H_3O^{+} (aq) + OH^{−} (aq)} \label{11.3.2} \]
Dans certains cas, nous constatons que les solutions préparées à partir de composés covalents conduisent l'électricité parce que les molécules du soluté réagissent chimiquement avec le solvant pour produire des ions. Par exemple, le chlorure d'hydrogène pur est un gaz constitué de molécules de HCl covalentes. Ce gaz ne contient pas d'ions. Cependant, lorsque nous dissolvons du chlorure d'hydrogène dans de l'eau, nous constatons que la solution est un très bon conducteur. Les molécules d'eau jouent un rôle essentiel dans la formation des ions : les solutions de chlorure d'hydrogène contenues dans de nombreux autres solvants, tels que le benzène, ne conduisent pas l'électricité et ne contiennent pas d'ions.
Le chlorure d'hydrogène est un acide, et ses molécules réagissent donc avec l'eau, transférant des ions H + pour former des ions hydronium (\(H_3O^+\)) et des ions chlorure (Cl −) :
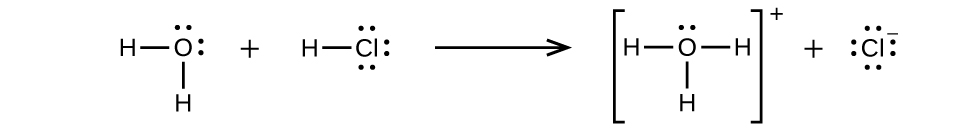
Cette réaction est pratiquement complète à 100 % pour le HCl (c'est-à-dire qu'il s'agit d'un acide fort et, par conséquent, d'un électrolyte fort). De même, les acides et les bases faibles qui ne réagissent que partiellement génèrent des concentrations d'ions relativement faibles lorsqu'ils sont dissous dans l'eau et sont classés dans la catégorie des électrolytes faibles. Le lecteur souhaitera peut-être revoir la discussion sur les acides forts et faibles présentée dans le chapitre précédent de ce texte sur les classes de réactions et la stœchiométrie.
Résumé
Les substances qui se dissolvent dans l'eau pour produire des ions sont appelées électrolytes. Les électrolytes peuvent être des composés covalents qui réagissent chimiquement avec l'eau pour produire des ions (par exemple, des acides et des bases), ou des composés ioniques qui se dissocient pour produire leurs cations et anions constitutifs, une fois dissous. La dissolution d'un composé ionique est facilitée par des attractions dipolaires ioniques entre les ions du composé et les molécules d'eau polaires. Les substances ioniques solubles et les acides forts s'ionisent complètement et sont des électrolytes puissants, tandis que les acides et les bases faibles ne s'ionisent que dans une faible mesure et sont des électrolytes faibles. Les substances non électrolytes ne produisent pas d'ions lorsqu'elles sont dissoutes dans l'eau.
Lexique
- dissociation
- processus physique accompagnant la dissolution d'un composé ionique dans lequel les ions constitutifs du composé sont solvatés et dispersés dans toute la solution
- électrolyte
- substance qui produit des ions lorsque dissoute dans l'eau
- attraction ion-dipôle
- attraction électrostatique entre un ion et une molécule polaire
- non électrolytique
- substance qui ne produit pas d'ions lorsqu'elle est dissoute dans l'eau
- électrolyte puissant
- substance qui se dissocie ou s'ionise complètement lorsqu'elle est dissoute dans l'eau
- électrolyte faible
- substance qui ne s'ionise que partiellement une fois dissoute dans l'eau


