11.1 : Le processus de dissolution
- Page ID
- 193938
- Décrire les propriétés de base des solutions et leur mode de formation.
- Prédisez si un mélange donné produira une solution en fonction des propriétés moléculaires de ses composants.
- Expliquez pourquoi certaines solutions produisent ou absorbent de la chaleur lorsqu'elles se forment.
Un chapitre précédent de ce texte a introduit des solutions, définies comme des mélanges homogènes de deux substances ou plus. Souvent, un composant d'une solution est présent à une concentration nettement supérieure, auquel cas il est appelé solvant. Les autres composants de la solution présents à des concentrations relativement faibles sont appelés solutés. Le sucre est un solide covalent composé de molécules de saccharose,\(\ce{C12H22O11}\). Lorsque ce composé se dissout dans l'eau, ses molécules se répartissent uniformément parmi les molécules d'eau :
\[\ce{C12H22O11 (s) ⟶ C12H22O11 (aq) } \label{Eq1} \]
L'indice « aq » de l'équation signifie que les molécules de saccharose sont des solutés et sont donc dispersées individuellement dans la solution aqueuse (l'eau est le solvant). Bien que les molécules de saccharose soient plus lourdes que les molécules d'eau, elles restent dispersées dans la solution ; la gravité ne les fait pas « se déposer » au fil du temps.
Le dichromate de potassium est un composé ionique composé d'ions potassium incolores et d'ions dichromate orange\(\ce{Cr_2O_7^{2−}}\).\(\ce{K_2Cr_2O_7}\)\(\mathrm{K^+}\) Lorsqu'une petite quantité de dichromate de potassium solide est ajoutée à l'eau, le composé se dissout et se dissocie pour produire des ions potassium et des ions dichromate répartis uniformément dans tout le mélange (Figure\(\PageIndex{1}\)), comme indiqué dans cette équation :
\[\ce{K2Cr2O7(s) ⟶ 2K^{+} (aq) + Cr2O7^{2-} (aq)} \label{Eq2} \]
Comme pour le mélange de sucre et d'eau, ce mélange est également une solution aqueuse. Ses solutés, les ions potassium et dichromate, restent dispersés individuellement parmi les molécules du solvant (eau).

L'eau est si souvent utilisée comme solvant que le mot solution en est venu à impliquer une solution aqueuse pour de nombreuses personnes. Cependant, presque tous les gaz, liquides ou solides peuvent agir comme solvants. De nombreux alliages sont des solutions solides d'un métal dissous dans un autre ; par exemple, les pièces de cinq cents américaines contiennent du nickel dissous dans du cuivre. L'air est une solution gazeuse, un mélange homogène d'azote, d'oxygène et de plusieurs autres gaz. L'oxygène (un gaz), l'alcool (un liquide) et le sucre (un solide) se dissolvent tous dans l'eau (un liquide) pour former des solutions liquides. Le tableau\(\PageIndex{1}\) donne des exemples de plusieurs solutions différentes et les phases des solutés et des solvants.
| Solution | Soluté | Solvant |
|---|---|---|
| air | O 2 (g) | N 2 (g) |
| boissons gazeuses | CO 2 (g) | H 2 O (l) |
| hydrogène dans le palladium | H 2 (g) | Dossier (s) |
| alcool à friction | H 2 O (l) | C 3 H 8 O (l) (2-propanol) |
| eau salée | NaCl (s) | H 2 O (l) |
| cuivre | Zn (s) | Tasse (s) |
Les solutions présentent les caractéristiques suivantes :
- Ils sont homogènes, c'est-à-dire qu'une fois la solution mélangée, elle a la même composition en tout point (sa composition est uniforme).
- L'état physique d'une solution, solide, liquide ou gazeuse, est généralement le même que celui du solvant, comme le montrent les exemples du tableau\(\PageIndex{1}\).
- Les composants d'une solution sont dispersés à l'échelle moléculaire, c'est-à-dire qu'ils sont constitués d'un mélange de molécules, d'atomes et/ou d'ions séparés.
- Le soluté dissous dans une solution ne se décantera pas et ne se séparera pas du solvant.
- La composition d'une solution, ou les concentrations de ses composants, peuvent être modifiées en continu, dans certaines limites.
La formation de solutions
La formation d'une solution est un exemple de processus spontané, un processus qui se produit dans des conditions spécifiées sans avoir besoin d'énergie provenant d'une source externe. Parfois, nous remuons un mélange pour accélérer le processus de dissolution, mais cela n'est pas nécessaire ; une solution homogène se formerait si nous attendions suffisamment longtemps. Le sujet de la spontanéité est d'une importance critique pour l'étude de la thermodynamique chimique et sera traité de manière plus approfondie dans un chapitre ultérieur de ce texte. Aux fins de la discussion de ce chapitre, il suffira de considérer deux critères qui favorisent, mais ne garantissent pas, la formation spontanée d'une solution :
- une diminution de l'énergie interne du système (un changement exothermique, comme indiqué dans le chapitre précédent sur la thermochimie)
- une augmentation du trouble du système (qui indique une augmentation de l'entropie du système, comme vous le découvrirez dans le chapitre suivant sur la thermodynamique)
Au cours du processus de dissolution, un changement d'énergie interne se produit souvent, mais pas toujours, lorsque la chaleur est absorbée ou émise. Une augmentation du désordre se produit toujours lorsqu'une solution se forme.
Lorsque les forces d'attraction intermoléculaires entre les espèces de soluté et de solvant dans une solution ne sont pas différentes de celles présentes dans les composants séparés, la solution se forme sans changement d'énergie associé. Une telle solution est appelée solution idéale. Un mélange de gaz idéaux (ou de gaz tels que l'hélium et l'argon, qui se rapprochent étroitement du comportement idéal) est un exemple de solution idéale, car les entités composant ces gaz ne présentent aucune attraction intermoléculaire significative.
Lorsque des récipients d'hélium et d'argon sont connectés, les gaz se mélangent spontanément en raison de la diffusion et forment une solution (Figure\(\PageIndex{2}\)). La formation de cette solution entraîne clairement une augmentation du désordre, puisque les atomes d'hélium et d'argon occupent un volume deux fois plus important que celui qu'ils occupaient chacun avant le mélange.
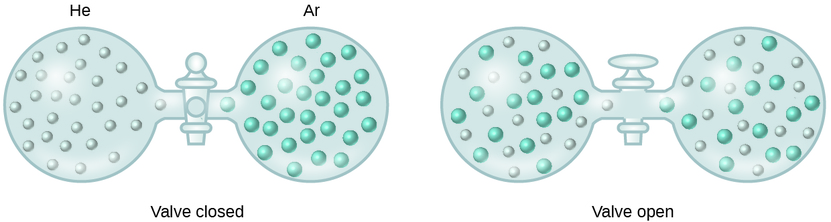
Des solutions idéales peuvent également se former lorsque des liquides de structure similaire sont mélangés. Par exemple, les mélanges des alcools méthanol (CH 3 OH) et éthanol (C 2 H 5 OH) forment des solutions idéales, de même que les mélanges des hydrocarbures pentane et hexane\(\ce{C6H14}\).\(\ce{C5H12}\) Le fait de placer du méthanol et de l'éthanol, ou du pentane et de l'hexane, dans les ampoules illustrées sur la figure\(\PageIndex{2}\) entraînera la même diffusion et le même mélange subséquent de ces liquides que ceux observés pour les gaz He et Ar (bien qu'à un rythme beaucoup plus lent), produisant des solutions sans changement significatif d'énergie. Contrairement à un mélange de gaz, les composants de ces solutions liquide-liquide sont toutefois soumis à des forces d'attraction intermoléculaires. Mais comme les molécules des deux substances mélangées sont structurellement très similaires, les forces d'attraction intermoléculaires entre des molécules similaires et différentes sont essentiellement les mêmes, et le processus de dissolution n'entraîne donc aucune augmentation ou diminution appréciable de l'énergie. Ces exemples illustrent comment la diffusion à elle seule peut fournir la force motrice requise pour provoquer la formation spontanée d'une solution. Dans certains cas, cependant, les amplitudes relatives des forces d'attraction intermoléculaires entre les espèces du soluté et du solvant peuvent empêcher la dissolution.
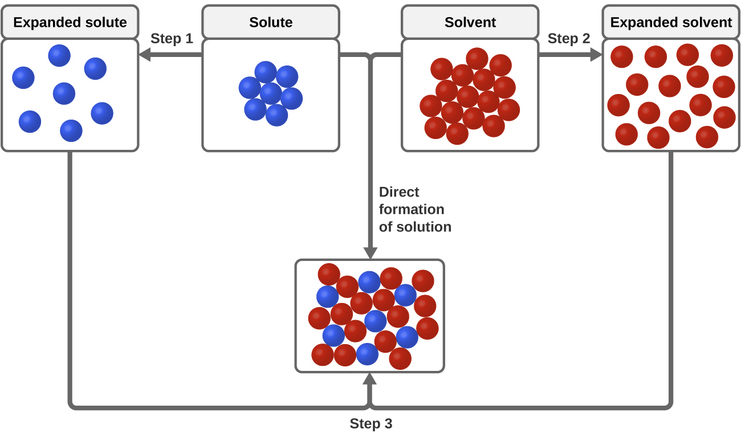
Trois types de forces d'attraction intermoléculaires sont pertinentes pour le processus de dissolution : soluté-soluté, solvant-solvant et solu-solvant. Comme l'illustre la figure\(\PageIndex{3}\), la formation d'une solution peut être considérée comme un processus par étapes dans lequel de l'énergie est consommée pour surmonter les attractions soluté-soluté et solvant-solvant (processus endothermiques) et libérée lorsque les attractions soluté-solvant sont établies (un processus exothermique appelé solvatation). L'ampleur relative des changements d'énergie associés à ces processus par étapes détermine si l'ensemble du processus de dissolution libérera ou absorbera de l'énergie. Dans certains cas, les solutions ne se forment pas parce que l'énergie requise pour séparer les espèces de soluté et de solvant est bien supérieure à l'énergie libérée par la solvatation.

Par exemple, les huiles de cuisson et l'eau ne se mélangent pas de manière appréciable pour obtenir des solutions (Figure\(\PageIndex{4}\)). La liaison hydrogène est la principale force d'attraction intermoléculaire présente dans l'eau liquide ; les molécules d'hydrocarbures non polaires des huiles de cuisson ne sont pas capables de se lier à l'hydrogène, mais sont maintenues ensemble par les forces de dispersion. Pour former une solution huile-eau, il faudrait surmonter la très forte liaison hydrogène dans l'eau, ainsi que les forces de dispersion significativement fortes entre les molécules de pétrole relativement grandes. Et comme les molécules d'eau polaires et les molécules d'huile non polaires ne subiraient pas une très forte attraction intermoléculaire, très peu d'énergie serait libérée par la solvatation.
D'autre part, un mélange d'éthanol et d'eau se mélangera dans toutes les proportions pour obtenir une solution. Dans ce cas, les deux substances sont capables de se lier à l'hydrogène, de sorte que le processus de solvatation est suffisamment exothermique pour compenser les séparations endothermiques des molécules de soluté et de solvant.

Comme indiqué au début de ce module, la formation spontanée de solutions est favorisée, mais non garantie, par les procédés de dissolution exothermiques. Alors que de nombreux composés solubles se dissolvent effectivement en libérant de la chaleur, certains se dissolvent par voie endothermique. Le nitrate d'ammonium (NH 4 NO 3) en est un exemple et est utilisé pour fabriquer des compresses froides instantanées pour traiter des blessures, comme celle illustrée sur la figure\(\PageIndex{5}\). Un sac d'eau en plastique à paroi mince est scellé à l'intérieur d'un sac plus grand contenant du NH 4 NO 3 solide. Lorsque le petit sac est cassé, une solution de NH 4 NO 3 se forme, absorbant la chaleur provenant de l'environnement (la zone lésée sur laquelle le sachet est appliqué) et fournit une compresse froide qui diminue l'enflure. Les dissolutions endothermiques comme celle-ci nécessitent un apport énergétique plus important pour séparer les espèces de solutés que ce qui est récupéré lorsque les solutés sont solvatés, mais elles sont néanmoins spontanées en raison de l'augmentation du désordre qui accompagne la formation de la solution.
Vidéo\(\PageIndex{1}\) : Regardez cette courte vidéo illustrant les processus de dissolution endothermique et exothermique.
Résumé
Une solution se forme lorsque deux substances ou plus se combinent physiquement pour former un mélange homogène au niveau moléculaire. Le solvant est le composant le plus concentré et détermine l'état physique de la solution. Les solutés sont les autres composants généralement présents à des concentrations inférieures à celles du solvant. Les solutions peuvent se former de manière endothermique ou exothermique, en fonction de l'importance relative des forces d'attraction intermoléculaires du soluté et du solvant. Les solutions idéales se forment sans changement d'énergie appréciable.
Notes
- Si des bulles de gaz sont observées dans le liquide, le mélange n'est pas homogène et ne constitue donc pas une solution.
Lexique
- alliage
- mélange solide d'un élément métallique et d'un ou plusieurs éléments supplémentaires
- solution idéale
- solution qui se forme sans changement d'énergie associé
- solvatation
- processus exothermique dans lequel les forces d'attraction intermoléculaires entre le soluté et le solvant dans une solution sont établies
- processus spontané
- changement physique ou chimique qui se produit sans ajout d'énergie provenant d'une source externe


