4.5 : Analyse chimique quantitative
- Page ID
- 194074
- Décrire les aspects fondamentaux des titrages et de l'analyse gravimétrique.
- Effectuez des calculs stœchiométriques à l'aide de données de titrage et de gravimétrie classiques.
Au XVIIIe siècle, la teneur (en fait la concentration) des échantillons de vinaigre a été déterminée en notant la quantité de carbonate de potassium, K 2 CO 3, qui devait être ajoutée, petit à petit, avant que le bouillonnement ne cesse. Plus le poids de carbonate de potassium ajouté pour atteindre le point de fin du bouillonnement est important, plus le vinaigre est concentré.
Nous savons maintenant que l'effervescence qui s'est produite au cours de ce processus était due à la réaction avec l'acide acétique, le CH 3 CO 2 H, le composé principalement responsable de l'odeur et du goût du vinaigre. L'acide acétique réagit avec le carbonate de potassium selon l'équation suivante :
\[\ce{2CH3CO2H}(aq)+\ce{K2CO3}(s)\rightarrow 2 \ce{KCH3CO3}(aq)+\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Le bouillonnement était dû à la production de CO 2.
Le test du vinaigre avec du carbonate de potassium est un type d'analyse quantitative : la détermination de la quantité ou de la concentration d'une substance dans un échantillon. Lors de l'analyse du vinaigre, la concentration du soluté (acide acétique) a été déterminée à partir de la quantité de réactif qui s'est combinée au soluté présent dans un volume connu de la solution. Dans d'autres types d'analyses chimiques, la quantité d'une substance présente dans un échantillon est déterminée en mesurant la quantité de produit obtenue.
Titrage
L'approche décrite pour mesurer la force du vinaigre était une première version de la technique analytique connue sous le nom d'analyse par titrage. Une analyse de titrage classique implique l'utilisation d'une burette (Figure\(\PageIndex{1}\)) pour ajouter progressivement une solution contenant une concentration connue d'une substance (le titrant) à une solution d'échantillon contenant la substance dont la concentration doit être mesurée (le analyte). Le titrant et l'analyte subissent une réaction chimique de stœchiométrie connue, de sorte que la mesure du volume de solution titrante requis pour une réaction complète avec l'analyte (point d'équivalence du titrage) permet de calculer la concentration de l'analyte. Le point d'équivalence d'un titrage peut être détecté visuellement si un changement distinct de l'aspect de la solution d'échantillon accompagne la fin de la réaction. L'arrêt de la formation de bulles dans l'analyse classique du vinaigre en est un exemple, bien que, le plus souvent, des colorants spéciaux appelés indicateurs soient ajoutés aux solutions des échantillons pour provoquer un changement de couleur au point d'équivalence du titrage ou très proche de celui-ci. Les points d'équivalence peuvent également être détectés en mesurant certaines propriétés de la solution qui changent de manière prévisible au cours du titrage. Quelle que soit l'approche adoptée pour détecter le point d'équivalence d'un titrage, le volume de titrant réellement mesuré est appelé point final. Des méthodes de titrage correctement conçues garantissent généralement que la différence entre l'équivalence et les points finaux est négligeable. Bien que n'importe quel type de réaction chimique puisse servir de base à une analyse de titrage, les trois réactions décrites dans ce chapitre (précipitation, acide-base et redox) sont les plus courantes. Des détails supplémentaires concernant l'analyse de titrage sont fournis dans le chapitre sur les équilibres acido-basiques.

Le point final d'un titrage d'un échantillon de 50,00 ml de HCl aqueux a été atteint par l'ajout de 35,23 ml de titrant NaOH à 0,250 M. La réaction de titrage est la suivante :
\[\ce{HCl}(aq)+\ce{NaOH}(aq)\rightarrow \ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
Quelle est la molarité du HCl ?
Solution
Comme pour tous les calculs de stœchiométrie des réactions, le principal problème est la relation entre les quantités molaires des espèces chimiques d'intérêt telles que décrites dans l'équation chimique équilibrée. L'approche décrite dans les modules précédents de ce chapitre est suivie, avec des considérations supplémentaires requises, puisque les quantités de réactifs fournies et demandées sont exprimées en concentrations de solution.
Pour cet exercice, le calcul suivra les étapes décrites ci-dessous :
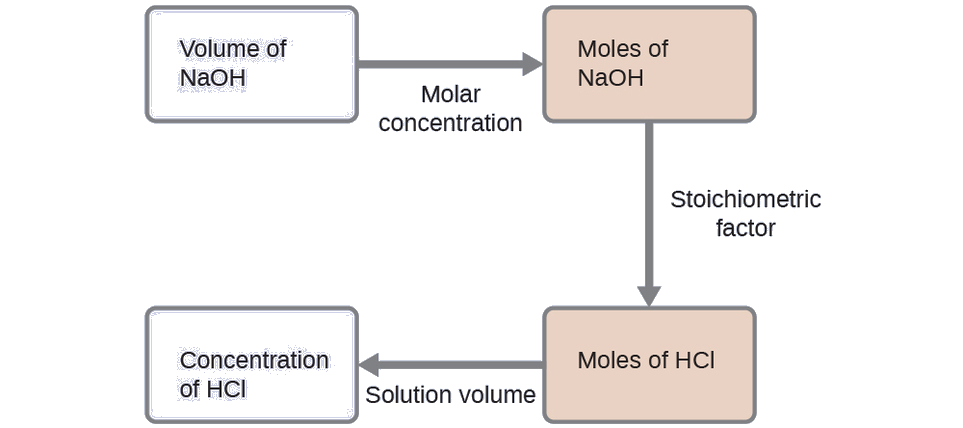
La quantité molaire de HCl est calculée comme suit :
\[\mathrm{35.23\:\cancel{mL\: NaOH}\times \dfrac{1\:\cancel{L}}{1000\:\cancel{mL}}\times \dfrac{0.250\:\cancel{mol\: NaOH}}{1\:\cancel{L}}\times \dfrac{1\: mol\: HCl}{1\:\cancel{mol\: NaOH}}=8.81\times 10^{-3}\:mol\: HCl} \nonumber \]
En utilisant le volume de solution de HCl fourni et la définition de la molarité, la concentration de HCl est la suivante :
\ [\ begin {align*}
M&= \ mathrm {\ dfrac {mol \ : HCl} {L \ : solution}} \ \
M&= \ mathrm {\ dfrac {8,81 \ times 10^ {-3} \ :mol \ : HCl} {50,00 \ : mL \ times \ dfrac {1 \ : L} {1000 \ : mL}} \
M&= &=0.176 \ :M
\ end {align*} \ nonnumber \]
Remarque : Pour ces types de calculs de titrage, il convient de reconnaître que la molarité de la solution est également égale au nombre de millimoles de soluté par millilitre de solution :
\[M=\mathrm{\dfrac{mol\: solute}{L\: solution}\times \dfrac{\dfrac{10^3\:mmol}{mol}}{\dfrac{10^3\:mL}{L}}=\dfrac{mmol\: solute}{mL\: solution}} \nonumber \]
L'utilisation de cette version de l'unité de molarité raccourcira le calcul en éliminant deux facteurs de conversion :
\[\mathrm{\dfrac{35.23\:mL\: NaOH\times \dfrac{0.250\:mmol\: NaOH}{mL\: NaOH}\times \dfrac{1\:mmol\: HCl}{1\:mmol\: NaOH}}{50.00\:mL\: solution}=0.176\: \mathit M\: HCl} \nonumber \]
Un échantillon de 20,00 ml d'acide oxalique aqueux, H 2 C 2 O 4, a été titré avec une solution 0,09113- M de permanganate de potassium, KMnO 4.
\[\ce{2MnO4-}(aq)+\ce{5H2C2O4}(aq)+\ce{6H+}(aq)\rightarrow \ce{10CO2}(g)+\ce{2Mn^2+}(aq)+\ce{8H2O}(l) \nonumber \]
Un volume de 23,24 ml était nécessaire pour atteindre le point final. Quelle est la molarité de l'acide oxalique ?
- Réponse
-
0,2648 M
Analyse gravimétrique
Une analyse gravimétrique est une analyse au cours de laquelle un échantillon est soumis à un traitement qui entraîne une modification de l'état physique de l'analyte, ce qui permet de le séparer des autres composants de l'échantillon. Les mesures de masse de l'échantillon, de l'analyte isolé ou de tout autre composant du système d'analyse, utilisées conjointement avec la stœchiométrie connue des composés concernés, permettent de calculer la concentration de l'analyte. Les méthodes gravimétriques ont été les premières techniques utilisées pour l'analyse chimique quantitative et elles restent des outils importants dans les laboratoires de chimie modernes.
Le changement d'état requis dans une analyse gravimétrique peut être obtenu par divers procédés physiques et chimiques. Par exemple, la teneur en humidité (eau) d'un échantillon est régulièrement déterminée en mesurant la masse d'un échantillon avant et après qu'il soit soumis à un processus de chauffage contrôlé qui évapore l'eau. Les techniques gravimétriques dans lesquelles l'analyte est soumis à une réaction de précipitation du type décrit plus haut dans ce chapitre sont également courantes. Le précipité est généralement isolé du mélange réactionnel par filtration, soigneusement séché, puis pesé (Figure\(\PageIndex{2}\)). La masse du précipité peut ensuite être utilisée, ainsi que les relations stœchiométriques pertinentes, pour calculer la concentration de l'analyte.

Un mélange solide de 0,4550 g contenant du MgSO 4 est dissous dans de l'eau et traité avec un excès de Ba (NO 3) 2, ce qui entraîne la précipitation de 0,6168 g de BaSO 4.
\[\ce{MgSO4}(aq)+\ce{Ba(NO3)2}(aq)\rightarrow \ce{BaSO4}(s)+\ce{Mg(NO3)2}(aq) \nonumber \]
Quelle est la concentration (pourcentage) de MgSO 4 dans le mélange ?
Solution
Le plan de ce calcul est similaire à celui des autres calculs stœchiométriques, l'étape centrale étant la connexion entre les moles de BaSO 4 et de MgSO 4 via leur facteur stœchiométrique. Une fois la masse de MgSO 4 calculée, elle peut être utilisée avec la masse du mélange d'échantillons pour calculer la concentration en pourcentage demandée.
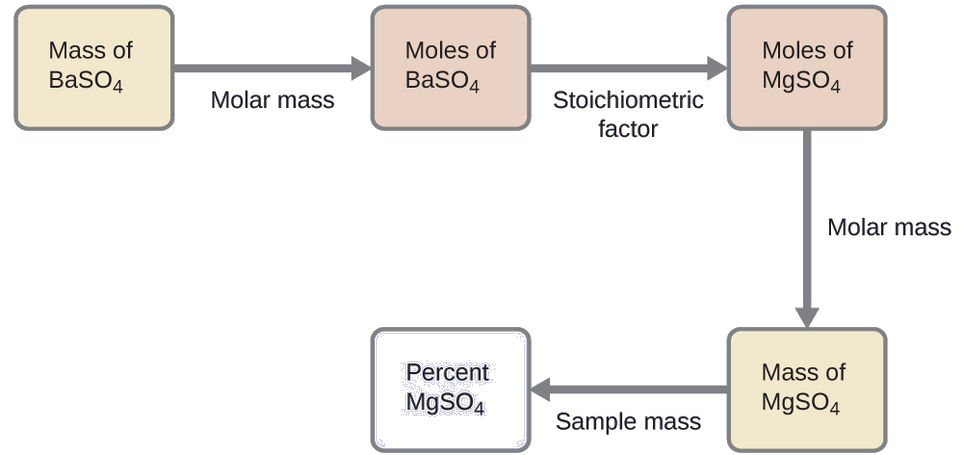
La masse de MgSO 4 qui produirait la masse de précipité fournie est
\[\mathrm{0.6168\:\cancel{g\: BaSO_4}\times \dfrac{1\:\cancel{mol\: BaSO_4}}{233.43\:\cancel{g\: BaSO_4}}\times \dfrac{1\:\cancel{mol\: MgSO_4}}{1\:\cancel{mol\: BaSO_4}}\times \dfrac{120.37\:g\: MgSO_4}{1\:\cancel{mol\: MgSO_4}}=0.3181\:g\: MgSO_4} \nonumber \]
La concentration de MgSO 4 dans le mélange d'échantillons est ensuite calculée pour être
\ [\ begin {align*}
\ ce {pourcentage \ : MgSO4} &= \ ce {\ dfrac {masse \ : MgSO4} {masse \ : échantillon}} \ times100 \ % \ \ \ mathrm {\ dfrac {0,3181
\ : g} {0,4550 \ : g}} \ times100 \ %&=69,91 \ % \ end {align*} : g} {0,4550 \ : g}} \ times100 \ %&=69,91
\ % \ end {align*} \ nonnumber \]
Quel est le pourcentage d'ions chlorure dans un échantillon si 1,1324 g de l'échantillon produit 1,0881 g d'AgCl lorsqu'ils sont traités avec un excès d'Ag + ?
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
- Réponse
-
23,76 %
Analyse de combustion
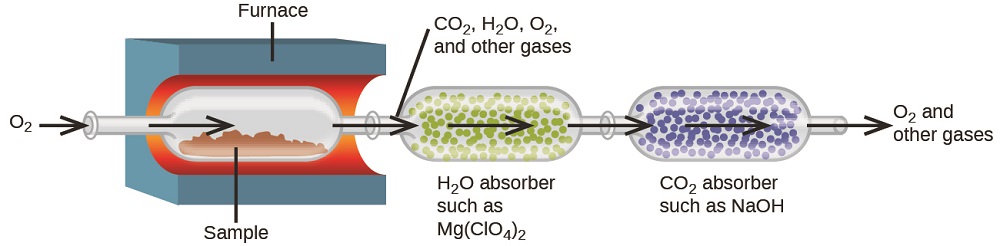
La composition élémentaire des hydrocarbures et des composés apparentés peut être déterminée par une méthode gravimétrique appelée analyse de combustion. Lors d'une analyse de combustion, un échantillon pesé du composé est chauffé à une température élevée sous un flux d'oxygène gazeux, ce qui entraîne sa combustion complète pour produire des produits gazeux d'identité connue. La combustion complète des hydrocarbures, par exemple, produira du dioxyde de carbone et de l'eau comme seuls produits. Les produits de combustion gazeux sont balayés à travers des dispositifs de collecte séparés et prépesés contenant des composés qui absorbent sélectivement chaque produit (Figure\(\PageIndex{3}\)). L'augmentation de masse de chaque dispositif correspond à la masse du produit absorbé et peut être utilisée dans un calcul stœchiométrique approprié pour déduire la masse de l'élément concerné.
Le polyéthylène est un polymère hydrocarboné utilisé pour fabriquer des sacs de conservation des aliments et de nombreux autres articles en plastique souple. L'analyse par combustion d'un échantillon de 0,00126 g de polyéthylène donne 0,00394 g de CO 2 et 0,00161 g de H 2 O. Quelle est la formule empirique du polyéthylène ?
Solution
L'hypothèse principale de cet exercice est que tout le carbone de l'échantillon brûlé est converti en dioxyde de carbone et que tout l'hydrogène de l'échantillon est converti en eau :
\[\mathrm{C_xH_y}(s)+\ce{excess\: O2}(g)\rightarrow x\ce{CO2}(g)+ \dfrac{y}{2} \ce{H2O}(g) \nonumber \]
Notez qu'une équation équilibrée n'est pas nécessaire pour la tâche à accomplir. Pour obtenir la formule empirique du composé, seuls les indices x et y sont nécessaires.
Tout d'abord, calculez les quantités molaires de carbone et d'hydrogène dans l'échantillon, en utilisant les masses fournies de dioxyde de carbone et d'eau, respectivement. Avec ces quantités molaires, la formule empirique du composé peut être écrite comme décrit dans le chapitre précédent de ce texte. Les grandes lignes de cette approche sont présentées dans l'organigramme suivant :
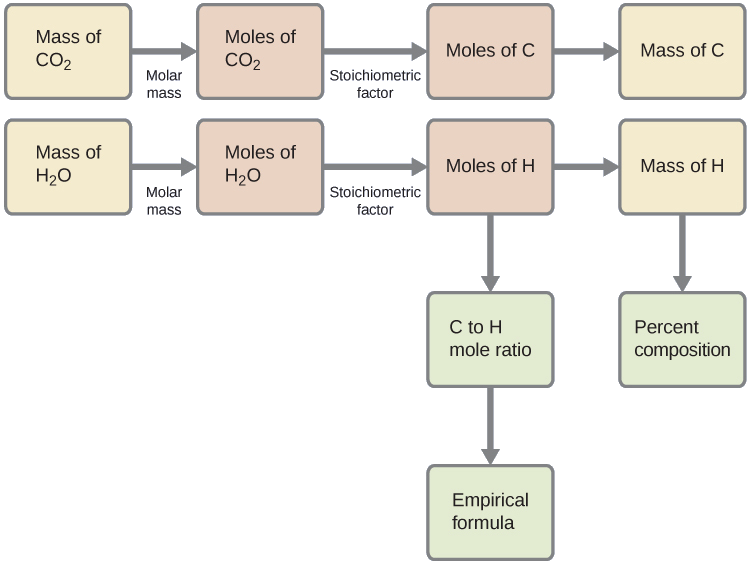
\[\mathrm{mol\: C=0.00394\:g\: CO_2\times\dfrac{1\:mol\: CO_2}{44.01\: g/mol}\times\dfrac{1\:mol\: C}{1\:mol\: CO_2}=8.95\times10^{-5}\:mol\: C} \nonumber \]
\[\mathrm{mol\: H=0.00161\:g\: H_2O\times\dfrac{1\:mol\: H_2O}{18.02\:g/mol}\times\dfrac{2\:mol\: H}{1\:mol\: H_2O}=1.79\times10^{-4}\:mol\: H} \nonumber \]
La formule empirique du composé est ensuite dérivée en identifiant les plus petits multiples entiers pour ces quantités molaires. Le rapport molaire H/C est
\[\mathrm{\dfrac{mol\: H}{mol\: C}=\dfrac{1.79\times10^{-4}\:mol\: H}{8.95\times10^{-5}\:mol\: C}=\dfrac{2\:mol\: H}{1\:mol\: C}} \nonumber \]
et la formule empirique pour le polyéthylène est CH 2.
Un échantillon de 0,00215 g de polystyrène, un polymère composé de carbone et d'hydrogène, a produit 0,00726 g de CO 2 et 0,00148 g de H 2 O lors d'une analyse de combustion. Quelle est la formule empirique pour le polystyrène ?
- Réponse
-
CHAP
Résumé
La stœchiométrie des réactions chimiques peut servir de base à des méthodes d'analyse chimique quantitative. Les titrages consistent à mesurer le volume d'une solution titrante nécessaire pour réagir complètement avec une solution d'échantillon. Ce volume est ensuite utilisé pour calculer la concentration d'analyte dans l'échantillon à l'aide de la stœchiométrie de la réaction de titrage. L'analyse gravimétrique consiste à séparer l'analyte de l'échantillon par un processus physique ou chimique, à déterminer sa masse, puis à calculer sa concentration dans l'échantillon en fonction de la stœchiométrie du procédé concerné. L'analyse de combustion est une méthode gravimétrique utilisée pour déterminer la composition élémentaire d'un composé en collectant et en pesant les produits gazeux de sa combustion.
Lexique
- analyte
- espèces chimiques d'intérêt
- buret
- dispositif utilisé pour la distribution précise de volumes de liquide variables, par exemple lors d'une analyse de titrage
- analyse de combustion
- technique gravimétrique utilisée pour déterminer la composition élémentaire d'un composé par la collecte et la pesée de ses produits de combustion gazeux
- point final
- volume mesuré de solution titrante qui entraîne la modification de l'apparence de la solution de l'échantillon ou d'une autre propriété attendue pour l'équivalence stœchiométrique (voir point d'équivalence)
- point d'équivalence
- volume de solution titrante nécessaire pour réagir complètement avec l'analyte lors d'une analyse de titrage ; fournit une quantité stœchiométrique de titrant pour l'analyte de l'échantillon en fonction de la réaction de titrage
- analyse gravimétrique
- méthode d'analyse chimique quantitative impliquant la séparation d'un analyte d'un échantillon par un processus physique ou chimique et des mesures de masse ultérieures de l'analyte, du produit de réaction et/ou de l'échantillon
- indicateur
- substance ajoutée à l'échantillon lors d'une analyse de titrage pour permettre la détection visuelle du point final
- analyse quantitative
- la détermination de la quantité ou de la concentration d'une substance dans un échantillon
- titrant
- solution contenant une concentration connue de substance qui réagira avec l'analyte lors d'une analyse de titrage
- analyse de titrage
- méthode d'analyse chimique quantitative qui consiste à mesurer le volume d'une solution réactive nécessaire pour réagir complètement avec l'analyte d'un échantillon


