4.4 : Rendements des réactions
- Page ID
- 194080
- Expliquer les concepts de rendement théorique et de réactifs/réactifs limites.
- Déterminer le rendement théorique d'une réaction dans des conditions spécifiées.
- Calculez le rendement en pourcentage d'une réaction.
Les quantités relatives de réactifs et de produits représentées dans une équation chimique équilibrée sont souvent appelées quantités stœchiométriques. Tous les exercices du module précédent impliquaient des quantités stœchiométriques de réactifs. Par exemple, lors du calcul de la quantité de produit générée à partir d'une quantité donnée de réactif, on a supposé que tous les autres réactifs nécessaires étaient disponibles en quantités stœchiométriques (ou plus). Dans ce module, des situations plus réalistes sont examinées, dans lesquelles les réactifs ne sont pas présents en quantités stœchiométriques.
Réactif limitant
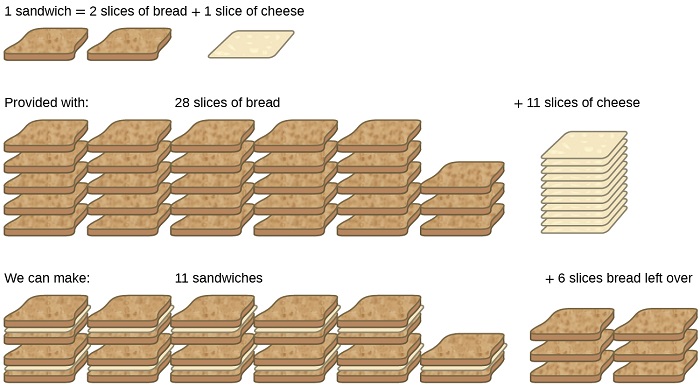
Prenons une autre analogie alimentaire, celle de la préparation de sandwichs au fromage grillé (Figure\(\PageIndex{1}\)) :
\[\text{1 slice of cheese} + \text{2 slices of bread} \rightarrow \text{1 sandwich} \label{4.5.A} \]
Les quantités stœchiométriques d'ingrédients pour sandwich pour cette recette sont des tranches de pain et de fromage dans un rapport de 2:1. Avec 28 tranches de pain et 11 tranches de fromage, on peut préparer 11 sandwichs selon la recette fournie, en utilisant tout le fromage fourni et en ayant six tranches de pain restantes. Dans ce scénario, le nombre de sandwichs préparés a été limité par le nombre de tranches de fromage, et les tranches de pain ont été fournies en excès.
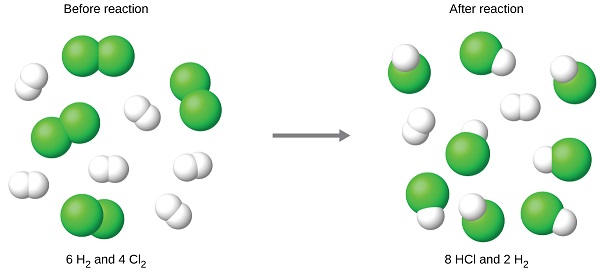
Examinons maintenant ce concept en ce qui concerne un processus chimique, la réaction de l'hydrogène avec le chlore pour produire du chlorure d'hydrogène :
\[\ce{H2}(g) + \ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
L'équation équilibrée montre que l'hydrogène et le chlore réagissent dans un rapport stœchiométrique de 1:1. Si ces réactifs sont fournis en d'autres quantités, l'un des réactifs sera presque toujours entièrement consommé, limitant ainsi la quantité de produit qui peut être générée. Cette substance est le réactif limitant et l'autre substance est le réactif en excès. Pour identifier les réactifs limites et excédentaires pour une situation donnée, il faut calculer les quantités molaires de chaque réactif fourni et les comparer aux quantités stœchiométriques représentées dans l'équation chimique équilibrée.
Par exemple, imaginez la combinaison de 6 moles de H 2 et de 4 moles de Cl 2. L'identification du réactif limitant implique de comparer la quantité de produit attendue pour la réaction complète de chaque réactif. Chaque quantité de réactif est utilisée pour calculer séparément la quantité de produit qui serait formée selon la stœchiométrie de la réaction. Le réactif produisant la plus faible quantité de produit est le réactif limitant.
Pour l'exemple du paragraphe précédent, la réaction complète de l'hydrogène produirait
\[\mathrm{mol\: HCl\: produced=6\: mol\:H_2\times \dfrac{2\: mol\: HCl}{1\: mol\:H_2}=12\: mol\: HCl} \nonumber \]
La réaction complète du chlore fourni produirait
\[\mathrm{mol\: HCl\: produced=4\: mol\:Cl_2\times \dfrac{2\: mol\: HCl}{1\: mol\:Cl_2}=8\: mol\: HCl} \nonumber \]
Le chlore sera complètement consommé une fois que 8 moles de HCl auront été produites. Comme suffisamment d'hydrogène a été fourni pour produire 12 moles de HCl, il restera de l'hydrogène n'ayant pas réagi une fois cette réaction terminée. Le chlore est donc le réactif limitant et l'hydrogène est le réactif en excès (Figure\(\PageIndex{2}\)). Pour déterminer la quantité de réactif en excès qui reste, la quantité d'hydrogène consommée dans la réaction peut être soustraite de la quantité d'hydrogène de départ.
La quantité d'hydrogène consommée est
\[\mathrm{mol\: H_2\: produced=8\: mol\:HCl\times \dfrac{1\: mol\: H_2}{2\: mol\:HCl}=4\: mol\: H_2} \nonumber \]
Soustrayez l'hydrogène consommé de la quantité de départ
\[\mathrm{mole\: of\: excess\:H_{2}=6\:mol\:H_{2}\:starting\:-\:4\:mol\:H_{2}\:consumed\:=\:2\:mol\:H_{2}\; excess} \nonumber \]
Le nitrure de silicium est une céramique très dure et résistante aux hautes températures utilisée comme composant des aubes de turbines des moteurs à réaction. Il est préparé selon l'équation suivante :
\[\ce{3Si}(s)+\ce{2N2}(g)\rightarrow \ce{Si3N4}(s) \nonumber \]
Quel est le réactif limite lorsque 2,00 g de Si et 1,50 g de N 2 réagissent ?
Solution
Calculez les quantités molaires de réactifs fournies, puis comparez-les à l'équation équilibrée pour identifier le réactif limite.
\[\mathrm{mol\: Si=2.00\:\cancel{g\: Si}\times \dfrac{1\: mol\: Si}{28.09\:\cancel{g\: Si}}=0.0712\: mol\: Si} \nonumber \]
\[\mathrm{mol\:N_2=1.50\:\cancel{g\:N_2}\times \dfrac{1\: mol\:N_2}{28.02\:\cancel{g\:N_2}}=0.0535\: mol\:N_2} \nonumber \]
Le rapport molaire Si:N 2 fourni est :
\[\mathrm{\dfrac{0.0712\: mol\: Si}{0.0535\: mol\:N_2}=\dfrac{1.33\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
Le rapport stœchiométrique Si:N 2 est le suivant :
\[\mathrm{\dfrac{3\: mol\: Si}{2\: mol\:N_2}=\dfrac{1.5\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
La comparaison de ces rapports montre que le Si est fourni en quantité inférieure à stœchiométrique, de même que le réactif limitant.
Vous pouvez également calculer la quantité de produit attendue pour une réaction complète de chacun des réactifs fournis. Les 0,0712 moles de silicium produiraient
\[\mathrm{mol\:Si_3N_4\:produced=0.0712\: mol\: Si\times \dfrac{1\:mol\:Si_3N_4}{3\: mol\: Si}=0.0237\: mol\:Si_3N_4} \nonumber \]
tandis que les 0,0535 moles d'azote produiraient
\[\mathrm{mol\:Si_3N_4\:produced=0.0535\: mol\:N_2\times \dfrac{1\: mol\:Si_3N_4}{2\: mol\:N_2}=0.0268\: mol\:Si_3N_4} \nonumber \]
Comme le silicium produit la plus faible quantité de produit, c'est le réactif limitant.
Quel est le réactif limite lorsque 5,00 g de H 2 et 10,0 g d'O 2 réagissent et forment de l'eau ?
- Réponse
-
O 2
Pourcentage de rendement
La quantité de produit qui peut être produite par une réaction dans des conditions spécifiées, telle que calculée selon la stœchiométrie d'une équation chimique équilibrée appropriée, est appelée rendement théorique de la réaction. En pratique, la quantité de produit obtenue est appelée rendement réel, et elle est souvent inférieure au rendement théorique pour plusieurs raisons. Certaines réactions sont intrinsèquement inefficaces et s'accompagnent de réactions secondaires qui génèrent d'autres produits. D'autres sont, par nature, incomplètes (considérez les réactions partielles des acides et des bases faibles discutées plus haut dans ce texte). Certains produits sont difficiles à récolter sans pertes, de sorte qu'une récupération imparfaite réduira le rendement réel. La mesure dans laquelle le rendement théorique d'une réaction est atteint est généralement exprimée en pourcentage de rendement :
\[\mathrm{percent\: yield=\dfrac{actual\: yield}{theoretical\: yield}\times 100\%} \nonumber \]
Les rendements réels et théoriques peuvent être exprimés en masses ou en quantités molaires (ou toute autre propriété appropriée ; par exemple, le volume, si le produit est un gaz). Tant que les deux rendements sont exprimés en utilisant les mêmes unités, ces unités seront annulées lors du calcul du pourcentage de rendement.
Par réaction de 1,274 g de sulfate de cuivre avec un excès de zinc métallique, on a obtenu 0,392 g de cuivre métallique selon l'équation suivante :
\[\ce{CuSO4}(aq)+\ce{Zn}(s)\rightarrow \ce{Cu}(s)+\ce{ZnSO4}(aq) \nonumber \]
Quel est le pourcentage de rendement ?
Solution
Les informations fournies identifient le sulfate de cuivre comme réactif limitant, de sorte que le rendement théorique est déterminé par l'approche illustrée dans le module précédent, comme indiqué ici :
\[\mathrm{1.274\:\cancel{g\:Cu_SO_4}\times \dfrac{1\:\cancel{mol\:CuSO_4}}{159.62\:\cancel{g\:CuSO_4}}\times \dfrac{1\:\cancel{mol\: Cu}}{1\:\cancel{mol\:CuSO_4}}\times \dfrac{63.55\:g\: Cu}{1\:\cancel{mol\: Cu}}=0.5072\: g\: Cu} \nonumber \]
À l'aide de ce rendement théorique et de la valeur fournie pour le rendement réel, le rendement en pourcentage est calculé comme suit :
\[\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100} \nonumber \]
\ [\ begin {align*}
\ mathrm {pourcentage \ : rendement} &= \ mathrm {\ left (\ dfrac {0,392 \ : g \ : Cu} {0,5072 \ : g \ : Cu} \ right) \ times 100} \ \
&=77,3 \ % \ %
\ end {align*} \ nonnumber \]
Quel est le rendement en pourcentage d'une réaction qui produit 12,5 g de fréon CF 2 Cl 2 à partir de 32,9 g de CCl 4 et d'un excès de HF ?
\[\ce{CCl4 + 2HF \rightarrow CF2Cl2 + 2HCl} \nonumber \]
- Réponse
-
48,3 %
La conception ciblée de produits et de procédés chimiques qui minimisent l'utilisation de substances dangereuses pour l'environnement et la production de déchets est connue sous le nom de chimie verte. La chimie verte est une approche philosophique appliquée à de nombreux domaines de la science et de la technologie, et sa pratique est résumée par des directives connues sous le nom de « Douze principes de la chimie verte ». L'un des 12 principes vise spécifiquement à maximiser l'efficacité des procédés de synthèse de produits chimiques. L'économie atomique d'un procédé est une mesure de cette efficacité, définie comme le pourcentage en masse du produit final d'une synthèse par rapport aux masses de tous les réactifs utilisés :
\[\mathrm{atom\: economy=\dfrac{mass\: of\: product}{mass\: of\: reactants}\times 100\%} \nonumber \]
Bien que la définition de l'économie atomique semble à première vue très similaire à celle du pourcentage de rendement, sachez que cette propriété représente une différence dans les efficacités théoriques des différents processus chimiques. Le rendement en pourcentage d'un procédé chimique donné, quant à lui, évalue l'efficacité d'un procédé en comparant le rendement du produit réellement obtenu au rendement maximum prédit par stœchiométrie.
La synthèse du médicament antidouleur en vente libre courant, l'ibuprofène, illustre bien le succès d'une approche de chimie verte (Figure\(\PageIndex{3}\)). Commercialisé pour la première fois au début des années 1960, l'ibuprofène a été produit à l'aide d'une synthèse en six étapes qui nécessitait 514 g de réactifs pour générer chaque mole (206 g) d'ibuprofène, soit une économie atomique de 40 %. Dans les années 1990, un procédé alternatif a été développé par la société BHC (aujourd'hui BASF Corporation) qui ne nécessite que trois étapes et présente une économie atomique d'environ 80 %, soit près du double de celle du procédé initial. Le procédé BHC génère beaucoup moins de déchets chimiques, utilise des matériaux moins dangereux et recyclables et permet de réaliser d'importantes économies pour le fabricant (et, par conséquent, pour le consommateur). En reconnaissance de l'impact environnemental positif du procédé BHC, l'entreprise a reçu le prix Greener Synthetic Pathways Award de l'Environmental Protection Agency en 1997.

Résumé
Lorsque les réactions sont effectuées en utilisant des quantités de réactifs inférieures à stoechiométriques, la quantité de produit générée sera déterminée par le réactif limite. La quantité de produit générée par une réaction chimique est son rendement réel. Ce rendement est souvent inférieur à la quantité de produit prédite par la stœchiométrie de l'équation chimique équilibrée représentant la réaction (son rendement théorique). La mesure dans laquelle une réaction génère la quantité théorique de produit est exprimée en pourcentage de rendement.
Équations clés
- \(\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100}\)
Lexique
- rendement réel
- quantité de produit formée lors d'une réaction
- excès de réactif
- réactif présent en quantité supérieure à celle requise par la stœchiométrie de la réaction
- réactif limitant
- réactif présent en quantité inférieure à celle requise par la stœchiométrie de la réaction, limitant ainsi la quantité de produit générée
- pourcentage de rendement
- mesure de l'efficacité d'une réaction, exprimée en pourcentage du rendement théorique
- rendement théorique
- quantité de produit pouvant être produite à partir d'une quantité donnée de réactif (s) selon la stœchiométrie de la réaction


