4.3 : Stœchiométrie des réactions
- Page ID
- 194073
- Expliquer le concept de stœchiométrie en ce qui concerne les réactions chimiques
- Utiliser des équations chimiques équilibrées pour dériver des facteurs stœchiométriques reliant les quantités de réactifs et de produits
- Effectuer des calculs stœchiométriques impliquant la masse, les moles et la molarité de la solution
Une équation chimique équilibrée fournit de nombreuses informations dans un format très succinct. Les formules chimiques fournissent l'identité des réactifs et des produits impliqués dans la modification chimique, ce qui permet de classer la réaction. Les coefficients fournissent le nombre relatif de ces espèces chimiques, ce qui permet une évaluation quantitative des relations entre les quantités de substances consommées et produites par la réaction. Ces relations quantitatives sont connues sous le nom de stoechiométrie de la réaction, terme dérivé des mots grecs stoïchéion (qui signifie « élément ») et métron (qui signifie « mesure »). Dans ce module, l'utilisation d'équations chimiques équilibrées pour diverses applications stœchiométriques est explorée.
L'approche générale de l'utilisation des relations stœchiométriques est similaire dans son concept à la façon dont les gens s'adonnent à de nombreuses activités courantes. La cuisine, par exemple, offre une comparaison appropriée. Supposons qu'une recette pour faire huit crêpes demande 1 tasse de mélange à crêpes, une\(\dfrac{3}{4}\) tasse de lait et un œuf. L' « équation » représentant la préparation des crêpes selon cette recette est
\[\mathrm{1\:cup\: mix+\dfrac{3}{4}\:cup\: milk+1\: egg \rightarrow 8\: pancakes} \label{4.4.1} \]
Si deux douzaines de crêpes sont nécessaires pour un petit-déjeuner familial copieux, les quantités d'ingrédients doivent être augmentées proportionnellement en fonction des quantités indiquées dans la recette. Par exemple, le nombre d'œufs requis pour faire 24 crêpes est de
\[\mathrm{24\: \cancel{pancakes} \times \dfrac{1\: egg}{8\: \cancel{pancakes}}=3\: eggs} \label{4.4.2} \]
Les équations chimiques équilibrées sont utilisées à peu près de la même manière pour déterminer la quantité d'un réactif nécessaire pour réagir avec une quantité donnée d'un autre réactif, ou pour produire une quantité donnée de produit, etc. Les coefficients de l'équation équilibrée sont utilisés pour dériver des facteurs stœchiométriques qui permettent de calculer la quantité souhaitée. Pour illustrer cette idée, considérez la production d'ammoniac par réaction d'hydrogène et d'azote :
\[\ce{N2}(g)+\ce{3H2}(g)\rightarrow \ce{2NH3}(g) \label{4.4.3} \]
Cette équation montre que les molécules d'ammoniac sont produites à partir de molécules d'hydrogène dans un rapport de 2:3, et les facteurs stœchiométriques peuvent être dérivés en utilisant n'importe quelle unité de quantité (nombre) :
\[\ce{\dfrac{2NH3 \: molecules}{3H2 \: molecules}\: or \: \dfrac{2 \: doz \: NH3\: molecules}{3\: doz\:H2 \:molecules} \: or \: \dfrac{2\: mol\: NH3\: molecules}{3\: mol\: H2\: molecules}} \label{4.4.4} \]
Ces facteurs stœchiométriques peuvent être utilisés pour calculer le nombre de molécules d'ammoniac produites à partir d'un nombre donné de molécules d'hydrogène, ou le nombre de molécules d'hydrogène nécessaires pour produire un nombre donné de molécules d'ammoniac. Des facteurs similaires peuvent être dérivés pour n'importe quelle paire de substances dans n'importe quelle équation chimique.
Combien de moles de I 2 sont nécessaires pour réagir avec 0,429 mol d'Al selon l'équation suivante (voir Figure\(\PageIndex{2}\)) ?
\[\ce{2Al + 3I2 \rightarrow 2AlI3} \label{4.4.5} \]

Solution
En se référant à l'équation chimique équilibrée, le facteur stœchiométrique reliant les deux substances d'intérêt est\(\ce{\dfrac{3\: mol\: I2}{2\: mol\: Al}}\). La quantité molaire d'iode est obtenue en multipliant la quantité molaire d'aluminium fournie par ce facteur :

\[\begin{align*} \mathrm{mol\: I_2} &=\mathrm{0.429\: \cancel{mol\: Al}\times \dfrac{3\: mol\: I_2}{2\:\cancel{mol\: Al}}} \\[4pt] &=\mathrm{0.644\: mol\: I_2} \end{align*} \nonumber \]
Combien de moles de Ca (OH) 2 sont nécessaires pour réagir avec 1,36 mol de H 3 PO 4 afin de produire du Ca 3 (PO 4) 2 selon l'équation\(\ce{3Ca(OH)2 + 2H3PO4 \rightarrow Ca3(PO4)2 + 6H2O}\) ?
- Réponse
-
2,04 mol
Combien de molécules de dioxyde de carbone sont produites lorsque 0,75 mol de propane est brûlée selon cette équation ?
\[\ce{C3H8 + 5O2 \rightarrow 3CO2 + 4H2O} \label{4.4.6} \]
Une solution
L'approche ici est la même que pour l'exemple\(\PageIndex{1}\), bien que le nombre absolu de molécules soit demandé, et non le nombre de moles de molécules. Cela nécessitera simplement l'utilisation du facteur de conversion des taupes en nombres, le nombre d'Avogadro.
L'équation équilibrée montre que le dioxyde de carbone est produit à partir du propane dans un rapport de 3:1 :
\[\ce{\dfrac{3\: mol\: CO2}{1\: mol\: C3H8}} \label{4.4.7} \]
En utilisant ce facteur stœchiométrique, la quantité molaire de propane fournie et le nombre d'Avogadro,

\[\mathrm{0.75\: \cancel{mol\: C_3H_8}\times \dfrac{3\: \cancel{mol\: CO_2}}{1\:\cancel{mol\:C_3H_8}}\times \dfrac{6.022\times 10^{23}\:CO_2\:molecules}{\cancel{mol\:CO_2}}=1.4\times 10^{24}\:CO_2\:molecules} \label{4.4.8} \]
Combien de molécules de NH 3 sont produites par la réaction de 4,0 mol de Ca (OH) 2 selon l'équation suivante :
\[\ce{(NH4)2SO4 + Ca(OH)2 \rightarrow 2NH3 + CaSO4 + 2H2O} \label{4.4.9} \]
- Réponse
-
4,8 × 10 24 molécules de NH 3
Ces exemples illustrent la facilité avec laquelle les quantités de substances impliquées dans une réaction chimique de stœchiométrie connue peuvent être liées. Mesurer directement le nombre d'atomes et de molécules n'est cependant pas une tâche facile, et l'application pratique de la stœchiométrie nécessite que nous utilisions la propriété de masse la plus facile à mesurer.
Quelle masse d'hydroxyde de sodium, NaOH, serait nécessaire pour produire 16 g de lait antiacide de magnésie [hydroxyde de magnésium, Mg (OH) 2] par la réaction suivante ?
Une solution
L'approche utilisée précédemment dans les exemples\(\PageIndex{1}\) et\(\PageIndex{2}\) est également utilisée ici ; c'est-à-dire que nous devons déduire un facteur stœchiométrique approprié à partir de l'équation chimique équilibrée et l'utiliser pour relier les quantités des deux substances d'intérêt. Dans ce cas, toutefois, les masses (et non les quantités molaires) sont fournies et demandées, de sorte que des étapes supplémentaires du type de celles apprises dans le chapitre précédent sont nécessaires. Les calculs requis sont décrits dans cet organigramme :
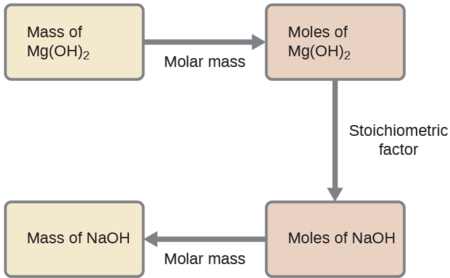
\[\mathrm{16\:\cancel{g\: Mg(OH)_2} \times \dfrac{1\:\cancel{mol\: Mg(OH)_2}}{58.3\:\cancel{g\: Mg(OH)_2}}\times \dfrac{2\:\cancel{mol\: NaOH}}{1\:\cancel{mol\: Mg(OH)_2}}\times \dfrac{40.0\: g\: NaOH}{\cancel{mol\: NaOH}}=22\: g\: NaOH} \nonumber \]
Quelle masse d'oxyde de gallium, Ga 2 O 3, peut être préparée à partir de 29,0 g de gallium métallique ? L'équation de la réaction est\(\ce{4Ga + 3O2 \rightarrow 2Ga2O3}\).
- Réponse
-
39,0 g
Quelle masse d'oxygène gazeux, O 2, provenant de l'air est consommée lors de la combustion de 702 g d'octane, C 8 H 18, l'un des principaux composants de l'essence ?
\[\ce{2C8H18 + 25O2 \rightarrow 16CO2 + 18H2O} \nonumber \]
Une solution
L'approche requise ici est la même que pour l'exemple\(\PageIndex{3}\), mais diffère uniquement en ce que les masses fournies et demandées concernent toutes deux des espèces réactives.
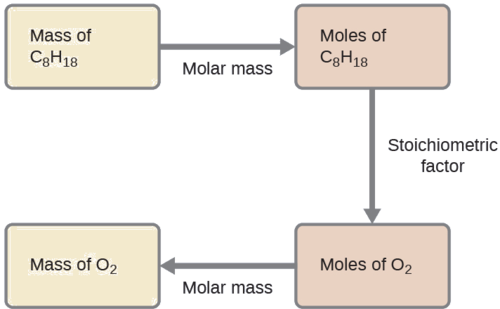
\(\mathrm{702\:\cancel{g\:\ce{C8H18}}\times \dfrac{1\:\cancel{mol\:\ce{C8H18}}}{114.23\:\cancel{g\:\ce{C8H18}}}\times \dfrac{25\:\cancel{mol\:\ce{O2}}}{2\:\cancel{mol\:\ce{C8H18}}}\times \dfrac{32.00\: g\:\ce{O2}}{\cancel{mol\:\ce{O2}}}=2.46\times 10^3\:g\:\ce{O2}}\)
Quelle masse de CO est nécessaire pour réagir avec 25,13 g de Fe 2 O 3 selon l'équation\(\ce{Fe2O3 + 3CO \rightarrow 2Fe + 3CO2}\) ?
- Réponse
-
13,22 g
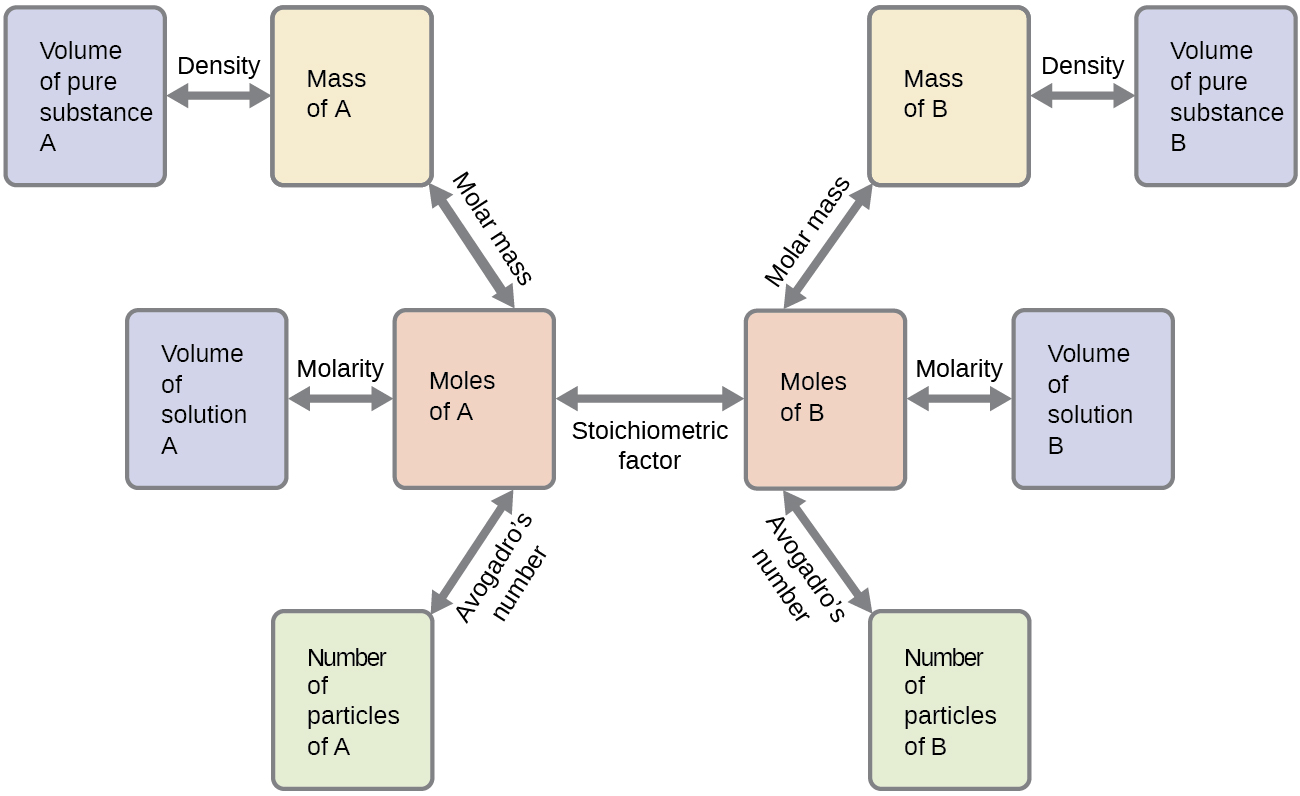
Ces exemples illustrent quelques exemples de calculs de stœchiométrie des réactions. De nombreuses variantes des étapes de calcul de début et de fin sont possibles en fonction des quantités spécifiques fournies et recherchées (volumes, concentrations de solutions, etc.). Quels que soient les détails, tous ces calculs partagent un élément essentiel commun : l'utilisation de facteurs stœchiométriques dérivés d'équations chimiques équilibrées. La figure\(\PageIndex{2}\) fournit un aperçu général des différentes étapes de calcul associées à de nombreux calculs de stœchiométrie des réactions.
Les airbags (Figure\(\PageIndex{3}\)) sont un dispositif de sécurité intégré à la plupart des automobiles depuis les années 1990. Le fonctionnement efficace d'un airbag nécessite qu'il soit rapidement gonflé avec une quantité (volume) de gaz appropriée lorsque le véhicule est impliqué dans une collision. Cette exigence est satisfaite dans de nombreux systèmes d'airbags automobiles grâce à l'utilisation de réactions chimiques explosives, un choix courant étant la décomposition de l'azide de sodium, NaN 3. Lorsque les capteurs du véhicule détectent une collision, un courant électrique traverse une quantité soigneusement mesurée de NaN 3 pour initier sa décomposition :
\[\ce{2NaN3}(s)\rightarrow \ce{3N2}(g)+\ce{2Na}(s) \nonumber \]
Cette réaction est très rapide et génère de l'azote gazeux qui peut déployer et gonfler complètement un airbag classique en une fraction de seconde (~0,03—0,1 s). Parmi les nombreuses considérations techniques, la quantité d'azoture de sodium utilisée doit être appropriée pour générer suffisamment d'azote gazeux pour gonfler complètement le coussin gonflable et garantir son bon fonctionnement. Par exemple, une petite masse (~100 g) de NaN 3 produira environ 50 L de N 2.

Résumé
Une équation chimique équilibrée peut être utilisée pour décrire la stœchiométrie d'une réaction (les relations entre les quantités de réactifs et de produits). Les coefficients de l'équation sont utilisés pour dériver des facteurs stœchiométriques qui peuvent ensuite être utilisés pour les calculs reliant les masses du réactif et du produit, les quantités molaires et d'autres propriétés quantitatives.
Lexique
- facteur stœchiométrique
- rapport des coefficients dans une équation chimique équilibrée, utilisé dans les calculs reliant les quantités de réactifs et de produits
- stœchiométrie
- relations entre les quantités de réactifs et les produits d'une réaction chimique


