4.2 : Classification des réactions chimiques
- Page ID
- 194090
- Définir trois types courants de réactions chimiques (précipitation, acide-base et oxydoréduction)
- Classer les réactions chimiques comme l'un de ces trois types en fonction de descriptions ou d'équations chimiques appropriées
- Identifier les acides et les bases courants
- Prédire la solubilité des composés inorganiques courants à l'aide de règles de solubilité
- Calculez les états d'oxydation des éléments des composés
Les humains interagissent les uns avec les autres de manières diverses et complexes, et nous classons ces interactions selon des modèles de comportement courants. Lorsque deux humains échangent des informations, nous disons qu'ils communiquent. Quand ils échangent des coups avec leurs poings ou leurs pieds, nous disons qu'ils se battent. Confrontés à un large éventail d'interactions entre des substances chimiques, les scientifiques ont également trouvé pratique (voire nécessaire) de classer les interactions chimiques en identifiant des modèles de réactivité communs. Ce module fournira une introduction à trois des types de réactions chimiques les plus courants : les précipitations, les réactions acido-basiques et l'oxydoréduction.
Réactions de précipitation et règles de solubilité
Une réaction de précipitation est une réaction au cours de laquelle des substances dissoutes réagissent pour former un (ou plusieurs) produits solides. De nombreuses réactions de ce type impliquent l'échange d'ions entre des composés ioniques en solution aqueuse et sont parfois appelées réactions de double déplacement, de double remplacement ou de métathèse. Ces réactions sont courantes dans la nature et sont responsables de la formation de récifs coralliens dans les eaux océaniques et de calculs rénaux chez les animaux. Ils sont largement utilisés dans l'industrie pour la production d'un certain nombre de produits chimiques de base et de spécialité. Les réactions de précipitation jouent également un rôle central dans de nombreuses techniques d'analyse chimique, notamment les tests ponctuels utilisés pour identifier les ions métalliques et les méthodes gravimétriques pour déterminer la composition de la matière (voir le dernier module de ce chapitre).
La mesure dans laquelle une substance peut être dissoute dans l'eau ou dans tout solvant est exprimée quantitativement par sa solubilité, définie comme la concentration maximale d'une substance pouvant être atteinte dans des conditions spécifiées. Les substances présentant des solubilités relativement importantes sont dites solubles. Une substance précipite lorsque les conditions de la solution sont telles que sa concentration dépasse sa solubilité. Les substances dont la solubilité est relativement faible sont dites insolubles, et il s'agit des substances qui précipitent facilement à partir de la solution. De plus amples informations sur ces concepts importants sont fournies dans le chapitre de texte sur les solutions. Pour prédire l'identité des solides formés par les réactions de précipitation, on peut simplement se référer aux modèles de solubilité qui ont été observés pour de nombreux composés ioniques (Tableau\(\PageIndex{1}\)).
| Les composés solubles contiennent | Les exceptions à ces règles de solubilité incluent : |
|
|
| Les composés insolubles contiennent | Les exceptions à ces règles d'insolubilité incluent : |
|
|
Un exemple frappant de précipitation est observé lorsque des solutions d'iodure de potassium et de nitrate de plomb sont mélangées, ce qui entraîne la formation d'iodure de plomb solide :
\[\ce{2KI}(aq)+\ce{Pb(NO3)2}(aq)\rightarrow \ce{PbI2}(s)+\ce{2KNO3}(aq) \nonumber \]
Cette observation est conforme aux directives de solubilité : le seul composé insoluble parmi toutes les substances impliquées est l'iodure de plomb, l'une des exceptions à la solubilité générale des sels d'iodure.
L'équation ionique nette représentant cette réaction est la suivante :
\[\ce{Pb^2+}(aq)+\ce{2I-}(aq)\rightarrow \ce{PbI2}(s) \nonumber \]
L'iodure de plomb est un solide jaune vif qui était autrefois utilisé comme pigment d'artiste connu sous le nom de jaune d'iode (Figure\(\PageIndex{1}\)). Les propriétés des cristaux pBi 2 purs les rendent utiles pour la fabrication de détecteurs de rayons X et de rayons gamma.

Les recommandations de solubilité présentées dans le tableau\(\PageIndex{1}\) peuvent être utilisées pour prédire si une réaction de précipitation se produira lorsque des solutions de composés ioniques solubles sont mélangées. Il suffit d'identifier tous les ions présents dans la solution, puis de se demander si l'appariement cation/anions possible pourrait aboutir à un composé insoluble. Par exemple, en mélangeant des solutions de nitrate d'argent et de fluorure de sodium, on obtient une solution contenant des ions Ag +\(\ce{NO3-}\), Na + et F −. Outre les deux composés ioniques initialement présents dans les solutions, AgNO 3 et NaF, deux composés ioniques supplémentaires peuvent être dérivés de cette collection d'ions : NaNO 3 et AgF. Les directives de solubilité indiquent que tous les sels de nitrate sont solubles, mais que l'AgF est l'une des exceptions à la solubilité générale des sels de fluorure. On prévoit donc qu'une réaction de précipitation se produira, comme décrit par les équations suivantes :
\[\ce{NaF}(aq)+\ce{AgNO3}(aq)\rightarrow \ce{AgF}(s)+\ce{NaNO3}(aq)\hspace{20px}\ce{(molecular)} \nonumber \]
\[\ce{Ag+}(aq)+\ce{F-}(aq)\rightarrow \ce{AgF}(s)\hspace{20px}\ce{(net\: ionic)} \nonumber \]
Prédire le résultat du mélange de solutions raisonnablement concentrées des composés ioniques suivants. Si des précipitations sont prévues, écrivez une équation ionique nette équilibrée pour la réaction.
- sulfate de potassium et nitrate de baryum
- chlorure de lithium et acétate d'argent
- nitrate de plomb et carbonate d'ammonium
Solution
(a) Les deux produits possibles pour cette combinaison sont le KNO 3 et le BaSO 4. Les recommandations de solubilité indiquent que le BaSO 4 est insoluble et qu'une réaction de précipitation est donc attendue. L'équation ionique nette pour cette réaction, dérivée de la manière détaillée dans le module précédent, est
\[\ce{Ba^2+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{BaSO4}(s) \nonumber \]
(b) Les deux produits possibles pour cette combinaison sont LiC 2 H 3 O 2 et AgCl. Les directives de solubilité indiquent que l'AgCl est insoluble et qu'une réaction de précipitation est donc attendue. L'équation ionique nette pour cette réaction, dérivée de la manière détaillée dans le module précédent, est
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
(c) Les deux produits possibles pour cette combinaison sont le PbCO 3 et le NH 4 NO 3. Les directives de solubilité indiquent que le PbCO 3 est insoluble et qu'une réaction de précipitation est donc attendue. L'équation ionique nette pour cette réaction, dérivée de la manière détaillée dans le module précédent, est
\[\ce{Pb^2+}(aq)+\ce{CO3^2-}(aq)\rightarrow \ce{PbCO3}(s) \nonumber \]
Quelle solution pourrait être utilisée pour précipiter l'ion baryum, Ba 2 +, dans un échantillon d'eau : chlorure de sodium, hydroxyde de sodium ou sulfate de sodium ? Quelle est la formule du précipité attendu ?
- Réponse
-
sulfate de sodium, BaSO 4
Réactions acido-basiques
Une réaction acide-base est une réaction au cours de laquelle un ion hydrogène, H+, est transféré d'une espèce chimique à une autre. Ces réactions sont d'une importance capitale pour de nombreux processus naturels et technologiques, allant des transformations chimiques qui se produisent dans les cellules, les lacs et les océans à la production industrielle d'engrais, de produits pharmaceutiques et d'autres substances essentielles à la société. Le sujet de la chimie acide-base mérite donc une discussion approfondie, et un chapitre complet est consacré à ce sujet plus loin dans le texte.
Aux fins de cette brève introduction, nous examinerons uniquement les types les plus courants de réactions acide-base qui se produisent dans des solutions aqueuses. Dans ce contexte, un acide est une substance qui se dissout dans l'eau pour produire des ions hydronium, H 3 O +. À titre d'exemple, considérez l'équation présentée ici :
\[\ce{HCl}(aq)+\ce{H2O}(aq)\rightarrow \ce{Cl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Le processus représenté par cette équation confirme que le chlorure d'hydrogène est un acide. Lorsqu'ils sont dissous dans l'eau, les ions H 3 O + sont produits par une réaction chimique au cours de laquelle les ions H + sont transférés des molécules de HCl aux molécules de H 2 O (Figure\(\PageIndex{2}\)).
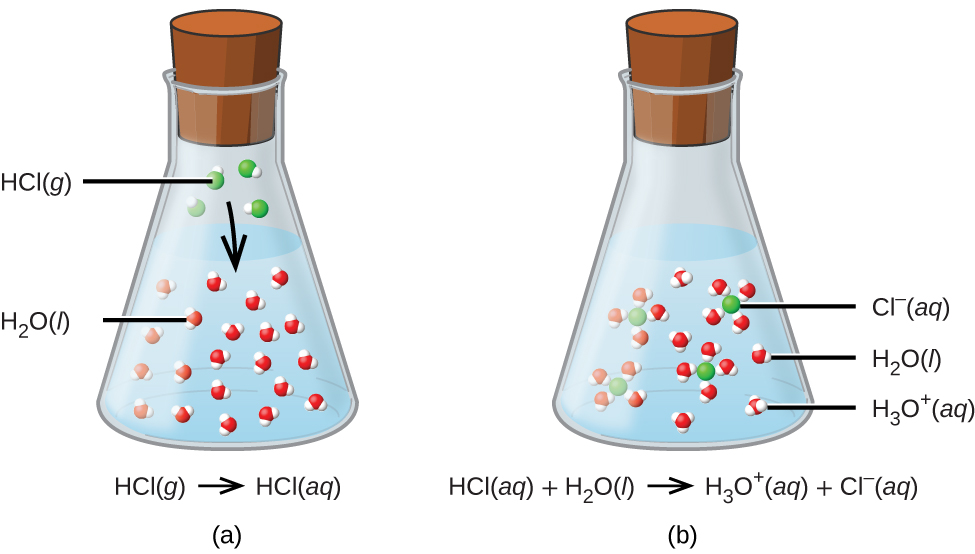
La nature du HCl est telle que sa réaction avec l'eau telle que décrite ci-dessus est essentiellement efficace à 100 % : pratiquement toutes les molécules de HCl qui se dissolvent dans l'eau subiront cette réaction. Les acides qui réagissent complètement de cette manière sont appelés acides forts, et le HCl est l'un des rares composés acides courants classés comme forts (Tableau\(\PageIndex{1}\)). Un nombre beaucoup plus important de composés se comportent comme des acides faibles et ne réagissent que partiellement avec l'eau, laissant la grande majorité des molécules dissoutes dans leur forme originale et générant une quantité relativement faible d'ions hydronium. Les acides faibles sont couramment rencontrés dans la nature. Ils sont en partie responsables du goût acidulé des agrumes, de la sensation de picotement des piqûres d'insectes et des odeurs désagréables associées aux odeurs corporelles. Un exemple familier d'acide faible est l'acide acétique, principal ingrédient des vinaigres alimentaires :
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{CH3CO2-}(aq)+\ce{H3O+}(aq) \nonumber \]
Lorsqu'elles sont dissoutes dans de l'eau dans des conditions normales, environ 1 % seulement des molécules d'acide acétique sont présentes sous forme ionisée\(\ce{CH3CO2-}\) (Figure\(\PageIndex{3}\)). (L'utilisation d'une double flèche dans l'équation ci-dessus indique l'aspect de réaction partielle de ce processus, un concept abordé en détail dans les chapitres sur l'équilibre chimique.)
| Formule composée | Nom en solution aqueuse |
|---|---|
| HBr | acide bromhydrique |
| HCl | acide chlorhydrique |
| SALUT | acide iodhydrique |
| N° 3 | acide nitrique |
| Chloé 4 | acide perchlorique |
| H 2 SO 4 | acide sulfurique |
Une base est une substance qui se dissout dans l'eau pour produire des ions hydroxyde, OH −. Les bases les plus courantes sont des composés ioniques composés de cations de métaux alcalins ou alcalino-terreux (groupes 1 et 2) combinés à l'ion hydroxyde, par exemple, NaOH et Ca (OH) 2. Lorsque ces composés se dissolvent dans l'eau, des ions hydroxyde sont libérés directement dans la solution. Par exemple, le KOH et le Ba (OH) 2 se dissolvent dans l'eau et se dissocient complètement pour produire des cations (K + et Ba 2 +, respectivement) et des ions hydroxyde, OH −. Ces bases, ainsi que d'autres hydroxydes qui se dissocient complètement dans l'eau, sont considérées comme des bases fortes.
Prenons par exemple la dissolution de la lessive (hydroxyde de sodium) dans l'eau :
\[\ce{NaOH}(s)\rightarrow \ce{Na+}(aq)+\ce{OH-}(aq) \nonumber \]
Cette équation confirme que l'hydroxyde de sodium est une base. Lorsqu'il est dissous dans l'eau, le NaOH se dissocie pour produire des ions Na + et OH −. Cela est également vrai pour tout autre composé ionique contenant des ions hydroxyde. Comme le processus de dissociation est pratiquement terminé lorsque les composés ioniques se dissolvent dans l'eau dans des conditions normales, le NaOH et les autres hydroxydes ioniques sont tous classés comme des bases fortes.
Contrairement aux hydroxydes ioniques, certains composés produisent des ions hydroxyde lorsqu'ils sont dissous en réagissant chimiquement avec des molécules d'eau. Dans tous les cas, ces composés ne réagissent que partiellement et sont donc classés comme des bases faibles. Ces types de composés sont également abondants dans la nature et constituent des matières premières importantes dans diverses technologies. Par exemple, la production mondiale d'ammoniac basique faible est généralement bien supérieure à 100 tonnes métriques par an, étant largement utilisé comme engrais agricole, matière première pour la synthèse chimique d'autres composés et ingrédient actif dans les nettoyants ménagers (Figure\(\PageIndex{4}\)). Lorsqu'il est dissous dans l'eau, l'ammoniac réagit partiellement pour produire des ions hydroxyde, comme indiqué ci-dessous :
\[\ce{NH3}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \nonumber \]
Il s'agit, par définition, d'une réaction acide-base, impliquant dans ce cas le transfert d'ions H + des molécules d'eau vers les molécules d'ammoniac. Dans des conditions normales, environ 1 % seulement de l'ammoniac dissous est présent sous forme\(\ce{NH4+}\) d'ions.

Les réactions chimiques décrites dans lesquelles les acides et les bases dissous dans l'eau produisent respectivement des ions hydronium et hydroxyde sont, par définition, des réactions acido-basiques. Dans ces réactions, l'eau sert à la fois de solvant et de réactif. Une réaction de neutralisation est un type spécifique de réaction acide-base dans lequel les réactifs sont un acide et une base, les produits sont souvent du sel et de l'eau, et aucun des réactifs n'est l'eau elle-même :
\[\mathrm{acid+base\rightarrow salt+water} \nonumber \]
Pour illustrer une réaction de neutralisation, considérez ce qui se passe lorsqu'un antiacide typique tel que du lait de magnésie (suspension aqueuse de Mg (OH) 2 solide) est ingéré pour atténuer les symptômes associés à un excès d'acide gastrique (HCl) :
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{2H2O}(l). \nonumber \]
Notez qu'en plus de l'eau, cette réaction produit un sel, le chlorure de magnésium.
Écrivez des équations chimiques équilibrées pour les réactions acide-base décrites ici :
- l'hypochlorite d'hydrogène faiblement acide réagit avec l'eau
- une solution d'hydroxyde de baryum est neutralisée avec une solution d'acide nitrique
Solution
a) Les deux réactifs sont fournis, HOCl et H 2 O. Comme la substance est considérée comme un acide, sa réaction avec l'eau impliquera le transfert de H + de HOCl à H 2 O pour générer des ions hydronium, H 3 O + et des ions hypochlorite, OCl − .
\[\ce{HOCl}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{OCl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Une double flèche est appropriée dans cette équation car elle indique que le HOCl est un acide faible qui n'a pas complètement réagi.
(b) Les deux réactifs sont fournis, Ba (OH) 2 et HNO 3. Comme il s'agit d'une réaction de neutralisation, les deux produits seront de l'eau et un sel composé du cation de l'hydroxyde ionique (Ba 2 +) et de l'anion généré lorsque l'acide transfère son ion hydrogène\(\ce{(NO3- )}\).
\[\ce{Ba(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Ba(NO3)2}(aq)+\ce{2H2O}(l) \nonumber \]
Écrivez l'équation ionique nette représentant la neutralisation de tout acide fort avec un hydroxyde ionique. (Conseil : considérez les ions produits lorsqu'un acide fort est dissous dans l'eau.)
- Réponse
-
\[\ce{H3O+}(aq)+\ce{OH-}(aq)\rightarrow \ce{2H2O}(l) \nonumber \]
Explorez la vue microscopique des acides et des bases forts et faibles.
Réactions d'oxydoréduction
L'atmosphère de la Terre contient environ 20 % d'oxygène moléculaire, O 2, un gaz chimiquement réactif qui joue un rôle essentiel dans le métabolisme des organismes aérobies et dans de nombreux processus environnementaux qui façonnent le monde. Le terme oxydation a été utilisé à l'origine pour décrire les réactions chimiques impliquant l'O 2, mais sa signification a évolué pour désigner une classe de réactions large et importante connue sous le nom de réactions d'oxydoréduction (redox). Quelques exemples de telles réactions seront utilisés pour se faire une idée claire de cette classification.
Certaines réactions d'oxydoréduction impliquent le transfert d'électrons entre les espèces réactives pour produire des produits ioniques, comme la réaction entre le sodium et le chlore pour produire du chlorure de sodium :
\[\ce{2Na}(s)+\ce{Cl2}(g)\rightarrow \ce{2NaCl}(s) \nonumber \]
Il est utile d'examiner le processus en fonction de chaque réactif individuel, c'est-à-dire de représenter le devenir de chaque réactif sous la forme d'une équation appelée demi-réaction :
\[ \begin{align*} \ce{2Na}(s) &\rightarrow \ce{2Na+}(s)+\ce{2e-} \\[4pt] \ce{Cl2}(g)+\ce{2e-} &\rightarrow \ce{2Cl-}(s) \end{align*} \nonumber \]
Ces équations montrent que les atomes de Na perdent des électrons tandis que les atomes de Cl (dans la molécule de Cl 2) gagnent des électrons, les indices « s » des ions résultants indiquant qu'ils sont présents sous la forme d'un composé ionique solide. Pour les réactions redox de ce type, la perte et le gain d'électrons définissent les processus complémentaires qui se produisent :
\ (\ begin {align}
\ textbf {oxydation} &= \ textrm {perte d'électrons} \ \
\ textbf {réduction} &= \ textrm {gain d'électrons}
\ end {align} \)
Dans cette réaction, le sodium est alors oxydé et le chlore est réduit. D'un point de vue plus actif, le sodium agit comme un agent réducteur (réducteur), puisqu'il fournit des électrons au chlore (ou le réduit). De même, le chlore agit comme un agent oxydant (oxydant), car il élimine efficacement les électrons du sodium (oxyde).
\ (\ begin {align}
\ textbf {agent réducteur} &= \ textrm {espèce oxydée} \
\ \ textbf {agent oxydant} &= \ textrm {espèce réduite}
\ end {align} \)
Certains processus d'oxydoréduction n'impliquent toutefois pas de transfert d'électrons. Prenons, par exemple, une réaction similaire à celle qui donne\(\ce{NaCl}\) :
\[\ce{H2}(g)+\ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
Le produit de cette réaction est un composé covalent, de sorte que le transfert d'électrons au sens explicite n'est pas impliqué. Pour clarifier la similitude de cette réaction avec la précédente et permettre une définition claire des réactions d'oxydoréduction, une propriété appelée indice d'oxydation a été définie. Le nombre d'oxydation (ou état d'oxydation) d'un élément d'un composé est la charge que ses atomes posséderaient si le composé était ionique. Les directives suivantes sont utilisées pour attribuer des nombres d'oxydation à chaque élément d'une molécule ou d'un ion.
- Le nombre d'oxydation d'un atome dans une substance élémentaire est nul.
- Le nombre d'oxydation d'un ion monatomique est égal à la charge de l'ion.
- Les numéros d'oxydation pour les produits non métalliques courants sont généralement attribués comme suit :
- Hydrogène : +1 lorsqu'il est combiné à des éléments non métalliques, -1 lorsqu'il est combiné à des métaux
- Oxygène : −2 dans la plupart des composés, parfois -1 (appelés peroxydes\(\ce{O2^2-}\)), très rarement\(-\dfrac{1}{2}\) (appelés superoxydes\(\ce{O2-}\)), valeurs positives lorsqu'il est combiné avec F (valeurs variables)
- Halogènes : −1 pour F toujours, −1 pour les autres halogènes sauf lorsqu'ils sont combinés à de l'oxygène ou à d'autres halogènes (nombres d'oxydation positifs dans ces cas, valeurs variables)
- La somme des nombres d'oxydation de tous les atomes d'une molécule ou d'un ion polyatomique est égale à la charge de la molécule ou de l'ion.
Remarque : La convention appropriée pour signaler les frais est d'écrire le chiffre en premier, suivi du signe (par exemple, 2+), tandis que le nombre d'oxydation est écrit dans la séquence inversée, le signe suivi d'un chiffre (par exemple, +2). Cette convention vise à souligner la distinction entre ces deux propriétés connexes.
Suivez les instructions de cette section du texte pour attribuer des numéros d'oxydation à tous les éléments des espèces suivantes :
- H 2 S
- \(\ce{SO3^2-}\)
- Na 2 SO 4
Solution
(a) Selon la directive 1, l'indice d'oxydation pour H est +1.
À l'aide de cet indice d'oxydation et de la formule du composé, la directive 4 peut ensuite être utilisée pour calculer l'indice d'oxydation du soufre :
\(\ce{charge\: on\: H2S}=0=(2\times +1)+(1\times x)\)
\(x=0-(2\times +1)=-2\)
(b) La directive 3 suggère que l'indice d'oxydation de l'oxygène est de −2.
À l'aide de ce nombre d'oxydation et de la formule de l'ion, la ligne directrice 4 peut ensuite être utilisée pour calculer l'indice d'oxydation du soufre :
\(\ce{charge\: on\: SO3^2-}=-2=(3\times -2)+(1\times x)\)
\(x=-2-(3\times -2)=+4\)
(c) Pour les composés ioniques, il est pratique d'attribuer des numéros d'oxydation au cation et à l'anion séparément.
Selon la directive 2, l'indice d'oxydation du sodium est de +1.
En supposant l'indice d'oxydation habituel pour l'oxygène (−2 selon la directive 3), l'indice d'oxydation pour le soufre est calculé comme indiqué dans la directive 4 :
\(x=-2-(4\times -2)=+6\)
Attribuez des états d'oxydation aux éléments dont les atomes sont soulignés dans chacun des composés ou ions suivants :
- K N O 3
- Al H 3
- \(\mathrm{\underline{N}H_4^+}\)
- \(\mathrm{\sideset{ }{_{\large{4}}^{-}}{H_2\underline{P}O}}\)
- Répondez à
-
N, +5
- Réponse b
-
Al, +3
- Réponse c
-
N, −3
- Réponse d
-
P, +5
En utilisant le concept du nombre d'oxydation, une définition complète de la réaction redox a été établie. Les réactions d'oxydoréduction (redox) sont celles dans lesquelles un ou plusieurs éléments impliqués subissent une modification de leur indice d'oxydation. Bien que la grande majorité des réactions d'oxydoréduction impliquent des modifications du nombre d'oxydation de deux éléments ou plus, il existe quelques exceptions intéressantes à cette règle, comme indiqué ci-dessous \). Les définitions des processus complémentaires de cette classe de réactions sont révisées en conséquence, comme indiqué ci-dessous :
\ [\ begin {align}
\ textbf {oxydation} &= \ textrm {augmentation du nombre d'oxydation} \ \
\ textbf {réduction} &= \ textrm {diminution du nombre d'oxydation}
\ end {align} \ nonumber \]
Pour en revenir aux réactions utilisées pour introduire ce sujet, elles peuvent maintenant être toutes deux identifiées comme des processus redox. Lors de la réaction entre le sodium et le chlore pour obtenir du chlorure de sodium, le sodium est oxydé (son indice d'oxydation augmente de 0 dans Na à +1 dans le NaCl) et le chlore est réduit (son indice d'oxydation diminue de 0 dans le Cl 2 à -1 dans le NaCl). Lors de la réaction entre l'hydrogène moléculaire et le chlore, l'hydrogène est oxydé (son indice d'oxydation augmente de 0 dans H 2 à +1 dans HCl) et le chlore est réduit (son indice d'oxydation diminue de 0 dans le Cl 2 à -1 dans le HCl).
Plusieurs sous-classes de réactions d'oxydoréduction sont reconnues, y compris les réactions de combustion dans lesquelles le réducteur (également appelé combustible) et l'oxydant (souvent, mais pas nécessairement, de l'oxygène moléculaire) réagissent vigoureusement et produisent des quantités importantes de chaleur, et souvent de lumière, sous forme de flamme. Les réactions solides avec des combustibles de fusée telles que celle décrite ci-dessous sont des processus de combustion. Une réaction propulsive typique au cours de laquelle l'aluminium solide est oxydé par le perchlorate d'ammonium est représentée par cette équation :
\[\ce{10Al}(s)+\ce{6NH4ClO4}(s)\rightarrow \ce{4Al2O3}(s)+\ce{2AlCl3}(s)+\ce{12H2O}(g)+\ce{3N2}(g) \nonumber \]
Regardez une courte vidéo montrant le tir d'essai d'un prototype de moteur-fusée hybride à petite échelle prévu pour être utilisé dans le nouveau système de lancement spatial développé par la NASA. Les premiers moteurs allumés à 3 s (flamme verte) utilisent un mélange combustible liquide/oxydant, et les seconds moteurs, plus puissants, allumés à 4 s (flamme jaune) utilisent un mélange solide.
Les réactions à déplacement unique (remplacement) sont des réactions d'oxydoréduction dans lesquelles un ion en solution est déplacé (ou remplacé) par l'oxydation d'un élément métallique. Un exemple courant de ce type de réaction est l'oxydation acide de certains métaux :
\[\ce{Zn}(s)+\ce{2HCl}(aq)\rightarrow \ce{ZnCl2}(aq)+\ce{H2}(g) \nonumber \]
Les éléments métalliques peuvent également être oxydés par des solutions d'autres sels métalliques, par exemple :
\[\ce{Cu}(s)+\ce{2AgNO3}(aq)\rightarrow \ce{Cu(NO3)2}(aq)+\ce{2Ag}(s) \nonumber \]
Cette réaction peut être observée en plaçant du fil de cuivre dans une solution contenant un sel d'argent dissous. Les ions argent en solution sont réduits en argent élémentaire à la surface du fil de cuivre, et les ions Cu 2 + qui en résultent se dissolvent dans la solution pour donner une couleur bleue caractéristique (Figure\(\PageIndex{4}\)).

Identifiez les équations qui représentent les réactions d'oxydoréduction, en fournissant un nom pour la réaction, le cas échéant. Pour les réactions identifiées comme redox, nommez l'oxydant et le réducteur.
- \(\ce{ZnCO3}(s)\rightarrow \ce{ZnO}(s)+\ce{CO2}(g)\)
- \(\ce{2Ga}(l)+\ce{3Br2}(l)\rightarrow \ce{2GaBr3}(s)\)
- \(\ce{2H2O2}(aq)\rightarrow \ce{2H2O}(l)+\ce{O2}(g)\)
- \(\ce{BaCl2}(aq)+\ce{K2SO4}(aq)\rightarrow \ce{BaSO4}(s)+\ce{2KCl}(aq)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(l)\)
Une solution
Les réactions d'oxydoréduction sont identifiées par définition si un ou plusieurs éléments subissent une modification de leur indice d'oxydation.
- Il ne s'agit pas d'une réaction d'oxydoréduction, car les indices d'oxydation restent inchangés pour tous les éléments.
- Il s'agit d'une réaction redox. Le gallium est oxydé, son indice d'oxydation passant de 0 dans Ga (l) à +3 dans le GabR 3 (s). L'agent réducteur est Ga (l). Le brome est réduit, son indice d'oxydation diminuant de 0 dans le Br 2 (l) à -1 dans le GabR 3 (s). L'agent oxydant est le Br 2 (l).
- Il s'agit d'une réaction redox. Il s'agit d'un procédé particulièrement intéressant, car il implique le même élément, l'oxygène, qui subit à la fois une oxydation et une réduction (une réaction dite de dismutation). L'oxygène est oxydé, son indice d'oxydation passant de -1 dans H 2 O 2 (aq) à 0 dans O 2 (g). L'oxygène est également réduit, son indice d'oxydation diminuant de -1 dans H 2 O 2 (aq) à -2 dans H 2 O (l). Pour les réactions de dismutation, la même substance joue le rôle d'oxydant et de réducteur.
- Il ne s'agit pas d'une réaction d'oxydoréduction, car les indices d'oxydation restent inchangés pour tous les éléments.
- Il s'agit d'une réaction redox (combustion). Le carbone est oxydé, son indice d'oxydation passant de -2 dans C 2 H 4 (g) à +4 dans CO 2 (g). L'agent réducteur (carburant) est du C 2 H 4 (g). L'oxygène est réduit, son indice d'oxydation diminuant de 0 dans O 2 (g) à -2 dans H 2 O (l). L'agent oxydant est l'O 2 (g).
Cette équation décrit la production de chlorure d'étain (II) :
\[\ce{Sn}(s)+\ce{2HCl}(g)\rightarrow \ce{SnCl2}(s)+\ce{H2}(g) \nonumber \]
S'agit-il d'une réaction redox ? Dans l'affirmative, donnez un nom plus précis à la réaction, s'il y a lieu, et identifiez l'oxydant et le réducteur.
- Réponse
-
Oui, une réaction de remplacement unique. Sn (s) est l'agent réducteur, HCl (g) est l'oxydant.
Équilibrage des réactions redox par la méthode des demi-réactions
Les réactions d'oxydoréduction qui se produisent dans des milieux aqueux impliquent souvent de l'eau, des ions hydronium et des ions hydroxyde en tant que réactifs ou produits. Bien que ces espèces ne soient ni oxydées ni réduites, elles participent aux changements chimiques d'autres manières (par exemple, en fournissant les éléments nécessaires à la formation des oxyanions). Les équations représentant ces réactions sont parfois très difficiles à équilibrer par inspection, de sorte que des approches systématiques ont été développées pour faciliter le processus. Une approche très utile consiste à utiliser la méthode des demi-réactions, qui comprend les étapes suivantes :
- Écrivez les deux demi-réactions représentant le processus redox.
- Équilibrez tous les éléments sauf l'oxygène et l'hydrogène.
- Équilibrez les atomes d'oxygène en ajoutant des molécules de H 2 O.
- Équilibrez les atomes d'hydrogène en ajoutant des ions H +.
- Équilibrez la charge 1 en ajoutant des électrons.
- Si nécessaire, multipliez les coefficients de chaque demi-réaction par les nombres entiers les plus petits possibles pour obtenir le même nombre d'électrons dans chacune d'elles.
- Additionnez les demi-réactions équilibrées et simplifiez en supprimant les espèces qui apparaissent des deux côtés de l'équation.
- Pour les réactions se produisant dans des milieux basiques (excès d'ions hydroxyde), effectuez les étapes supplémentaires suivantes :
- Ajoutez des ions OH − des deux côtés de l'équation en nombres égaux au nombre d'ions H +.
- Du côté de l'équation contenant à la fois des ions H + et OH −, combinez ces ions pour obtenir des molécules d'eau.
- Simplifiez l'équation en supprimant toutes les molécules d'eau redondantes.
- Enfin, vérifiez que le nombre d'atomes et les charges totales 2 sont équilibrés.
Écrivez une équation équilibrée pour la réaction entre l'ion dichromate et le fer (II) pour obtenir du fer (III) et du chrome (III) en solution acide.
\[\ce{Cr2O7^2- + Fe^2+ \rightarrow Cr^3+ + Fe^3+} \nonumber \]
Une solution
Écrivez les deux demi-réactions.
Chaque demi-réaction contiendra un réactif et un produit ayant un élément en commun.
\(\ce{Cr2O7^2- \rightarrow Cr^3+}\)
Équilibrez tous les éléments sauf l'oxygène et l'hydrogène. La demi-réaction de fer est déjà équilibrée, mais la demi-réaction de chrome montre deux atomes de Cr à gauche et un atome de Cr à droite. La modification du coefficient sur le côté droit de l'équation à 2 permet d'obtenir un équilibre en ce qui concerne les atomes de Cr.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+}\)
Équilibrez les atomes d'oxygène en ajoutant des molécules de H 2 O. La demi-réaction du fer ne contient pas d'atomes O. La demi-réaction du chrome montre sept atomes d'O sur la gauche et aucun sur la droite, de sorte que sept molécules d'eau sont ajoutées sur le côté droit.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+ + 7H2O}\)
Équilibrez les atomes d'hydrogène en ajoutant des ions H +. La demi-réaction du fer ne contient pas d'atomes H. La demi-réaction du chrome montre 14 atomes H sur la droite et aucun sur la gauche, de sorte que 14 ions hydrogène sont ajoutés sur le côté gauche.
\(\ce{Cr2O7^2- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Équilibrez la charge en ajoutant des électrons. La demi-réaction du fer montre une charge totale de 2+ sur le côté gauche (1 ion Fe 2 +) et de 3+ sur le côté droit (1 ion Fe 3 +). L'ajout d'un électron sur le côté droit amène la charge totale de ce côté à (3+) + (1−) = 2+, et l'équilibre de charge est atteint.
La demi-réaction du chrome montre une charge totale de (1 × 2−) + (14 × 1+) = 12+ sur le côté gauche (\(\ce{1 Cr2O7^2-}\)ion et 14 ions H +). La charge totale sur le côté droit est de (2 × 3+) = 6 + (2 ions Cr 3 +). L'ajout de six électrons sur le côté gauche portera la charge totale de ce côté à (12+ + 6−) = 6+, et l'équilibre de charge est atteint.
\(\ce{Fe^2+ \rightarrow Fe^3+ + e-}\)
\(\ce{Cr2O7^2- + 14H+ + 6e- \rightarrow 2Cr^3+ + 7H2O}\)
Multipliez les deux demi-réactions de manière à ce que le nombre d'électrons dans une réaction soit égal au nombre d'électrons dans l'autre réaction. Pour être compatible avec la conservation de la masse et l'idée selon laquelle les réactions redox impliquent le transfert (et non la création ou la destruction) d'électrons, le coefficient de la demi-réaction du fer doit être multiplié par 6.
\(\ce{6Fe^2+ \rightarrow 6Fe^3+ + 6e-}\)
\(\ce{Cr2O7^2- + 6e- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Ajoutez les demi-réactions équilibrées et annulez les espèces qui apparaissent des deux côtés de l'équation.
\[\ce{6Fe^2+ + Cr2O7^2- + 6e- + 14H+ \rightarrow 6Fe^3+ + 6e- + 2Cr^3+ + 7H2O} \nonumber \]
Seuls les six électrons sont des espèces redondantes. En les retirant de chaque côté de l'équation, on obtient l'équation simplifiée et équilibrée suivante :
\[\ce{6Fe^2+ + Cr2O7^2- + 14H+ \rightarrow 6Fe^3+ + 2Cr^3+ + 7H2O} \nonumber \]
Une dernière vérification de l'équilibre des atomes et des charges confirme que l'équation est équilibrée.
| Réactifs | Produits | |
|---|---|---|
| Fe | 6 | 6 |
| Cr | 2 | 2 |
| O | 7 | 7 |
| H | 14 | 14 |
| charge | 24 ans et plus | 24 ans et plus |
En solution acide, le peroxyde d'hydrogène réagit avec le Fe 2 + pour produire du Fe 3 + et du H 2 O. Écrivez une équation équilibrée pour cette réaction.
- Réponse
-
\[\ce{H2O2}(aq)+\ce{2H+}(aq)+\ce{2Fe^2+} \rightarrow \ce{2H2O}(l)+\ce{2Fe^3+} \nonumber \]
Résumé
Les réactions chimiques sont classées selon des modèles de comportement similaires. Un grand nombre de réactions importantes sont classées en trois catégories : précipitation, acide-base et oxydoréduction (redox). Les réactions de précipitation impliquent la formation d'un ou de plusieurs produits insolubles. Les réactions acido-basiques impliquent le transfert d'ions hydrogène entre les réactifs. Les réactions d'oxydoréduction impliquent une modification du nombre d'oxydation d'un ou de plusieurs éléments réactifs. L'écriture d'équations équilibrées pour certaines réactions d'oxydoréduction qui se produisent dans des solutions aqueuses est simplifiée en utilisant une approche systématique appelée méthode des demi-réactions.
Notes
- 1 L'exigence d'un « équilibre de charge » n'est qu'un type spécifique de « bilan de masse » dans lequel les espèces en question sont des électrons. Une équation doit représenter un nombre égal d'électrons du côté du réactif et du côté du produit, de sorte que les atomes et les charges doivent être équilibrés.
- 2 L'exigence d'un « équilibre de charge » n'est qu'un type spécifique de « bilan de masse » dans lequel les espèces en question sont des électrons. Une équation doit représenter un nombre égal d'électrons du côté du réactif et du côté du produit, de sorte que les atomes et les charges doivent être équilibrés.
Lexique
- acide
- substance qui produit du H 3 O + lorsqu'elle est dissoute dans l'eau
- réaction acide-base
- réaction impliquant le transfert d'un ion hydrogène entre des espèces réactives
- base
- substance qui produit OH − lorsqu'elle est dissoute dans l'eau
- réaction de combustion
- réaction redox vigoureuse produisant des quantités importantes d'énergie sous forme de chaleur et, parfois, de lumière
- demi-réaction
- une équation qui indique si chaque réactif perd ou gagne des électrons lors d'une réaction.
- insoluble
- relativement peu soluble ; ne se dissolvant que dans une faible mesure
- réaction de neutralisation
- réaction entre un acide et une base pour produire du sel et de l'eau
- oxydation
- processus dans lequel le nombre d'oxydation d'un élément est augmenté par la perte d'électrons
- réaction d'oxydoréduction
- (également réaction redox) réaction impliquant une modification de l'indice d'oxydation d'un ou de plusieurs éléments réactifs
- nombre d'oxydation
- (également, état d'oxydation) la charge que chaque atome d'un élément aurait dans un composé si le composé était ionique
- agent oxydant
- (également oxydant) substance qui provoque l'oxydation d'une autre substance et qui, au cours du processus, devient réduite
- précipiter
- produit insoluble qui se forme à la suite de la réaction de réactifs solubles
- réaction de précipitation
- réaction qui produit un ou plusieurs produits insolubles ; lorsque les réactifs sont des composés ioniques, parfois appelée double déplacement ou métathèse
- réduction
- processus dans lequel le nombre d'oxydation d'un élément est diminué par le gain d'électrons
- agent réducteur
- (également, agent réducteur) qui entraîne la réduction d'une autre substance et qui, au cours du processus, s'oxyde
- sel
- composé ionique pouvant être formé par la réaction d'un acide avec une base contenant un cation et un anion autre que l'hydroxyde ou l'oxyde
- réaction à déplacement unique
- Réaction redox (également de remplacement) impliquant l'oxydation d'une substance élémentaire par une espèce ionique
- soluble
- d'une solubilité relativement élevée ; se dissolvant dans une mesure relativement importante
- solubilité
- la mesure dans laquelle une substance peut être dissoute dans l'eau ou dans tout solvant
- acide fort
- acide qui réagit complètement lorsqu'il est dissous dans l'eau pour produire des ions hydronium
- base solide
- base qui réagit complètement lorsqu'elle est dissoute dans l'eau pour produire des ions hydroxyde
- acide faible
- acide qui ne réagit que légèrement lorsqu'il est dissous dans l'eau pour produire des ions hydronium
- base faible
- base qui ne réagit que légèrement lorsqu'elle est dissoute dans l'eau pour produire des ions hydroxyde

