2.2: 水
- Page ID
- 199306
你有没有想过科学家为什么要花时间在其他星球上寻找水? 这是因为水对生命至关重要;即使水在另一个星球上的微小痕迹也可能表明生命可能存在或确实存在于该星球上。 水是活细胞中最丰富的分子之一,也是我们所知道的对生命最重要的分子。 大约 60-70% 的身体是由水组成的。 没有它,生命根本不存在。
水是极性的
水分子中的氢和氧原子形成极性共价键。 与氢原子相比,共享电子花在氧原子上的时间更多。 水分子没有总电荷,但是每个氢原子上都有轻微的正电荷,氧原子上有轻微的负电荷。 由于这些电荷,稍微正的氢原子相互排斥并形成图2.1.6 所示的独特形状。 每个水分子都会吸引其他水分子,因为分子的不同部分有正负电荷。 水还会吸引其他极性分子(例如糖),形成氢键。 当一种物质容易与水形成氢键时,它可以溶解在水中,被称为亲水性(“爱水”)。 氢键不容易由油和脂肪等非极性物质形成(图\(\PageIndex{1}\))。 这些非极性化合物具有疏水性(“防水”),不会溶解在水中。

水可以稳定温度
水中的氢键使其吸收和释放热能的速度比许多其他物质更慢。 温度是衡量分子运动(动能)的指标。 随着运动的增加,能量会增加,因此温度会升高。 水在温度升高之前会吸收大量能量。 能量的增加会破坏水分子之间的氢键。 由于这些键可以迅速产生和破坏,因此水吸收的能量增加和温度变化的幅度很小。 这意味着水可以缓和生物体内部及其环境中的温度变化。 随着能量输入的继续,氢键形成和破坏之间的平衡转向破坏方面。 破裂的债券多于形成的债券。 这个过程导致在称为蒸发的过程中在液体表面(例如水体、植物的叶子或生物体的皮肤)释放单个水分子。 汗液(90% 的水)的蒸发可以使生物体冷却,因为破坏氢键需要输入能量并带走人体的热量。
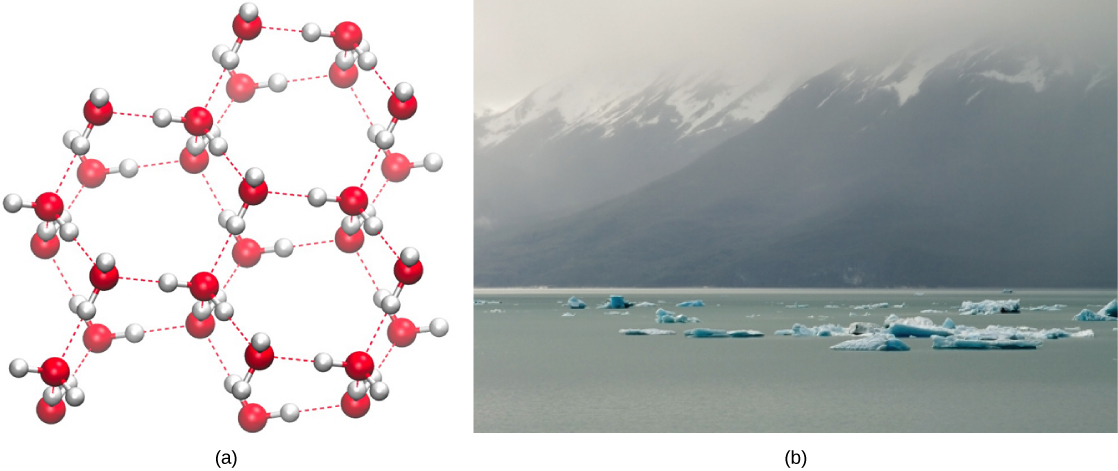
相反,随着分子运动的减少和温度的下降,破坏水分子之间氢键的能量就会减少。 这些键保持完好无损,开始形成坚硬的晶格状结构(例如冰)(图\(\PageIndex{2}\) a)。 冷冻时,冰的密度低于液态水(分子相距更远)。 这意味着冰漂浮在水体表面(图\(\PageIndex{2}\) b)。 在湖泊、池塘和海洋中,水面会形成冰,形成隔热屏障,保护地下的动植物免受水中冻结。 如果不发生这种情况,生活在水中的动植物将冻结在冰块中,无法自由移动,从而使在寒冷的温度下生活变得困难或不可能。
水是一种极好的溶剂
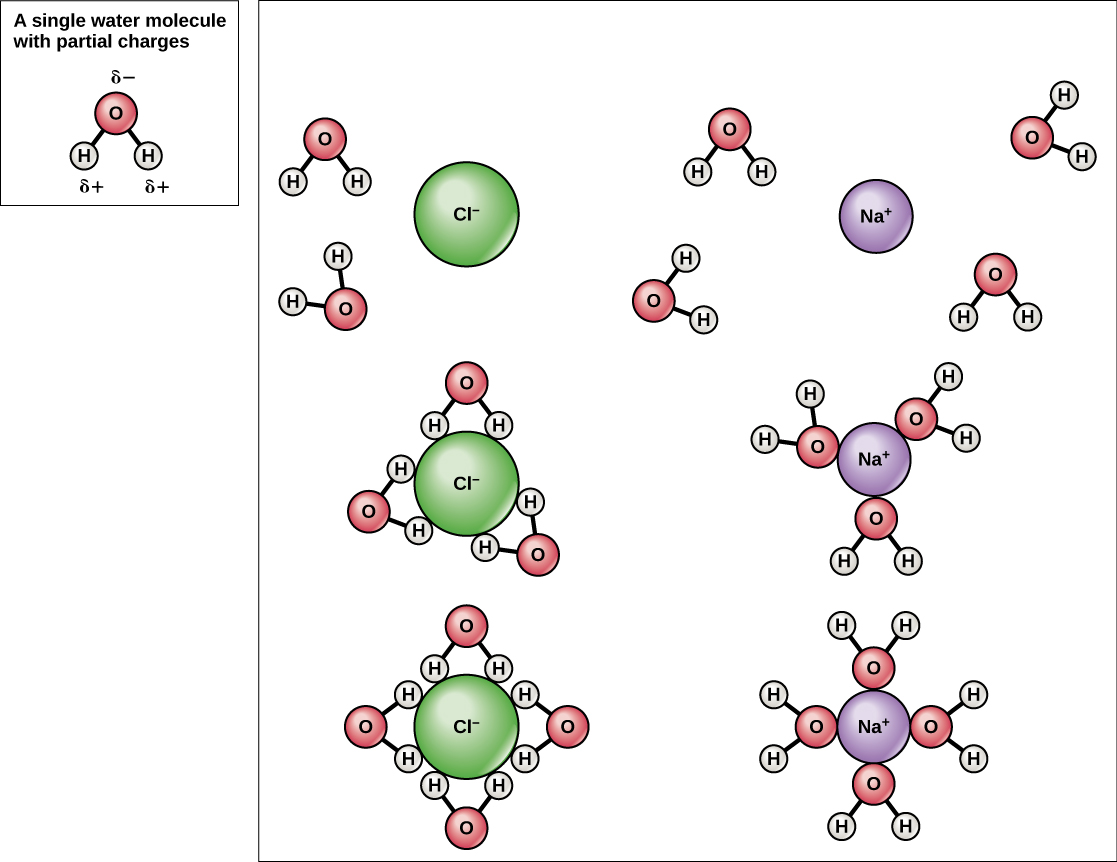
由于水是极性的,具有轻微的正负电荷,因此离子化合物和极性分子很容易溶解在其中。 因此,水就是所谓的溶剂,一种能够溶解另一种物质的物质。 带电粒子将与周围的水分子层形成氢键。 这被称为水合球,用于保持颗粒在水中的分离或分散。 如果食盐(NaCl)混合在水中(图\(\PageIndex{3}\)),钠和氯离子在水中分离或分离,水合球在离子周围形成。 带正电荷的钠离子被水分子中氧原子的部分负电荷所包围。 带负电荷的氯离子被水分子中氢原子的部分正电荷所包围。 这些水合球也被称为补水壳。 水分子的极性使其成为一种有效的溶剂,在生命系统中的许多作用中起着重要作用。
水具有凝聚力
你有没有把一杯水装到最上面然后慢慢地再加几滴? 在水溢出之前,水实际上会在玻璃边缘上方形成圆顶状的形状。 由于凝聚力的特性,这种水可以保持在玻璃上方。 在凝聚力中,水分子相互吸引(因为氢键),尽管玻璃中没有更多的空间,但这些分子在液体-空气(气体)界面处保持在一起。 凝聚力会产生表面张力,即物质在张力或应力下承受破裂的能力。 当你将一小块纸丢到一滴水上时,纸会漂浮在水滴的顶部,尽管物体比水更密集(重)。 之所以发生这种情况,是因为水分子产生的表面张力。 内聚力和表面张力保持水分子完好无损,物品漂浮在顶部。 如果将钢针轻轻放置,甚至可以将钢针 “漂浮” 到一杯水上,而不会破坏表面张力(图\(\PageIndex{4}\))。

这些凝聚力还与水的粘附特性或水分子与其他分子之间的吸引力有关。 当水 “爬上” 放在一杯水中的吸管时,就会观察到这种情况。 你会注意到吸管两侧的水似乎比中间的水高。 这是因为水分子被吸附在吸管上,因此会粘附在吸管上。
凝聚力和粘合力对于维持生命很重要。 例如,由于这些力,水可以从植物的根部向上流动,流向植物的顶部,为植物提供食物。
概念在行动
要了解有关水的更多信息,请访问美国地质调查局学校水科学:关于水的一切! 网站。
缓冲液、pH、酸和碱
溶液的 pH 值是衡量其酸度或碱度的指标。 你可能用过石蕊纸来测试溶液中存在多少酸或碱(碱度),这种纸张经过天然水溶性染料处理,可以用作 pH 指示剂。 你甚至可能用过一些来确保室外游泳池中的水得到适当的处理。 在这两种情况下,这种 pH 测试都会测量给定溶液中存在的氢离子的含量。 高浓度的氢离子会产生较低的 pH 值,而低水平的氢离子会导致 pH 值较高。 氢离子的总浓度与其 pH 值成反比,可以在 pH 值上测量(图\(\PageIndex{5}\))。 因此,氢离子越多,pH 值越低;相反,氢离子越少,pH 值越高。
pH 值范围为 0 到 14。 pH 值上一个单位的变化表示氢离子浓度变化为 10 倍,两个单位的变化表示氢离子浓度变化 100 倍。 因此,pH 值的微小变化表示氢离子浓度的巨大变化。 纯净水是中性的。 它既不是酸性也不是碱性的,pH 值为 7.0。 任何低于 7.0(从 0.0 到 6.9)的东西都是酸性的,任何高于 7.0(从 7.1 到 14.0)的东西都是碱性的。 静脉中的血液呈微碱性(pH = 7.4)。 胃中的环境是高度酸性的(pH = 1 到 2)。 橙汁是轻度酸性的(pH = 大约 3.5),而小苏打是碱性的(pH = 9.0)。

酸是提供氢离子 (H +) 和降低 pH 值的物质,而碱提供氢氧化物离子 (OH —) 并提高 pH 值。 酸越强,它越容易捐赠 H +。 例如,盐酸和柠檬汁的酸性很强,加入水中后很容易放弃 H +。 相反,碱是那些容易捐赠 OH — 的物质。 OH — 离子与 H + 结合产生水,从而提高物质的 pH 值。 氢氧化钠和许多家用清洁剂碱性很强,放入水中会迅速释放氢氧化钠,从而提高 pH 值。
我们体内的大多数细胞在pH值范围非常狭窄的窗口内运作,通常仅在7.2到7.6之间。 如果人体的pH值超出这个范围,呼吸系统就会出现故障,体内其他器官也是如此。 细胞不再正常运作,蛋白质会分解。 超出 pH 值范围的偏差会导致昏迷甚至导致死亡。
那么,我们怎么能摄入或吸入酸性或碱性物质而不死亡? 缓冲区是关键。 缓冲液很容易吸收多余的 H + 或 OH —,小心地将人体 pH 值保持在上述狭窄范围内。 二氧化碳是人体重要缓冲系统的一部分;它使pH值保持在适当的范围内。 该缓冲系统涉及碳酸(H 2 CO 3)和碳酸氢盐(HCO 3 —)阴离子。 如果过多的 H + 进入人体,碳酸氢盐将与 H + 结合产生碳酸并限制 pH 值的降低。 同样,如果在系统中引入过多的 OH —,碳酸会迅速分解成碳酸氢盐和 H + 离子。 H + 离子可以与 OH — 离子结合,限制 pH 值的增加。 虽然碳酸是这种反应中的重要产物,但它的存在是短暂的,因为我们每次呼吸时碳酸都会作为二氧化碳气体从体内释放出来。 如果没有这种缓冲系统,我们体内的pH值波动太大,我们将无法生存。
摘要
水具有许多对维持生命至关重要的特性。 它是极性的,允许形成氢键,从而使离子和其他极性分子溶解在水中。 因此,水是一种极好的溶剂。 水分子之间的氢键使水比许多其他物质能够更好地保持热量。 随着温度的升高,水之间的氢键不断断裂并发生变化,从而使整体温度保持稳定,尽管增加了系统的能量。 水的凝聚力允许表面张力的特性。 水的所有这些独特特性在活生物体的化学中都很重要。
溶液的 pH 值是衡量溶液中氢离子浓度的指标。 氢离子含量高的溶液是酸性的,pH 值低。 含有大量氢氧化物离子的溶液是碱性的,pH 值很高。 pH 值范围为 0 到 14,pH 值为 7 表示中性。 缓冲液是在缓冲系统中添加酸或碱时适度 pH 值变化的溶液。 缓冲液在生物系统中很重要,因为它们能够维持恒定的 pH 值。
脚注
- 1 Humphrey、W.、Dalke、A. 和 Schulten,K.,“VMD—视觉分子动力学”,J. Molec。 Graphics,1996 年,第 14 卷,第 33-38 页。 http://www.ks.uiuc.edu/Research/vmd/
词汇表
- 酸
- 一种分泌氢离子从而降低 pH 值的物质
- 附着力
- 水分子与另一种物质的分子之间的吸引力
- 基础
- 一种吸收氢离子从而提高 pH 值的物质
- 缓冲
- 一种通过吸收或释放氢或氢氧化物离子来抵抗 pH 值变化的溶液
- 凝聚力
- 由水的极性引起的水分子之间的分子间力;产生表面张力
- 蒸发
- 从液态水中释放水分子形成水蒸气
- 亲水性的
- 描述一种溶解在水中的物质;喜欢水
- 恐水的
- 描述一种不溶于水的物质;怕水
- 石蕊纸
- 经过天然水溶性染料处理的滤纸,因此可用作 pH 指示剂
- pH 标尺
- 一个从 0 到 14 的量表,用于测量物质氢离子的近似浓度
- 溶剂
- 一种能够溶解另一种物质的物质
- 表面张力
- 液体表面的内聚力,它阻止分子分离
- 温度
- 分子运动的测量



