2.1: 分子的基石
- Page ID
- 199294
在最基本的层面上,生命是由物质组成的。 物质占据空间并具有质量。 所有物质都由元素组成,即无法分解或化学转化为其他物质的物质。 每个元素都由原子组成,每个原子都具有恒定数量的质子和独特的特性。 总共定义了118种元素;但是,只有92种元素是自然存在的,在活细胞中发现的元素少于30个。 其余的26种元素不稳定,因此不存在很长时间,或者是理论上的,尚未被发现。
每种元素都由其化学符号(例如 H、N、O、C 和 Na)表示,并具有独特的特性。 这些独特的特性允许元素以特定方式组合和相互结合。
原子
原子是元素中最小的成分,它保留了该元素的所有化学特性。 例如,一个氢原子具有氢元素的所有特性,例如它在室温下以气体形式存在,它与氧气结合产生水分子。 在保留氢气特性的同时,氢原子无法分解成任何更小的东西。 如果氢原子被分解成亚原子粒子,它将不再具有氢的特性。
在最基本的层面上,所有生物都是由多种元素组合组成的。 它们包含结合在一起形成分子的原子。 在动物等多细胞生物体中,分子可以相互作用形成细胞,这些细胞结合形成组织,从而构成器官。 这些组合一直持续到整个多细胞生物形成为止。
所有原子都包含质子、电子和中子(图\(\PageIndex{1}\))。 唯一的例外是氢气(H),它由一个质子和一个电子组成。 质子是一种带正电荷的粒子,位于原子核(原子的核心)中,质量为 1,电荷为 +1。 电子是一种带负电荷的粒子,在原子核周围的空间中传播。 换句话说,它位于原子核之外。 它的质量可以忽略不计,电荷为—1。
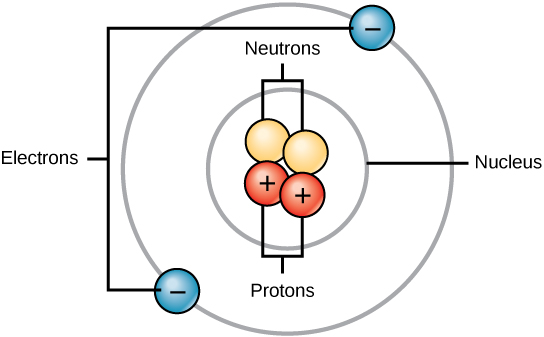
中子,像质子一样,存在于原子的原子核中。 它们的质量为 1 且不带电荷。 正电荷(质子)和负(电子)电荷在净电荷为零的中性原子中相互平衡。
因为质子和中子的质量各为 1,所以原子的质量等于该原子的质子和中子的数量。 电子的数量不计入总质量,因为它们的质量太小了。
如前所述,每个元素都有自己独特的属性。 每个都包含不同数量的质子和中子,赋予它自己的原子序数和质量数。 元素的原子序数等于该元素包含的质子数。 质量数或原子质量是质子数加上该元素的中子数。 因此,可以通过从质量数中减去原子序数来确定中子的数量。
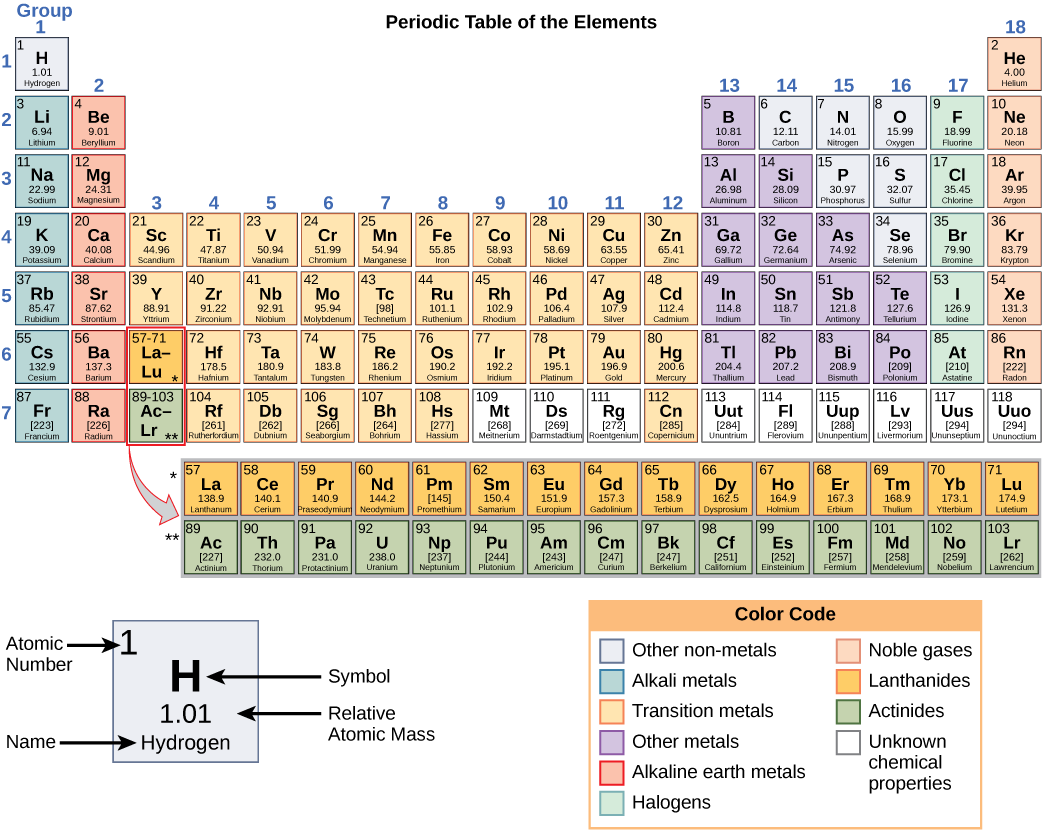
这些数字提供了有关元素以及它们在组合时将如何反应的信息。 不同的元素具有不同的熔点和沸点,并且在室温下处于不同的状态(液体、固体或气体)。 它们还以不同的方式组合在一起。 有些构成特定类型的债券,而另一些则不是。 它们的组合方式取决于存在的电子数量。 由于这些特性,元素被排列成元素周期表,这是一张元素的图表,其中包括每个元素的原子序数和相对原子质量。 元素周期表还提供有关元素属性的关键信息(图\(\PageIndex{2}\)),通常用颜色编码表示。 表格的排列还显示了每个元素中的电子是如何组织的,并提供了有关原子如何相互反应形成分子的重要细节。
同位素是相同元素的不同形式,具有相同数量的质子,但中子数量不同。 一些元素,例如碳、钾和铀,具有天然存在的同位素。 碳12是最常见的碳同位素,包含六个质子和六个中子。 因此,它的质量数为12(六个质子和六个中子),原子序数为6(这使其成为碳)。 Carbon-14 包含六个质子和八个中子。 因此,它的质量数为14(六个质子和八个中子),原子序数为6,这意味着它仍然是碳元素。 这两种替代形式的碳是同位素。 有些同位素是不稳定的,会失去质子、其他亚原子粒子或能量以形成更稳定的元素。 它们被称为放射性同位素或放射性同位素。
艺术连接
(K) 钾-39和钾-40分别有多少中子?
行动中的进化:碳定年
Carbon-14(14 C)是一种天然存在的放射性同位素,由宇宙射线在大气中产生。 这是一个连续的过程,因此总会创建更多 14 C。 随着活生物体的发育,其体内 14 摄氏度的相对水平等于大气中 14 摄氏度的浓度。 当生物死亡时,它不再摄入 14 摄氏度,因此该比例将下降。 14 C 通过一种叫做 β 衰变的过程衰变为 14 N;它在这个缓慢的过程中会释放能量。
大约 5,730 年后,14 C 的起始浓度中只有一半会转化为 14 N。同位素原始浓度的一半衰变为更稳定的形式所需的时间称为其半衰期。 由于 14 C 的半衰期很长,因此它被用来老化以前的活物体,例如化石。 使用在物体中发现的 14 摄氏度浓度与在大气中检测到的 14 摄氏度的比率,可以确定尚未衰变的同位素量。 根据这个数额,化石的年龄可以计算为大约50,000年(图\(\PageIndex{3}\))。 半衰期较长的同位素,例如钾40,用于计算较旧化石的年龄。 通过使用碳定年法,科学家可以重建生活在过去 50,000 年内的生物的生态和生物地理学。

概念在行动
要了解有关原子和同位素的更多信息,以及如何区分一种同位素和另一种同位素,请访问此网站并运行模拟。
化学键
元素如何相互作用取决于它们的电子是如何排列的,以及原子中存在电子的最外层区域有多少电子开口。 电子存在于能量水平,在原子核周围形成壳。 最近的外壳最多可以容纳两个电子。 离原子核最近的壳总是先被填满,然后才能填充任何其他外壳。 氢气有一个电子;因此,它在最低的外壳内只有一个点占据。 氦有两个电子;因此,它可以用两个电子完全填充最低的外壳。 如果你看一下元素周期表,你会发现氢气和氦气是第一行中仅有的两个元素。 这是因为它们的第一个外壳中只有电子。 氢气和氦气是仅有的两种具有最低外壳且没有其他外壳的元素。
第二和第三能级最多可以容纳八个电子。 八个电子分成四对排列,在任何电子对完成之前,每对电子中的一个位置都被电子填充。
再看一下元素周期表(图\(\PageIndex{2}\)),你会注意到有七行。 这些行对应于该行内元素所拥有的壳数。 随着列从左向右移动,特定行中的元素具有越来越多的电子元素。 尽管每个元素都有相同数量的炮弹,但并非所有炮弹都完全充满了电子。 如果你看元素周期表的第二行,你会发现锂(Li)、(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)和霓虹灯(Ne)。 它们都有仅占据第一和第二壳的电子。 锂的最外壳中只有一个电子,铍有两个电子,硼有三个电子,依此类推,直到整个壳充满八个电子,就像霓虹灯一样。
并非所有元素都有足够的电子来填充其最外层的外壳,但是当最外层壳中的所有电子位置都被填满时,原子处于最稳定的状态。 由于最外层的壳中有这些空位,我们看到了化学键的形成,或者两个或更多相同或不同元素之间的相互作用导致了分子的形成。 为了获得更大的稳定性,原子往往会完全填满其外壳,并与其他元素结合,通过共享电子、接受来自另一个原子的电子或向另一个原子捐赠电子来实现这一目标。 因为原子序数低的元素(最多为钙,原子序数为20)的最外层壳可以容纳八个电子,所以这被称为八位组法则。 元素可以捐赠、接受或与其他元素共享电子,以填充其外壳并满足八位组规则。
当原子不包含相等数量的质子和电子时,它被称为离子。 因为电子的数量不等于质子的数量,所以每个离子都有净电荷。 正离子是通过丢失电子形成的,被称为阳离子。 负离子是通过获得电子形成的,被称为阴离子。
例如,钠的最外壳中只有一个电子。 钠捐出一个电子所消耗的能量要比接受另外七个电子填充外壳所需的能量少。 如果钠失去一个电子,它现在有 11 个质子和 10 个电子,剩下的总电荷为 +1。 它现在被称为钠离子。
氯原子的外壳中有七个电子。 同样,氯气获得一个电子比失去七个电子更节能。 因此,它倾向于获得电子来产生具有17个质子和18个电子的离子,从而产生净负(—1)电荷。 它现在被称为氯离子。 电子从一个元素到另一个元素的这种运动被称为电子转移。 如图所\(\PageIndex{4}\)示,钠原子(Na)的最外壳中只有一个电子,而氯原子(Cl)的最外壳中有七个电子。 钠原子将捐出其一个电子来清空其外壳,而氯原子将接受该电子填充其外壳,变成氯化物。 现在,两个离子都满足八位组规则,并且具有完整的最外层炮弹。 由于电子的数量不再等于质子的数量,因此每个电子现在都是离子,并且具有 +1(钠)或 —1(氯化物)电荷。
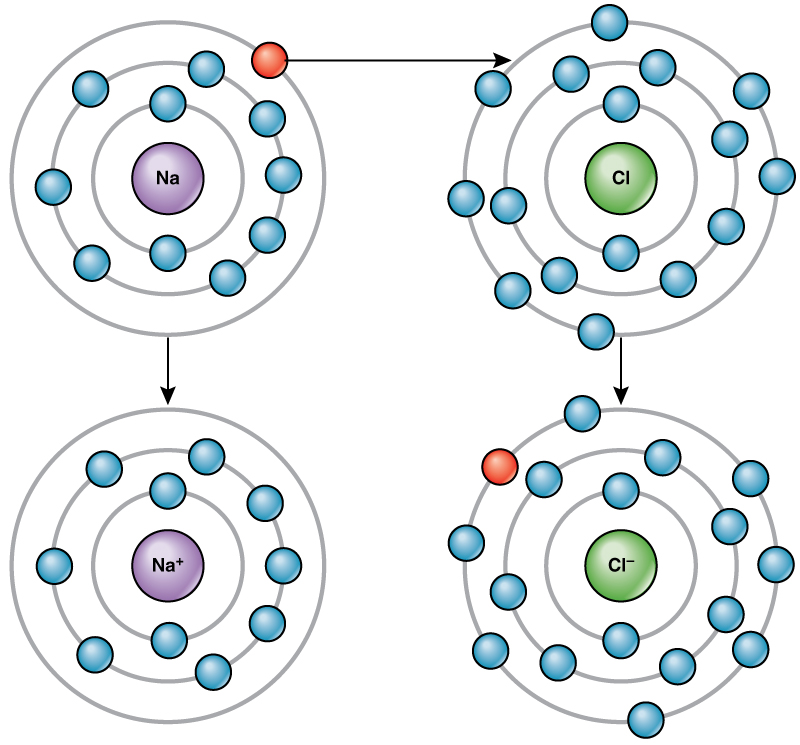
离子键
有四种类型的键或相互作用:离子键、共价键、氢键和范德华相互作用。 离子键和共价键是很强的相互作用,需要更大的能量输入才能分解。 当一个元素从其外壳捐出一个电子时,如上面的钠原子示例,就会形成正离子。 接受电子的元素现在带负电荷。 由于正电荷和负电荷会吸引,因此这些离子会保持在一起并在离子之间形成离子键或键。 这些元素与来自一个元素的电子结合在一起,主要与另一个元素保持联系。 当 Na + 和 Cl — 离子结合产生 NaCl 时,来自钠原子的电子与其他七个来自氯原子的电子停留,钠和氯离子在净电荷为零的离子晶格中相互吸引。
共价债券
两个或多个原子之间的另一种强化学键是共价键。 这些键是在两个元素之间共享电子时形成的,是活生物体中最强和最常见的化学键形式。 构成我们细胞中生物分子的元素之间形成共价键。 与离子键不同,共价键不会在水中分离。
结合形成水分子的氢原子和氧原子通过共价键结合在一起。 来自氢原子的电子在氢原子的外壳和氧原子的不完整外壳之间划分时间。 为了完全填充氧原子的外壳,需要来自两个氢原子的两个电子,因此 H 2 O 中的下标 “2”。电子在原子之间共享,将它们之间的时间分开以 “填充” 每个氢原子的外壳。 对于所有涉及的原子来说,这种共享的能量状态比它们在没有外壳填充的情况下存在的能量状态要低。
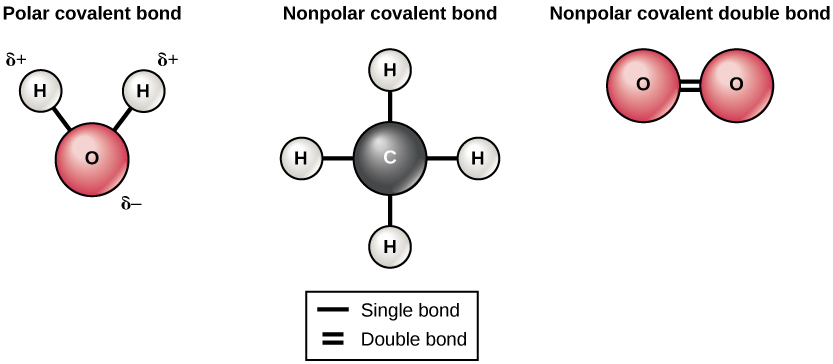
共价键有两种类型:极性和非极性。 非极性共价键在相同元素的两个原子之间或平等共享电子的不同元素之间形成。 例如,一个氧原子可以与另一个氧原子结合以填充其外壳。 这种关联是非极性的,因为电子将在每个氧原子之间平均分布。 两个氧原子之间形成两个共价键,因为氧气需要两个共享的电子才能填充其最外层的外壳。 氮原子将在两个氮原子之间形成三个共价键(也称为三共价),因为每个氮原子需要三个电子才能填充其最外壳。 在甲烷(CH 4)分子中发现了非极性共价键的另一个例子。 碳原子的最外壳中有四个电子,还需要四个电子才能填充它。 它从四个氢原子中获得这四个氢原子,每个原子提供一个。 这些元素平等共享电子,形成四个非极共价键(图\(\PageIndex{5}\))。
在极性共价键中,原子共享的电子在靠近一个原子核的时间比离另一个原子核更近的时间长。 由于不同原子核之间的电子分布不均匀,因此会产生略带正电荷(α+)或略为负(β—)的电荷。 水中氢原子和氧原子之间的共价键是极性共价键。 共享电子在氧核附近停留的时间比在氢核附近停留的时间要多,这会给这些分子带来很小的正电荷。
氢键
离子键和共价键是强键,需要大量能量才能断开。 但是,并非元素之间的所有键都是离子键或共价键。 也可能形成较弱的债券。 这些吸引力发生在正电荷和负电荷之间,不需要太多的能量就能消失。 经常出现的两个弱键是氢键和范德华相互作用。 这些键产生了水的独特特性以及DNA和蛋白质的独特结构。
当形成含有氢原子的极性共价键时,该键中的氢原子具有略带正电荷。 这是因为共享电子被更强地拉向另一个元素,远离氢核。 由于氢原子略为正 (α+),它会被邻近的负部分电荷 (β—) 吸引。 发生这种情况时,一个分子的氢原子的α+电荷与另一个分子的α—电荷之间会发生微弱的相互作用。 这种相互作用被称为氢键。 这种类型的键很常见;例如,水的液体性质是由水分子之间的氢键引起的(图\(\PageIndex{6}\))。 氢键赋予水维持生命的独特特性。 如果不是为了氢键,那么在室温下,水将是气体而不是液体。
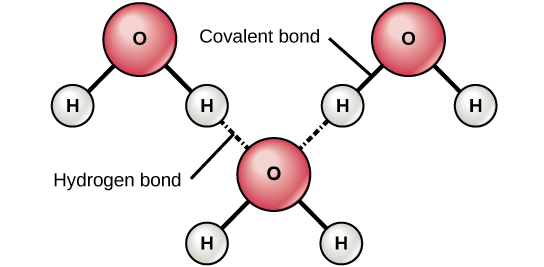
氢键可以在不同的分子之间形成,它们不一定总是包含水分子。 任何分子内极键中的氢原子都可以与其他相邻分子形成键。 例如,氢键将两条长的 DNA 链结合在一起,使 DNA 分子具有独特的双链结构。 氢键也是蛋白质某些三维结构的原因。
范德华互动
与氢键一样,范德华的相互作用是分子之间的弱吸引力或相互作用。 它们发生在不同分子中的极性、共价结合的原子之间。 其中一些弱吸引力是由电子在原子核周围移动时形成的暂时部分电荷引起的。 分子之间的这些微弱相互作用在生物系统中很重要。
职业发展:射线照相技术员
你或你认识的人有没有做过磁共振成像(MRI)扫描、乳房 X 光检查或 X 光检查? 这些测试使用摄入或注射到体内的无线电波或特殊同位素(放射性标记或荧光标记),生成软组织和器官(如核磁共振成像或乳房 X 光检查)或骨骼(如在 X 射线中发生的那样)的图像。 这些测试通过创建器官或骨骼系统的图像为疾病诊断提供数据。
核磁共振成像的工作原理是使软组织中水中丰富的氢核受到波动的磁场,从而使它们发射自己的磁场。 然后,机器中的传感器读取该信号,并由计算机解释以形成详细的图像。
一些射线照相技术人员和技术人员专门从事计算机断层扫描、核磁共振成像和乳房X光检查。 他们制作身体胶片或图像,帮助医疗专业人员检查和诊断。 放射科医生直接与患者合作,解释机器,为他们做好检查准备,并确保他们的身体或身体部位处于正确位置,以产生所需的图像。 然后,医生或放射科医生分析测试结果。
射线照相技术人员可以在医院、医生办公室或专业成像中心工作。 成为射线照相技术人员的培训是在提供射线照相证书、副学士学位或学士学位的医院、学院和大学进行的。
摘要
物质是任何占据空间并具有质量的东西。 它由不同元素的原子组成。 所有自然存在的92种元素都具有独特的特性,使它们能够以各种方式结合形成化合物或分子。 原子由质子、中子和电子组成,是保留该元素所有特性的元素的最小单位。 电子可以在原子之间捐赠或共享以产生键,包括离子键、共价键和氢键,以及范德华的相互作用。
艺术联系
图\(\PageIndex{2}\):(K)钾-39和钾-40分别有多少中子?
- 回答
-
钾-39 有二十个中子。 钾40有二十一个中子。
词汇表
- 阴离子
- 通过获得电子形成的负离子
- 原子数
- 原子中的质子数
- 阳离子
- 通过丢失电子形成的正离子
- 化学键
- 两个或多个相同或不同元素之间的相互作用,导致分子的形成
- 共价键
- 两个或多个相同或不同元素之间的一种强键;在元素之间共享电子时形成
- 电子
- 一种位于电子轨道原子核之外的带负电荷的粒子;缺乏功能质量且电荷为 —1
- 电子转移
- 电子从一个元素到另一个元素的移动
- 元素
- 118 种无法分解成较小物质并保留该物质的特性的独特物质之一;每种元素都有指定数量的质子和独特的特性
- 氢键
- 部分带正电荷的氢原子和部分带负电荷的元素或分子之间的弱键
- 离子
- 一种原子或化合物,它不包含相等数量的质子和电子,因此具有净电荷
- 离子键
- 在电荷相反的离子之间形成的化学键
- 同位素
- 一种或多种具有不同中子数的元素形式
- 质量数
- 原子中的质子数加上中子的数量
- 事情
- 任何有质量并占用空间的东西
- 中子
- 存在于原子核中的不带电荷的粒子;质量为 1
- 非极性共价键
- 一种共价键,当电子在原子之间平均共享时在原子之间形成,导致没有像极共价键那样具有部分电荷的区域
- 核
- (化学)由质子和(氢原子除外)中子组成的原子的密集中心
- 八位组规则
- 指出,原子序数低的元素的最外壳可以容纳八个电子
- 元素周期表
- 元素的组织结构图,表示每个元素的原子序数和质量数;还提供有关元素属性的关键信息
- 极性共价键
- 一种共价键,其中电子被拉向一个原子而远离另一个原子,从而在分子中产生略带正电荷和略带负电荷的区域
- 质子
- 存在于原子核中的带正电荷的粒子;质量为 1,电荷为 +1
- 放射性同位素
- 一种自发发射粒子或能量以形成更稳定元素的同位素
- 范德华互动
- 由带轻微带正电荷或带轻微负电荷的原子引起的分子之间的微弱吸引力或相互作用


