15.2:病原体如何导致疾病
- Page ID
- 200157
学习目标
- 分别总结科赫的假设和分子科赫的假设,并解释它们的重要性和局限性
- 用传染剂量和致死剂量解释致病性(毒性)的概念
- 区分原发病原体和机会性病原体,并找出每种病原体的具体例子
- 总结发病机制的各个阶段
- 解释出入口在疾病传播中的作用,并找出这些门户的具体例子
对于大多数传染病来说,准确识别致病病原体的能力是寻找或开出有效治疗方法的关键步骤。 今天的医生、患者和研究人员欠医生罗伯特·科赫(Robert Koch)(1843—1910 年)的巨额债务,他设计了一种系统的方法来确认疾病与特定病原体之间的病原关系。
科赫的假设
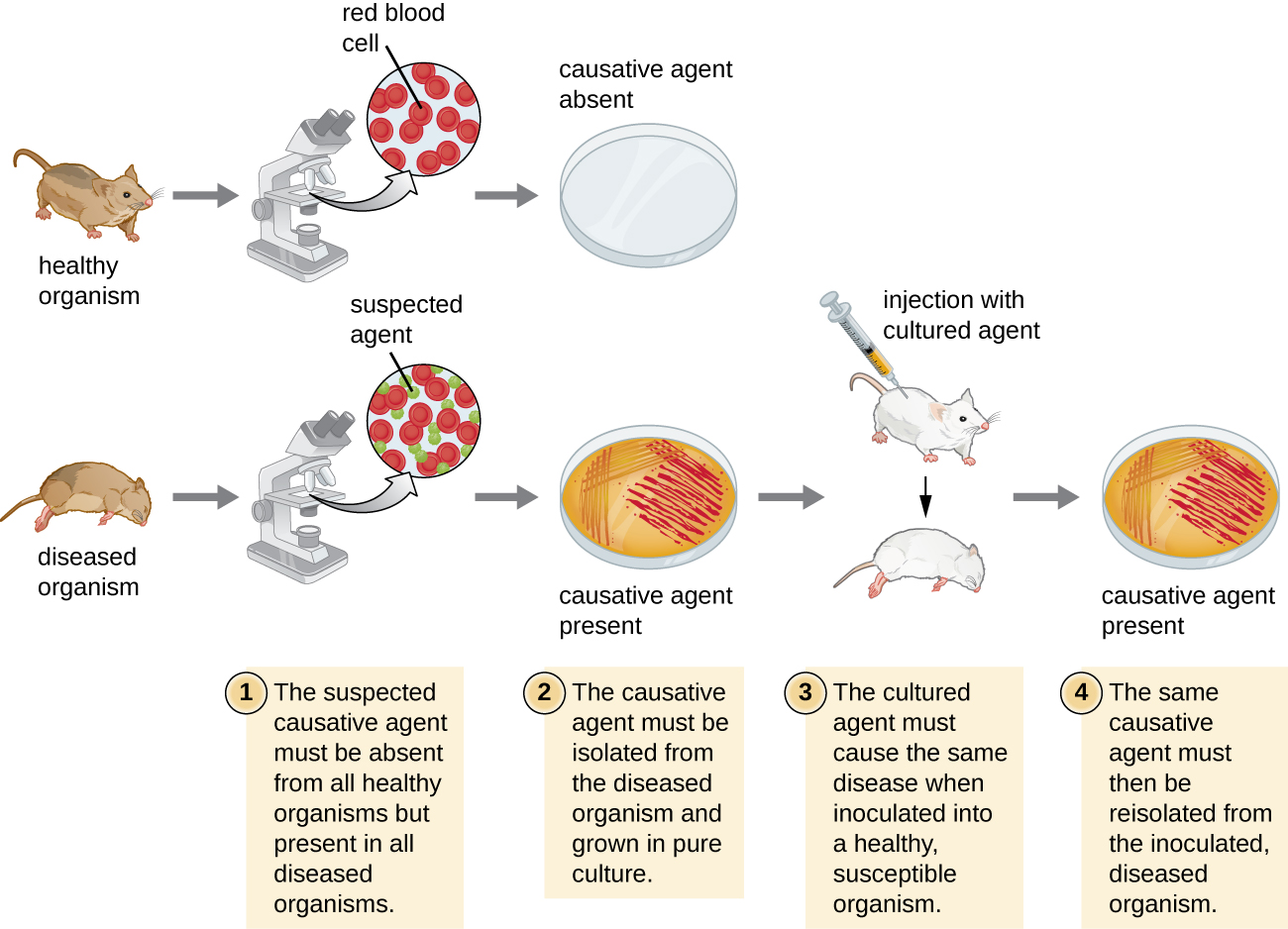
1884年,科赫发表了四项假设,总结了他确定特定微生物是否是特定疾病原因的方法。 科赫的每一项假设都代表了一个在疾病与病原体呈正联系之前必须满足的标准。 为了确定是否符合标准,对实验动物进行了测试,并比较了健康和患病动物的培养物(图\(\PageIndex{1}\))。
科赫的假设
- 在每种病例中都必须发现疑似病原体,而不能在健康人群中发现疑似病原体。
- 疑似病原体可以在纯培养物中分离和生长。
- 感染疑似病原体的健康检测对象必须出现与假设中相同的疾病体征和症状
- 病原体必须与新宿主重新分离,并且必须与假设 2 中的病原体相同。
在许多方面,科赫的假设仍然是我们目前对疾病原因的理解的核心。 但是,微生物学的进步揭示了科赫标准中的一些重要局限性。 科赫做出了几个假设,我们现在知道这些假设在许多情况下都是不真实的。 第一个与假设1有关,该假设假设病原体仅存在于患病而非健康个体中。 对于许多病原体来说,情况并非如此。 例如,幽门螺杆菌在本章前面被描述为一种引起慢性胃炎的病原体,也是许多从未患过胃炎的健康人体胃中正常微生物群的一部分。 据估计,超过50%的人口在生命的早期就感染了幽门螺杆菌,其中大多数人将其作为正常微生物群的一部分在余生中从未患上过疾病。
科赫的第二个错误假设是,所有健康的测试对象都同样容易患病。 我们现在知道个人对疾病的敏感性并不相同。 在任何给定时间,个体在微生物群和免疫系统状态方面都是独一无二的。 常住微生物群的构成会影响个人对感染的敏感性。 正常微生物群的成员通过抑制短暂性病原体的生长,在免疫中起着重要作用。 在某些情况下,微生物群可能会阻止病原体产生感染;在其他情况下,它可能无法完全预防感染,但可能会影响体征和症状的严重程度或类型。 因此,两个患有相同疾病的人可能并不总是表现出相同的体征和症状。 此外,有些人的免疫系统比其他人强。 免疫系统因年龄而减弱或患有不相关疾病的人比具有强大免疫系统的人更容易受到某些感染。
科赫还假设所有病原体都是可以在纯培养物中生长的微生物(假设2),动物可以作为人类疾病的可靠模型。 但是,我们现在知道,并非所有病原体都可以在纯培养物中生长,许多人类疾病无法在动物宿主中可靠地复制。 病毒和某些细菌,包括立克次体和衣原体,是专有的细胞内病原体,只有在宿主细胞内才能生长。 如果无法培养微生物,研究人员就无法超越假设 2。 同样,如果没有合适的非人类宿主,研究人员如果不故意感染人类,就无法评估假设2,这会带来明显的伦理问题。 艾滋病就是这种疾病的一个例子,因为人类免疫缺陷病毒(HIV)只会导致人类疾病。
练习\(\PageIndex{1}\)
简要总结一下科赫假设的局限性。
分子科赫的假设
1988年,斯坦利·法尔科(1934—)提出了科赫假设的修订形式,即科赫分子假设。 这些列在表的左栏中\(\PageIndex{1}\)。 科赫分子假设的前提不是分离特定病原体的能力,而是识别可能导致该生物致病的基因。
法尔科对科赫最初假设的修改不仅解释了由细胞内病原体引起的感染,还解释了通常是非致病性的致病生物菌株的存在。 例如,大肠杆菌的主要形式是人体肠道正常微生物群的成员,通常被认为是无害的。 但是,也有大肠杆菌的致病菌株,例如产生肠毒素的大肠杆菌(ETEC)和肠出血性大肠杆菌(O157:H7)(EHEC)。 我们现在知道ETEC和EHEC之所以存在,是因为曾经无害的大肠杆菌获得了新基因,而大肠杆菌以这些致病菌株的形式现在能够产生毒素并导致疾病。 致病形式是由微小的遗传变化引起的。 表的右栏\(\PageIndex{1}\)说明了如何应用分子科赫的假设来鉴定 EHEC 为致病细菌。
| 分子科赫的假设 | 向 EHEC 申请 |
|---|---|
| (1) 表型(疾病的体征或症状)应仅与物种的致病菌株相关。 | EHEC 会引起肠道炎症和腹泻,而非致病性大肠杆菌菌则不会。 |
| (2) 失活与致病性相关的可疑基因应导致可衡量的致病性丧失。 | EHEC 中的一个基因编码志贺毒素,这是一种抑制蛋白质合成的细菌毒素(毒药)。 使该基因失活会降低细菌引起疾病的能力。 |
| (3)非活性基因的逆转应恢复疾病表型。 | 通过将编码毒素的基因重新添加到基因组中(例如,使用噬菌体或质粒),EHEC 引起疾病的能力得以恢复。 |
与科赫最初的假设一样,分子科赫的假设也有局限性。 例如,使用目前的分子遗传学方法无法对某些病原体进行基因操纵。 同样,有些疾病没有合适的动物模型,这限制了原始假设和分子假设的效用。
练习\(\PageIndex{2}\)
解释科赫最初的假设与科赫分子假设之间的区别。
致病性和毒性
微生物菌剂引起疾病的能力称为致病性,生物体的致病程度称为毒性。 毒力是一个连续体。 光谱的一端是无毒(无害)的生物,另一端是毒性很强的生物。 高毒性病原体在引入人体后几乎总是会导致疾病状态,有些甚至可能导致健康个体的多器官和身体系统衰竭。 毒性较低的病原体可能导致初次感染,但不一定会导致严重疾病。 毒力低的病原体更有可能导致轻微的疾病体征和症状,例如低烧、头痛或肌肉酸痛。 有些人甚至可能没有症状。
高毒性微生物的一个例子是炭疽杆菌,它是造成炭疽的病原体。 炭疽杆菌可产生不同形式的疾病,具体取决于传播途径(例如皮肤注射、吸入、摄入)。 最严重的炭疽是吸入性炭疽病。 吸入炭疽杆菌孢子后,它们就会发芽。 出现活性感染,细菌会释放出强效毒素,从而导致水肿(组织中积液)、缺氧(一种阻止氧气进入组织的疾病)和坏死(细胞死亡和炎症)。 吸入炭疽的体征和症状包括高烧、呼吸困难、呕吐和咳血,以及提示心脏病发作的严重胸痛。 吸入炭疽后,毒素和细菌进入血液,这可能导致患者多器官衰竭和死亡。 如果参与发病机制的一个或多个基因(或多个)失活,则细菌的毒性或非致病性就会降低。
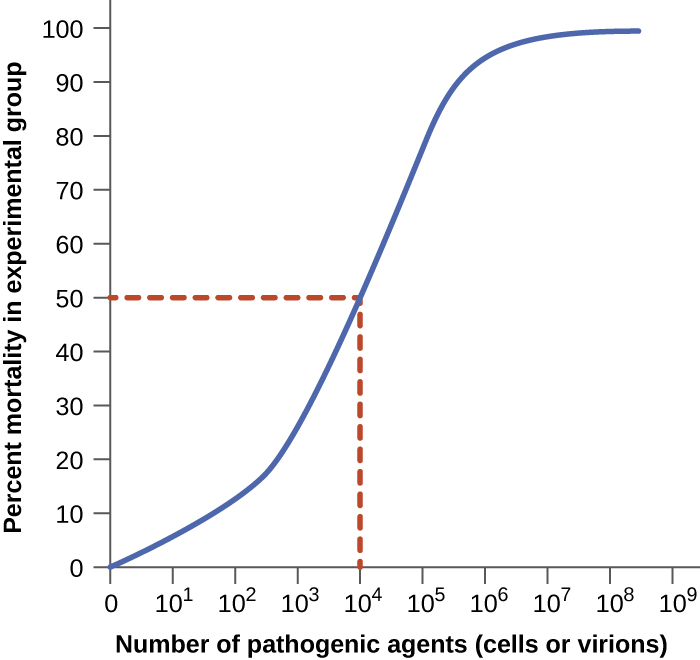
可以使用实验动物的对照实验来量化病原体的毒力。 毒力的两个重要指标是传染剂量中位数(ID 50)和中位致死剂量(LD 50),两者通常都是使用动物模型通过实验确定的。 ID 50 是在 50% 的接种动物中引起主动感染所需的病原体细胞或病毒体的数量。 LD 50 是杀死 50% 受感染动物所需的致病细胞、病毒体或毒素量。 为了计算这些值,每组动物都要接种一系列已知数量的病原体细胞或病毒体中的一种。 在图中所示的图表中\(\PageIndex{2}\),被感染(ID 50)或死亡(LD 50)的动物的百分比是根据接种的病原体浓度绘制的。 \(\PageIndex{2}\)该图代表了从测量病原体 LD 50 的假设实验中得出的数据。 对这张图中数据的解释表明,试验动物的病原体的 LD 50 是 10 4 个病原体细胞或病毒体(取决于所研究的病原体)。
表中\(\PageIndex{2}\)列出了选定的食源性病原体及其在人类中的ID 50 值(根据流行病学数据和对人类志愿者的研究确定)。 请记住,这些是中位值。 个体的实际感染剂量可能有很大差异,这取决于入境途径;宿主的年龄、健康和免疫状态;以及环境和病原体特异性因素,例如对胃酸性 pH 值的敏感性。 同样重要的是要注意,病原体的感染剂量不一定与疾病严重程度相关。 例如,只有一个肠道沙门氏菌血清型鼠伤寒细胞就能导致活动性感染。 由此产生的疾病,即沙门氏菌胃肠炎或沙门氏菌病,可引起恶心、呕吐和腹泻,但健康成年人的死亡率低于1%。 相比之下,伤寒杆菌血清型的ID 50 要高得多,通常需要多达1,000个细胞才能产生感染。 但是,这种血清型会导致伤寒,伤寒是一种更具系统性和更严重的疾病,在未经治疗的人中,其死亡率高达10%。
| 病原体 | ID 50 |
|---|---|
| 病毒 | |
| 甲型肝炎病毒 | 10—100 |
| 诺如病毒 | 1—10 |
| 轮状病毒 | 10—100 |
| 细菌 | |
| 大肠埃希氏菌,肠出血(EHEC,血清型 O157) | 10—100 |
| 肠侵入性大肠杆菌 (EIEC) | 200—5,000 |
| 肠致病性大肠杆菌(EPEC) | 10,000,000—10,000,000,000,000 |
| 大肠杆菌,产肠毒素(ETEC) | 10,000,000—10,000,000,000,000 |
| 肠道沙门氏菌 serovar Typhi | <1,000> |
| S. enterica serovar Typhimurium | ≥ 1 |
| 志贺氏痢疾 | 10—200 |
| 霍乱弧菌(血清型 O139、O1) | 1,000,000 |
| V. parahemolyticus | 100,000,000 |
| 原生动物 | |
| 蓝氏贾第鞭毛虫 | 1 |
| 隐孢子虫 parvum | 10—100 |
练习\(\PageIndex{3}\)
- 病原体的感染剂量和致死剂量有什么区别?
- 哪个与疾病的严重程度关系更密切?
主要病原体与机会性病原体
病原体可以分为主要病原体或机会性病原体。 无论宿主的常驻微生物群或免疫系统如何,原发病原体都可能导致宿主疾病。 相比之下,机会主义病原体只有在损害宿主防御能力的情况下才能导致疾病,例如人体的保护屏障、免疫系统或正常微生物群。 易受机会性感染的人包括年幼的人、老年人、孕妇、正在接受化疗的患者、免疫缺陷患者(例如获得性免疫缺陷综合症 [AIDS])、正在从手术中康复的患者以及有缺陷的患者防护屏障(例如严重伤口或烧伤)。
原发病原体的一个例子是肠出血性大肠杆菌(EHEC),它会产生一种称为志贺毒素的毒性因子。 这种毒素抑制蛋白质合成,导致严重的血性腹泻、炎症和肾功能衰竭,即使在免疫系统健康的患者中也是如此。 另一方面,表皮葡萄球菌是一种机会主义病原体,是医院疾病的最常见原因之一。 2 S. epidermidis 是皮肤正常微生物群的成员,通常具有无毒性。 但是,在医院中,它也可以在生物膜中生长,这些生物膜在外科手术期间插入体内的导管、植入物或其他设备上形成。 一旦进入体内,表皮梭菌会引起严重的感染,例如心内膜炎,并产生毒性因子,促进此类感染的持续存在。
在某些情况下,正常微生物群的其他成员也可能导致机会性感染。 当无害地生活在一个身体部位的微生物最终进入另一个身体系统并导致疾病时,通常会发生这种情况。 例如,通常存在于大肠中的大肠杆菌如果进入膀胱,可能会导致尿路感染。 这是女性尿路感染的主要原因。
当人体环境的变化导致特定微生物的过度生长时,正常微生物群的成员也可能导致疾病。 例如,酵母念珠菌是皮肤、口腔、肠道和阴道正常微生物群的一部分,但其种群受到其他微生物群的控制。 但是,如果一个人正在服用抗菌药物,通常会抑制念珠菌生长的细菌可以被杀死,从而导致念珠菌数量的突然增加,而念珠菌是一种真菌,因此不受抗菌药物的影响。 念珠菌的过度生长可表现为口腔鹅口疮(口腔、喉咙和舌头生长)、阴道酵母菌感染或皮肤念珠菌病。 其他情况也可能为念珠菌感染提供机会。 未经治疗的糖尿病会导致唾液中高浓度的葡萄糖,这为念珠菌的生长提供了最佳环境,从而导致鹅口疮。 免疫缺陷,例如在艾滋病毒、艾滋病和癌症患者中看到的免疫缺陷也会导致鹅口疮的发病率更高。 阴道酵母菌感染可能是由于月经或更年期雌激素水平下降引起的。 阴道内乳酸杆菌可获得的糖原量受雌激素水平控制;当雌激素水平较低时,乳酸杆菌产生的乳酸较少。 由此产生的阴道 pH 值的增加会导致念珠菌在阴道中过度生长。
练习\(\PageIndex{4}\)
- 解释原发病原体和机会主义病原体之间的区别。
- 描述一些可能发生机会性感染的情况。
发病机理的各个阶段
要引起疾病,病原体必须成功达到发病机制的四个步骤或阶段:暴露(接触)、粘附(定植)、入侵和感染。 病原体必须能够进入宿主,传播到可以确立感染的地方,逃避或克服宿主的免疫反应,并对宿主造成损害(即疾病)。 在许多情况下,当病原体离开宿主并传播给新宿主时,循环就完成了。
曝光
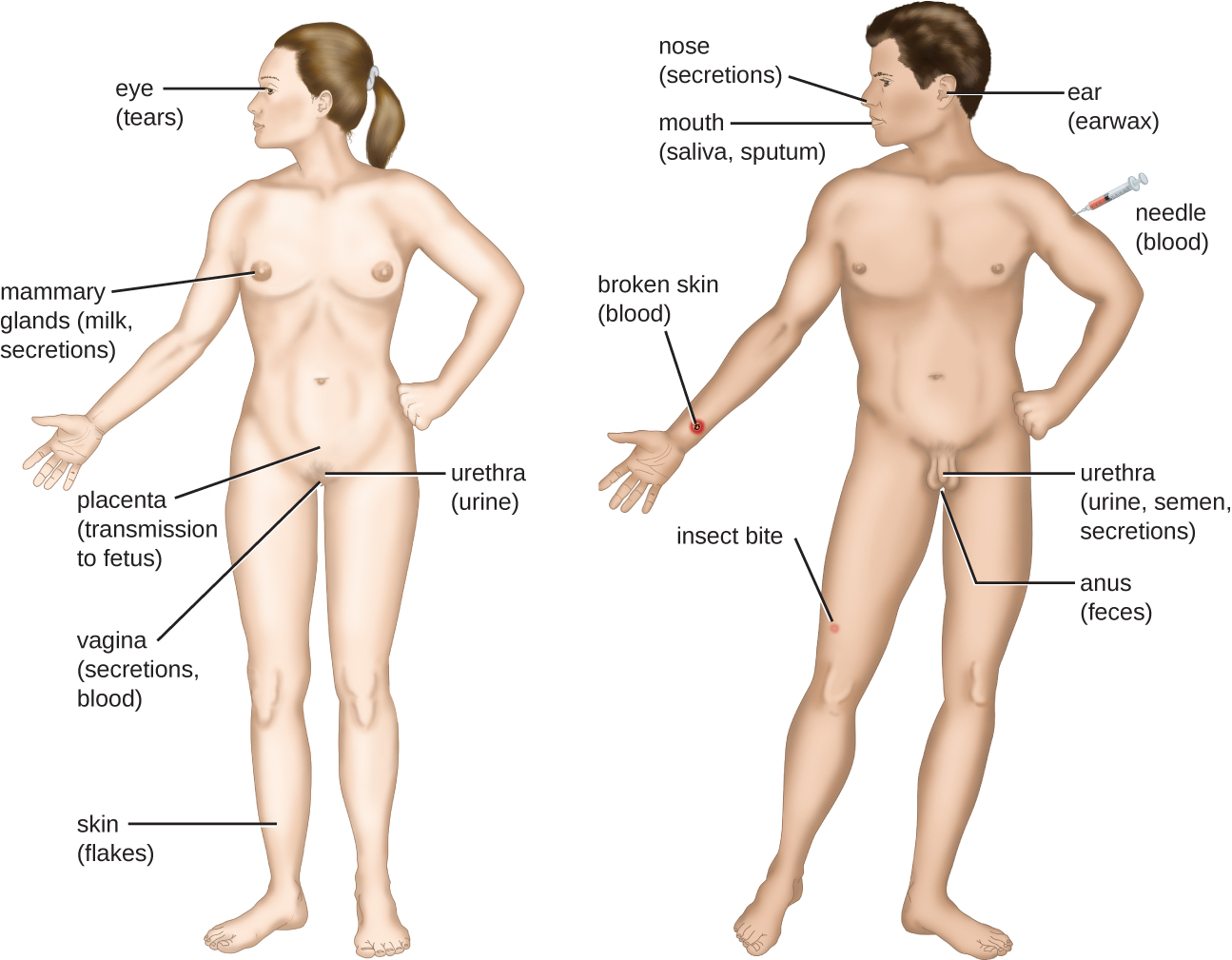
与潜在病原体的接触被称为暴露或接触。 我们吃的食物和我们处理的物体都是我们接触潜在病原体的方式。 但是,并非所有接触都会导致感染和疾病。 要使病原体引起疾病,它需要能够进入宿主组织。 病原体可以进入宿主组织的解剖部位被称为入口入口。 这些是宿主细胞与外部环境直接接触的位置。 图\(\PageIndex{3}\)中标出了主要的入口入口,包括皮肤、粘膜和肠外通道。
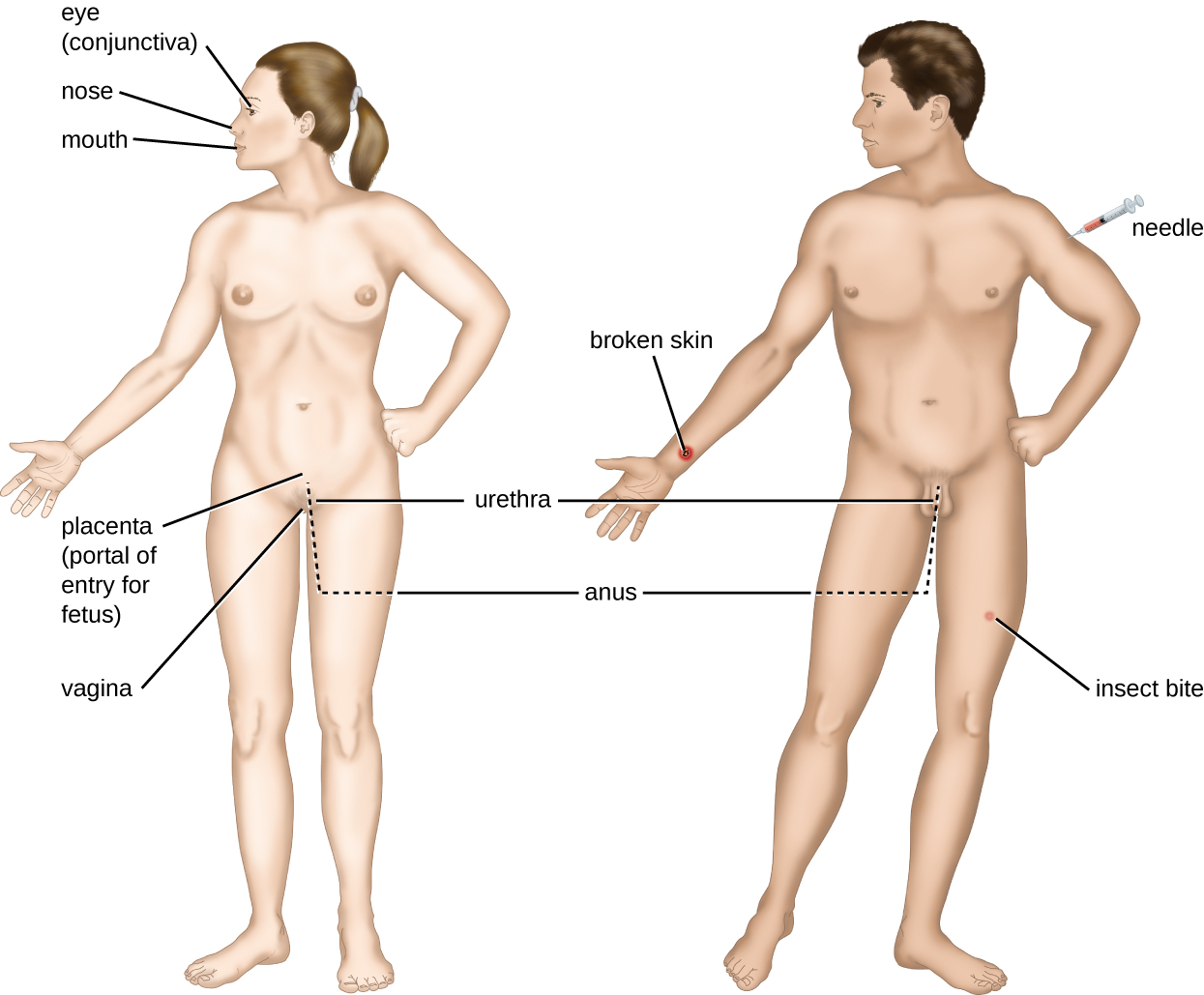
粘膜表面是微生物最重要的进入门户;这些微生物包括呼吸道、胃肠道和泌尿生殖道的粘膜。 尽管大多数粘膜表面位于身体内部,但有些粘膜与身体各个开口处的外部皮肤相邻,包括眼睛、鼻子、嘴巴、尿道和肛门。
大多数病原体适用于特定的入口。 病原体的门户特异性由生物体的环境适应及其分泌的酶和毒素决定。 呼吸道和胃肠道是特别脆弱的进入门户,因为含有微生物的颗粒分别被不断吸入或摄入。
病原体也可以通过皮肤和粘膜保护屏障的突破进入。 据说以这种方式进入人体的病原体是通过肠外途径进入的。 例如,皮肤是抵御病原体的良好天然屏障,但皮肤破裂(例如伤口、昆虫叮咬、动物咬伤、针刺伤)可以为微生物提供肠外入口。
在孕妇中,胎盘通常会阻止微生物从母亲传给胎儿。 但是,一些病原体能够穿过血胎盘屏障。 导致食源性疾病李斯特菌病的革兰氏阳性细菌单核细胞增生李斯特菌就是一个例子,它对胎儿构成严重风险,有时可能导致自然流产。 其他可以通过胎盘屏障感染胎儿的病原体统称为首字母缩略词 TORCH(表\(\PageIndex{3}\))。
当婴儿通过产道出生时,母婴传染病也是一个令人担忧的问题。 母亲患有活性衣原体或淋病感染的婴儿可能会接触到阴道中的致病性病原体,这可能导致眼部感染,从而导致失明。 为了防止这种情况,标准做法是在婴儿出生后不久给眼睛滴抗生素。
| 疾病 | 病原体 | |
|---|---|---|
| T | 弓形虫病 | 弓形虫(原生动物) |
| O 3 |
梅毒 水痘 乙型肝炎 艾滋病毒 第五种疾病(传染性红斑) |
梅毒@@ 螺旋体(细菌) 水痘带状疱疹病毒(人类疱疹病毒 3) 乙型肝炎病毒(肝炎病毒) 逆转录病毒 Parvovirus B19 |
| R | 风疹(德国麻疹) | Togavirus |
| C | 巨细胞病毒 | 人类疱疹病毒 5 |
| H | 疱疹 | 单纯疱疹病毒 (HSV) 1 和 2 |
临床重点:第 2 部分
在诊所,一位医生记录了迈克尔的病史,询问了他过去一周的活动和饮食情况。 在得知迈克尔在聚会结束后的第二天生病后,医生下令进行血液检查,以检查是否有与食源性疾病相关的病原体。 在测试证实迈克尔的血液中存在革兰氏阳性棒之后,他被注射了广谱抗生素,然后被送往附近的医院,在那里他作为病人住院。 他将在那里接受额外的静脉注射抗生素治疗和液体。
练习\(\PageIndex{5}\)
- 迈克尔血液中的这种细菌是正常微生物群的一部分吗?
- 细菌使用了哪个入口来引起这种感染?
附着力
初次接触后,病原体会粘附在入口处。 粘附一词是指致病微生物利用粘附因子附着在人体细胞上的能力,不同的病原体使用不同的机制粘附在宿主组织的细胞上。
称为粘附素的分子(蛋白质或碳水化合物)存在于某些病原体的表面,并与宿主细胞上的特定受体(糖蛋白)结合。 粘附素存在于细菌的纤维和鞭毛、原生动物的纤毛以及病毒的衣壳或膜上。 原生动物也可以使用钩子和倒钩进行粘附;病毒上的刺蛋白还可以增强病毒的粘附力。 糖酵素(粘液层和胶囊)(图\(\PageIndex{4}\))的产生具有高糖和蛋白质含量,也可以使某些细菌病原体附着在细胞上。
生物膜的生长也可以作为粘附因子。 生物膜是产生糖萼的细菌群落,称为外聚物质(EPS),允许生物膜附着在表面上。 持续的铜绿假单胞菌感染在患有囊性纤维化、烧伤和中耳感染(中耳炎)的患者中很常见,因为铜绿假单胞菌会产生生物膜。 EPS 允许细菌粘附在宿主细胞上,使宿主更难物理去除病原体。 EPS 不仅允许附着,还可以保护免疫系统和抗生素治疗,防止抗生素进入生物膜内的细菌细胞。 此外,并非生物膜中的所有细菌都在快速生长;有些细菌处于静止阶段。 由于抗生素对快速生长的细菌最有效,因此生物膜中的部分细菌可以免受抗生素的侵害。 4
入侵
一旦粘附成功,入侵就可以继续。 入侵涉及病原体在局部组织或人体中传播。 病原体可能产生外酶或毒素,这些外酶或毒素是毒性因子,当它们扩散到体内深处时,它们能够定植和破坏宿主组织。 病原体还可能产生毒性因子,保护它们免受免疫系统防御的侵害。 病原体的特定毒力因子决定所发生的组织损伤程度。 该图\(\PageIndex{5}\)显示幽门螺杆菌侵入胃组织,在进展过程中造成损害。
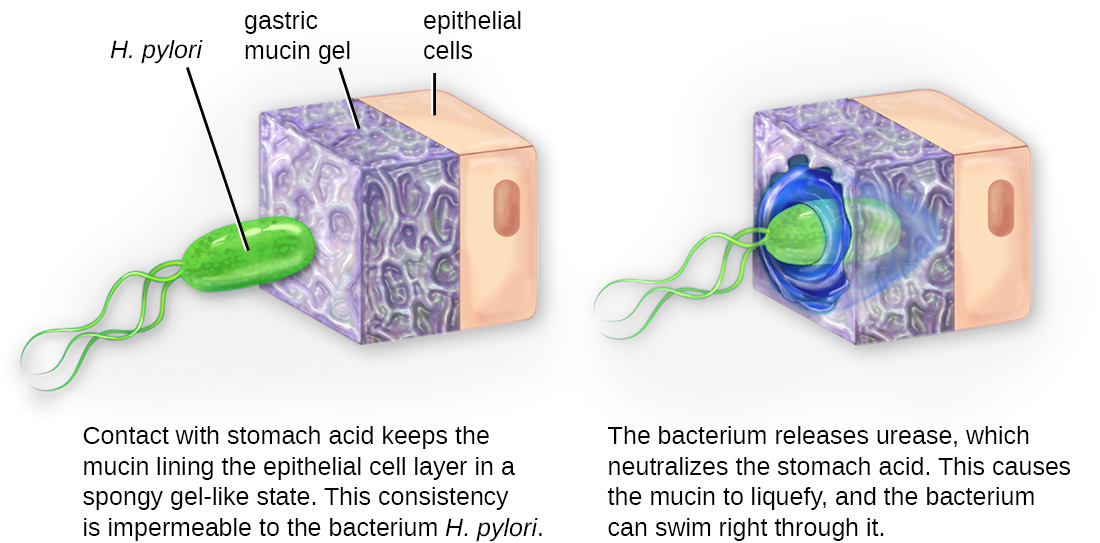
细胞内病原体通过进入宿主的细胞并繁殖来实现入侵。 有些是专性的细胞内病原体(这意味着它们只能在宿主细胞内部繁殖),而另一些则是兼性细胞内病原体(这意味着它们可以在宿主细胞内部或外部繁殖)。 通过进入宿主细胞,细胞内病原体能够逃避免疫系统的某些机制,同时还可以利用宿主细胞中的营养。
可通过内吞作用进入细胞。 对于大多数类型的宿主细胞,病原体使用两种不同的内吞作用和进入机制之一。 一种机制依赖于病原体分泌的效应蛋白;这些效应蛋白触发进入宿主细胞。 这是沙门氏菌和志贺氏菌在侵入肠道上皮细胞时使用的方法。 当这些病原体与肠道中的上皮细胞接触时,它们会分泌效应分子,从而导致膜褶边突出,从而将细菌细胞带入。 这个过程被称为膜褶皱。 第二种机制依赖于在病原体上表达的表面蛋白,这些蛋白与宿主细胞上的受体结合,从而进入。 例如,假结核耶尔森氏菌会产生一种称为侵入素的表面蛋白,它与宿主细胞表面表达的 beta-1 整合素结合。
一些宿主细胞,例如白细胞和免疫系统的其他吞噬细胞,在称为吞噬作用的过程中主动内分泌糖病原体。 尽管吞噬作用允许病原体进入宿主细胞,但在大多数情况下,宿主细胞使用消化酶杀死和降解病原体。 通常,当病原体被吞噬细胞摄入时,它会被封闭在细胞质中的吞噬体内;吞噬体与溶酶体融合形成吞噬体,消化酶在其中杀死病原体(参见病原体识别和吞噬作用)。 但是,一些细胞内病原体具有在吞噬细胞中存活和繁殖的能力。 例子包括单核细胞增生李斯特菌和志贺氏菌;这些细菌产生的蛋白质在吞噬体与溶酶体融合之前将其裂解,从而使细菌能够逃离到吞噬细胞的细胞质中,在那里它们可以繁殖。 结核分枝杆菌、嗜肺军团菌和沙门氏菌等细菌使用略有不同的机制来逃避被吞噬细胞消化。 这些细菌阻止吞噬体与溶酶体的融合,从而保持活力并在吞噬体内分裂。
感染
入侵后,病原体的成功繁殖会导致感染。 根据感染的程度,可以将感染描述为局部感染、局灶性感染或全身性感染。 局部感染仅限于身体的一小部分区域,通常位于入口门附近。 例如,被金黄色葡萄球菌感染的毛囊可能会导致感染部位周围沸腾,但细菌主要控制在这个狭小的地方。 涉及更广泛组织受累的局部感染的其他例子包括局限于膀胱的尿路感染或局限于肺部的肺炎。
在局灶感染中,局部病原体或其产生的毒素可以扩散到次要部位。 例如,牙科保健员用锋利的工具在牙龈上划伤可能会导致正常口腔微生物群的链球菌在牙龈中局部感染。 然后,这些链球菌属可能会进入血液并进入体内其他部位,从而导致继发感染。
当感染传播到全身时,我们称之为全身感染。 例如,水痘带状疱疹病毒的感染通常通过上呼吸系统的粘膜进入。 然后它扩散到全身,导致与水痘相关的典型红皮损伤。 由于这些病变不是初始感染部位,因此它们是全身感染的征兆。
有时,原发感染,即由一种病原体引起的初始感染,可能导致另一种病原体的继发感染。 例如,原发感染艾滋病毒的患者的免疫系统受到损害,使患者更容易感染继发性疾病,例如口腔鹅口疮和其他由机会性病原体引起的疾病。 同样,流感病毒的原发感染会损害和降低肺部的防御机制,使患者更容易感染流感嗜血杆菌或肺炎链球菌等细菌病原体的继发性肺炎。 一些继发感染甚至可能是由于原发感染的治疗而发生的。 针对原发病原体的抗生素治疗可能对正常微生物群造成附带损害,从而为机会性病原体创造机会(参见下文案例:继发酵母菌感染)。
继发酵母菌感染
安妮塔是一位36岁的三个孩子的母亲,她去急诊中心抱怨骨盆压力、尿频和疼痛、腹部绞痛以及偶尔有血迹斑的尿液。 怀疑患有尿路感染(UTI),医生要求提供尿液样本并将其送往实验室进行尿液分析。 由于大约需要24小时才能获得培养结果,因此医生立即开始安妮塔服用抗生素环丙沙星。 第二天,微生物实验室确认安妮塔的尿液中存在大肠杆菌,这与推定诊断一致。 但是,抗微生物药物敏感性测试表明,环丙沙星不能有效治疗安妮塔的尿路感染,因此医生开了另一种抗生素处方。
服用抗生素一周后,安妮塔回到诊所抱怨处方不起作用。 尽管排尿疼痛已经消退,但她现在出现阴道瘙痒、灼热和分泌物。 经过简短的检查,医生向安妮塔解释说,抗生素很可能成功地杀死了导致她尿路感染的大肠杆菌;但是,在此过程中,它们还消灭了安妮塔正常微生物群中的许多 “好” 细菌。 安妮塔报告的新症状与白色念珠菌的继发酵母菌感染一致,白色念珠菌是一种机会性真菌,通常存在于阴道中,但受到通常生活在同一环境中的细菌的抑制。
为了确认这一诊断,从分泌物中制备直接阴道涂片的显微镜载玻片,以检查是否存在酵母菌。 这张幻灯片附有分泌物样本前往微生物实验室,以确定导致阴道炎的酵母数量是否有所增加。 在微生物实验室确认诊断后,医生为安妮塔开了一种抗真菌药物,用于消除她的继发酵母菌感染。
练习\(\PageIndex{6}\)
- 为什么念珠菌不能被为尿路感染开的抗生素杀死?
- 列出可能导致继发感染的三种情况。
疾病的传播
要使病原体持续存在,它必须处于传播给新宿主的位置,让受感染的宿主通过出口入口(图\(\PageIndex{6}\))。 与入口一样,许多病原体适应于使用特定的出口入口。 与入口类似,最常见的出口门包括皮肤和呼吸道、泌尿生殖道和胃肠道。 咳嗽和打喷嚏可以将病原体排出呼吸道。 一次打喷嚏就能将成千上万的病毒颗粒送入空中。 分泌物和排泄物可以将病原体运出其他出口。 粪便、尿液、精液、阴道分泌物、眼泪、汗水和脱落的皮肤细胞都可以作为病原体离开体内的载体。 依赖昆虫媒介传播的病原体通过叮咬昆虫提取的血液离开人体。 同样,一些病原体通过针头提取的血液排出人体。
关键概念和摘要
- 科赫的假设用于确定特定微生物是否为病原体。 分子科赫的假设用于确定哪些基因有助于病原体引起疾病的能力。
- 毒力,即病原体可能导致疾病的程度,可以通过计算给定人群中病原体的 ID 50 或 LD 50 来量化。
- 原发病原体能够在健康个体中引起与疾病相关的病理变化,而机会性病原体只有在个体因保护屏障破裂或免疫抑制而受到损害时才会导致疾病。
- 感染和疾病可能由环境中的病原体或个人常驻微生物群中的微生物引起。
- 根据病原体在体内的传播程度,可以将感染分为局部感染、局灶性感染或全身性感染。
- 继发感染有时会在宿主的防御能力或正常微生物群因原发感染或抗生素治疗而受到损害后发生。
- 病原体通过入口进入人体,然后通过出口门离开。 发病阶段包括暴露、粘连、侵袭、感染和传播。


