14.5:测试抗微生物药物的有效性
- Page ID
- 200551
学习目标
- 解释耐药性的概念
- 描述微生物是如何产生或获得耐药性的
- 描述抗微生物药物耐药的不同机制
抗微生物药物耐药性并不是一个新现象。 在自然界中,微生物不断进化,以克服其他微生物产生的抗微生物化合物。 人类开发抗微生物药物及其在临床上的广泛使用只是提供了另一种促进进一步进化的选择性压力。 几个重要因素可以加速耐药性的演变。 其中包括过度使用和滥用抗微生物药物、不当使用抗微生物药物、亚疗剂量以及患者不遵守推荐疗程。
病原体暴露于抗微生物化合物可以选择产生耐药性的染色体突变,这些突变可以垂直转移到随后的微生物世代,最终在反复接触抗微生物的微生物群体中占主导地位。 或者,在质粒或转座子中发现了许多导致耐药性的基因,这些基因可以通过水平基因转移在微生物之间轻松转移(参见无性原核生物如何实现遗传多样性)。 转座子还有能力在质粒和染色体之间移动抗性基因,以进一步促进耐药性的传播。
耐药机制
有几种常见的耐药机制,如图所示\(\PageIndex{1}\)。 这些机制包括药物的酶改造、抗微生物靶标的修饰以及防止药物渗透或积累。
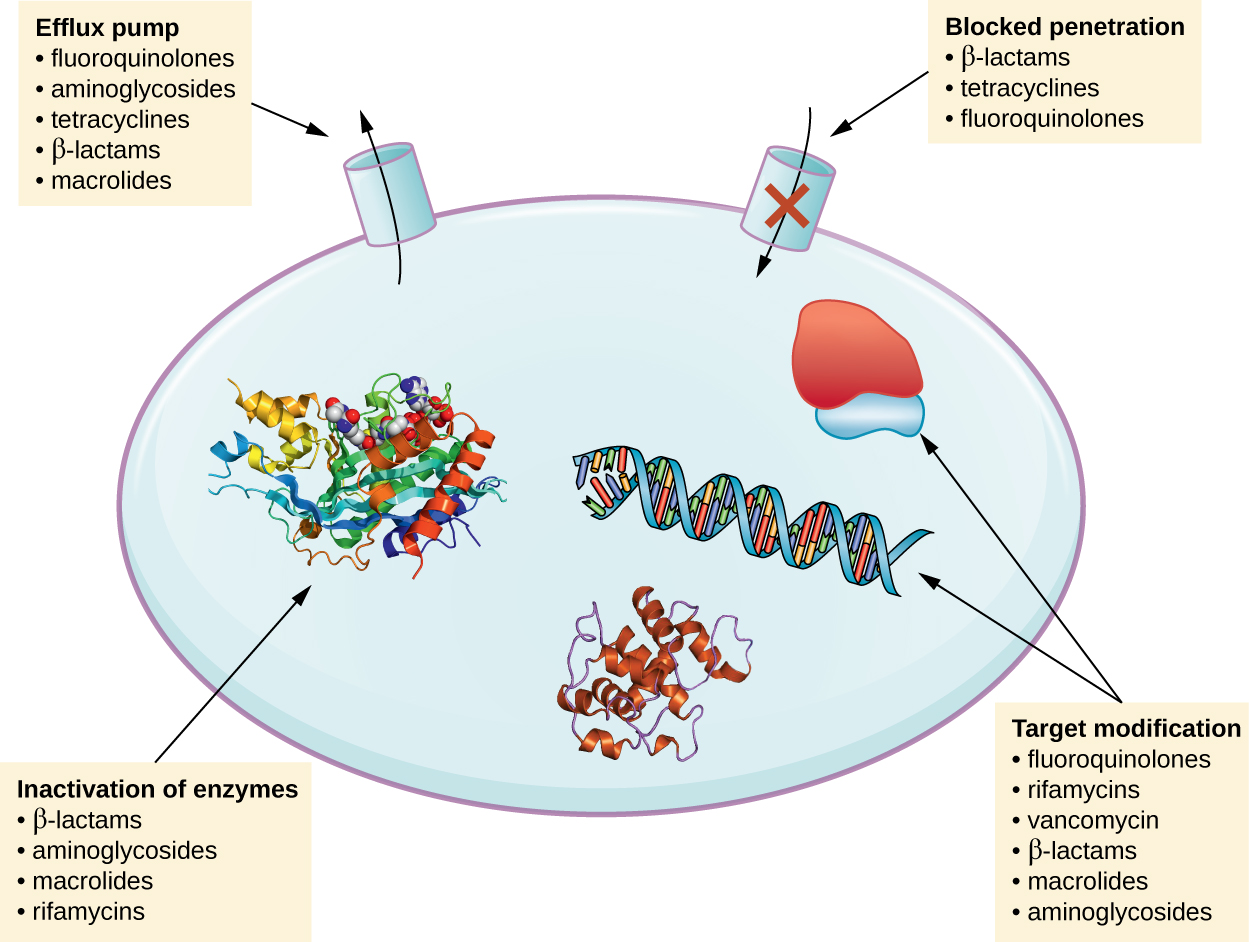
药物改性或灭活
耐药基因可能编码对抗微生物进行化学修饰的酶,从而使其失活,或者通过水解破坏抗微生物药物。 对多种抗微生物药物的耐药性是通过这种机制发生的。 例如,氨基糖苷类耐药性可以通过将化学基团转移到药物分子中而发生,从而损害药物与其细菌靶标的结合。 对于 β-内酰胺,细菌耐药性可能涉及药物分子β-内酰胺环内β-内酰胺键的酶解作用。 一旦β-内酰胺键破裂,该药物就会失去其抗菌活性。 这种耐药机制由β-内酰胺酶介导,β-内酰胺酶是β-内酰胺耐药的最常见机制。 利福平的失活通常是通过糖基化、磷酸化或二磷酸腺苷(ADP)核糖基化发生的,对大环内酯类和林可酰胺的耐药性也可能由于药物的酶失活或改性而发生。
防止细胞吸收或外流
微生物可能会产生耐药机制,包括抑制抗微生物药物的积累,从而阻止该药物达到其细胞靶标。 这种策略在革兰氏阴性病原体中很常见,可能涉及外膜脂质成分、孔蛋白通道选择性和/或孔蛋白通道浓度的变化。 例如,铜绿假单胞菌耐碳青霉烯的一个常见机制是减少其 OprD porin 的含量,OprD porin 是碳青霉烯类通过该病原体外膜的主要入口。 此外,许多革兰氏阳性和革兰氏阴性致病细菌会产生外流泵,这些泵会主动将抗微生物药物运出细胞,防止药物积累到抗菌水平。 例如,对β-内酰胺、四环素和氟喹诺酮类药物的耐药性通常是通过主动外流出细胞而发生的,单个外流泵能够转移多种类型的抗微生物药物的情况相当常见。
目标修改
由于抗微生物药物具有非常具体的靶标,因此对这些靶标的结构变化可以阻止药物结合,从而使药物失效。 通过编码抗菌药物靶点的基因的自发突变,细菌具有进化优势,使它们能够对药物产生耐药性。 这种抗性发展机制很常见。 影响青霉素结合蛋白(PBP)活性位点的遗传变化可以抑制β-内酰胺药物的结合,并对此类中的多种药物提供耐药性。 这种机制在肺炎链球菌菌株中非常常见,这些菌株通过遗传机制改变自身的多溴联苯酚。 相比之下,金黄色葡萄球菌菌株通过获取新的低亲和力 PBP 而产生对甲氧西林(MRSA)的耐药性,而不是在结构上改变其现有的 PBP。 这种新的低亲和力 PBP 不仅具有对甲氧西林的耐药性,而且对几乎所有 β-内酰胺药物都具有耐药性,但专为杀死 MRSA 而设计的新型第五代头孢菌素除外。 这种阻力策略的其他例子包括以下方面的改变
- 核糖体亚单位,对大环内酯类,四环素类和氨基糖苷类提供抗性;
- 脂多糖(LPS)结构,提供对多粘菌素的抗性;
- RNA聚合酶,提供对利福平的抗性;
- DNA回旋酶,提供对氟喹诺酮类药物的耐药性;
- 代谢酶,提供对磺胺类药物、砜和甲氧苄氨嘧啶的耐药性;以及
- 肽聚糖亚单位肽链,提供对糖肽的抗性。
瞄准生产过剩或酶绕过
当抗微生物药物起到抗代谢药的作用,靶向一种特定的酶以抑制其活性时,微生物耐药性可能通过其他方式发生。 首先,微生物可能会过度产生靶酶,因此有足够数量的不含抗微生物药物的酶来进行适当的酶促反应。 其次,细菌细胞可能会形成绕过对功能性靶酶的需求的旁路。 这两种策略都被发现是磺胺耐药的机制。 事实证明,金黄色葡萄球菌中的万古霉素耐药性涉及细菌细胞壁中肽链的交联减少,这增加了万古霉素在外细胞壁中结合的靶标。 增加万古霉素在外细胞壁中的结合提供了阻塞作用,防止游离药物分子渗透到可以阻断新细胞壁合成的地方。
目标模仿
最近发现的一种称为靶标模仿的耐药机制涉及产生结合和封存药物的蛋白质,从而阻止药物与靶标结合。 例如,结核分枝杆菌会产生一种具有常规五肽重复序列的蛋白质,该蛋白质似乎模仿 DNA 的结构。 这种蛋白结合氟喹诺酮类药物,隔离它们并防止它们与DNA结合,从而为结核杆菌提供对氟喹诺酮的耐药性。 已发现模仿细菌核糖体 A 位点的蛋白质也会增加氨基糖苷类的耐药性。 1
练习\(\PageIndex{1}\)
列出几种耐药机制。
耐多药微生物和交叉耐药性
从临床角度来看,我们最担心的是耐多药微生物(MDR)和交叉耐药性。 MDR 俗称 “超级细菌”,具有一种或多种耐药机制,使其对多种抗微生物药物具有耐药性。 在交叉耐药中,单一耐药机制赋予对多种抗微生物药物的耐药性。 例如,使用可以输出多种抗微生物药物的外流泵是微生物通过使用单一耐药机制对多种药物产生耐药性的常见方法。 近年来,出现了几种临床上重要的超级细菌,美国疾病预防控制中心报告说,超级细菌每年在美国造成超过200万例感染,造成至少23,000人死亡。 2 以下章节中讨论的几种超级细菌被称为 ESKAPE 病原体。 这个首字母缩写指的是病原体(粪肠球菌、金黄色葡萄球菌、肺炎克雷伯氏菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌属)的名称,但它也很合适病原体能够 “逃脱” 许多传统形式的抗微生物疗法。 因此,ESKAPE 病原体的感染可能难以治疗,它们会导致大量的医院感染。
耐甲氧西林金黄色葡萄球菌 (MRSA)
甲氧西林是一种半合成的青霉素,旨在抵抗 β-内酰胺酶失活。 不幸的是,在将甲氧西林引入临床实践后不久,耐甲氧西林的金黄色葡萄球菌菌株出现并开始传播。 耐药机制,即获得一种新的低亲和力 PBP,为金黄色葡萄球菌提供了对所有可用的 β-内酰胺的耐药性。 耐甲氧西林金黄色葡萄球菌(MRSA)菌株是普遍存在的机会性病原体,尤其会引起皮肤和其他伤口感染,但也可能导致肺炎和败血症。 尽管最初在医疗机构(医院获得性金黄色葡萄球菌 [HA-MRSA])中存在问题,但现在也可以通过与受污染的公众接触(称为社区相关金黄色葡萄球菌(CA-MRSA))而感染金黄色葡萄球菌。 大约三分之一的人口携带金黄色葡萄球菌作为正常鼻腔微生物群的成员而没有疾病,这些菌株中约有6%具有甲氧西林耐药性。 3 4
克拉维酸:青霉素的小帮手
随着20世纪40年代初青霉素的引入及其随后的批量生产,社会开始将抗生素视为各种传染病的奇迹疗法。 不幸的是,早在1945年,青霉素耐药性就被首次记录在案并开始蔓延。 目前超过 90% 的金黄色葡萄球菌临床分离株对青霉素具有耐药性。 5
尽管开发新的抗微生物药物是解决这个问题的一种方法,但科学家们已经探索了新的方法,包括开发使耐药机制失活的化合物。 克拉维酸的开发是这种策略的早期例子。 克拉维酸是由链球菌 clavuligerus 产生的一种分子。 它含有β-内酰胺环,使其在结构上与青霉素和其他 β-内酰胺类似,但单独使用时没有临床疗效。 相反,克拉维酸在β-内酰胺酶的活性位点内不可逆地结合,防止它们失活共同施用的青霉素。
克拉维酸最早是在20世纪70年代开发的,从20世纪80年代开始与阿莫西林联合销售,品牌名为Augmentin。 与往常一样,对阿莫西林-克拉维酸组合的耐药性很快出现。 耐药性最常见的原因是细菌增加了β-内酰胺酶的产生,压倒了克拉维酸的抑制作用,使它们的β-内酰胺酶发生突变以使其不再受到克拉维酸的抑制,或者源于获得一种不受克拉维酸抑制的新β-内酰胺酶。 尽管对耐药性的担忧日益增加,但克拉维酸和相关的β-内酰胺酶抑制剂(舒巴坦和他唑巴坦)代表了一项重要的新策略:开发直接抑制赋予抗微生物药物耐药性的酶的化合物。
耐万古霉素肠球菌和金黄色葡萄球菌
万古霉素仅对革兰氏阳性菌有效,用于治疗由对其他抗生素具有耐药性的病原体引起的伤口感染、败血性感染、心内膜炎和脑膜炎。 它被认为是抵御包括金黄色葡萄球菌在内的此类耐药性感染的最后一道防线之一。 随着20世纪70年代和1980年代抗生素耐药性的上升,万古霉素的使用增加,我们看到耐万古霉素肠球菌(VRE)、耐万古霉素金黄色葡萄球菌(VRSA)和万古霉素中间体金黄色葡萄球菌(VISA)的出现和传播也就不足为奇了。 肠球菌中万古霉素耐药的机制是靶点修饰,涉及肽聚糖亚基的肽成分的结构变化,从而阻止万古霉素结合。 这些菌株通常在临床环境中通过接触卫生保健工作者和受污染的表面和医疗设备在患者中传播。
VISA和VRSA菌株在耐药机制和每种机制赋予的耐药程度方面彼此不同。 VISA菌株表现出中等耐药性,最低抑制浓度(MIC)为4—8 μg/mL,其机制涉及万古霉素靶标的增加。 VISA 菌株可减少细胞壁中肽链的交联,从而增加将万古霉素捕获在外细胞壁中的万古霉素靶标的数量。 相比之下,VRSA 菌株通过水平转移来自 VRE 的耐药基因获得万古霉素耐药性,这为同时感染了 VRE 和 MRSA 的个体提供了机会。 VRSA 表现出更高的阻力水平,MIC 为 16 μg/mL 或更高。 6 对于所有三种类型的万古霉素耐药细菌,必须进行快速的临床鉴定,这样才能实施适当的程序来限制传播。 像利奈唑胺这样的恶唑烷酮可用于治疗这些耐万古霉素的机会性病原体以及金黄色葡萄球菌。
产生革兰阴性病原体的广谱β-内酰胺酶
产生广谱β-内酰胺酶(ESBL)的革兰氏阴性病原体表现出的耐药性远远超过青霉素。 ESBLs灭活的β-内酰胺谱对所有青霉素、头孢菌素、单巴克胺和β-内酰胺酶抑制剂组合具有耐药性,但对碳青霉烯类药物不具有耐药性。 更令人担忧的是,编码 ESBL 的基因通常存在于移动质粒上,这些质粒还含有对其他药物类别(例如氟喹诺酮类、氨基糖苷类、四环素)的耐药基因,并且可能很容易通过水平基因转移传播给其他细菌。 这些耐多药细菌是某些人肠道微生物群的成员,但它们也是住院患者机会性感染的重要原因,它们可以从住院患者传播给其他人。
耐碳青霉烯革兰氏阴性细菌
在其他革兰氏阴性细菌(例如铜绿杆菌、鲍曼不动杆菌、Stenotrophomonas maltophila)中,耐碳青霉烯类肠杆菌(CRE)和碳青霉烯耐药性的出现越来越令人担忧。 这些病原体通过多种机制产生对碳青霉烯类的耐药性,包括产生碳青霉烯酶(使所有β-内酰胺失活的广谱β-内酰胺酶,包括碳青霉烯类药物)、碳青霉烯类物质主动外流出细胞和/或防止碳青霉烯通过孔蛋白通道进入。 与对ESBL的担忧类似,耐碳青霉烯的革兰氏阴性病原体通常对多类抗菌药物具有耐药性,有些甚至出现了泛耐药性(对所有可用抗菌药物的耐药性)。 耐碳青霉烯的革兰氏阴性病原体的感染通常发生在医疗机构中,途径是与受污染的人或医疗器械相互作用,或者是手术所致。
耐多药结核分枝杆菌
耐多药结核分枝杆菌(MDR-TB)和广泛耐药结核分枝杆菌(XDR-TB)的出现也引起了全球的严重关注。 耐多药结核菌株对利福平和异烟肼均具有耐药性,后者是通常用于治疗结核病的药物组合。 此外,XDR-TB 菌株对任何氟喹诺酮以及作为第二线治疗的三种其他药物(阿米卡星、卡那霉素或卷曲霉素)中的至少一种具有耐药性,这使得这些患者几乎没有治疗选择。 这两种病原体在免疫功能低下的人群中尤其成问题,包括感染艾滋病毒的人。 这些菌株产生耐药性通常是由于在结核病治疗中错误使用抗微生物药物,选择耐药性造成的。
练习\(\PageIndex{2}\)
耐药性如何导致超级细菌?
要了解有关美国面临的 18大耐药威胁的更多信息,请访问CDC的网站。
工厂化农业和耐药性
尽管畜牧业长期以来一直是美国农业的重要组成部分,但自20世纪50年代以来,集中动物饲养业务(CAFO)的兴起带来了一些新的环境问题,包括生物废物对水和空气的污染,以及与动物权利有关的伦理问题也与以这种方式生长动物有关。 此外,CAFO的增加涉及在饲养牲畜时广泛使用抗微生物药物。 在近距离的CAFO中,抗微生物药物用于预防传染病的发展;但是,工厂化养殖中使用的大多数抗微生物药物用于促进生长,换句话说,用于种植大型动物。
这种强化增长的背后机制尚不清楚。 这些抗生素不一定与临床上用于人类的抗生素相同,但它们在结构上与用于人类的药物有关。 因此,在动物身上使用抗微生物药物可以选择抗微生物药物耐药性,这些耐药细菌会与通常用于人类的药物产生交叉耐药性。 例如,在动物身上使用泰乐菌素似乎是选择对其他大环内酯类物质(包括人类常用的红霉素)具有交叉耐药性的细菌。
由CAFO产生的耐药细菌菌株在这些农场周围的水和土壤中的浓度增加。 如果这些耐药细菌在人类中没有直接致病性,则可以充当移动遗传元素的储存库,这些元素随后可以将耐药基因传递给人类病原体。 幸运的是,烹饪过程通常会使肉类中残留的任何抗微生物药物失活,因此人类通常不会直接摄入这些药物。 尽管如此,许多人呼吁更明智地使用这些药物,也许可以向农民收取使用费,以减少滥用。 实际上,2012年,FDA发布了针对自愿逐步停止使用抗微生物药物的农民的指导方针,除非在兽医监督下并在必要时确保动物健康。 尽管目前遵守该指南是自愿的,但FDA确实建议在生产食物的动物身上 “明智” 地使用抗微生物药物,以降低抗微生物药物耐药性。
临床重点:第 3 部分
不幸的是,环丙沙星治疗没有解决玛丽莎的尿路感染。 实验室测试显示,她的感染是由一种具有明显抗微生物药物耐药性的肺炎克雷伯氏菌菌株引起的。 这种肺炎杆菌的耐药性特征包括对碳青霉烯类抗菌药物的耐药性,碳青霉烯类抗菌是一组通常用于治疗高耐药细菌的β-内酰胺。 肺炎杆菌是一种机会性的、胶囊化的革兰氏阴性杆菌,可能是肠道正常微生物群的成员,但也可能导致多种疾病,包括肺炎和尿路感染。
对玛丽莎的样本进行了寻找产生碳青霉烯酶的特定实验室测试,结果呈阳性。 根据这一结果,结合她的健康史,怀疑会产生一种名为新德里金属-β-内酰胺酶(NDM)的碳青霉烯酶。 尽管 NDM 碳青霉烯酶的起源尚不完全清楚,但许多感染了含有 NDM 菌株的患者都有旅行史,涉及在印度或周边国家住院。
练习\(\PageIndex{1}\)
医生将如何确定应使用哪种类型的抗微生物药物?
关键概念和摘要
- 抗微生物药物耐药性呈上升趋势,这是在临床环境中选择耐药菌株、过度使用和滥用抗菌药物、使用亚治疗剂量的抗菌药物以及患者对抗菌药物疗法的依从性差的结果。
- 耐药基因通常携带在质粒或转座子上,这些质粒或转座子很容易进行垂直转移,也可以在微生物之间通过水平基因转移携带。
- 抗微生物药物耐药性的常见模式包括药物改造或失活、防止细胞摄取或外流、靶标修饰、靶标过量生产或酶绕过以及靶点模仿。
- 出现了表现出广泛抗微生物药物耐药性的有问题的微生物菌株;其中许多菌株可以作为正常微生物群的成员存在于个体中,但也可能导致机会性感染。 其中许多高耐药性微生物菌株的传播通常发生在临床环境中,但也可能是社区获得性的。
脚注
- 1 D.H. Fong,A.M. Berghuis。 “通过靶标模仿使氨基糖苷类抗生素耐药酶的底物混杂。” EMBO Journal 21 第 10 期 (2002): 2323—2331。
- 2 疾病控制与预防中心。 “抗生素/抗微生物药物耐药性。” http://www.cdc.gov/drugresistance/index.html。 已于 2016 年 6 月 2 日访问。
- 3 A.S. Kalokhe 等人。 “耐多药结核药物敏感性和分子诊断测试:文献综述。 《美国医学科学杂志》 345 第 2 期 (2013): 143—148。
- 4 疾病控制与预防中心。 “耐甲氧西林金黄色葡萄球菌(MRSA):社区中有关耐甲氧西林金黄色葡萄球菌的一般信息。” http://www.cdc.gov/mrsa/community/index.html。 已于 2016 年 6 月 2 日访问
- 5 F.D. Lowy。 “抗微生物药物耐药性:金黄色葡萄球菌的例子。” 《临床研究杂志》 111 第 9 期 (2003): 1265—1273。
- 6 疾病控制与预防中心。 “医疗保健相关感染(HIA):有关 VISA/VRSA 的一般信息。” www.cdc.gov/hai/organms/VIS... visa_vrsa.html。 已于 2016 年 6 月 2 日访问。


