9.5: نموذج الإلكترون الحر للمعادن
- Page ID
- 196450
في نهاية هذا القسم، ستكون قادرًا على:
- وصف نموذج الإلكترون الحر الكلاسيكي للمعادن من حيث مفهوم كثافة عدد الإلكترون
- شرح نموذج الإلكترون الحر الكمي للمعادن من حيث مبدأ استبعاد باولي
- احسب مستويات الطاقة والتباعد بين مستويات الطاقة للإلكترون الحر في المعدن
يتم ربط المعادن، مثل النحاس والألمنيوم، معًا بواسطة روابط مختلفة تمامًا عن تلك الخاصة بالجزيئات. بدلاً من مشاركة الإلكترونات وتبادلها، يتم تثبيت المعدن بشكل أساسي بواسطة نظام من الإلكترونات الحرة التي تتجول في جميع أنحاء المادة الصلبة. إن أبسط نموذج للمعدن هو نموذج الإلكترون الحر. ينظر هذا النموذج إلى الإلكترونات كغاز. ننظر أولاً في الحالة البسيطة أحادية البعد التي تتحرك فيها الإلكترونات بحرية على طول الخط، مثل من خلال قضيب معدني رقيق جدًا. الوظيفة المحتملة\(U(x)\) لهذه الحالة هي بئر مربع غير محدود أحادي البعد حيث تتوافق جدران البئر مع حواف القضيب. يتجاهل هذا النموذج التفاعلات بين الإلكترونات ولكنه يحترم مبدأ الاستبعاد. بالنسبة للحالة الخاصة\(T = 0 \, K\)، تملأ\(N\) الإلكترونات مستويات الطاقة، من الأدنى إلى الأعلى، مرتين في كل مرة (تدور لأعلى وتدور لأسفل)، حتى يتم ملء أعلى مستوى للطاقة. أعلى طاقة مملوءة تسمى طاقة فيرمي.
يمكن تحسين نموذج الإلكترون الحر أحادي البعد من خلال النظر في الحالة ثلاثية الأبعاد: الإلكترونات التي تتحرك بحرية في كتلة معدنية ثلاثية الأبعاد. تم تصميم هذا النظام بواسطة بئر مربع لا نهائي ثلاثي الأبعاد. يتطلب تحديد حالات الطاقة المسموح بها حل معادلة Schrödinger المستقلة عن الوقت
\[-\dfrac{h^2}{2m_c}\left(\dfrac{\partial^2}{\partial x^2} + \dfrac{\partial^2}{\partial y^2} + \dfrac{\partial^2}{\partial z^2}\right) \psi (x,y,z) = E \psi (x,y,z), \label{eq1} \]
حيث نفترض أن الطاقة الكامنة داخل الصندوق هي صفر وما لا نهاية بخلاف ذلك. يمكن كتابة وظائف الموجة المسموح بها التي تصف الحالات الكمومية للإلكترون على النحو التالي
\[\psi(x,y,z) = \left(\sqrt{\dfrac{2}{L_x}}\sin \dfrac{n_x\pi x}{L_x}\right) \left(\sqrt{\dfrac{2}{L_y}}\sin \dfrac{n_y\pi y}{L_y}\right)\left(\sqrt{\dfrac{2}{L_z}}\sin \dfrac{n_z\pi z}{L_z}\right), \label{eq2} \]
حيث\(n_x, \, n_y\)\(n_z\) توجد أعداد صحيحة موجبة تمثل الأرقام الكمومية المقابلة للحركة في اتجاهات x - و y - و z، على التوالي\(L_x\)،\(L_y\) و،\(L_z\) وهي أبعاد المربع في تلك الاتجاهات. المعادلة\ ref {eq2} هي ببساطة نتاج ثلاث وظائف موجية أحادية البعد. الطاقات المسموح بها للإلكترون في المكعب (\(L = L_x = L_y = L_z\)) هي
\[E = \dfrac{\pi^2 \hbar^2}{2mL^2} (n_1^2 + n_2^2 + n_3^2). \label{eq3} \]
ترتبط بكل مجموعة من الأرقام الكمومية\((n_x, \, n_y, \, n_z)\) حالتان كموميتين، تدور لأعلى وتدور لأسفل. في المواد الحقيقية، يكون عدد الدول المملوءة هائلاً. على سبيل المثال، في السنتيمتر المكعب من المعدن، يكون هذا الرقم في ترتيب\(10^{22}\). حساب عدد الجسيمات في أي حالة يكون العمل صعبًا، والذي يتطلب غالبًا مساعدة كمبيوتر قوي. ومع ذلك، فإن هذا الجهد يستحق العناء لأن هذه المعلومات غالبًا ما تكون وسيلة فعالة للتحقق من النموذج.
ضع في اعتبارك مكعبًا معدنيًا صلبًا بطول الحافة 2.0 سم.
- ما أقل مستوى طاقة للإلكترون داخل المعدن؟
- ما المسافة بين هذا المستوى ومستوى الطاقة التالي؟
إستراتيجية
يمكن تصميم الإلكترون في المعدن كموجة. تتوافق أقل طاقة مع أكبر طول موجي وأصغر رقم كمي:\(n_x, \, n_y, \, n_z = (1,1,1)\). توفر المعادلة\ ref {eq3} قيمة طاقة «الحالة الأرضية» هذه. نظرًا لأن طاقة الإلكترون تزداد مع العدد الكمومي، فإن المستوى الأعلى التالي يتضمن أصغر زيادة في الأرقام الكمومية، أو\((n_x, \, n_y, \, n_z) = (2,1,1), (1,2,1),\) أو\((1,1,2)\).
الحل
يتوافق أدنى مستوى للطاقة مع الأرقام الكمومية\(n_x = n_y = n_z = 1\). من المعادلة\ ref {eq3}، طاقة هذا المستوى هي
\[\begin{align*} E(1,1,1) &= \dfrac{\pi^2 h^2}{2m_eL^2} (1^2 + 1^2 + 1^2) \nonumber \\[4pt] &= \dfrac{3\pi^2 (1.05 \times 10^{-34} \, J \cdot s)^2}{2(9.11 \times 10^{-31} kg)(2.00 \times 10^{-2} m)^2} \nonumber \\[4pt] &= 4.48 \times 10^{-34} J\nonumber \\[4pt] &= 2.80 \times 10^{-15} eV. \nonumber \end{align*} \nonumber \]
يتم الوصول إلى مستوى الطاقة الأعلى التالي عن طريق زيادة أي واحد من الأرقام الكمومية الثلاثة بمقدار 1. وبالتالي، هناك بالفعل ثلاث حالات كمية بنفس الطاقة. لنفترض أننا نزيد\(n_x\) بمقدار 1. ثم تصبح الطاقة
\[\begin{align*} E(2,1,1) &= \dfrac{\pi^2h^2}{2m_eL^2} (2^2 + 1^2 + 1^2) \nonumber \\[4pt] &= \dfrac{6\pi^2(1.05 \times 10^{-34} \, J \cdot s)^2}{2(9.11 \times 10^{-31} kg)(2.00 \times 10^{-2}m)^2} \nonumber \\[4pt] &= 8.96 \times 10^{-34} J \nonumber \\[4pt] &= 5.60 \times 10^{-15} eV.\nonumber \end{align*} \nonumber \]
وبالتالي فإن تباعد الطاقة بين أدنى حالة طاقة وحالة الطاقة التالية الأعلى هو
\[E(2,1,1) - E(1,1,1) = 2.80 \times 10^{-15} eV. \nonumber \]
الدلالة
هذا فرق صغير جدًا في الطاقة. قارن هذه القيمة بمتوسط الطاقة الحركية للجسيم\(k_BT\)، حيث\(k_B\) يكون ثابت بولتزمان ودرجة\(T\) الحرارة المطلقة. المنتج أكبر\(k_BT\) بحوالي 1000 مرة من تباعد الطاقة.
ماذا يحدث لطاقة الحالة الأرضية للإلكترون إذا زادت أبعاد المادة الصلبة؟
- إجابة
-
إنه يتناقص.
في كثير من الأحيان، لا نهتم بالعدد الإجمالي للجسيمات في جميع الحالات، بل عدد الجسيمات dN ذات الطاقات في فترة طاقة ضيقة. يمكن التعبير عن هذه القيمة من خلال
\[\begin{align} dN &= n(E)dE \nonumber \\[4pt] &= g(E)dE \cdot F \nonumber \end{align} \nonumber \]
أين\(n(E)\) كثافة عدد الإلكترون، أو عدد الإلكترونات لكل وحدة حجم؛\(g(E)\) هي كثافة الحالات، أو عدد الحالات الكمومية المسموح بها لكل وحدة طاقة؛\(dE\) هو حجم فترة الطاقة؛\(F\) وهو عامل فيرمي . عامل فيرمي هو احتمال ملء الدولة. على سبيل المثال، إذا كانت\(g(E)dE\) 100 حالة متوفرة، ولكن\(F\) بنسبة 5٪ فقط، فإن عدد الجسيمات في فترة الطاقة الضيقة هذه هو خمسة فقط. \(g(E)\)يتطلب البحث حل معادلة شرودنغر (في ثلاثة أبعاد) لمستويات الطاقة المسموح بها (المعادلة\ ref {eq1}). يتم إجراء الحساب حتى بالنسبة للنموذج الخام، ولكن النتيجة بسيطة:
\[g(E) = \dfrac{\pi V}{2} \left(\dfrac{8m_e}{h^2} \right)^{3/2} E^{1/2}, \nonumber \]
حيث V هو حجم المادة الصلبة،\(m_e\) وهي كتلة الإلكترون، و E هي طاقة الحالة. لاحظ أن كثافة الحالات تزداد مع الجذر التربيعي للطاقة. تتوفر المزيد من الولايات بطاقة عالية مقارنة بالطاقة المنخفضة. لا يوفر هذا التعبير معلومات عن كثافة الإلكترونات في الفضاء المادي، بل كثافة مستويات الطاقة في «مساحة الطاقة». على سبيل المثال، في دراستنا للبنية الذرية، تعلمنا أن مستويات الطاقة لذرة الهيدروجين متباعدة على نطاق واسع لقيم الطاقة الصغيرة (بالقرب من الحالة الأرضية) مقارنة بالقيم الأكبر.
تخبرنا هذه المعادلة عن عدد حالات الإلكترون المتاحة في مادة صلبة معدنية ثلاثية الأبعاد. ومع ذلك، فإنه لا يخبرنا بمدى احتمالية ملء هذه الولايات. وبالتالي، نحتاج إلى تحديد عامل فيرمي، F. ضع في اعتبارك الحالة البسيطة لـ\(T = 0 \, K\). من الفيزياء الكلاسيكية، نتوقع أن تذهب جميع الإلكترونات\((\approx 10^{22} / cm^3)\) ببساطة إلى الحالة الأرضية لتحقيق أقل طاقة ممكنة. ومع ذلك، فإن هذا ينتهك مبدأ استبعاد باولي، الذي ينص على أنه لا يمكن أن يكون إلكترونان في نفس الحالة الكمومية. وبالتالي، عندما نبدأ في ملء الحالات بالإلكترونات، يتم احتلال الحالات ذات الطاقة الأقل أولاً، ثم الدول ذات الطاقات الأعلى تدريجيًا. يحتوي الإلكترون الأخير الذي وضعناه على أعلى طاقة. هذه الطاقة هي طاقة فيرمي\(E_F\) لغاز الإلكترون الحر. الحالة ذات الطاقة\(E < E_F\) يشغلها إلكترون واحد، والحالة ذات الطاقة\(E > E_F\) غير مشغولة. لوصف ذلك من حيث احتمال F (E) أن تكون حالة الطاقة E مشغولة، نكتب عن\(T = 0 \, K\):
\[F(E) = 1 \, (E < E_F) \nonumber \]
\[F(E) = 0 \, (E > E_F). \nonumber \]
تم رسم كثافة الحالات وعامل فيرمي وكثافة عدد الإلكترون مقابل الطاقة في الشكل\(\PageIndex{1}\).
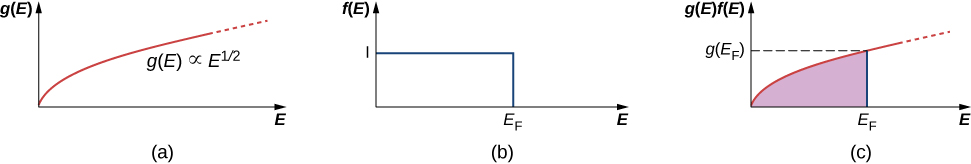
بعض الملاحظات مرتبة. أولاً، ينخفض توزيع كثافة عدد الإلكترون (الصف الأخير) بشكل حاد عند طاقة فيرمي. وفقًا للنظرية، يتم إعطاء هذه الطاقة من خلال
\[E_F = \dfrac{h^2}{8m_e} \left(\dfrac{3 \, N}{\pi V} \right)^{2/3}. \label{eq5} \]
يتم سرد طاقات Fermi للمواد المختارة في الجدول\(\PageIndex{1}\). لاحظ أيضًا أن الرسم البياني فقط هو الشكل\(\PageIndex{1c}\) الذي يجيب على السؤال «كم عدد الجسيمات الموجودة في نطاق الطاقة؟» يتم التحقق من خلال التجربة. درجة حرارة فيرمي أو «درجة الحرارة» الفعالة للإلكترون عند طاقة فيرمي هي
\[T_F = \dfrac{E_F}{k_B}. \nonumber \]
| العنصر | كثافة إلكترون في نطاق التوصيل\((10^{28}m^{-3})\) | نموذج الإلكترون الحر فيرمي إنرجي (\(eV\)) |
|---|---|---|
| جميع | \ (10^ {28} m^ {-3})\)» النمط = «محاذاة النص: المركز؛» class="lt-phys-4544">18.1 | \ (eV\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4544">11.7 |
| با | \ (10^ {28} m^ {-3})\)» النمط = «محاذاة النص: المركز؛» class="lt-phys-4544">3.15 | \ (eV\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4544">3.64 |
| كوب | \ (10^ {28} m^ {-3})\)» النمط = «محاذاة النص: المركز؛» class="lt-phys-4544">8.47 | \ (eV\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4544">7.00 |
| Au | \ (10^ {28} m^ {-3})\)» النمط = «محاذاة النص: المركز؛» class="lt-phys-4544">5.90 | \ (eV\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4544">5.53 |
| عنصر الحديد | \ (10^ {28} m^ {-3})\)» النمط = «محاذاة النص: المركز؛» class="lt-phys-4544">17.0 | \ (eV\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4544">11.1 |
| العمر | \ (10^ {28} m^ {-3})\)» النمط = «محاذاة النص: المركز؛» class="lt-phys-4544">5.86 | \ (eV\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4544">5.49 |
الفضة المعدنية هي موصل ممتاز. يحتوي على إلكترونات\(5.89 \times 10^{28}\) توصيل لكل متر مكعب. (أ) حساب طاقة فيرمي الخاصة بها. (ب) قارن هذه الطاقة بالطاقة الحرارية للإلكترونات عند درجة حرارة الغرفة 300 K.\(k_BT\)
الحل
- من المعادلة\ ref {eq5}، طاقة فيرمي هي\[\begin{align} E_F &= \dfrac{h^2}{2m_e}(3\pi^2n_e)^{2/3} \nonumber \\[4pt] &= \dfrac{(1.05 \times 10^{-34} J \cdot s)^2}{2(9.11 \times 10^{-31}kg)} \times [(3\pi^2 (5.89 \times 10^{28}m^{-3})]^{2/3} \nonumber \\[4pt] &= 8.79 \times 10^{-19}J = 5.49 \, eV. \nonumber \end{align} \nonumber \] هذه القيمة النموذجية لطاقة فيرمي للمعادن، كما يتضح من الجدول\(\PageIndex{1}\).
- يمكننا ربط درجة حرارة فيرمي\(T_F\) بطاقة فيرمي عن طريق الكتابة\(k_BT_F = E_F\). ثم نجد درجة حرارة فيرمي\[\begin{align} T_F &= \dfrac{8.79 \times 10^{-19}J}{1.38 \times 10^{-23} J/K} \nonumber \\[4pt] &= 6.37 \times 10^6 K,\nonumber \end{align} \nonumber \] التي هي أعلى بكثير من درجة حرارة الغرفة وأيضًا نقطة الانصهار النموذجية (\(\approx 10^3 \, K\)) للمعدن. نسبة طاقة Fermi من الفضة إلى الطاقة الحرارية في درجة حرارة الغرفة هي\[\dfrac{E_F}{k_BT} = \dfrac{T_F}{T} \approx 210. \nonumber \]
لتصور كيفية ملء الحالات الكمومية، قد نتخيل صب الماء ببطء في كوب، مثل الشكل\(\PageIndex{2}\). تحتل قطرات الماء الأولى (الإلكترونات) الجزء السفلي من الزجاج (الحالات ذات الطاقة الأقل). مع ارتفاع المستوى، يتم احتلال حالات الطاقة العالية والعالية. علاوة على ذلك، نظرًا لأن الزجاج يحتوي على فتحة واسعة وجذع ضيق، فإن الماء يحتل الجزء العلوي من الزجاج أكثر من الجزء السفلي. وهذا يعكس حقيقة أن كثافة الحالات g (E) تتناسب مع\(E^{1/2}\)، لذلك يوجد عدد كبير نسبيًا من الإلكترونات ذات الطاقة العالية في غاز الإلكترون الحر. أخيرًا، يتوافق المستوى الذي يتم ملء الزجاج به مع طاقة Fermi.

لنفترض أنه عند\(T = 0 \, K\)، يكون عدد إلكترونات التوصيل لكل وحدة حجم في عينتنا هو\(n_e\). نظرًا لأن كل حالة ميدانية تحتوي على إلكترون واحد، فإن عدد الحالات المملوءة لكل وحدة حجم هو نفس عدد الإلكترونات لكل وحدة حجم.


