9.4: الترابط في المواد الصلبة البلورية
- Page ID
- 196495
في نهاية هذا القسم، ستكون قادرًا على:
- وصف هياكل التعبئة للمواد الصلبة الشائعة
- اشرح الفرق بين الترابط في المادة الصلبة والجزيء
- أوجد مسافة فصل الاتزان بمعلومية الخصائص البلورية
- أوجد طاقة تفكك الملح بمعلومية الخصائص البلورية
بدءًا من هذا القسم، ندرس المواد الصلبة البلورية، والتي تتكون من ذرات مرتبة في نمط منتظم ممتد يسمى الشبكة. يتم تصنيف المواد الصلبة التي لا تشكل أو لا تستطيع تكوين البلورات على أنها مواد صلبة غير متبلورة. على الرغم من أن المواد الصلبة غير المتبلورة (مثل الزجاج) لها مجموعة متنوعة من التطبيقات التكنولوجية المثيرة للاهتمام، فإن تركيز هذا الفصل سيكون على المواد الصلبة البلورية.
ترتب الذرات نفسها في شبكة لتشكيل بلورة بسبب قوة الجاذبية الصافية بين الإلكترونات المكونة لها والنواة الذرية. تنتمي البلورات المتكونة من ترابط الذرات إلى واحدة من ثلاث فئات، مصنفة حسب ارتباطها: الأيوني، التساهمي، والمعدني. يمكن للجزيئات أيضًا أن تترابط معًا لتكوين بلورات؛ هذه الروابط، التي لم تتم مناقشتها هنا، تصنف على أنها جزيئية. في أوائل القرن العشرين، كان النموذج الذري للمادة الصلبة مجرد تخمين. لدينا الآن دليل مباشر على الذرات في المواد الصلبة (الشكل\(\PageIndex{1}\)).
الرابطة الأيونية في المواد الصلبة
تتشكل العديد من المواد الصلبة عن طريق الترابط الأيوني المثال النموذجي هو بلورة كلوريد الصوديوم، كما ناقشنا سابقًا. تنتقل الإلكترونات من ذرات الصوديوم إلى ذرات الكلور المجاورة، نظرًا لأن إلكترونات التكافؤ في الصوديوم مرتبطة بشكل فضفاض والكلور له تقارب إلكتروني كبير. تتجمع أيونات الصوديوم ذات الشحنة الموجبة وأيونات الكلور (الكلوريد) سالبة الشحنة في مصفوفة منتظمة ممتدة من الذرات (الشكل\(\PageIndex{2}\)).
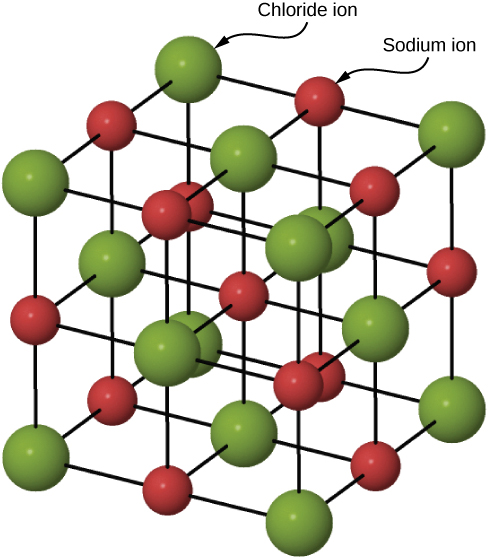
تكون توزيعات الشحنة لأيونات الصوديوم والكلوريد متماثلة كرويًا، ويبلغ أيون الكلوريد حوالي ضعف قطر أيون الصوديوم. يُطلق على أدنى ترتيب للطاقة لهذه الأيونات اسم الهيكل المكعب المتمركز حول الوجه (FCC). في هذه البنية، يكون كل أيون هو الأقرب إلى ستة أيونات من الأنواع الأخرى. خلية الوحدة عبارة عن مكعب - تحتل الذرة مركز وزوايا كل «وجه» للمكعب. تمت كتابة الطاقة الكامنة الجذابة للأيونات بسبب حقول هذه\(Cl^-\) الأيونات الستة\(Na^+\)
\[U_1 = -6\frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
حيث تحدد علامة الطرح إمكانات جذابة (ونحددها\(k = 1/4 \pi \epsilon_0\)). على مسافة قريبة\(\sqrt{2r}\) هي أقرب جيرانها: اثنا عشر\(Na^+\) أيونات من نفس الشحنة. إجمالي الطاقة الكامنة المثيرة للاشمئزاز المرتبطة بهذه الأيونات
\[U_2 = 12\frac{e^2}{4\pi \epsilon_0\sqrt{2}r}. \nonumber \]
الأقرب التالية هي ثمانية\(Cl^-\) أيونات على مسافة 3√ r3r من\(Na^+\) الأيون. الطاقة الكامنة\(Na^+\) للأيونات في مجال هذه الأيونات الثمانية هي
\[U_3 = -8\frac{e^2}{4\pi \epsilon_0 \sqrt{3}r}. \nonumber \]
بالاستمرار بنفس الطريقة مع المجموعات البديلة من\(Cl^-\)\(Na^+\) الأيونات، نجد أن الطاقة الكامنة الجذابة الصافية\(U_A\)\(Na^+\) للأيونات الفردية يمكن كتابتها كـ
\[U_{coul} = - \alpha \frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
أين\(\alpha\) هو ثابت ماديلونج، الذي تم تقديمه سابقًا. من خلال هذا التحليل، يمكننا أن نرى أن هذا الثابت هو المجموع المتقارب اللانهائي
\[\alpha = 6 - \frac{12}{sqrt{2}} + \frac{8}{\sqrt{3}} + . . . \nonumber \]
تساهم الأيونات البعيدة بشكل كبير في هذا المجموع، لذلك تتقارب ببطء، ويجب استخدام العديد من المصطلحات لحساب ألفا بدقة. بالنسبة لجميع المواد الصلبة الأيونية لـ FCC، تبلغ قيمة ألفا 1.75 تقريبًا.
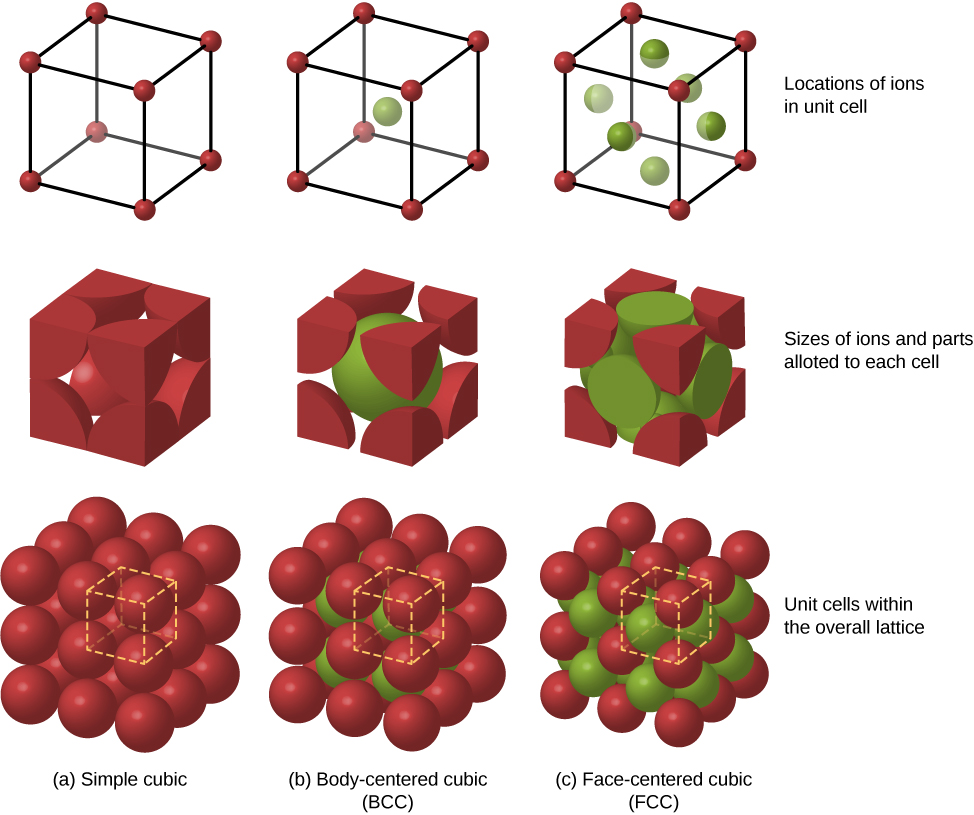
تشمل ترتيبات التعبئة الممكنة الأخرى للذرات في المواد الصلبة المكعب البسيط والمتركز على الجسم (BCC). تتم مقارنة هياكل التعبئة الثلاثة المختلفة للمواد الصلبة في الشكل\(\PageIndex{3}\). يمثل الصف الأول موقع الأيونات وليس حجمها؛ ويشير الصف الثاني إلى خلايا الوحدة لكل هيكل أو شبكة؛ ويمثل الصف الثالث موقع الأيونات وحجمها. يحتوي هيكل BCC على ثمانية جيران أقرب، مع ثابت Madelung يبلغ حوالي 1.76 - يختلف قليلاً فقط عن هيكل FCC. إن تحديد ثابت Madelung لمواد صلبة معينة هو عمل صعب وموضوع البحث الحالي.
لا ترجع طاقة أيونات الصوديوم بالكامل إلى القوى الجذابة بين الأيونات المشحونة معاكسًا. إذا تم شراء الأيونات قريبة جدًا من بعضها البعض، فإن وظائف الموجة للإلكترونات الأساسية للأيونات تتداخل، وتتنافر الإلكترونات بسبب مبدأ الاستبعاد. وبالتالي فإن إجمالي الطاقة الكامنة\(Na^+\) للأيونات هو مجموع إمكانات Coulomb الجذابة (\(U_{coul}\)) والإمكانات المثيرة للاشمئزاز المرتبطة بمبدأ الاستبعاد (\(U_{ex}\)). يتطلب حساب هذه الإمكانات المثيرة للاشمئزاز أجهزة كمبيوتر قوية. ولكن لحسن الحظ، يمكن وصف هذه الطاقة بدقة من خلال صيغة بسيطة تحتوي على معايير قابلة للتعديل:
\[U_{ex} = \frac{A}{r^n} \nonumber \]
حيث يتم اختيار المعلمات A و n لإعطاء تنبؤات تتفق مع البيانات التجريبية. بالنسبة للمشكلة الموجودة في نهاية هذا الفصل، يُشار إلى المعلمة n باسم ثابت التنافر. وبالتالي فإن إجمالي الطاقة الكامنة\(Na^+\) للأيون هو
\[U = -\alpha\frac{e^2}{4\pi \epsilon_0 r} + \frac{A}{r^n}. \nonumber \]
في حالة الاتزان، لا توجد قوة صافية على الأيون، لذلك يجب أن تكون المسافة\(Na^+\) بين\(Cl^-\) الأيونات المجاورة هي القيمة\(r_0\) التي يكون U الحد الأدنى لها. الإعداد\(\frac{dU}{dr} = 0\)، لدينا
\[0 = \frac{\alpha e^2}{4\pi \epsilon_0 r_0^2} - \frac{nA}{r_0^{n+1}}. \nonumber \]
وهكذا،
\[A = \frac{\alpha e^2 r_0^{n-1}}{4\pi \epsilon_0 n}. \nonumber \]
عند إدخال هذا التعبير في التعبير عن إجمالي الطاقة الكامنة، لدينا
\[U = - \frac{\alpha e^2}{4\pi \epsilon_0 r_0} \left[\frac{r_0}{r} - \frac{1}{n}\left(\frac{r_0}{r}\right)^n \right]. \nonumber \]لاحظ أن إجمالي الطاقة الكامنة الآن يحتوي فقط على معامل واحد قابل للتعديل، n. تم استبدال المعلمة A بدالة تتضمن r0r0، مسافة فصل التوازن، والتي يمكن قياسها من خلال تجربة الحيود (تعرفت على الحيود في فصل سابق). تم رسم إجمالي الطاقة الكامنة في الشكل الخاص\(\PageIndex{4}\) بـ\(n = 0\)، القيمة التقريبية لـ n لـ NaCl.
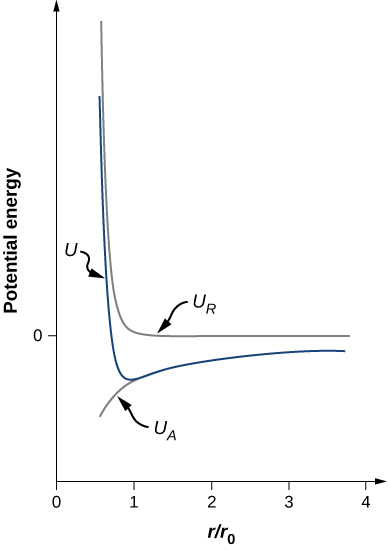
طالما\(n > 1\) أن منحنى U له نفس الشكل العام: تقترب U من اللانهاية\(r \rightarrow 0\) وتقترب U من الصفر كـ\(r \rightarrow \infty\). يتم إعطاء الحد الأدنى لقيمة الطاقة الكامنة من خلال
\[U_{min} (r = r_0) = -\alpha \frac{fe^2}{r_0}\left( 1 - \frac{1}{n}\right). \nonumber \]
وبالتالي فإن الطاقة اللازمة لكل زوج أيون لفصل البلورة إلى أيونات
\[U_{diss} = \alpha \frac{ke^2}{r_0}\left(1 - \frac{1}{n}\right). \nonumber \]
هذه هي طاقة تفكك المادة الصلبة. يمكن أيضًا استخدام طاقة التفكك لوصف إجمالي الطاقة اللازمة لكسر مول من مادة صلبة إلى الأيونات المكونة لها، والتي غالبًا ما يتم التعبير عنها بالكيلو جول/مول. يمكن تحديد طاقة التفكك بشكل تجريبي باستخدام حرارة التبخير الكامنة. يتم إعطاء قيم العينة في الجدول التالي.
| \(F^-\) | \(Cl^-\) | \(Br^-\) | \(I^-\) | |
|---|---|---|---|---|
| \(Li^+\) | \ (F^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">1036 | \ (Cl^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">853 | \ (Br^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">807 | \ (I^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543" > 757 |
| \(Na^+\) | \ (F^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">923 | \ (Cl^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">787 | \ (Br^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543" >747 | \ (I^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">704 |
| \(K^+\) | \ (F^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">821 | \ (Cl^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">715 | \ (Br^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">682 | \ (I^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543" >649 |
| \(Rb^+\) | \ (F^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543" > 785 | \ (Cl^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">689 | \ (Br^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">660 | \ (I^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">630 |
| \(Cs^+\) | \ (F^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">740 | \ (Cl^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">659 | \ (Br^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543">631 | \ (I^-\)» النمط = «محاذاة النص: المركز؛» class= «lt-phys-4543" >604 |
وبالتالي، يمكننا تحديد ثابت Madelung من البنية البلورية و n من طاقة الشبكة. بالنسبة لـ NaCl\(r_0 = 2.81 A\)، لدينا\(n \approx 8\)، و\(U_{diss} = 7.84 \, eV/ion \, pair\). طاقة التفكك هذه كبيرة نسبيًا. الفوتون الأكثر نشاطًا من الطيف المرئي، على سبيل المثال، لديه طاقة تبلغ تقريبًا
\[hf = (4.14 \times 10^{-15} eV \cdot s)(7.5 \times 10^{14} Hz) = 3.1 \, eV. \nonumber \]
نظرًا لأن الأيونات في البلورات مرتبطة بإحكام شديد، فإن البلورات الأيونية لها الخصائص العامة التالية:
- إنها صعبة ومستقرة إلى حد ما.
- تتبخر في درجات حرارة عالية نسبيًا (1000 إلى 2000 كلفن).
- إنها شفافة للإشعاع المرئي، لأن الفوتونات في الجزء المرئي من الطيف ليست نشطة بما يكفي لإثارة الإلكترون من حالته الأرضية إلى حالة الإثارة.
- إنها موصلات كهربائية ضعيفة، لأنها لا تحتوي بشكل فعال على إلكترونات حرة.
- عادة ما تكون قابلة للذوبان في الماء، لأن جزيء الماء يحتوي على لحظة ثنائية القطب كبيرة يكون مجالها الكهربائي قويًا بما يكفي لكسر الروابط الكهروستاتيكية بين الأيونات.
حدد طاقة تفكك كلوريد الصوديوم (NaCl) بالكيلو جول/مول. (تلميح: ثابت التنافر n لـ NaCl هو 8 تقريبًا.)
إستراتيجية
يبلغ فصل الاتزان لبلورة كلوريد الصوديوم 0.282 nm. (قارن هذه القيمة بـ 0.236 نانومتر لوحدة ثنائية الذرة الحرة من NaCl.) تعتمد طاقة التفكك على مسافة الفصل وثابت التنافر وثابت Madelung لهيكل FCC. تعتمد مسافة الفصل بدورها على الكتلة المولية والكثافة المقاسة. يمكننا تحديد مسافة الفصل، ثم استخدام هذه القيمة لتحديد طاقة التفكك لمول واحد من المادة الصلبة.
الحل
الكتلة الذرية لـ Na و Cl هي 23.0 u و 58.4 u، وبالتالي فإن الكتلة المولية لـ NaCl هي 58.4 جم/مول. كثافة NaCl هي\(2.16 \, g/cm^3\). العلاقة بين هذه الكميات هي
\[\rho = \frac{M}{V} = \frac{M}{2N_A r_0^3}, \nonumber \]
حيث M هي كتلة مول واحد من الملح، و NANA هو رقم Avogadro، و r0r0 هي مسافة فصل التوازن. العامل 2 مطلوب لأن كل من أيونات الصوديوم والكلوريد تمثل حجمًا مكعبًا\(r_0^3\). نحصل على حل للمسافة
\[r_0^3 = \frac{M}{2N_A \rho} = \frac{58.4 \, g/mol}{2(6.03 \times 10^{23})(2.160 \, g/cm^3)} = 2.23 \times 10^{-23} \, cm^3, \nonumber \]أو
\[r_0 = 2.80 \times 10^{-8} cm = 0.280 \, nm. \nonumber \]
الطاقة الكامنة لزوج أيون واحد (\(Na^+ Cl^-\)) هي
\[U = -\alpha \frac{ke^2}{r_0} \left(1 - \frac{1}{n}\right), \nonumber \]
أين\(\alpha\) ثابت ماديلونج،\(r_0\) هو مسافة فصل التوازن، و n هو ثابت التنافر. NaCl هو FCC، لذا فإن ثابت Madelung هو\(\alpha = 1.7476\). باستبدال هذه القيم، نحصل على
\[U = -1.75 \frac{1.44 \, eV \cdot nm}{0.280 \, nm} \left(1 - \frac{1}{8}\right) = - 7.88 \frac{eV}{ion \, pair}. \nonumber \]
وبالتالي فإن طاقة التفكك لمول واحد من كلوريد الصوديوم هي
\[D = \left(\frac{7.88 \, eV}{ion \, pair}\right)\left( \frac{\frac{23.052 \, kcal}{1 \, mol}}{\frac{1 \, eV}{ion \, pair}}\right) = 182 \, kcal/mol = 760 \, kJ/mol. \nonumber \]
الأهمية
هذه القيمة النظرية لطاقة التفكك البالغة 766 كيلوجول/مول قريبة من القيمة التجريبية المقبولة البالغة 787 كيلوجول/مول. لاحظ أنه بالنسبة للكثافة الأكبر، تكون مسافة فصل التوازن بين أزواج الأيونات أصغر، كما هو متوقع. تعمل مسافة الفصل الصغيرة هذه على زيادة القوة بين الأيونات وبالتالي طاقة التفكك. استفاد التحويل في نهاية المعادلة من عامل التحويل\(1 \, kJ = 0.239 \, kcal\).
إذا كانت طاقة التفكك أكبر، فهل سيجعل ذلك من السهل أو الأصعب تفكيك المادة الصلبة؟
- إجابة
-
أكثر صعوبة
الرابطة التساهمية في المواد الصلبة
يمكن أيضًا تشكيل البلورات عن طريق الترابط التساهمي. على سبيل المثال، تعتبر الروابط التساهمية مسؤولة عن تجميع ذرات الكربون معًا في بلورات الماس. التكوين الإلكتروني لذرة الكربون هو\(1s^22s^22p^2\) - نواة He بالإضافة إلى أربعة إلكترونات تكافؤ. يقل تكوين الإلكترون هذا بأربعة إلكترونات عن الغلاف الكامل، لذلك من خلال مشاركة هذه الإلكترونات الأربعة مع ذرات الكربون الأخرى في رابطة تساهمية، يتم ملء أغلفة جميع ذرات الكربون. يحتوي الماس على بنية أكثر تعقيدًا من معظم البلورات الأيونية (الشكل\(\PageIndex{5}\)). كل ذرة كربون هي مركز رباعي السطوح العادي، والزاوية بين الروابط هي 110 °.110°. هذه الزاوية هي نتيجة مباشرة لاتجاه مدارات p لذرات الكربون.
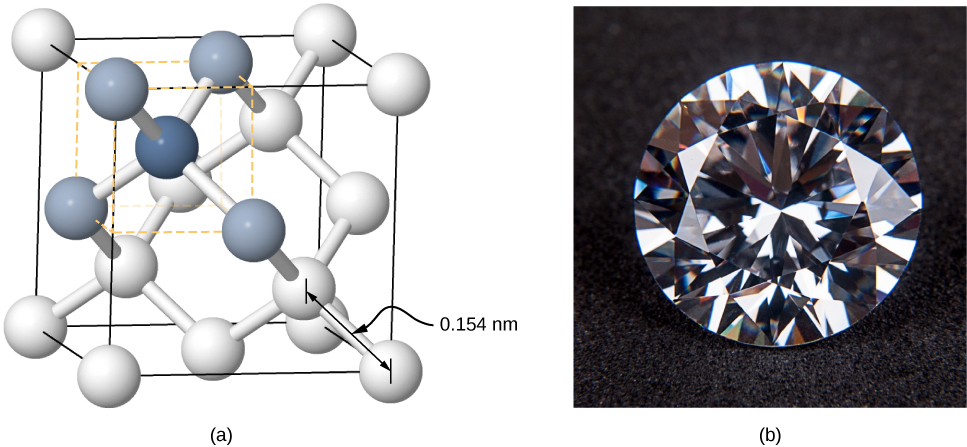
البلورات المرتبطة تساهميًا ليست موحدة مثل البلورات الأيونية ولكنها صلبة بشكل معقول ويصعب ذوبانها وغير قابلة للذوبان في الماء. على سبيل المثال، يتمتع الماس بدرجة حرارة انصهار عالية للغاية (4000 K) وهو شفاف للضوء المرئي. وبالمقارنة، فإن القصدير الملتصق تساهميًا (المعروف أيضًا باسم ألفا-تين، وهو غير معدني) يكون ناعمًا نسبيًا ويذوب عند 600 كلفن ويعكس الضوء المرئي. هناك مثالان مهمان آخران للبلورات المرتبطة تساهميًا هما السيليكون والجرمانيوم. يتم استخدام كل من هذه المواد الصلبة على نطاق واسع في تصنيع الصمامات الثنائية والترانزستورات والدوائر المتكاملة. سنعود إلى هذه المواد لاحقًا في مناقشتنا لأشباه الموصلات.
الرابطة المعدنية في المواد الصلبة
كما يوحي الاسم، فإن الرابطة المعدنية مسؤولة عن تكوين البلورات المعدنية. إلكترونات التكافؤ خالية أساسًا من الذرات وقادرة على التحرك بسهولة نسبيًا في جميع أنحاء البلورة المعدنية. يرجع الترابط إلى القوى الجذابة بين الأيونات الموجبة وإلكترونات التوصيل. الروابط المعدنية أضعف من الروابط الأيونية أو التساهمية، مع وجود طاقات تفكك في النطاق\(1 - 3 \, eV\).


