24.3: الالتهابات البكتيرية في الجهاز الهضمي
- Page ID
- 195480
أهداف التعلم
- حدد البكتيريا الأكثر شيوعًا التي يمكن أن تسبب التهابات الجهاز الهضمي
- قارن الخصائص الرئيسية لأمراض بكتيرية محددة تؤثر على الجهاز الهضمي
تحدث مجموعة واسعة من أمراض الجهاز الهضمي بسبب التلوث البكتيري للأغذية. تذكر أن الأمراض المنقولة بالغذاء يمكن أن تنشأ عن العدوى أو التسمم. في كلتا الحالتين، عادةً ما تكون السموم البكتيرية مسؤولة عن إنتاج علامات المرض وأعراضه. يكمن التمييز في مكان إنتاج السموم. في حالة العدوى، يتم ابتلاع العامل الميكروبي، واستعمار الأمعاء، ثم ينتج السموم التي تتلف الخلايا المضيفة. في حالة التسمم، تنتج البكتيريا السموم في الطعام قبل تناوله. في كلتا الحالتين، تتسبب السموم في تلف الخلايا المبطنة للجهاز الهضمي، وعادةً ما تكون القولون. وهذا يؤدي إلى العلامات والأعراض الشائعة للإسهال أو البراز المائي وتشنجات البطن، أو الزحار الأكثر حدة. غالبًا ما تشمل أعراض الأمراض المنقولة بالغذاء الغثيان والقيء، وهي آليات يستخدمها الجسم لطرد المواد السامة.
معظم أمراض الجهاز الهضمي البكتيرية قصيرة الأجل ومحدودة ذاتيًا؛ ومع ذلك، يمكن أن يؤدي فقدان السوائل بسبب مرض الإسهال الشديد إلى الجفاف الذي يمكن أن يكون مميتًا في بعض الحالات دون علاج مناسب. يعد العلاج بالإماهة الفموية باستخدام محاليل الإلكتروليت جانبًا أساسيًا من العلاج لمعظم مرضى أمراض الجهاز الهضمي، خاصة عند الأطفال والرضع.
التسمم الغذائي بالمكورات العنقودية
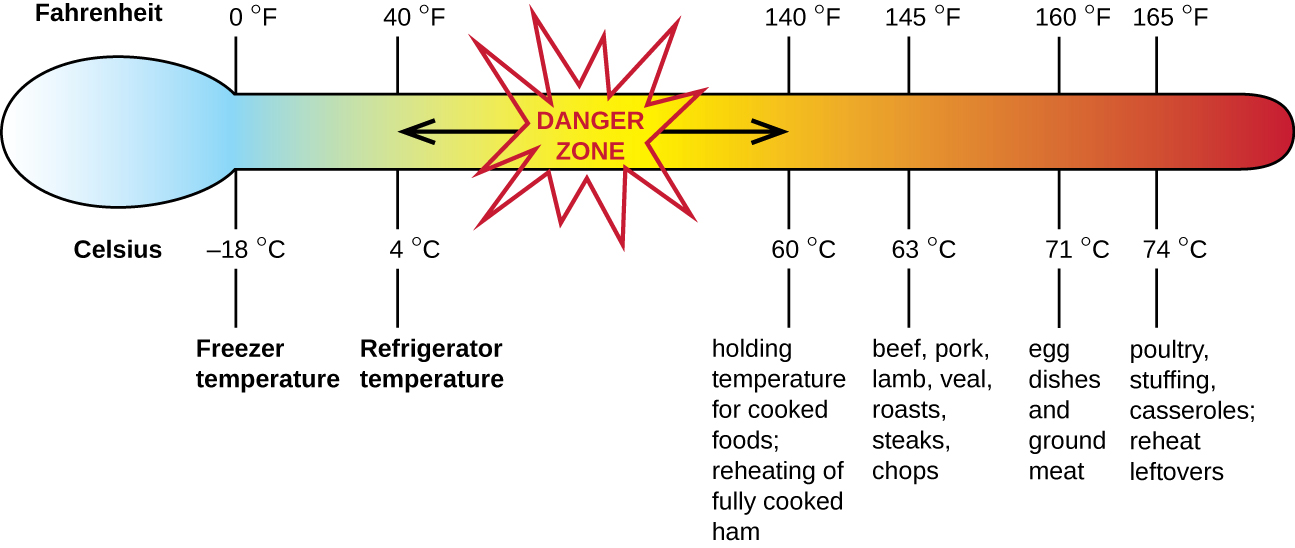
التسمم الغذائي بالمكورات العنقودية هو أحد أشكال التسمم الغذائي. عندما تنمو المكورات العنقودية الذهبية في الغذاء، فإنها قد تنتج السموم المعوية التي، عند تناولها، يمكن أن تسبب أعراضًا مثل الغثيان والإسهال والتشنج والقيء في غضون ساعة إلى ست ساعات. في بعض الحالات الشديدة، قد يسبب الصداع والجفاف والتغيرات في ضغط الدم ومعدل ضربات القلب. تزول العلامات والأعراض في غضون 24 إلى 48 ساعة. غالبًا ما يرتبط S. aureus بمجموعة متنوعة من الأطعمة النيئة أو غير المطبوخة جيدًا والمطبوخة بما في ذلك اللحوم (مثل اللحوم المعلبة ولحم الخنزير والنقانق) ومنتجات الألبان (مثل الجبن والحليب والزبدة). يوجد أيضًا بشكل شائع في اليدين ويمكن أن ينتقل إلى الأطعمة الجاهزة من خلال سوء النظافة، بما في ذلك سوء غسل اليدين واستخدام أسطح تحضير الطعام الملوثة، مثل ألواح التقطيع. الخطر الأكبر هو ترك الطعام عند درجة حرارة أقل من 60 درجة مئوية (140 درجة فهرنهايت)، مما يسمح للبكتيريا بالنمو. يجب إعادة تسخين الأطعمة المطبوخة بشكل عام إلى 60 درجة مئوية على الأقل (140 درجة فهرنهايت) من أجل السلامة ويجب طهي معظم اللحوم النيئة حتى درجات حرارة داخلية أعلى (الشكل\(\PageIndex{1}\)).
هناك ما لا يقل عن 21 من السموم المعوية للمكورات العنقودية والسموم الشبيهة بالمكورات العنقودية المعوية التي يمكن أن تسبب التسمم الغذائي. السموم المعوية هي بروتينات مقاومة لدرجة الحموضة المنخفضة، مما يسمح لها بالمرور عبر المعدة. وهي مستقرة بالحرارة ولا يتم تدميرها بالغليان عند 100 درجة مئوية، وعلى الرغم من أن البكتيريا نفسها قد تُقتل، إلا أن السموم المعوية وحدها يمكن أن تسبب القيء والإسهال، على الرغم من عدم فهم الآليات بشكل كامل. قد تكون بعض الأعراض على الأقل ناتجة عن عمل السموم المعوية كمستضد فائق وإثارة استجابة مناعية قوية من خلال تنشيط تكاثر الخلايا التائية.
يساعد الظهور السريع للعلامات والأعراض على تشخيص هذا المرض المنقول بالغذاء. نظرًا لأن البكتيريا لا تحتاج إلى أن تكون موجودة حتى يتسبب السم في ظهور الأعراض، يتم تأكيد التشخيص من خلال تحديد السم في عينة طعام أو في عينات بيولوجية (براز أو قيء) من المريض. يمكن أيضًا استخدام التقنيات المصلية، بما في ذلك ELISA، لتحديد السم في عينات الطعام.
تزول الحالة بشكل عام بسرعة نسبية، في غضون 24 ساعة، دون علاج. في بعض الحالات، قد تكون هناك حاجة إلى علاج داعم في المستشفى.
التمارين\(\PageIndex{1}\)
كيف يمكن أن تسبب S. aureus التسمم الغذائي؟
داء الشيغيلات (الزحار العصوي)
عندما يرتبط مرض الجهاز الهضمي ببكتيريا Shigella التي تشبه القضيب والتي لا تحتوي على جرامات، فإنها تسمى الزحار العصوي أو داء الشيغيلات. يمكن أن تحدث العدوى بسبب بكتيريا S. dysenteriae و/أو S. flexneri و/أو S. boydii و/أو S. sonnei التي تستعمر الجهاز الهضمي. يمكن أن ينتشر داء الشيغيلات من اليد إلى الفم أو من خلال الأغذية والمياه الملوثة. في معظم الأحيان، ينتقل المرض من خلال الطريق البرازي الفموي.
تغزو بكتيريا الشيغيلا الخلايا الظهارية المعوية. عند نقلها إلى فاجوسوم، يمكنها الهروب ثم العيش داخل السيتوبلازم للخلية أو الانتقال إلى الخلايا المجاورة. عندما تتكاثر الكائنات الحية، قد تتقرح الظهارة والهياكل ذات الخلايا M في بقع Peyer في الأمعاء وتتسبب في فقدان السوائل. غالبًا ما تتطور تشنجات المعدة والحمى والإسهال المائي الذي قد يحتوي أيضًا على القيح والمخاط و/أو الدم. قد تؤدي الحالات الأكثر شدة إلى تقرح الغشاء المخاطي والجفاف ونزيف المستقيم. بالإضافة إلى ذلك، قد يصاب المرضى لاحقًا بمتلازمة انحلال الدم اليوريمي (HUS)، وهي حالة خطيرة تتراكم فيها خلايا الدم التالفة في الكلى وقد تسبب الفشل الكلوي، أو التهاب المفاصل التفاعلي، وهي حالة يتطور فيها التهاب المفاصل في مفاصل متعددة بعد الإصابة. قد يصاب المرضى أيضًا بمتلازمة القولون العصبي المزمن بعد العدوى (IBS).
الزحار من النوع 1 قادر على إنتاج توكسين شيغا، الذي يستهدف الخلايا البطانية للأوعية الدموية الصغيرة في الأمعاء الدقيقة والغليظة عن طريق الارتباط بالجليكوسفنغوليبيد. بمجرد دخول الخلايا البطانية، يستهدف السم الوحدة الفرعية الريبوسومية الكبيرة، مما يؤثر على تخليق البروتين لهذه الخلايا. يمكن أن ينتج عن ذلك نزيف وآفات في القولون. يمكن أن يستهدف السم كبيبات الكلى، وهي الأوعية الدموية التي يبدأ عندها ترشيح الدم في الكلية، مما يؤدي إلى الإصابة بمتلازمة انحلال الدم اليوريمي.
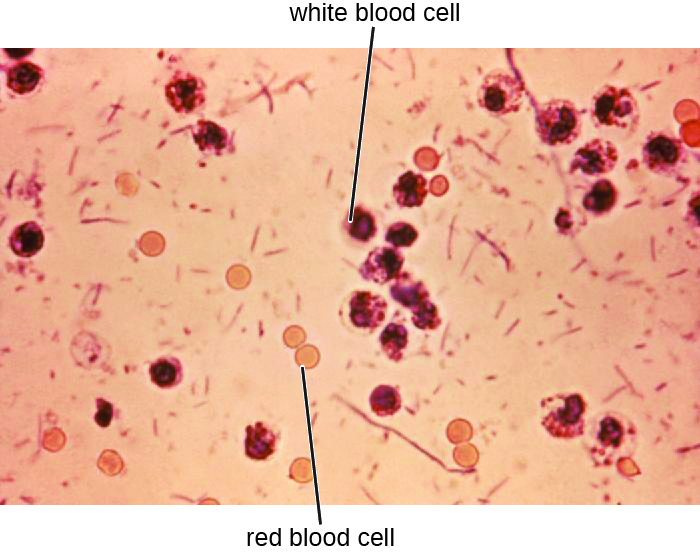
يتم تحليل عينات البراز، التي يجب معالجتها على الفور، باستخدام التقنيات المصلية أو الجزيئية. إحدى الطرق الشائعة هي إجراء مقايسات مناعية لـ S. dysenteriae. (تشمل الطرق الأخرى التي يمكن استخدامها لتحديد Shigella شرائط اختبار API أو أنظمة Enterotube أو اختبار PCR. يحدث وجود خلايا الدم البيضاء والدم في عينات البراز في حوالي 70٪ من المرضى 1 (الشكل\(\PageIndex{2}\)). قد تتطلب الحالات الشديدة مضادات حيوية مثل سيبروفلوكساسين وأزيثروميسين، ولكن يجب وصف هذه المضادات بعناية لأن المقاومة شائعة بشكل متزايد.
التمارين\(\PageIndex{2}\)
قارن وقارن بين عدوى الشيغيلا والتسمم.
داء السلمونيلات
يحدث التهاب المعدة والأمعاء بالسالمونيلا، المعروف أيضًا باسم داء السلمونيلات، بسبب بكتيريا السالمونيلا على شكل قضيب وسالبة الجرام. يسبب نوعان، S. enterica و S. bongori، المرض لدى البشر، لكن S. enterica هي الأكثر شيوعًا. الأنماط المصلية الأكثر شيوعًا لـ S. enterica هي Enteritidis و Typhi. سنناقش حمى التيفوئيد التي تسببها الأنماط المصلية Typhi و Paratyphi A بشكل منفصل. سنركز هنا على داء السلمونيلات الناجم عن الأنماط المصلية الأخرى.
السالمونيلا هي جزء من الميكروبات المعوية الطبيعية للعديد من الأفراد. ومع ذلك، يحدث داء السلمونيلات بسبب عوامل خارجية، ويمكن أن تحدث العدوى اعتمادًا على النمط المصلي وحجم اللقاح والصحة العامة للمضيف. تحدث العدوى بسبب تناول الأطعمة الملوثة أو التعامل مع قشر البيض أو التعرض لحيوانات معينة. تعتبر السالمونيلا جزءًا من ميكروبيوتا الدواجن، لذا فإن التعرض للبيض النيء والدواجن النيئة يمكن أن يزيد من خطر العدوى. يقلل غسل اليدين وطهي الأطعمة جيدًا بشكل كبير من خطر انتقال العدوى. يمكن أن تنجو بكتيريا السالمونيلا من التجمد لفترات طويلة ولكنها لا تستطيع تحمل درجات الحرارة المرتفعة.
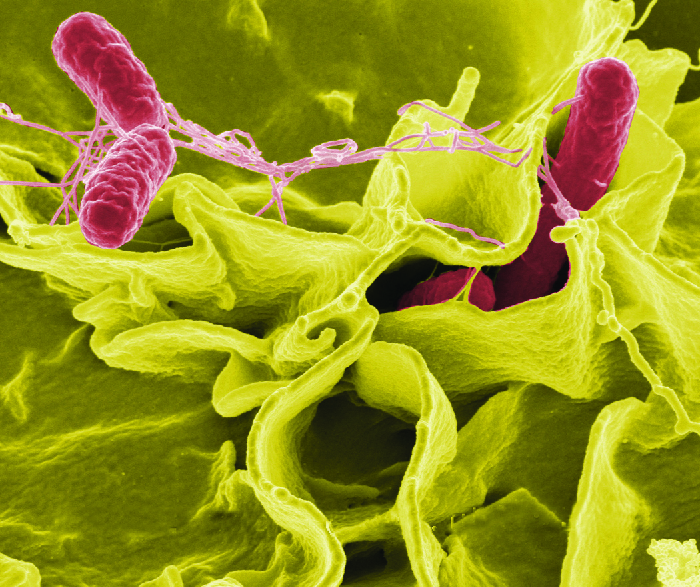
بمجرد ابتلاع البكتيريا، تتكاثر داخل الأمعاء وتخترق الخلايا المخاطية الظهارية عبر الخلايا M حيث تستمر في النمو (الشكل\(\PageIndex{3}\)). إنها تؤدي إلى العمليات الالتهابية وفرط إفراز السوائل. بمجرد دخولها الجسم، يمكن أن تستمر داخل فاجوسومات البلاعم. يمكن للسالمونيلا عبور غشاء الخلية الظهارية والدخول إلى مجرى الدم والجهاز اللمفاوي. تنتج بعض سلالات السالمونيلا أيضًا سمًا معويًا يمكن أن يسبب التسمم.
يصاب الأفراد المصابون بالحمى والغثيان وتشنجات البطن والقيء والصداع والإسهال. تستمر هذه العلامات والأعراض بشكل عام من بضعة أيام إلى أسبوع. وفقًا لمراكز السيطرة على الأمراض والوقاية منها (CDC)، هناك 1000000 حالة سنويًا، مع 380 حالة وفاة كل عام. 2 ومع ذلك، نظرًا لأن المرض عادة ما يكون مقيدًا ذاتيًا، لا يتم الإبلاغ عن العديد من الحالات للأطباء وقد يكون معدل الإصابة الإجمالي أقل من اللازم. يشمل التشخيص الثقافة متبوعة بالنمط المصلي وأخذ بصمات الحمض النووي إذا لزم الأمر. يتم الإبلاغ عن النتائج الإيجابية إلى CDC. عند اكتشاف نمط مصلي غير عادي، يتم إرسال العينات إلى CDC لمزيد من التحليل. التنميط المصلي مهم لتحديد العلاج. يشيع استخدام العلاج بالإماهة الفموية. يوصى باستخدام المضادات الحيوية فقط للحالات الخطيرة. عند الحاجة إلى المضادات الحيوية، كما هو الحال في المرضى الذين يعانون من نقص المناعة، يوصى باستخدام الفلوروكينولونات والجيل الثالث من السيفالوسبورين والأمبيسلين. تُعد مقاومة المضادات الحيوية مصدر قلق بالغ.
حمى التيفود
تتسبب أنماط مصلية معينة من المكورات المعوية، وخاصة النمط المصلي التيفي (S. typhi) وأيضًا الباراتيفي، في حدوث نوع أكثر حدة من داء السلمونيلات يسمى حمى التيفوئيد. هذا المرض الخطير، الذي يبلغ معدل الوفيات غير المعالج 10٪، يسبب ارتفاع درجة الحرارة وآلام الجسم والصداع والغثيان والخمول والطفح الجلدي المحتمل.
يحمل بعض الأفراد بكتيريا S. typhi دون ظهور علامات أو أعراض (تُعرف باسم ناقلات الأعراض) ويطلقونها باستمرار في برازهم. غالبًا ما تحتوي هذه الناقلات على البكتيريا في المرارة أو ظهارة الأمعاء. يمكن أن يصاب الأفراد الذين يستهلكون الطعام أو الماء الملوث بهذا البراز.
تخترق بكتيريا S. typhi الغشاء المخاطي المعوي، وتنمو داخل البلاعم، وتنتقل عبر الجسم، ولا سيما إلى الكبد والمرارة. في نهاية المطاف، تتحلل البلاعم، وتطلق بكتيريا S. typhi في مجرى الدم والجهاز اللمفاوي. يمكن أن تنتج الوفيات عن تقرح وانثقاب الأمعاء. يمكن أن تحدث مجموعة واسعة من المضاعفات، مثل الالتهاب الرئوي واليرقان، مع المرض المنتشر.
تحتوي بكتيريا S. typhi على جزر السالمونيلا المسببة للأمراض (SPI) التي تحتوي على جينات العديد من عوامل ضراوتها. هناك مثالان على سموم التيفوئيد المهمة وهما مستضد Vi، الذي يقوم بالتشفير لإنتاج الكبسولات، وتوكسين A2B5 الخيالي، الذي يسبب العديد من علامات وأعراض المرحلة الحادة من حمى التيفوئيد.
يتم استخدام الفحص السريري والثقافة لإجراء التشخيص. يمكن زراعة البكتيريا من البراز أو البول أو الدم أو نخاع العظام. يتم استخدام علم الأمصال، بما في ذلك ELISA، لتحديد أكثر السلالات المسببة للأمراض، ولكن هناك حاجة إلى التأكيد من خلال اختبار الحمض النووي أو الثقافة. يمكن أيضًا استخدام اختبار PCR، ولكنه غير متاح على نطاق واسع.
يشمل العلاج بالمضادات الحيوية الموصى به الفلوروكينولونات والسيفترياكسون والأزيثروميسين. يجب أن يكون الأفراد حذرين للغاية لتجنب إصابة الآخرين أثناء العلاج. يمكن الوقاية من حمى التيفوئيد من خلال التطعيم للأفراد الذين يسافرون إلى أجزاء من العالم حيث تنتشر.
التمارين\(\PageIndex{3}\)
لماذا يعتبر التنميط المصلي مهمًا بشكل خاص في عدوى السالمونيلا وحمى التيفوئيد؟
كانت ماري مالون مهاجرة إيرلندية عملت كطاهية في نيويورك في أوائل القرن العشرين. على مدى سبع سنوات، من 1900 إلى 1907، عملت مالون في عدد من الأسر المختلفة، ونشرت المرض دون قصد إلى الأشخاص الذين عاشوا في كل منها. في عام 1906، استأجرت إحدى العائلات جورج سوبر، الخبير في أوبئة حمى التيفوئيد، لتحديد سبب الأمراض في أسرتها. في نهاية المطاف، تعقبت سوبر مالون وربطت مباشرة 22 حالة من حمى التيفوئيد بها. اكتشف أن مالون كانت حاملة للتيفوئيد لكنها كانت محصنة ضده بنفسها. على الرغم من التعرف على الناقلات النشطة من قبل، كانت هذه هي المرة الأولى التي يتم فيها تحديد حامل للعدوى بدون أعراض.
لأنها هي نفسها لم تكن مريضة أبدًا، وجدت مالون صعوبة في تصديق أنها يمكن أن تكون مصدر المرض. هربت من سوبر والسلطات لأنها لم ترغب في أن يتم وضعها في الحجر الصحي أو إجبارها على التخلي عن مهنتها، والتي كانت تتقاضى أجرًا جيدًا نسبيًا لشخص لديه خلفيتها. ومع ذلك، تم القبض على مالون في النهاية وتم الاحتفاظ بها في منشأة عزل في برونكس، حيث بقيت حتى عام 1910، عندما أفرجت عنها إدارة الصحة في نيويورك بشرط ألا تعمل مرة أخرى مع الطعام. لسوء الحظ، لم تمتثل مالون، وسرعان ما بدأت العمل كطاهية مرة أخرى. بعد ظهور حالات جديدة أسفرت عن وفاة شخصين، قامت السلطات بتعقبها مرة أخرى وأعادتها إلى العزل، حيث بقيت لمدة 23 عامًا إضافيًا حتى وفاتها في عام 1938. تمكن علماء الأوبئة من تتبع 51 حالة من حمى التيفوئيد وثلاث حالات وفاة مباشرة إلى مالون، الذي يُذكر على نحو لا يُحب باسم «تيفوئيد ماري».
ترتبط حالة التيفوئيد ماري ارتباطًا مباشرًا في صناعة الرعاية الصحية. لنأخذ على سبيل المثال كاسي هيكوكس، الممرضة الأمريكية التي عالجت مرضى الإيبولا في غرب إفريقيا خلال وباء عام 2014. بعد عودتها إلى الولايات المتحدة، تم وضع هيكوكس في الحجر الصحي ضد إرادتها لمدة ثلاثة أيام وتبين لاحقًا أنها ليست مصابة بالإيبولا. عارض Hickox بشدة الحجر الصحي. في افتتاحية نُشرت في صحيفة الجارديان البريطانية، قال 3 هيكوكس إن الحجر الصحي للعاملين في مجال الرعاية الصحية الذين لا تظهر عليهم أعراض والذين لم تثبت إصابتهم بمرض ما لن يمنع هؤلاء الأفراد من ممارسة مهنتهم فحسب، بل سيثني الآخرين عن التطوع للعمل فيها المناطق المليئة بالأمراض حيث هناك حاجة ماسة إلى العاملين في مجال الرعاية الصحية.
ما هي مسؤولية فرد مثل ماري مالون لتغيير سلوكها لحماية الآخرين؟ ماذا يحدث عندما يعتقد الفرد أنها ليست مخاطرة، لكن يعتقد البعض الآخر أنها كذلك؟ كيف سيكون رد فعلك إذا كنت في مكان مالون وتم وضعك في الحجر الصحي الذي لا تعتقد أنه ضروري، على حساب حريتك الخاصة وربما حياتك المهنية؟ هل يهم إذا كنت مصابًا بالتأكيد أم لا؟
عدوى E. coli
يعتبر القضيب السالب للجرام Escherichia coli عضوًا شائعًا في الميكروبات الطبيعية للقولون. على الرغم من أن الغالبية العظمى من سلالات E. coli هي بكتيريا مصاحبة مفيدة، إلا أن بعضها يمكن أن يكون مسببًا للأمراض وقد يسبب مرض إسهال خطير. تحتوي السلالات المسببة للأمراض على عوامل ضراوة إضافية مثل الأورام الليفية من النوع الأول التي تعزز استعمار القولون أو قد تنتج السموم (انظر عوامل ضراوة مسببات الأمراض البكتيرية والفيروسية). يتم الحصول على عوامل الضراوة هذه من خلال النقل الأفقي للجينات.
يمكن أن يحدث مرض خارج الأمعاء إذا انتشرت البكتيريا من الجهاز الهضمي. على الرغم من أن هذه البكتيريا يمكن أن تنتقل من شخص لآخر، إلا أنها غالبًا ما يتم الحصول عليها من خلال الطعام أو الماء الملوث. هناك ست مجموعات مسببة للأمراض معروفة من E. coli، لكننا سنركز هنا على المجموعات الأربع الأكثر شيوعًا التي تنتقل عن طريق الطعام والماء.
تسبب الإشريكية القولونية المعوية (ETEC)، والمعروفة أيضًا باسم إسهال المسافر، مرض الإسهال وهي شائعة في البلدان الأقل تقدمًا. في المكسيك، يُطلق على عدوى ETEC اسم انتقام مونتيزوما. بعد تناول الطعام أو الماء الملوث، يصاب الأفراد المصابون بالإسهال المائي وتشنجات البطن والشعور بالضيق (الشعور بالإعياء) وانخفاض درجة الحرارة. ينتج ETEC سمًا معويًا مستقرًا للحرارة يشبه توكسين الكوليرا، ومواد لاصقة تسمى عوامل الاستعمار التي تساعد البكتيريا على الالتصاق بجدار الأمعاء. تنتج بعض سلالات ETEC أيضًا سموم قابلة للحرارة. عادة ما يكون المرض خفيفًا نسبيًا ومقيدًا ذاتيًا. يشمل التشخيص الزراعة و PCR. إذا لزم الأمر، قد يؤدي العلاج بالمضادات الحيوية بالفلوروكينولونات والدوكسيسيكلين والريفاكسيمين وتريميثوبريم-سلفاميثوكسازول (TMP/SMZ) إلى تقصير مدة الإصابة. ومع ذلك، تمثل مقاومة المضادات الحيوية مشكلة.
الإشريكية القولونية المعوية (EIEC) تشبه إلى حد كبير داء الشيغيلات، بما في ذلك التسبب في الغزو داخل الخلايا للأنسجة الظهارية المعوية. تحمل هذه البكتيريا بلازميد كبير يشارك في اختراق الخلايا الظهارية. عادة ما يكون المرض مقيدًا ذاتيًا، مع أعراض تشمل الإسهال المائي والقشعريرة والتشنجات والشعور بالضيق والحمى والدوسنتاريا. يمكن استخدام الزراعة واختبار PCR للتشخيص. لا ينصح بالعلاج بالمضادات الحيوية، لذلك يتم استخدام العلاج الداعم إذا لزم الأمر.
يمكن أن تسبب الإشريكية القولونية المعوية (EPEC) إسهالًا مميتًا، خاصة عند الرضع وأولئك الذين يعيشون في البلدان الأقل نموًا. يمكن أن تؤدي الحمى والقيء والإسهال إلى الجفاف الشديد. تحقن هذه الإشريكية القولونية بروتينًا (Tir) يلتصق بسطح الخلايا الظهارية المعوية ويؤدي إلى إعادة ترتيب أكتين الخلية المضيفة من الزغابات الدقيقة إلى الركائز. يحدث أيضًا أن Tir هو مستقبل Intimin، وهو بروتين سطحي تنتجه EPEC، مما يسمح للإشريكية القولونية «بالجلوس» على قاعدة التمثال. يتم ترميز الجينات اللازمة لتكوين قاعدة التمثال هذه على موضع جزيرة إمراضية انصهار الخلايا المعوية (LEE). كما هو الحال مع ETEC، يشمل التشخيص الزراعة و PCR. العلاج مشابه لذلك الخاص بـ ETEC.
أخطر السلالات هي E. coli النزفية المعوية (EHEC)، وهي السلالات القادرة على التسبب في الأوبئة. على وجه الخصوص، كانت السلالة O157: H7 مسؤولة عن العديد من حالات التفشي الأخيرة. تذكر أن O و H يشيران إلى المستضدات السطحية التي تساهم في الإمراضية وتحفز الاستجابة المناعية للمضيف (يشير «O» إلى السلسلة الجانبية O من السكاريد الدهني ويشير الحرف «H» إلى السوط). على غرار EPEC، تشكل EHEC أيضًا الركائز. تنتج EHEC أيضًا سمًا يشبه Shiga. نظرًا لتسلسل جينوم هذه البكتيريا، فمن المعروف أن جينات سموم شيغا تم اكتسابها على الأرجح من خلال النقل (النقل الأفقي للجينات). نشأت جينات شيغا توكسين من الشيغيلا dysenteriae. نبوءة من فصيلة بكتيرية أصابت الشيغيلا سابقًا واندمجت في كروموسوم E. coli. غالبًا ما يُطلق على السم الشبيه بالشيجا اسم الفيروتوكسين.
يمكن أن يسبب EHEC مرضًا يتراوح من خفيف نسبيًا إلى مهدد للحياة. تشمل الأعراض الإسهال الدموي مع التشنج الشديد، ولكن بدون حمى. على الرغم من أنه غالبًا ما يكون مقيدًا ذاتيًا، إلا أنه قد يؤدي إلى التهاب القولون النزفي والنزيف الغزير. أحد المضاعفات المحتملة هو HUS. يشمل التشخيص الزرع، وغالبًا ما يتم استخدام MacConkey مع أجار السوربيتول للتمييز بين E. coli O157:H7، التي لا تخمر السوربيتول، وغيرها من السلالات الأقل ضراوة من E. coli التي يمكنها تخمير السوربيتول.
يمكن أيضًا استخدام الكتابة المصلية أو اختبار PCR، بالإضافة إلى الاختبار الجيني لتوكسين شيغا. لتمييز EPEC عن EHEC، نظرًا لأن كلاهما يشكل ركائز على الخلايا الظهارية المعوية، فمن الضروري اختبار تشفير الجينات لكل من السم الشبيه بالشيغا و LEE. يحتوي كل من EPEC و EHEC على LEE، لكن EPEC يفتقر إلى جين توكسين شيغا. لا يُنصح بالعلاج بالمضادات الحيوية وقد يؤدي ذلك إلى تفاقم متلازمة انحلال الدم اليوريمي بسبب السموم المنبعثة عند قتل البكتيريا، لذلك يجب استخدام العلاجات الداعمة. \(\PageIndex{1}\)يلخص الجدول خصائص المجموعات المسببة للأمراض الأربع الأكثر شيوعًا.
| مجموعة | عوامل الضراوة والجينات | العلامات والأعراض | اختبارات تشخيصية | العلاج |
|---|---|---|---|---|
| الإشريكية القولونية المعوية (ETEC) | توكسين معوي مستقر حراريًا يشبه توكسين الكوليرا | إسهال مائي خفيف نسبيًا | الثقافة، PCR | الحد الذاتي؛ إذا لزم الأمر، الفلوروكينولونات، الدوكسيسيكلين، ريفاكسيمين، TMP/SMZ؛ مقاومة المضادات الحيوية هي مشكلة |
| الإشريكية القولونية المعوية (EIEC) | جينات البلازميد الإنفينية (الغازية) | إسهال مائي خفيف نسبيًا؛ قد يحدث الزحار أو التهاب القولون الالتهابي | الاستنبات، PCR؛ اختبار الجين الوريدي؛ فحوصات إضافية للتمييز عن الشيغيلا | العلاج الداعم فقط؛ لا ينصح باستخدام المضادات الحيوية |
| الإشريكية القولونية المعوية (EPEC) | موضع مسح الخلايا المعوية (LEE) - جزيرة الإمراضية | حمى شديدة، قيء، إسهال غير دموي، جفاف؛ قد تكون قاتلة | الزراعة، PCR؛ الكشف عن LEE الذي يفتقر إلى جينات سامة تشبه الشيغا | الحد الذاتي؛ إذا لزم الأمر، الفلوروكينولونات والدوكسيسيكلين والريفاكسيمين (TMP/SMZ)؛ مقاومة المضادات الحيوية هي مشكلة |
| الإشريكية القولونية المعوية النزفية (EHEC) | فيروتوكسين | قد يكون خفيفًا أو شديدًا جدًا؛ إسهال دموي؛ قد يؤدي إلى متلازمة انحلال الدم اليوريمي | الزراعة؛ وضع لوحة على أجار MacConkey مع أجار السوربيتول لأنه لا يخمر السوربيتول؛ الكشف عن تفاعل البوليميراز الثنائي الفينيل متعدد الكلور الذي يحتوي على جينات سامة تشبه شيغا | لا ينصح بالمضادات الحيوية بسبب خطر HUS |
التمارين\(\PageIndex{4}\)
قارن وقارن بين عوامل الضراوة وعلامات وأعراض العدوى مع مجموعات E. coli الأربعة الرئيسية.
الكوليرا وغيرها من الضمائم
مرض الكوليرا المعدي المعوي هو عدوى خطيرة غالبًا ما ترتبط بسوء الصرف الصحي، خاصة بعد الكوارث الطبيعية، لأنها تنتشر من خلال المياه الملوثة والأغذية التي لم يتم تسخينها إلى درجات حرارة عالية بما يكفي لقتل البكتيريا. وينجم هذا المرض عن النمط المصلي لداء الضمة الكوليرية O1، وهو جرثومة سوطية سالبة الجرام على شكل قضيب منحني (فيبريو). وفقًا لمركز مكافحة الأمراض والوقاية منها، تتسبب الكوليرا في ما يقدر بـ 3 إلى 5 ملايين حالة و100000 حالة وفاة كل عام. 4
نظرًا لأن V. cholerae تُقتل بحمض المعدة، هناك حاجة إلى جرعات كبيرة نسبيًا لعدد قليل من الخلايا الميكروبية للبقاء على قيد الحياة للوصول إلى الأمعاء والتسبب في العدوى. تنتقل الخلايا المتحركة عبر الطبقة المخاطية للأمعاء، حيث تلتصق بالخلايا الظهارية وتطلق السموم المعوية للكوليرا. السم هو توكسين A-B مع نشاط من خلال أدينيلات سيكلاز (انظر عوامل ضراوة مسببات الأمراض البكتيرية والفيروسية). داخل الخلية المعوية، تزداد مستويات AMP الدوري (CamP)، مما ينشط قناة الكلوريد ويؤدي إلى إطلاق الأيونات في التجويف المعوي. تؤدي هذه الزيادة في الضغط الاسموزي في التجويف إلى دخول الماء أيضًا إلى التجويف. عندما يغادر الماء والإلكتروليتات الجسم، يتسبب ذلك في الجفاف السريع وعدم توازن الإلكتروليت. الإسهال غزير جدًا لدرجة أنه غالبًا ما يطلق عليه «براز ماء الأرز»، ويتم وضع المرضى في مهود بها ثقب لمراقبة فقدان السوائل (الشكل\(\PageIndex{4}\)).
يتم تشخيص الكوليرا عن طريق أخذ عينة من البراز وزراعة عقار فيبريو. البكتيريا إيجابية للأوكسيديز وتظهر تخمرًا بدون اللاكتوز في أجار MacConkey. ستنتج مخمرات اللاكتوز سالبة الجرام مستعمرات حمراء بينما تنتج أجهزة التخمير غير المخمرة مستعمرات بيضاء/عديمة اللون. لن تنمو البكتيريا الإيجابية بالجرام على MacConkey. يُستخدم تخمير اللاكتوز بشكل شائع لتحديد مسببات الأمراض لأن الميكروبات الطبيعية تخمر اللاكتوز بشكل عام بينما لا تقوم مسببات الأمراض بذلك. يمكن أيضًا استزراع بكتيريا الضمة الكوليرية على أجار أملاح السكروز (TCBS) التي تحتوي على سيترات ثيوسلفات، وهي مادة انتقائية وتفاضلية لمادة Vibrio spp، التي تنتج مستعمرة صفراء مميزة.
قد يتم الحد من الكوليرا ذاتيًا ويتضمن العلاج إعادة التميؤ وتجديد الإلكتروليت. على الرغم من أن المضادات الحيوية ليست ضرورية عادةً، إلا أنه يمكن استخدامها لعلاج الأمراض الشديدة أو المنتشرة. يوصى باستخدام التتراسيكلين، ولكن يمكن استخدام الدوكسيسيكلين والإريثروميسين والأورفلوكساسين والسيبروفلوكساسين و TMP/SMZ. تشير الأدلة الحديثة إلى أن أزيثروميسين هو أيضًا مضاد حيوي جيد من الخط الأول. يعد الصرف الصحي الجيد - بما في ذلك المعالجة المناسبة لمياه الصرف الصحي والإمدادات النظيفة للطهي ومياه الشرب النقية - أمرًا مهمًا لمنع العدوى (الشكل\(\PageIndex{4}\))

V. الكوليرا ليست نوع Vibrio الوحيد الذي يمكن أن يسبب المرض. يرتبط V. parahemolyticus باستهلاك المأكولات البحرية الملوثة ويسبب أمراض الجهاز الهضمي مع علامات وأعراض مثل الإسهال المائي والغثيان والحمى والقشعريرة وتشنجات البطن. تنتج البكتيريا هيموليسين مستقر الحرارة، مما يؤدي إلى الزحار والأمراض المنتشرة المحتملة. كما أنه يسبب أحيانًا التهابات الجروح. يتم تشخيص V. parahemolyticus باستخدام مستنبتات من الدم أو البراز أو الجرح. كما هو الحال مع V. cholera، يعمل الوسط الانتقائي (خاصة TCBS agar) بشكل جيد. يمكن استخدام التتراسيكلين والسيبروفلوكساسين لعلاج الحالات الشديدة، ولكن المضادات الحيوية بشكل عام ليست ضرورية.
يوجد Vibrio vulnificus في مياه البحر الدافئة، وعلى عكس V. cholerae، لا يرتبط بالظروف الصحية السيئة. يمكن العثور على البكتيريا في المأكولات البحرية النيئة، ويسبب الابتلاع أمراض الجهاز الهضمي. يمكن أيضًا الحصول عليها من قبل الأفراد الذين يعانون من جروح جلدية مفتوحة يتعرضون للماء بتركيزات عالية من العامل الممرض. في بعض الحالات، تنتشر العدوى إلى مجرى الدم وتسبب تسمم الدم. يمكن أن تؤدي عدوى الجلد إلى الوذمة والكدمة (تغير لون الجلد بسبب النزيف) والخراجات. المرضى الذين يعانون من مرض كامن لديهم معدل وفيات مرتفع يبلغ حوالي 50٪. إنه مصدر قلق خاص للأفراد المصابين بأمراض الكبد المزمنة أو الذين يعانون من نقص المناعة لأن الجهاز المناعي الصحي يمكن أن يمنع العدوى من التطور في كثير من الأحيان. يتم تشخيص V. vulnificus عن طريق زراعة العامل الممرض من عينات البراز أو عينات الدم أو خراجات الجلد. يتم علاج المرضى البالغين بالدوكسيسيكلين جنبًا إلى جنب مع الجيل الثالث من السيفالوسبورين أو بالفلوروكينولونات، ويتم علاج الأطفال بـ TMP/SMZ.
يرتبط اثنان من الضمائر الأخرى، وهما Aeromonas hydrophila و Plesiomonas shigelloides، أيضًا بالبيئات البحرية والمأكولات البحرية النيئة؛ ويمكن أن يتسببوا أيضًا في التهاب المعدة والأمعاء. مثل V. vulnificus، غالبًا ما ترتبط A. hydrophila بالتهابات الجروح، عمومًا تلك المكتسبة في الماء. في بعض الحالات، يمكن أن يسبب أيضًا تسمم الدم. يمكن أن تسبب الأنواع الأخرى من Aeromonas المرض. ترتبط P. shigelloides أحيانًا بالتهابات جهازية أكثر خطورة إذا تم تناولها في طعام أو ماء ملوث. يمكن استخدام الثقافة لتشخيص عدوى A. hydrophila و P. shigelloides، والتي لا تحتاج عمومًا إلى العلاج بالمضادات الحيوية. عند الضرورة، يمكن استخدام التتراسيكلين والسيبروفلوكساسين، من بين المضادات الحيوية الأخرى، لعلاج A. hydrophila، والفلوروكينولونات وتريميثوبريم هي العلاجات الفعالة لـ P. shigelloides.
التمارين\(\PageIndex{5}\)
كيف تتسبب عدوى الكوليرا V. في الجفاف السريع؟
كامبيلوباكتر لالتهاب المعدة والأمعاء
كامبيلوباكتر هو جنس من البكتيريا سالبة الجرام أو اللولبية أو المنحنية. قد يكون لديهم سوط واحد أو سوطين. التهاب المعدة والأمعاء العطيفة، وهو شكل من أشكال داء العطيفة، هو مرض واسع الانتشار يسببه كامبيلوباكتر جيجوني. الطريق الرئيسي لانتقال العدوى هو من خلال الدواجن التي تصبح ملوثة أثناء الذبح. يؤدي التعامل مع الدجاج النيء بدوره إلى تلويث أسطح الطهي والأواني والأطعمة الأخرى. يعتبر الحليب غير المبستر أو المياه الملوثة أيضًا وسيلة محتملة لانتقال العدوى. في معظم الحالات، يكون المرض مقيدًا ذاتيًا ويشمل الحمى والإسهال والتشنجات والقيء وأحيانًا الزحار. تحدث أحيانًا علامات وأعراض أكثر خطورة، مثل تجرثم الدم والتهاب السحايا والتهاب البنكرياس والتهاب المرارة والتهاب الكبد. وقد ارتبط أيضًا بأمراض المناعة الذاتية مثل متلازمة Guillain-Barré، وهو مرض عصبي يحدث بعد بعض الالتهابات ويؤدي إلى شلل مؤقت. يمكن أن تحدث العدوى التالية لـ HUS أيضًا. إن ضراوة العديد من السلالات هي نتيجة إنتاج الهيموليسين ووجود سم الكامبيلوباكتر المنتشر للخلايا (CDT)، وهو ديوكسي ريبونوكلياز قوي (DNaSE) يدمر الحمض النووي للخلايا المضيفة بشكل لا رجعة فيه.
يشمل التشخيص الزراعة في ظل ظروف خاصة، مثل ارتفاع درجة الحرارة، وانخفاض توتر الأكسجين، وغالبًا ما يتم تكميله بكميات متوسطة بعوامل مضادة للميكروبات. يجب زراعة هذه البكتيريا في وسط انتقائي (مثل Campy CV أو وسط انتقائي للفحم أو أجار ديوكسي تشولات فحم سيفابيرازون) واحتضانها تحت ظروف ميكروإيروفيليك لمدة 72 ساعة على الأقل عند 42 درجة مئوية، ولا تكون هناك حاجة عادةً للعلاج بالمضادات الحيوية، ولكن يمكن استخدام الإريثروميسين أو السيبروفلوكساسين.
قرحة هضمية
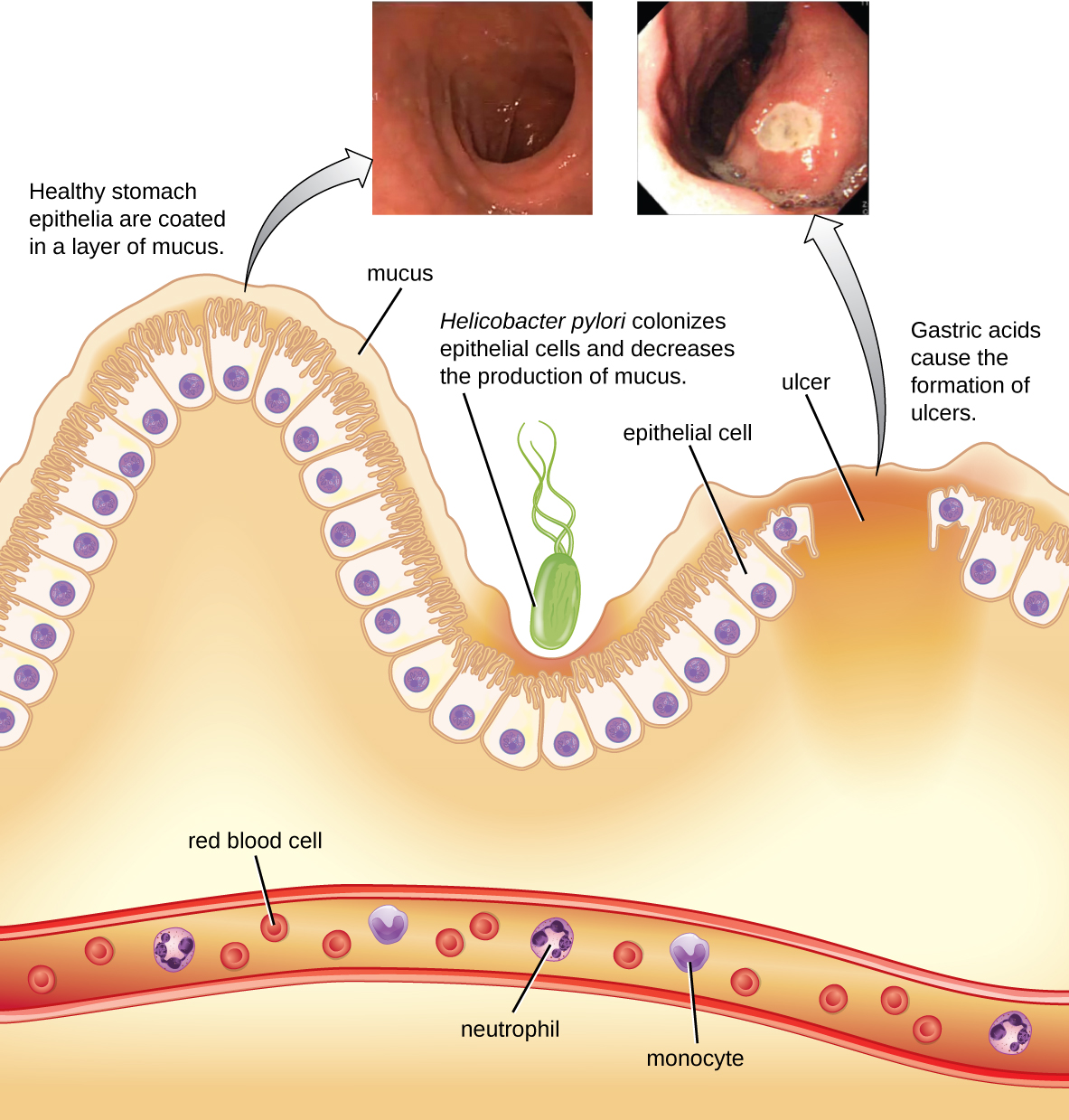
إن بكتيريا Helicobacter pylori التي لا تحمل الجرام قادرة على تحمل البيئة الحمضية للمعدة البشرية وقد ثبت أنها سبب رئيسي للقرحة الهضمية، وهي قرحة المعدة أو الاثني عشر. ترتبط البكتيريا أيضًا بزيادة خطر الإصابة بسرطان المعدة (الشكل\(\PageIndex{5}\)). وفقًا لمركز مكافحة الأمراض والوقاية منها (CDC)، فإن ما يقرب من ثلثي السكان مصابون ببكتيريا H. pylori، ولكن أقل من 20٪ معرضون لخطر الإصابة بالقرحة أو سرطان المعدة. توجد بكتيريا H. pylori في حوالي 80٪ من قرحة المعدة وفي أكثر من 90٪ من قرحة الاثني عشر. 5
تستعمر بكتيريا H. pylori الخلايا الظهارية في المعدة باستخدام pili للالتصاق. تنتج هذه البكتيريا اليورياز، الذي يحفز الاستجابة المناعية وينتج الأمونيا التي تعمل على تحييد أحماض المعدة لتوفير بيئة ميكروية أكثر ملاءمة. تتلف العدوى خلايا بطانة المعدة، بما في ذلك تلك التي تنتج عادة المخاط الواقي الذي يعمل كحاجز بين الأنسجة وحمض المعدة. ونتيجة لذلك، يحدث الالتهاب (التهاب المعدة) وقد تتطور القرحة ببطء. يمكن أن يحدث تكوين القرحة أيضًا بسبب نشاط السموم. تم الإبلاغ عن أن 50٪ من العزلات السريرية لـ H. pylori لها مستويات يمكن اكتشافها من نشاط السموم الخارجية في المختبر. 6 هذا السم، VaCa، يحفز تكوين فجوة في الخلايا المضيفة. لا يحتوي VaCA على تماثل التسلسل الأولي مع السموم البكتيرية الأخرى، وفي نموذج الفأر، هناك علاقة بين وجود الجين السام ونشاط السم وتلف الأنسجة الظهارية في المعدة.
تشمل العلامات والأعراض الغثيان ونقص الشهية والانتفاخ والتجشؤ وفقدان الوزن. قد تنتج قرحة النزيف برازًا داكنًا. إذا لم يتم توفير العلاج، يمكن أن تصبح القرحة أكثر عمقًا، ويمكن أن يصاب المزيد من الأنسجة، ويمكن أن يحدث ثقب في المعدة. نظرًا لأن الانثقاب يسمح بإنزيمات الجهاز الهضمي والأحماض بالتسرب إلى الجسم، فهي حالة خطيرة جدًا.
لتشخيص عدوى بكتيريا H. pylori، تتوفر طرق متعددة. في اختبار التنفس، يبتلع المريض اليوريا التي تحمل علامة إشعاعية. في حالة وجود بكتيريا H. pylori، ستنتج البكتيريا اليوريا لتحطيم اليوريا. ينتج عن هذا التفاعل ثاني أكسيد الكربون المشع الذي يمكن اكتشافه في نفس المريض. يمكن أيضًا استخدام اختبار الدم للكشف عن الأجسام المضادة لـ H. pylori. يمكن اكتشاف البكتيريا نفسها باستخدام اختبار البراز أو خزعة جدار المعدة.
يمكن استخدام المضادات الحيوية لعلاج العدوى. ومع ذلك، فإن توصية إدارة الغذاء والدواء الأمريكية، التي تنفرد بها بكتيريا H. pylori، هي استخدام العلاج الثلاثي. البروتوكولات الحالية هي 10 أيام من العلاج بأوميبرازول وأموكسيسيلين وكلاريثروميسين (OAC)؛ 14 يومًا من العلاج باستخدام بسموث سبساليسيلات وميترونيدازول والتتراسيكلين (BMT)؛ أو 10 أو 14 يومًا من العلاج باستخدام لانسوبرازول وأموكسيسيلين وكلاريثروميسين (LAC). لا تعتبر أوميبرازول وبزموت سبساليسيلات ولانسوبرازول من المضادات الحيوية ولكنها تستخدم بدلاً من ذلك لتقليل مستويات الحمض لأن H. pylori تفضل البيئات الحمضية.
على الرغم من أن العلاج غالبًا ما يكون ذا قيمة، إلا أن هناك أيضًا مخاطر لاستئصال بكتيريا الملوية البوابية. قد تحمي العدوى ببكتيريا الملوية البوابية فعليًا من بعض أنواع السرطان، مثل سرطان المريء ومرض الارتجاع المعدي المريئي. 7 8
التمارين\(\PageIndex{6}\)
كيف تسبب بكتيريا الملوية البوابية القرحة الهضمية؟
التهاب المعدة والأمعاء الحاد
التهاب المعدة والأمعاء المطثية perfringens هو مرض خفيف ينتقل عن طريق الغذاء بشكل عام ويرتبط باللحوم غير المطبوخة جيدًا والأطعمة الأخرى. C. perfringens هي بكتيريا لاهوائية موجبة الجرام على شكل قضيب مكونة للأبواغ وتتحمل درجات الحرارة العالية والمنخفضة. في درجات الحرارة المرتفعة، يمكن للبكتيريا تكوين مسام داخلية تنبت بسرعة في الأطعمة أو داخل الأمعاء. التسمم الغذائي حسب سلالات النوع A شائع. تنتج هذه السلالة دائمًا السموم المعوية، الموجودة أحيانًا أيضًا في سلالات أخرى، والتي تسبب الأعراض السريرية للتشنجات والإسهال. يتسبب شكل أكثر حدة من المرض، يسمى خنزير البحر أو التهاب الأمعاء النخرية، في حدوث نزيف وألم وقيء وانتفاخ. قد ينتج عن ذلك حدوث الغرغرينا في الأمعاء. يحتوي هذا النموذج على معدل وفيات مرتفع ولكنه نادر في الولايات المتحدة.
يشمل التشخيص الكشف عن توكسين C. perfrengens في عينات البراز باستخدام تقنيات البيولوجيا الجزيئية (اكتشاف PCR للجين السام) أو تقنيات المناعة (ELISA). يمكن أيضًا اكتشاف البكتيريا نفسها في الأطعمة أو في عينات البراز. يشمل العلاج العلاج بالإماهة واستبدال الإلكتروليت والسوائل الوريدية. لا ينصح بالمضادات الحيوية لأنها يمكن أن تضر بتوازن الميكروبات في الأمعاء، وهناك مخاوف بشأن مقاومة المضادات الحيوية. يمكن الوقاية من المرض من خلال التعامل السليم مع الأطعمة وطهيها، بما في ذلك التبريد الفوري في درجات حرارة منخفضة بما فيه الكفاية وطهي الطعام إلى درجة حرارة عالية بما فيه الكفاية.
كلوستريديوم العسيرة
المطثية العسيرة عبارة عن قضيب إيجابي الجرام يمكن أن يكون بكتيريا شائعة كجزء من الميكروبات الطبيعية للأفراد الأصحاء. عندما تتعطل الميكروبات الطبيعية بسبب استخدام المضادات الحيوية على المدى الطويل، يمكن أن تسمح بنمو هذه البكتيريا بشكل مفرط، مما يؤدي إلى الإسهال المرتبط بالمضادات الحيوية الناجم عن المطثية العسيرة. يمكن أيضًا اعتبار الإسهال المرتبط بالمضادات الحيوية مرضًا استشفائيًا. المرضى الأكثر عرضة لخطر الإصابة بعدوى المطثية العسيرة هم أولئك الذين يعانون من نقص المناعة، أو الذين مكثوا في أماكن الرعاية الصحية لفترات طويلة، أو كبار السن، أو تناولوا المضادات الحيوية مؤخرًا، أو خضعوا لعمليات معدية معوية، أو يستخدمون مثبطات مضخة البروتون، التي تقلل من حموضة المعدة و تسمح بانتشار C. العسيرة. نظرًا لأن هذا النوع يمكن أن يشكل مسامًا داخلية، فإنه يمكن أن يعيش لفترات طويلة من الوقت في البيئة في ظل ظروف قاسية ويشكل مصدر قلق كبير في أماكن الرعاية الصحية.
تنتج هذه البكتيريا نوعين من السموم، وهما توكسين الكلوستريديوم العسير A (TCDA) وتوكسين الكلوستريديوم العسير B (TCDB). تعمل هذه السموم على تعطيل البروتينات الصغيرة المرتبطة بـ GTP، مما يؤدي إلى تكثيف الأكتين وتقريب الخلايا، يليه موت الخلايا. تبدأ العدوى بالنخر البؤري، ثم التقرح بالإفرازات، ويمكن أن تتطور إلى التهاب القولون الغشائي الكاذب، الذي يتضمن التهاب القولون وتطور غشاء كاذب من الفيبرين يحتوي على خلايا ظهارية ميتة وكريات بيضاء (الشكل\(\PageIndex{6}\)). يمكن أن يؤدي ذلك إلى الإسهال المائي والجفاف والحمى وفقدان الشهية وآلام البطن. يمكن أن يحدث ثقب في القولون، مما يؤدي إلى تسمم الدم والصدمة والموت. ترتبط المطثية العسيرة أيضًا بالتهاب الأمعاء والقولون الناخر في الأطفال المبتسرين والقولون المعوي العدلة المرتبط بعلاجات السرطان.
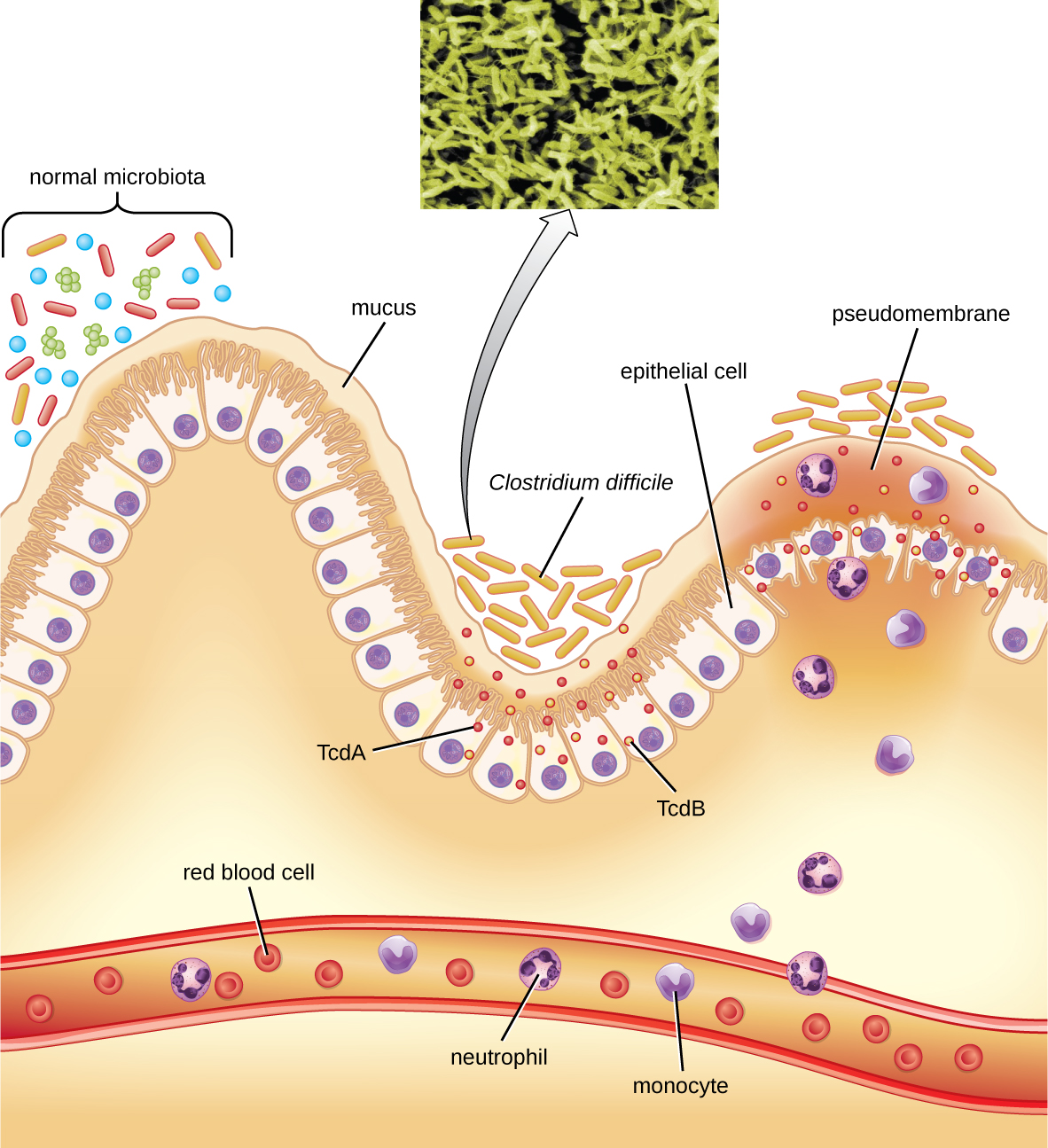
يتم التشخيص من خلال النظر في تاريخ المريض (مثل التعرض للمضادات الحيوية)، والعرض السريري، والتصوير، والتنظير، والاختبارات المعملية، وغيرها من البيانات المتاحة. يتم استخدام الكشف عن السم في عينات البراز لتأكيد التشخيص. على الرغم من تفضيل الثقافة، إلا أنها نادرًا ما تكون عملية في الممارسة السريرية لأن البكتيريا عبارة عن أناروب إلزامي. تعتبر اختبارات تضخيم الحمض النووي، بما في ذلك PCR، أفضل من اختبار ELISA للتحليل الجزيئي.
الخطوة الأولى من العلاج التقليدي هي إيقاف استخدام المضادات الحيوية، ثم توفير العلاج الداعم باستبدال الإلكتروليت والسوائل. ميترونيدازول هو العلاج المفضل إذا تم تأكيد تشخيص المطثية العسيرة. يمكن أيضًا استخدام فانكومايسين، ولكن يجب تخصيصه للمرضى الذين لم يكن ميترونيدازول فعالًا بالنسبة لهم أو الذين يستوفون معايير أخرى (على سبيل المثال، تحت سن 10 سنوات، أو الحوامل، أو الذين يعانون من الحساسية تجاه ميترونيدازول).
يركز أسلوب العلاج الأحدث، المعروف باسم زراعة البراز، على استعادة الكائنات الحية الدقيقة في الأمعاء من أجل مكافحة العدوى. في هذا الإجراء، يتبرع شخص سليم بعينة من البراز، يتم خلطها بمحلول ملحي وزرعها إلى المتلقي عن طريق تنظير القولون أو التنظير الداخلي أو التنظير السيني أو حقنة شرجية. تم الإبلاغ عن أن هذا الإجراء حقق نجاحًا أكبر من 90٪ في حل عدوى المطثية العسيرة. 9
التمارين\(\PageIndex{7}\)
كيف يؤدي استخدام المضادات الحيوية إلى عدوى المطثية العسيرة؟
الأمراض المنقولة بالغذاء بسبب العصيات الشمعية
Bacillus cereus، التي توجد بشكل شائع في التربة، هي بكتيريا مكونة للأبواغ إيجابية الجرام ويمكن أن تسبب أحيانًا أمراضًا منقولة بالغذاء. يمكن أن تبقى بكتيريا B. cereus endospores على قيد الحياة أثناء الطهي وتنتج السموم المعوية في الطعام بعد تسخينه؛ غالبًا ما تحدث الأمراض بعد تناول الأرز والأطعمة الجاهزة الأخرى التي تُترك في درجة حرارة الغرفة لفترة طويلة جدًا. تظهر العلامات والأعراض في غضون ساعات قليلة من الابتلاع وتشمل الغثيان والألم وتشنجات البطن. ينتج B. cereus اثنين من السموم: أحدهما يسبب الإسهال والآخر يسبب القيء. يمكن أن تظهر علامات وأعراض أكثر حدة في بعض الأحيان.
يمكن إجراء التشخيص عن طريق عزل البكتيريا عن عينات البراز أو القيء والأطعمة المصابة غير المأكولة. يشمل العلاج الإماهة والعلاج الداعم. لا تكون المضادات الحيوية ضرورية عادةً، لأن المرض عادة ما يكون خفيفًا نسبيًا ويرجع ذلك إلى نشاط السموم.
الأمراض المنقولة بالغذاء بسبب اليرسينيا
يشتهر جنس اليرسينيا بـ Yersinia pestis، وهو قضيب سالب الجرام يسبب الطاعون. ومع ذلك، يمكن أن تسبب بكتيريا Y. enterocolitica و Y. pseudotlius التهاب تنتقل العدوى بشكل عام من خلال الطريق البرازي الفموي، مع تناول الطعام أو الماء الملوث بالبراز. يمكن أن يحدث التسمم أيضًا بسبب نشاط السموم الداخلية والسموم الخارجية (عامل نخر السموم المعوية والسموم الخلوية). عادة ما يكون المرض خفيفًا نسبيًا ومقيدًا ذاتيًا. ومع ذلك، يمكن أن يحدث الإسهال الشديد والدوسنتاريا عند الرضع. في البالغين، يمكن أن تنتشر العدوى وتسبب مضاعفات مثل التهاب المفاصل التفاعلي، واضطرابات الغدة الدرقية، والتهاب الشغاف، والتهاب كبيبات الكلى، والتهاب العين، و/أو الحمامي العقدي. قد تتطور تجرثم الدم في حالات نادرة.
يتم التشخيص بشكل عام عن طريق اكتشاف البكتيريا في عينات البراز. يمكن أيضًا الحصول على عينات من الأنسجة الأخرى أو سوائل الجسم. عادة ما يكون العلاج داعمًا، بما في ذلك معالجة الجفاف، بدون مضادات حيوية. في حالة وجود تجرثم الدم أو أي مرض جهازي آخر، يمكن استخدام المضادات الحيوية مثل الفلوروكينولونات والأمينوغليكوزيدات والدوكسيسيكلين وتريميثوبريم-سلفاميثوكسازول. يمكن أن يستغرق التعافي ما يصل إلى أسبوعين.
التمارين\(\PageIndex{8}\)
قارن وقارن بين الأمراض المنقولة بالغذاء بسبب B. cereus و Yersinia.
الالتهابات البكتيرية في الجهاز الهضمي
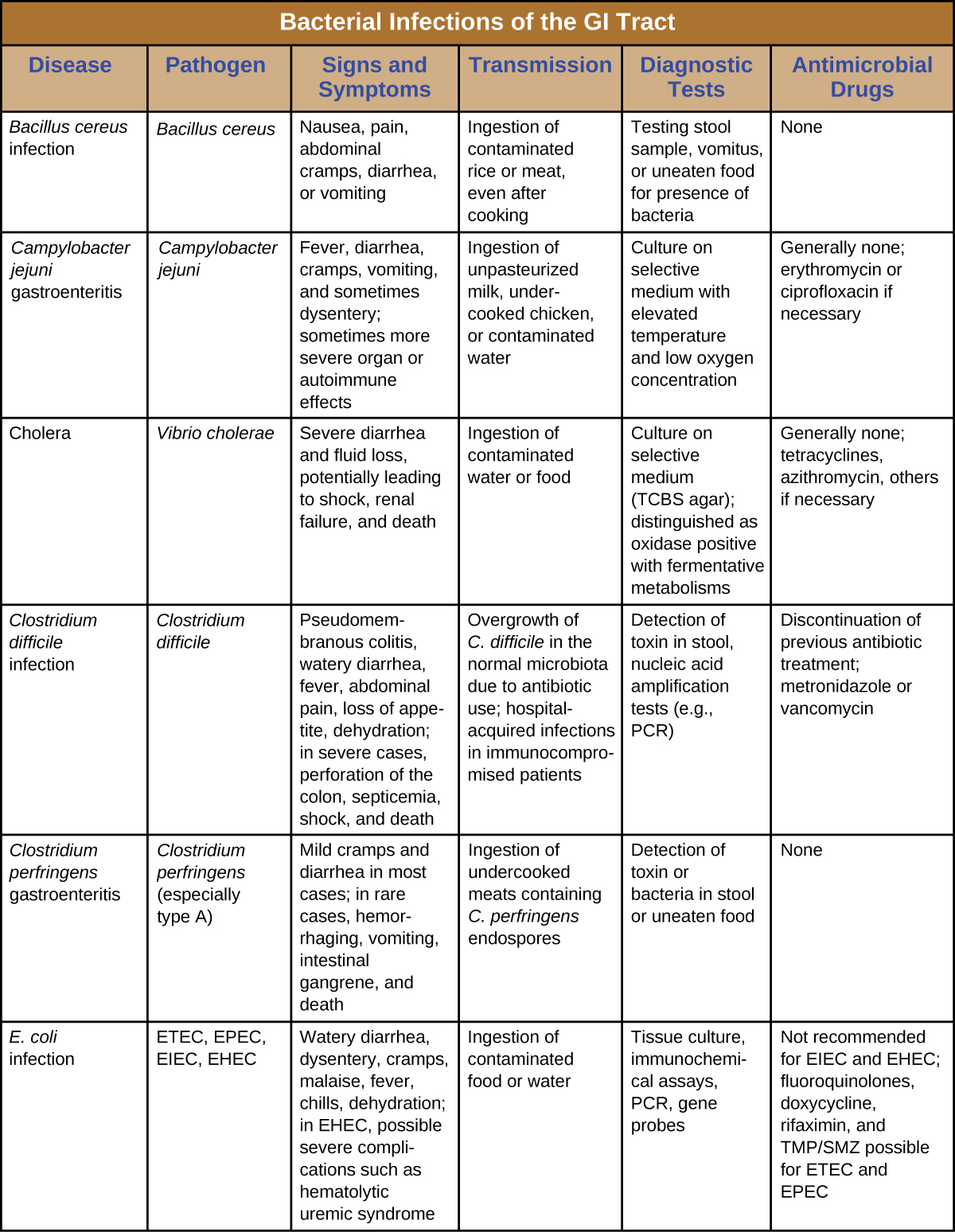
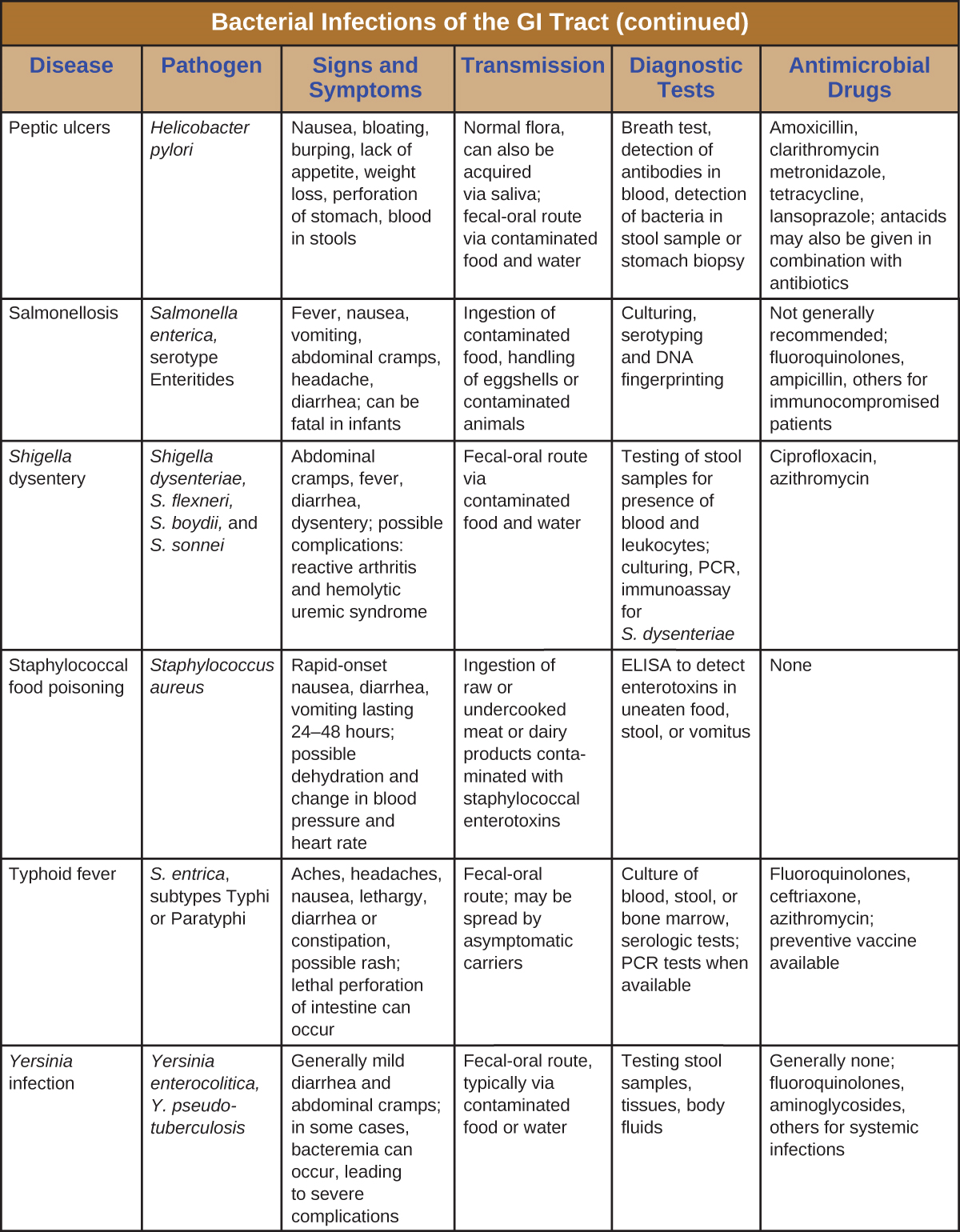
تحدث الالتهابات البكتيرية في الجهاز الهضمي بشكل عام عندما يتم تناول البكتيريا أو السموم البكتيرية في الطعام أو الماء الملوث. يمكن أن تؤدي السموم وعوامل الضراوة الأخرى إلى التهاب الجهاز الهضمي والأعراض العامة مثل الإسهال والقيء. يمكن أن تختلف عدوى الجهاز الهضمي البكتيرية بشكل كبير من حيث الشدة والعلاج. يمكن علاج بعضها بالمضادات الحيوية، ولكن في حالات أخرى قد تكون المضادات الحيوية غير فعالة في مكافحة السموم أو حتى تؤدي إلى نتائج عكسية إذا كانت تعرض الميكروبات المعوية للخطر. الشكل\(\PageIndex{7}\) والشكل السمات\(\PageIndex{8}\) الرئيسية لعدوى الجهاز الهضمي البكتيرية الشائعة.
التركيز السريري: الجزء 2
في المستشفى، بدأ طبيب كارلي بالتفكير في الأسباب المحتملة لضائقة الجهاز الهضمي الشديدة. كان أحد الاحتمالات هو التسمم الغذائي، ولكن لم يكن أي شخص آخر في عائلتها مريضًا. سأل الطبيب عما أكلته كارلي في اليوم السابق؛ وذكرت والدتها أنها تناولت البيض على الغداء، وأنه ربما لم يتم طهيه جيدًا. أخذ الطبيب عينة من براز كارلي وأرسلها للفحص المعملي كجزء من فحصها. اشتبهت في أن كارلي يمكن أن تكون مصابة بالتهاب المعدة والأمعاء الجرثومي أو الفيروسي، لكنها كانت بحاجة إلى معرفة السبب من أجل وصف العلاج المناسب.
في المختبر، حدد الفنيون مجهريًا العصيات سالبة الجرام في عينة براز كارلي. كما قاموا بتأسيس ثقافة نقية للبكتيريا وقاموا بتحليلها بحثًا عن مستضدات. أظهر هذا الاختبار أن العامل المسبب هو السالمونيلا.
التمارين\(\PageIndex{9}\)
ما الذي يجب على الطبيب فعله الآن لعلاج كارلي؟
المفاهيم الأساسية والملخص
- تشمل الأسباب الرئيسية لأمراض الجهاز الهضمي السالمونيلا spp. والمكورات العنقودية spp. و Helicobacter pylori و Clostridium perfringens و Clostridium devicile و Bacillus cereus وبكتيريا اليرسينيا.
- المطثية العسيرة هي سبب مهم للعدوى المكتسبة في المستشفى.
- ويتسبب ضمة الكوليرا في الإصابة بالكوليرا، التي يمكن أن تكون مرضًا شديدًا بالإسهال.
- تسبب سلالات مختلفة من E. coli، بما في ذلك ETEC و EPEC و EIEC و EHEC، أمراضًا مختلفة بدرجات متفاوتة من الشدة.
- ترتبط بكتيريا الملوية البوابية بالقرحة الهضمية.
- يمكن أن تسبب الأنماط المصلية للسالمونيلا المعوية حمى التيفوئيد، وهي مرض أكثر حدة من داء السلمونيلات.
- غالبًا ما تستخدم معالجة الجفاف والعلاجات الداعمة الأخرى كعلاجات عامة.
- يجب استخدام المضادات الحيوية بعناية لتقليل خطر التسبب في عدوى المطثية العسيرة وعند علاج العدوى المقاومة للمضادات الحيوية.
الحواشي
- 1 جايا سوريشبابو. «فحص عدوى الشيغيلا». ميدسكيب. تم التحديث في 28 يونيو 2016. http://emedicine.medscape.com/article/968773-workup.
- 2 مراكز السيطرة على الأمراض والوقاية منها. السالمونيلا. تم التحديث في 25 أغسطس 2016. https://www.cdc.gov/salmonella.
- 3 جاكي هيكوكس. «توقف عن مناداتي بـ» ممرضة الإيبولا». الجارديان. 17 نوفمبر 2014. www.theguardian.com/commentis... se-kaci-hickox.
- 4 مراكز للسيطرة على الأمراض والوقاية منها. عدوى الكوليرا - فيبريو كوليرا. تم تحديثه في 6 نوفمبر 2014. http://www.cdc.gov/cholera/general. تم الوصول إليه في 14 سبتمبر 2016.
- 5 مراكز للسيطرة على الأمراض والوقاية منها. «هيليكوباكتر بيلوري: ورقة حقائق لمقدمي الرعاية الصحية.» تم تحديثه في تموز/يوليه 1998. www.cdc.gov/locre/files/hpfacts.
- غطاء سعة 6 لتر. «السموم الخلوية الفراغية من هيليكوباكتر بيلوري». علم الأحياء الدقيقة الجزيئي 20 (1996) 2: الصفحات 241-246. http://www.ncbi.nlm.nih.gov/pubmed/8733223.
- 7 مارتن جيه بلاسر. «اختفاء الميكروبات: حماية هيليكوباكتر بيلوري ضد سرطان المريء الغدي.» أبحاث الوقاية من السرطان 1 (2008) 5: الصفحات 308-311. http://cancerpreventionresearch.aacr....full.pdf+html.
- (8) إيفان ف. ن. هونغ و بنجامين سي واي وونغ. «تقييم مخاطر وفوائد علاج عدوى هيليكوباكتر بيلوري.» التطورات العلاجية في أمراض الجهاز الهضمي 2 (2009) 3: ص، 141-147. دوي: 10.11756283X08100279.
- 9 فيث روهلكي ونيل ستولمان. «زرع الميكروبات البرازية في عدوى المطثية العسيرة الراجعة»، التطورات العلاجية في أمراض الجهاز الهضمي 5 (2012) 6:403-420. المرجع: 10.1177/1756283X12453637.


