14.4: الاعتبارات السريرية
- Page ID
- 195381
أهداف التعلم
- اشرح الاختلافات بين طرق عمل الأدوية التي تستهدف الفطريات والبروتوزوا والديدان الطفيلية والفيروسات
نظرًا لأن الفطريات والبروتوزوا والديدان الطفيلية حقيقية النواة، فإن خلاياها تشبه إلى حد كبير الخلايا البشرية، مما يزيد من صعوبة تطوير أدوية ذات سمية انتقائية. بالإضافة إلى ذلك، تتكاثر الفيروسات داخل الخلايا المضيفة البشرية، مما يجعل من الصعب تطوير أدوية سامة بشكل انتقائي للفيروسات أو الخلايا المصابة بالفيروسات. على الرغم من هذه التحديات، هناك أدوية مضادة للميكروبات تستهدف الفطريات والبروتوزوا والديدان الطفيلية والفيروسات، بل إن بعضها يستهدف أكثر من نوع واحد من الميكروبات. \(\PageIndex{4}\)يقدم الجدول\(\PageIndex{2}\) والجدول\(\PageIndex{3}\) والجدول أمثلة للأدوية المضادة للميكروبات في هذه الفئات المختلفة.\(\PageIndex{1}\)
الأدوية المضادة للفطريات
طريقة العمل الأكثر شيوعًا للأدوية المضادة للفطريات هي تعطيل غشاء الخلية. تستفيد مضادات الفطريات من الاختلافات الصغيرة بين الفطريات والبشر في المسارات البيوكيميائية التي تصنع الستيرول. تعتبر الستيرول مهمة في الحفاظ على سيولة الغشاء المناسبة، وبالتالي الوظيفة المناسبة لغشاء الخلية. بالنسبة لمعظم الفطريات، فإن الستيرول الغشائي السائد هو إرغوستيرول. نظرًا لأن أغشية الخلايا البشرية تستخدم الكوليسترول، بدلاً من الإرغوستيرول، فإن الأدوية المضادة للفطريات التي تستهدف تخليق الإرغوستيرول تكون سامة بشكل انتقائي (الشكل\(\PageIndex{1}\)).
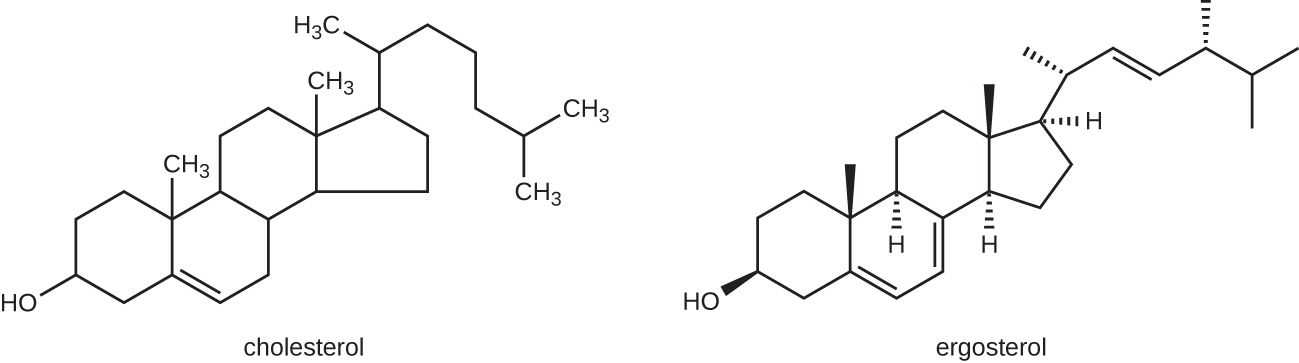
الإيميدازول عبارة عن مبيدات فطرية اصطناعية تعطل التخليق الحيوي للإرغوستيرول؛ وهي تستخدم بشكل شائع في التطبيقات الطبية وأيضًا في الزراعة لمنع البذور والمحاصيل المحصودة من التشكيل. تشمل الأمثلة الميكونازول والكيتوكونازول والكلوتريمازول، والتي تستخدم لعلاج الالتهابات الجلدية الفطرية مثل السعفة، وتحديدًا سعفة القدم (قدم الرياضي)، سعفة القضيب (حكة جوك)، وتسعفة الجسم. تحدث هذه العدوى بشكل شائع بسبب الفطريات الجلدية من أجناس Trichophyton و Epidermophyton و Microsporum. يستخدم ميكونازول أيضًا في الغالب لعلاج التهابات الخميرة المهبلية التي تسببها الفطريات المبيضات، ويستخدم الكيتوكونازول لعلاج سعفة اللون وقشرة الرأس، وكلاهما يمكن أن يسببه فطر Malassezia.
كما تمنع أدوية التريازول، بما في ذلك الفلوكونازول، التخليق الحيوي للإرغوستيرول. ومع ذلك، يمكن إعطاؤها عن طريق الفم أو الوريد لعلاج عدة أنواع من عدوى الخميرة الجهازية، بما في ذلك مرض القلاع الفموي والتهاب السحايا بالمكورات الخفية، وكلاهما منتشر في مرضى الإيدز. تُظهر التريازول أيضًا سمية أكثر انتقائية، مقارنة بالإميدازول، وترتبط بآثار جانبية أقل.
تمنع الأليلامينات، وهي فئة مختلفة هيكليًا من الأدوية الاصطناعية المضادة للفطريات، خطوة مبكرة في التخليق الحيوي للإرغوستيرول. الأليلامين الأكثر استخدامًا هو تيربينافين (الذي يتم تسويقه تحت اسم العلامة التجارية Lamisil)، والذي يستخدم موضعيًا لعلاج التهابات الجلد الفطرية مثل قدم الرياضي والقوباء الحلقية وحكة الألعاب الرياضية. يستخدم العلاج الفموي بالتيربينافين أيضًا لعلاج فطريات أظافر الأصابع وأظافر القدم، ولكن يمكن أن يترافق مع الآثار الجانبية النادرة للتسمم الكبدي.
البولينات هي فئة من العوامل المضادة للفطريات التي تنتجها بشكل طبيعي بعض بكتيريا التربة الأكتينوميسيت وترتبط هيكليًا بالماكروليدات. ترتبط هذه الجزيئات الكبيرة المحبة للدهون بالإرغوستيرول في الأغشية السيتوبلازمية الفطرية، وبالتالي تخلق المسام. تشمل الأمثلة الشائعة النيستاتين والأمفوتريسين B. يستخدم Nystatin عادةً كعلاج موضعي لالتهابات الخميرة في الجلد والفم والمهبل، ولكن يمكن استخدامه أيضًا للعدوى الفطرية المعوية. يستخدم عقار الأمفوتريسين B في الالتهابات الفطرية الجهازية مثل داء الرشاشيات والتهاب السحايا بالمكورات الخفية وداء النوسجات وداء الفطريات وداء المبيضات. كان الأمفوتريسين B الدواء الوحيد المضاد للفطريات المتاح لعدة عقود، ولكن استخدامه يرتبط ببعض الآثار الجانبية الخطيرة، بما في ذلك السمية الكلوية (السمية الكلوية).
غالبًا ما يستخدم الأمفوتريسين B مع فلوسيتوزين، وهو نظير بيريميدين مفلور يتم تحويله بواسطة إنزيم خاص بالفطريات إلى منتج سام يتداخل مع كل من تكرار الحمض النووي وتخليق البروتين في الفطريات. يرتبط الفلوسيتوزين أيضًا بالسمية الكبدية (سمية الكبد) واكتئاب نخاع العظام.
بالإضافة إلى استهداف الإرغوستيرول في أغشية الخلايا الفطرية، هناك عدد قليل من الأدوية المضادة للفطريات التي تستهدف الهياكل الفطرية الأخرى (الشكل\(\PageIndex{2}\)). والإشينوكاندين، بما في ذلك كاسبوفونجين، عبارة عن مجموعة من المركبات المضادة للفطريات المنتجة بشكل طبيعي والتي تمنع تخليق الجلوكان β (1←3) الموجود في جدران الخلايا الفطرية ولكن غير موجود في الخلايا البشرية. هذه الفئة من الأدوية لها لقب «البنسلين للفطريات». يستخدم Caspofungin لعلاج داء الرشاشيات وكذلك التهابات الخميرة الجهازية.
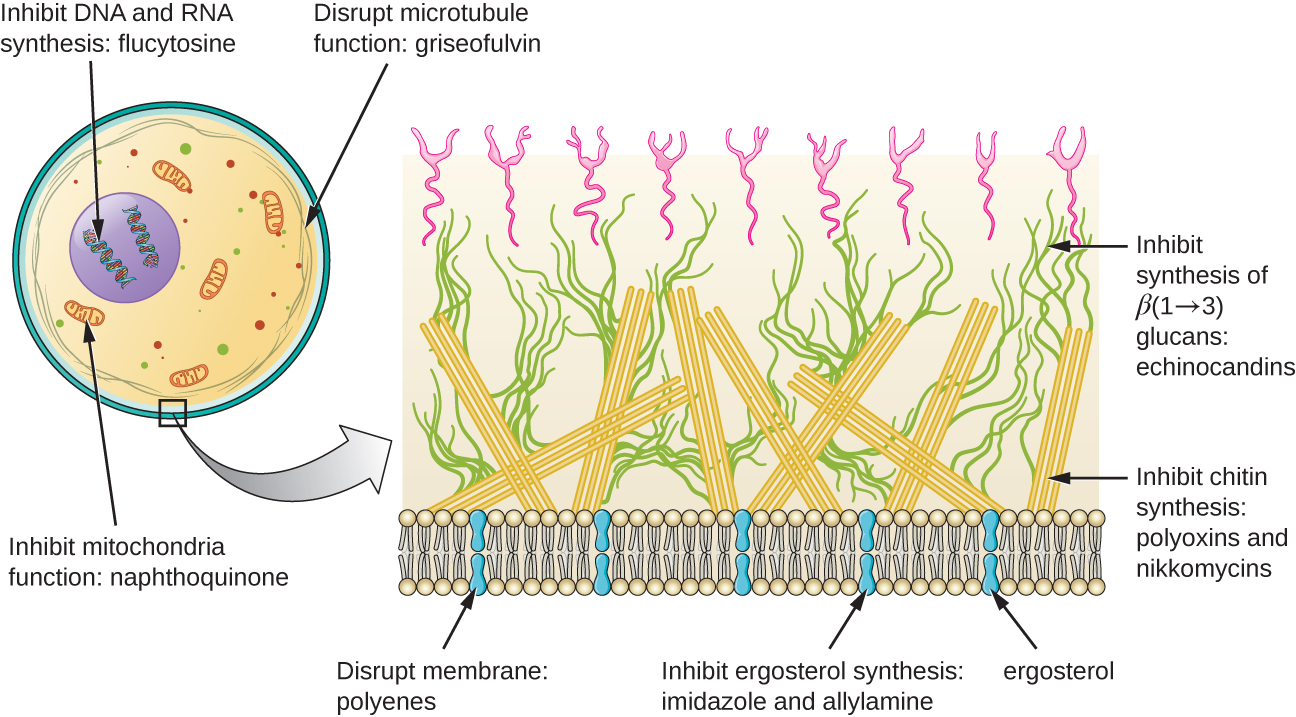
على الرغم من أن الكيتين ليس سوى مكون ثانوي لجدران الخلايا الفطرية، إلا أنه غائب أيضًا في الخلايا البشرية، مما يجعله هدفًا انتقائيًا. يتم إنتاج البوليوكسين والنيكومايسين بشكل طبيعي من مضادات الفطريات التي تستهدف تخليق الكيتين. تُستخدم البوليوكسينات للسيطرة على الفطريات للأغراض الزراعية، والنيكومايسين Z قيد التطوير حاليًا لاستخدامه في البشر لعلاج عدوى الخميرة وحمى الوادي (coccidioidomycosis)، وهو مرض فطري منتشر في جنوب غرب الولايات المتحدة. 1
يُعتقد أن الجريزوفولفين المضاد للفطريات المنتج طبيعيًا يعطل على وجه التحديد انقسام الخلايا الفطرية عن طريق التدخل في الأنابيب الدقيقة المشاركة في تكوين المغزل أثناء الانقسام الفتيلي. كانت واحدة من أولى مضادات الفطريات، ولكن استخدامها يرتبط بالتسمم الكبدي. عادة ما يتم تناوله عن طريق الفم لعلاج أنواع مختلفة من الالتهابات الجلدية الفطرية عندما تكون العلاجات المضادة للفطريات الموضعية الأخرى غير فعالة.
هناك عدد قليل من الأدوية التي تعمل كمضادات الأيض ضد العمليات الفطرية. على سبيل المثال، يعد أتوفاكون، وهو ممثل لفئة أدوية النفثوكينون، مضادًا شبه صناعي للإصدارات الفطرية والبروتوزولية من السيتوكروم الميتوكوندري المهم في نقل الإلكترون. من الناحية الهيكلية، هو نظير لأنزيم Q، الذي يتنافس معه على الارتباط الإلكتروني. إنه مفيد بشكل خاص لعلاج الالتهاب الرئوي المتكيسات الرئوية الناجم عن المكورات الرئوية الجيروفيتشي. تعمل تركيبة سلفاميثوكسازول-تريميثوبريم المضادة للبكتيريا أيضًا كمضاد للأيض ضد P. jirovecii.
\(\PageIndex{1}\)يوضح الجدول الفئات العلاجية المختلفة للأدوية المضادة للفطريات، مصنفة حسب طريقة العمل، مع أمثلة لكل منها.
| آلية العمل | فئة الدواء | أدوية محددة | الاستخدامات السريرية |
|---|---|---|---|
| تمنع تخليق إرغوستيرول | إيميدازولز | ميكونازول، كيتوكونازول، كلوتريمازول | التهابات الجلد الفطرية وعدوى الخميرة المهبلية |
| تريازولز | فلوكونازول | عدوى الخميرة الجهازية والقلاع الفموي والتهاب السحايا بالمكورات الخفية | |
| أليلامينات | تيربينافين | الالتهابات الجلدية الفطرية (قدم الرياضي، الدودة الحلقية، حكة الركض)، والتهابات أظافر اليدين والقدمين | |
| اربط إرغوستيرول في غشاء الخلية وقم بإنشاء مسام تعطل الغشاء | البولينات | نيستاتين | يستخدم موضعياً لالتهابات الخميرة في الجلد والفم والمهبل؛ يستخدم أيضًا للعدوى الفطرية للأمعاء |
| أمفوتيريسين ب | عدوى فطرية جهازية متنوعة | ||
| تمنع تخليق جدار الخلية | إشينوكاندين | كاسبوفونجين | داء الرشاشيات وعدوى الخميرة الجهازية |
| لا ينطبق | نيكومايسين زد | داء الكوكسيديودوميكوسيس (حمى الوادي) وعدوى الخميرة | |
| تمنع الأنابيب الدقيقة وانقسام الخلايا | لا ينطبق | غريسيوفولفين | التهابات الجلد الجلدية |
التمارين\(\PageIndex{1}\)
كيف يكون تعطيل التخليق الحيوي للإرغوستيرول طريقة عمل فعالة لمضادات الفطريات؟
علاج العدوى الفطرية للرئتين
جاك، مهندس يبلغ من العمر 48 عامًا، مصاب بفيروس نقص المناعة البشرية ولكنه يتمتع بصحة جيدة بشكل عام بفضل العلاج المضاد للفيروسات (ART). ومع ذلك، بعد أسبوع مكثف للغاية في العمل، أصيب بالحمى والسعال الجاف. لقد افترض أنه أصيب للتو بنزلة برد أو إنفلونزا خفيفة بسبب الإرهاق ولم يفكر كثيرًا في ذلك. ومع ذلك، بعد حوالي أسبوع، بدأ يعاني من التعب وفقدان الوزن وضيق التنفس. قرر زيارة طبيبه، الذي وجد أن جاك لديه مستوى منخفض من الأوكسجين في الدم. طلب الطبيب فحص الدم والأشعة السينية للصدر وجمع عينة البلغم المستحث لتحليلها. وأظهرت الأشعة السينية التي أجراها وجود غيوم دقيقة والعديد من الخلايا الرئوية (جيوب الهواء الرقيقة الجدران)، مما يشير إلى الالتهاب الرئوي المتكيسات الرئوية (PCP)، وهو نوع من الالتهاب الرئوي الناجم عن فطر Plonumocystis jirovecii. أدخله طبيب جاك إلى المستشفى ووصف عقار باكترم، وهو مزيج من سلفاميثوكسازول وتريميثوبريم، ليتم إعطاؤه عن طريق الوريد.
P. jirovecii هو فطر يشبه الخميرة وله دورة حياة مماثلة لدورة حياة البروتوزوان. على هذا النحو، تم تصنيفها على أنها بروتوزوان حتى الثمانينيات. يعيش فقط في أنسجة الرئة للأشخاص المصابين وينتقل من شخص لآخر، مع تعرض العديد من الأشخاص له وهم أطفال. عادةً ما يسبب P. jirovecii الالتهاب الرئوي فقط لدى الأفراد الذين يعانون من نقص قد يحمل الأشخاص الأصحاء الفطريات في رئتيهم دون أي أعراض للمرض. يعتبر PCP مشكلة خاصة بين مرضى فيروس نقص المناعة البشرية الذين يعانون من ضعف جهاز المناعة
وعادة ما يُعالج الفينول الخماسي الكلور بالباكتريم الفموي أو الوريدي، ولكن الأتوفاكون أو البنتاميدين (دواء آخر مضاد للطفيليات) يعتبران بديلين. وفي حالة عدم علاجه، يمكن أن يتطور الفينول الخماسي الكلور، مما يؤدي إلى انهيار الرئة وقرابة 100% من الوفيات. حتى مع العلاج بالعقاقير المضادة للميكروبات، لا يزال PCP مسؤولاً عن 10٪ من الوفيات المرتبطة بفيروس نقص المناعة البشرية.
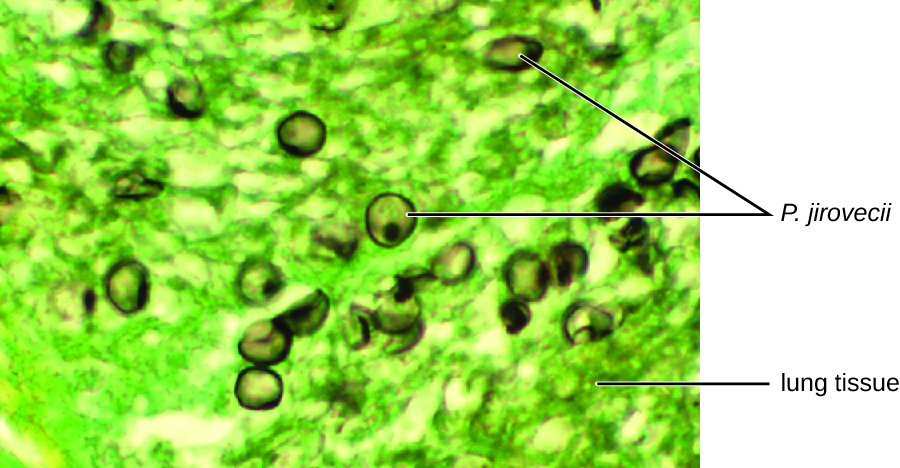
أكد الفحص الخلوي، باستخدام مقايسة الفلورة المناعية المباشرة (DFA)، لمسحة من عينة البلغم الخاصة بجاك وجود P. jirovecii (الشكل\(\PageIndex{3}\)). بالإضافة إلى ذلك، كشفت نتائج اختبارات دم جاك أن عدد خلايا دمه البيضاء قد انخفض، مما جعله أكثر عرضة للفطر. قام طبيبه بمراجعة نظام ART الخاص به وإجراء التعديلات. بعد بضعة أيام من العلاج في المستشفى، تم إطلاق سراح جاك لمواصلة العلاج بمضادات الميكروبات في المنزل. مع التعديلات على علاجه بمضادات الفيروسات القهقرية، بدأت أعداد CD4 لدى جاك في الزيادة وتمكن من العودة إلى العمل.
أدوية أنتيبروتوزوان
هناك عدد قليل من الآليات التي تستهدف بها الأدوية المضادة للبروتوزوان البروتوزوان المعدية (الجدول\(\PageIndex{3}\)). بعضها عبارة عن مضادات الأيض، مثل أتوفاكون وبروغوانيل وأرتيميسينين. الأتوفاكون، بالإضافة إلى كونه مضادًا للفطريات، يمنع نقل الإلكترون في البروتوزوان ويستخدم لعلاج التهابات البروتوزوان بما في ذلك الملاريا والبابيزيا وداء المقوسات. Proguanil هو أحد مضادات الأيض الاصطناعية الأخرى التي تتم معالجتها في الخلايا الطفيلية في شكلها النشط، مما يمنع تخليق حمض الفوليك البروتوزوان. غالبًا ما يتم استخدامه مع أتوفاكون، ويتم تسويق المزيج باسم Malarone لعلاج الملاريا والوقاية منها.
يعتبر مادة الأرتيميسينين، وهي مادة مضادة للفطريات مشتقة من النباتات اكتشفها العلماء الصينيون لأول مرة في السبعينيات، فعالة جدًا ضد الملاريا. تعتبر مشتقات الأرتيميسينين شبه الاصطناعية أكثر قابلية للذوبان في الماء من النسخة الطبيعية، مما يجعلها أكثر توفرًا بيولوجيًا. على الرغم من أن آلية العمل الدقيقة غير واضحة، يبدو أن الأرتيميسينين تعمل كعقاقير أولية يتم استقلابها بواسطة الخلايا المستهدفة لإنتاج أنواع الأكسجين التفاعلية (ROS) التي تتلف الخلايا المستهدفة. بسبب ارتفاع مقاومة الأدوية المضادة للملاريا، يشيع استخدام الأرتيميسينين أيضًا مع مركبات أخرى مضادة للملاريا في العلاج المركب القائم على الأرتيميسينين (ACT).
يتم استخدام العديد من مضادات الأيض لعلاج داء المقوسات الناجم عن طفيل التوكسوبلازما جوندي. يعمل عقار السلفا الصناعي سلفاديازين بشكل تنافسي على تثبيط الإنزيم في إنتاج حمض الفوليك في الطفيليات ويمكن استخدامه لعلاج الملاريا وداء المقوسات. البيريميثامين هو دواء اصطناعي يثبط إنزيمًا مختلفًا في مسار إنتاج حمض الفوليك وغالبًا ما يستخدم مع السلفادوكسين (دواء السلفا الآخر) لعلاج الملاريا أو بالاشتراك مع السلفاديازين لعلاج داء المقوسات. تشمل الآثار الجانبية للبيريميثامين انخفاض نشاط نخاع العظام الذي قد يسبب زيادة الكدمات وانخفاض عدد خلايا الدم الحمراء. عندما تكون السمية مصدرًا للقلق، يتم عادةً إعطاء سبيراميسين، وهو مثبط لتخليق بروتين الماكروليد، لعلاج داء المقوسات.
تتداخل فئتان من الأدوية المضادة للبروتوزوان مع تخليق الحمض النووي: النيترويميدازول والكينولين. يعتبر نيترويميدازول، بما في ذلك الميترونيدازول شبه الصناعي، الذي تمت مناقشته سابقًا كدواء مضاد للبكتيريا، وتينيدازول الاصطناعي، مفيدًا في مكافحة مجموعة متنوعة من مسببات الأمراض الأولية، مثل جيارديا لامبليا وإنتامويبا هيستوليتيكا وتريكوموناس فاجيناليس . عند الإدخال إلى هذه الخلايا في البيئات منخفضة الأكسجين، يتم تنشيط النيترويميدازول وإدخال كسر خيوط الحمض النووي، مما يتداخل مع تكرار الحمض النووي في الخلايا المستهدفة. لسوء الحظ، يرتبط ميترونيدازول بالتسبب في التسرطن (تطور السرطان) لدى البشر.
هناك نوع آخر من الأدوية المضادة للبروتوزوان الاصطناعية التي يُعتقد منذ فترة طويلة أنها تتداخل بشكل خاص مع تكرار الحمض النووي في بعض مسببات الأمراض وهو البنتاميدين. تم استخدامه تاريخيًا لعلاج مرض النوم الأفريقي (الناجم عن داء المثقبيات البروتوزواني) وداء الليشمانيات (الناجم عن البروتوزوا من جنس الليشمانيا)، ولكنه أيضًا علاج بديل لفطر الالتهاب الرئوي. تشير بعض الدراسات إلى أنه يرتبط بشكل خاص بالحمض النووي الموجود داخل الكينيتوبلاستس (kDNA؛ هياكل طويلة تشبه الميتوكوندريا فريدة من نوعها للمثقبيات)، مما يؤدي إلى انشقاق الحمض النووي kDNA. ومع ذلك، يظل الحمض النووي النووي لكل من الطفيل والمضيف غير متأثر. يبدو أيضًا أنه يرتبط بـ trNA، مما يمنع إضافة الأحماض الأمينية إلى الحمض الريبي الريبي، وبالتالي يمنع تخليق البروتين. تشمل الآثار الجانبية المحتملة لاستخدام البنتاميدين ضعف البنكرياس وتلف الكبد.
الكينولين هو فئة من المركبات الاصطناعية المتعلقة بالكينين، والتي لها تاريخ طويل من الاستخدام ضد الملاريا. يُعتقد أن الكينولين يتداخل مع إزالة السموم من الهيم، وهو أمر ضروري لتفكك الطفيل الفعال للهيموغلوبين إلى أحماض أمينية داخل خلايا الدم الحمراء. تُستخدم المشتقات الاصطناعية الكلوروكين والكيناكرين (وتسمى أيضًا الميباكرين) والميفلوكين بشكل شائع كمضادات للملاريا، ويستخدم الكلوروكين أيضًا لعلاج داء الأميبات الذي يسببه عادةً Entamoeba histolytica. قد يؤدي الاستخدام الوقائي طويل الأمد للكلوروكين أو الميفلوكين إلى آثار جانبية خطيرة، بما في ذلك الهلوسة أو مشاكل القلب. يعاني المرضى الذين يعانون من نقص الجلوكوز 6-فوسفات ديهيدروجيناز من فقر الدم الشديد عند علاجهم بالكلوروكين.
| آلية العمل | فئة الدواء | أدوية محددة | الاستخدامات السريرية |
|---|---|---|---|
| تمنع نقل الإلكترونات في الميتوكوندريا | النفثوكينون | أتوفاكون | الملاريا والبابيزيا وداء المقوسات |
| تمنع تخليق حمض الفوليك | لا ينطبق | بروكوانيل | العلاج المركب مع أتوفاكون لعلاج الملاريا والوقاية منها |
| سلفوناميد | سلفاديازين | الملاريا وداء المقوسات | |
| لا ينطبق | بيريميثامين | العلاج المركب مع سولفادوكسين (دواء السلفا) للملاريا | |
| ينتج أنواعًا ضارة من الأكسجين التفاعلي | لا ينطبق | مادة الأرتيميسينين | العلاج المركب لعلاج الملاريا |
| تمنع تخليق الحمض النووي | نيترويميدازول | ميترونيدازول، تينيدازول | الالتهابات التي تسببها الجيارديا لامبليا وإنتامويبا هيستوليتيكا والتريكوموناس فاجيناليس |
| لا ينطبق | بنتاميدين | مرض النوم الأفريقي وداء الليشمانيات | |
| تمنع إزالة السموم من الهيم | الكينولين | كلوروكين | الملاريا والالتهابات مع E. histolytica |
| ميباكرين، ميفلوكين | الملاريا |
التمارين\(\PageIndex{2}\)
اذكر طريقتين للعمل للأدوية المضادة للبروتوزوان.
الأدوية المضادة للديدان
نظرًا لأن الديدان الطفيلية هي حقيقيات النواة متعددة الخلايا مثل البشر، فإن تطوير عقاقير ذات سمية انتقائية ضدها يمثل تحديًا كبيرًا. على الرغم من ذلك، تم تطوير العديد من الفصول الفعالة (الجدول\(\PageIndex{3}\)). ترتبط البنزيميدازول الاصطناعية، مثل الميبيندازول والألبيندازول، بالديدان بيتا توبولين، مما يمنع تكوين النبيب الدقيقة. يبدو أن الأنابيب الدقيقة في الخلايا المعوية للديدان تتأثر بشكل خاص، مما يؤدي إلى انخفاض امتصاص الجلوكوز. إلى جانب نشاطها ضد مجموعة واسعة من الديدان الطفيلية، تنشط البنزيميدازول أيضًا ضد العديد من الكائنات الأولية والفطريات والفيروسات، ويتم دراسة استخدامها لتثبيط الانقسام وتطور دورة الخلية في الخلايا السرطانية. 2 الآثار الجانبية المحتملة لاستخدامها تشمل تلف الكبد وقمع نخاع العظام.
ينتمي الأفيرميكتين إلى عائلة الماكروليد التي تم اكتشافها لأول مرة في عزلة التربة اليابانية، وهي Streptomyces avermectinius. أحد المشتقات شبه الاصطناعية الأكثر فعالية للأفيرمكتين هو الإيفرمكتين، الذي يرتبط بقنوات الكلوريد المشبعة بالجلوتامات الخاصة باللافقاريات بما في ذلك الديدان الطفيلية، مما يمنع انتقال الخلايا العصبية ويسبب الجوع والشلل وموت الديدان. يستخدم الإيفرمكتين لعلاج أمراض الدودة، بما في ذلك داء كلابية الذنب (المعروف أيضًا بالعمى النهري، والذي تسببه دودة Onchocerca volvulus) وداء سترونغيلويديا (الذي تسببه الدودة Strongyloides stercoralis أو S. fuelleborni). يمكن للإيفرمكتين أيضًا علاج الحشرات الطفيلية مثل العث والقمل وبق الفراش، وهو غير سام للبشر.
Niclosamide هو دواء اصطناعي تم استخدامه لأكثر من 50 عامًا لعلاج عدوى الدودة الشريطية. على الرغم من أن طريقة عمله ليست واضحة تمامًا، يبدو أن النكلوساميد يمنع تكوين ATP في الظروف اللاهوائية ويمنع الفسفرة التأكسدية في الميتوكوندريا لمسببات الأمراض المستهدفة. لا يتم امتصاص النيكلوساميد من الجهاز الهضمي، وبالتالي يمكن أن يحقق تركيزات معوية موضعية عالية في المرضى. وقد ثبت مؤخرًا أنه يحتوي أيضًا على أنشطة مضادة للبكتيريا والفيروسات ومضادة للأورام. 3 4 5
وهناك دواء اصطناعي آخر مضاد للديدان هو البرازيكوانتيل، الذي يستخدم لعلاج الديدان الشريطية الطفيلية ودمى الكبد، وهو مفيد بشكل خاص في علاج داء البلهارسيات (الذي يسببه تدفق الدم من ثلاثة أجناس من البلهارسيا). لا يزال أسلوب عملها غير واضح، ولكن يبدو أنه يتسبب في تدفق الكالسيوم إلى الدودة، مما يؤدي إلى تشنج شديد وشلل للدودة. غالبًا ما يستخدم كبديل مفضل للنيكلوساميد في علاج الديدان الشريطية عندما يحد الانزعاج الهضمي من استخدام النيكلوساميد.
يُظهر الثيوكسانثينونات، وهو فئة أخرى من العقاقير الاصطناعية المرتبطة هيكليًا بالكينين، نشاطًا مضادًا للبلهارستوسوما عن طريق تثبيط تخليق الحمض النووي الريبي. كان ثيوكسانثينون لوكانثون ومستقلبه هيكانثون أول من استخدم سريريًا، ولكن الآثار الجانبية الخطيرة العصبية والجهاز الهضمي والقلب والأوعية الدموية والكبد أدت إلى توقفهما. يعتبر أوكسامنيكين، وهو مشتق أقل سمية من الهيكانثون، فعالاً فقط ضد بكتيريا المنسونية، وهي واحدة من الأنواع الثلاثة المعروفة بتسببها في داء البلهارسيات لدى البشر. تم تطوير البرازيكوانتيل لاستهداف النوعين الآخرين من البلهارسوم، ولكن المخاوف بشأن زيادة المقاومة جددت الاهتمام بتطوير مشتقات إضافية من أوكسامينكين لاستهداف جميع أنواع البلهارسوم الثلاثة المهمة سريريًا.
| آلية العمل | فئة الدواء | أدوية محددة | الاستخدامات السريرية |
|---|---|---|---|
| تمنع تكوين الأنابيب الدقيقة، مما يقلل من امتصاص الجلوكوز | بنزيميدازول | ميبندازول، ألبيندازول | مجموعة متنوعة من عدوى الديدان الطفيلية |
| منع انتقال الخلايا العصبية، مما يسبب الشلل والجوع | أفيرميكتين | آيفرمكتين | أمراض الدودة، بما في ذلك العمى النهري وداء السترونيلويديا، وعلاج الحشرات الطفيلية |
| تمنع إنتاج ATP | لا ينطبق | نيكلوساميد | عدوى الدودة الشريطية المعوية |
| تحفيز تدفق الكالسيوم | لا ينطبق | برازيكوانتيل | داء البلهارسيات (تدفقات الدم) |
| تمنع تخليق RNA | ثيوكسانثينونات | لوكانثون، هيكانثون، أوكسامنيكين | داء البلهارسيات (تدفقات الدم) |
التمارين\(\PageIndex{3}\)
لماذا يصعب تطوير الأدوية المضادة للديدان؟
الأدوية المضادة للفيروسات
على عكس التركيب المعقد للفطريات والبروتوزوا والديدان الطفيلية، فإن التركيب الفيروسي بسيط، ويتكون من الحمض النووي، والغطاء البروتيني، والإنزيمات الفيروسية، وأحيانًا غلاف دهني. علاوة على ذلك، تعد الفيروسات من مسببات الأمراض داخل الخلايا التي تستخدم الآلية الخلوية للمضيف للتكاثر. هذه الخصائص تجعل من الصعب تطوير أدوية ذات سمية انتقائية ضد الفيروسات.
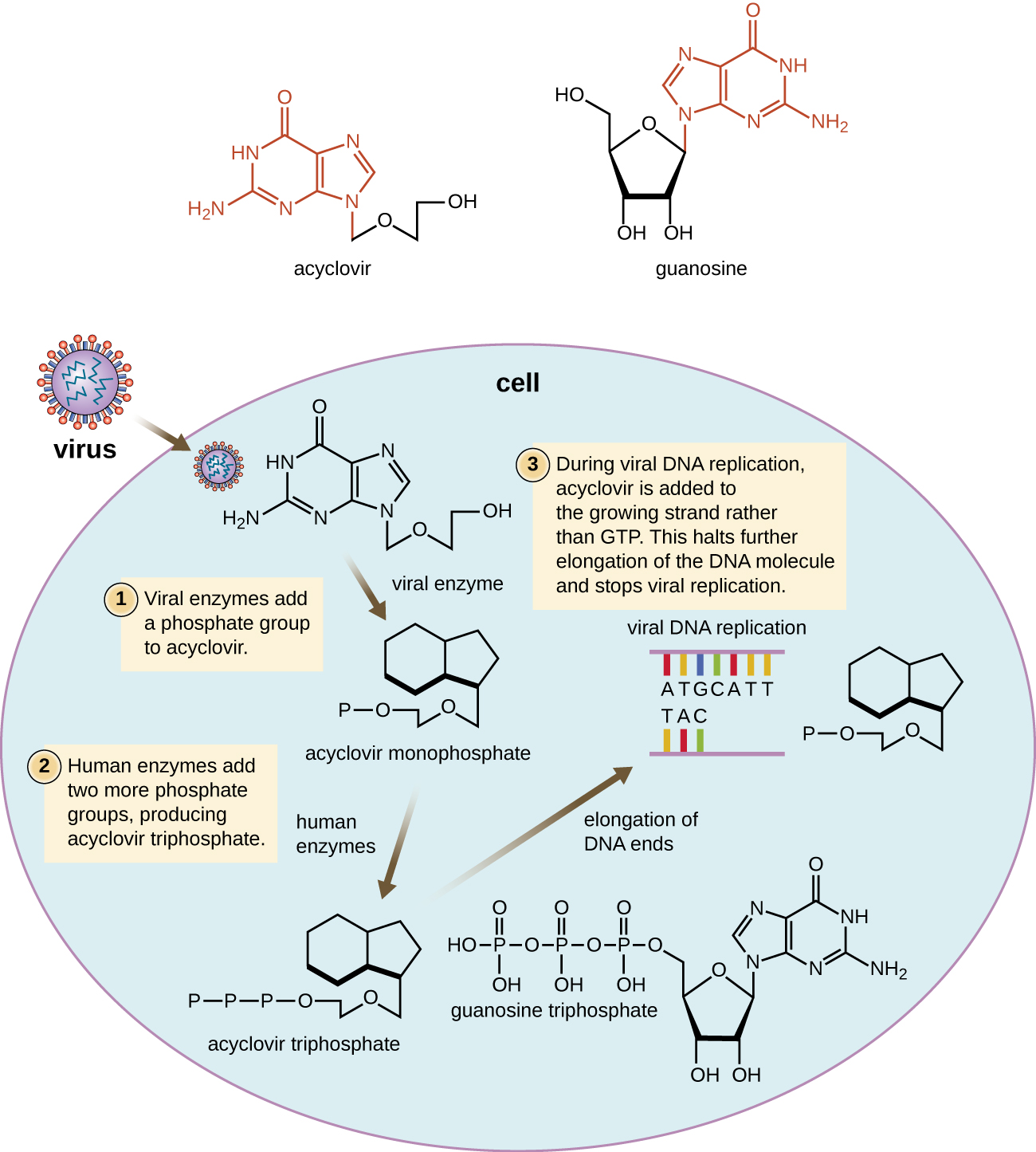
العديد من الأدوية المضادة للفيروسات هي نظائر النيوكليوسيد وتعمل عن طريق تثبيط التخليق الحيوي للحمض النووي. على سبيل المثال، الأسيكلوفير (الذي يتم تسويقه باسم Zovirax) هو نظير اصطناعي لغوانوزين النيوكليوزيد (الشكل\(\PageIndex{4}\)). يتم تنشيطه بواسطة إنزيم ثيميدين كيناز الفيروسي بالهربس البسيط، وعند إضافته إلى خيط الحمض النووي المتنامي أثناء التكاثر، يؤدي إلى إنهاء السلسلة. تأتي خصوصيته للخلايا المصابة بالفيروسات من الحاجة إلى إنزيم فيروسي لتنشيطه وزيادة تقارب الشكل المنشط لبوليميراز الحمض النووي الفيروسي مقارنة ببوليميراز الحمض النووي للخلايا المضيفة. كثيرًا ما يستخدم الأسيكلوفير ومشتقاته لعلاج عدوى فيروس الهربس، بما في ذلك الهربس التناسلي والجدري المائي والهربس النطاقي وعدوى فيروس Epstein-Barr وعدوى الفيروس المضخم للخلايا. يمكن إعطاء الأسيكلوفير موضعيًا أو نظاميًا، اعتمادًا على العدوى. أحد الآثار الجانبية المحتملة لاستخدامه يشمل السمية الكلوية. عقار أدينين-أرابينوسيد، الذي يتم تسويقه باسم فيدارابين، هو نظير اصطناعي للديوكسيدينوزين الذي له آلية عمل مماثلة لتلك الموجودة في الأسيكلوفير. كما أنها فعالة لعلاج فيروسات الهربس البشرية المختلفة. ومع ذلك، نظرًا للآثار الجانبية المحتملة التي تشمل انخفاض عدد خلايا الدم البيضاء والسمية العصبية، يُفضل الآن العلاج باستخدام الأسيكلوفير.
يعمل الريبافيرين، وهو نظير اصطناعي آخر للغوانوسين، من خلال آلية عمل غير واضحة تمامًا. يبدو أنه يتداخل مع تخليق كل من الحمض النووي والحمض النووي الريبي، ربما عن طريق تقليل التجمعات داخل الخلايا من ثلاثي فوسفات الجوانوسين (GTP). كما يبدو أن ريبافارين يثبط بوليميراز الحمض النووي الريبي لفيروس التهاب الكبد C. يستخدم في المقام الأول لعلاج فيروسات الحمض النووي الريبي مثل التهاب الكبد C (في العلاج المركب مع الإنترفيرون) والفيروس المخلوي التنفسي. تشمل الآثار الجانبية المحتملة لاستخدام الريبافيرين فقر الدم والآثار التنموية على الأطفال الذين لم يولدوا بعد في المرضى الحوامل. في السنوات الأخيرة، تم أيضًا تطوير نظير آخر للنيوكليوتيد، وهو سوفوسبوفير (سولفالدي)، لعلاج التهاب الكبد C. سوفوسبوفير هو نظير اليوريدين الذي يتداخل مع نشاط البوليميراز الفيروسي. عادة ما يتم تناوله بشكل مشترك مع الريبافيرين، مع الإنترفيرون وبدونه.
إن تثبيط تخليق الحمض النووي ليس الهدف الوحيد لمضادات الفيروسات الاصطناعية. على الرغم من أن طريقة عمل الأمانتادين وريمانتادين النسبي له ليست واضحة تمامًا، يبدو أن هذه الأدوية مرتبطة ببروتين عبر الغشاء يشارك في هروب فيروس الأنفلونزا من الإندوسومات. يمنع منع تسرب الفيروس أيضًا إطلاق الحمض النووي الريبي الفيروسي في الخلايا المضيفة والتكاثر الفيروسي اللاحق. أدت المقاومة المتزايدة إلى الحد من استخدام الأمانتادين والريمانتادين في علاج الأنفلونزا A. يمكن أن يؤدي استخدام الأمانتادين إلى آثار جانبية عصبية، ولكن الآثار الجانبية للريمانتادين تبدو أقل حدة. ومن المثير للاهتمام أنه نظرًا لتأثيرهما على المواد الكيميائية في الدماغ مثل الدوبامين و NMDA (N-methyl D-aspartate)، فإن الأمانتادين والريمانتادين يستخدمان أيضًا لعلاج مرض باركنسون.
تستهدف مثبطات النيورامينيداز، بما في ذلك أولسيتاميفير (تاميفلو) وزاناميفير (ريلينزا) وبيراميفير (رابيفاب)، فيروسات الإنفلونزا على وجه التحديد عن طريق منع نشاط نيورامينيداز فيروس الإنفلونزا، مما يمنع إطلاق الفيروس من الخلايا المصابة. يمكن لهذه الأدوية الثلاثة المضادة للفيروسات أن تقلل من أعراض الأنفلونزا وتقصر مدة المرض، ولكنها تختلف في طرق تناولها: يتم إعطاء أولسيتاميفير عن طريق الفم، ويتم استنشاق الزاناميفير، ويتم إعطاء البيراميفير عن طريق الوريد. يبدو أن مقاومة مثبطات النيورامينيداز هذه لا تزال ضئيلة.
Pleconaril هو مضاد فيروسات اصطناعي قيد التطوير أظهر وعدًا لعلاج فيروسات بيكورنافيروس. لم تتم الموافقة على استخدام pleconaril لعلاج نزلات البرد التي تسببها فيروسات الأنف من قبل إدارة الغذاء والدواء الأمريكية في عام 2002 بسبب عدم الفعالية المثبتة وعدم الاستقرار والارتباط بعدم انتظام الدورة الشهرية. تم إيقاف تطويره لهذا الغرض في عام 2007. ومع ذلك، لا يزال يتم فحص pleconaril لاستخدامه في علاج المضاعفات التي تهدد الحياة للفيروسات المعوية، مثل التهاب السحايا والإنتان. كما يتم التحقيق فيه لاستخدامه في الاستئصال العالمي لفيروس معوي محدد، وهو شلل الأطفال. 6 يبدو أن Pleconaril يعمل عن طريق الارتباط بالقفيصة الفيروسية ومنع تفكك الجسيمات الفيروسية داخل الخلايا المضيفة أثناء العدوى الفيروسية.
يمكن أن تكون الفيروسات ذات دورات الحياة المعقدة، مثل فيروس نقص المناعة البشرية، أكثر صعوبة في العلاج. أولاً، يستهدف فيروس نقص المناعة البشرية خلايا الدم البيضاء الإيجابية CD4، والتي تعتبر ضرورية للاستجابة المناعية الطبيعية للعدوى. ثانيًا، فيروس نقص المناعة البشرية هو فيروس ارتجاعي، مما يعني أنه يحول جينوم الحمض النووي الريبي الخاص به إلى نسخة من الحمض النووي تتكامل مع جينوم الخلية المضيفة، وبالتالي يختبئ داخل الحمض النووي للخلية المضيفة. ثالثًا، يفتقر النسخ العكسي لفيروس نقص المناعة البشرية إلى نشاط التدقيق اللغوي ويدخل طفرات تسمح بالتطور السريع لمقاومة الأدوية المضادة للفيروسات. للمساعدة في منع ظهور المقاومة، عادةً ما يتم استخدام مزيج من الأدوية الاصطناعية المضادة للفيروسات في العلاج بمضادات الفيروسات القهقرية لفيروس نقص المناعة البشرية (الشكل\(\PageIndex{5}\)).
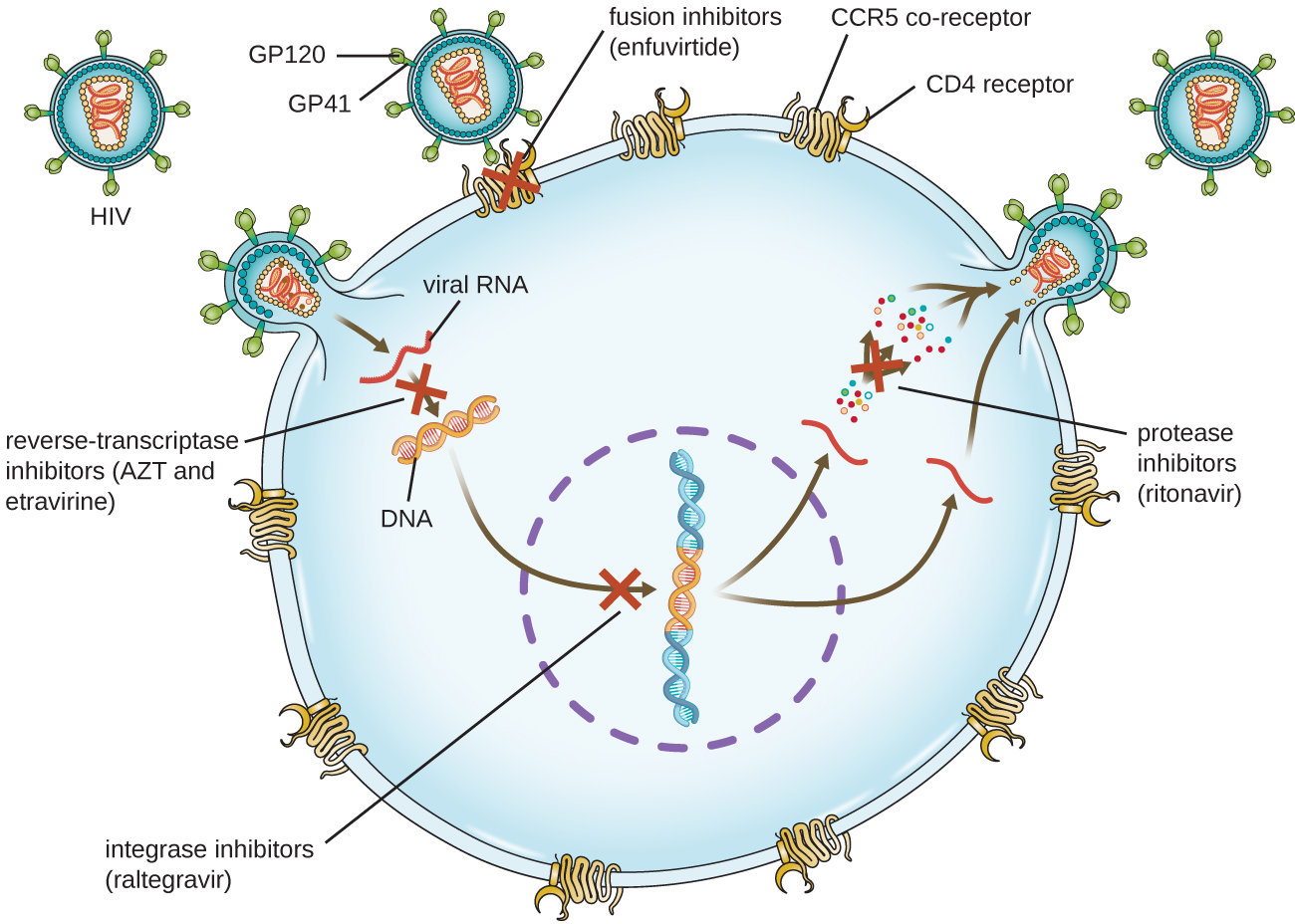
تمنع مثبطات النسخ العكسي الخطوة المبكرة لتحويل جينوم الحمض النووي الريبي الفيروسي إلى الحمض النووي الريبي، ويمكن أن تشمل مثبطات النيوكليوزيد التناظرية التنافسية (على سبيل المثال، أزيدوثيميد/زيدوفودين، أو AZT) ومثبطات غير النيوكليوزيد غير التنافسية (مثل إترافيرين) التي تربط النسخ العكسي وتسبب تعطيل التغيير التوافقي. الأدوية التي تسمى مثبطات الأنزيم البروتيني (مثل ريتونافير) تمنع معالجة البروتينات الفيروسية وتمنع النضج الفيروسي. كما يتم تطوير مثبطات البروتياز لعلاج الأنواع الفيروسية الأخرى. 7 على سبيل المثال، تمت الموافقة على سيمبيرير (Olysio) لعلاج التهاب الكبد C ويتم إعطاؤه مع الريبافيرين والإنترفيرون في العلاج المركب. تمنع مثبطات الإنتيغراز (مثل رالتيغرافير) نشاط تكامل فيروس نقص المناعة البشرية المسؤول عن إعادة تركيب نسخة الحمض النووي للجينوم الفيروسي في كروموسوم الخلية المضيفة. تشمل فئات الأدوية الإضافية لعلاج فيروس نقص المناعة البشرية مضادات CCR5 ومثبطات الاندماج (على سبيل المثال، enfuviritide)، التي تمنع ارتباط فيروس نقص المناعة البشرية بمستقبلات الخلية المضيفة (مستقبل الكيموكين من النوع 5 [CCR5]) ودمج الغلاف الفيروسي مع غشاء الخلية المضيفة، على التوالي. \(\PageIndex{4}\)يوضح الجدول الفئات العلاجية المختلفة للأدوية المضادة للفيروسات، مصنفة حسب طريقة العمل، مع أمثلة لكل منها.
| آلية العمل | دواء | الاستخدامات السريرية |
|---|---|---|
| تثبيط النوكليوسيد التناظري لتخليق الحمض النووي | أسيكلو | عدوى فيروس الهربس |
| أزيدوثيميدين/زيدوفودين (AZT) | عدوى فيروس نقص المناعة | |
| ريبافيرين | فيروس التهاب الكبد C وعدوى الفيروس المخلوي التنفسي | |
| فيدارابين | عدوى فيروس الهربس | |
| سوفوسبوفير | عدوى فيروس التهاب الكبد C | |
| التثبيط غير التنافسي للنيوكليوزيد | إترافيرين | عدوى فيروس نقص المناعة |
| تمنع تسرب الفيروس من الإندوسومات | أمانتادين، ريمانتادين | العدوى بفيروس الأنفلونزا |
| تمنع النوراميناداز | أولسيتاميفير، زاناميفير، بيراميفير | العدوى بفيروس الأنفلونزا |
| تمنع إزالة الطلاء الفيروسي | بليكوناريل | عدوى الفيروس المعوي الخطيرة |
| تثبيط البروتياز | ريتونافير | عدوى فيروس نقص المناعة |
| سيمبيريفير | عدوى فيروس التهاب الكبد C | |
| تثبيط الإنتيغراز | رالتغرافير | عدوى فيروس نقص المناعة |
| تثبيط الاندماج الغشائي | إنفوفيريتيد | عدوى فيروس نقص المناعة |
التمارين\(\PageIndex{4}\)
لماذا يصعب علاج فيروس نقص المناعة البشرية بمضادات الفيروسات؟
لمعرفة المزيد عن الفئات المختلفة من الأدوية المضادة للفيروسات القهقرية المستخدمة في العلاج بمضادات الفيروسات القهقرية لعدوى فيروس نقص المناعة البشرية، استكشف كل من الأدوية في فئات أدوية فيروس نقص المناعة البشرية التي تقدمها وزارة الصحة والخدمات الإنسانية الأمريكية على هذا الموقع.
المفاهيم الأساسية والملخص
- نظرًا لأن الفطريات والبروتوزوان والديدان الطفيلية هي كائنات حقيقية النواة مثل الخلايا البشرية، فمن الصعب تطوير عقاقير مضادة للميكروبات تستهدفها على وجه التحديد. وبالمثل، من الصعب استهداف الفيروسات لأن الفيروسات البشرية تتكاثر داخل الخلايا البشرية.
- تتداخل الأدوية المضادة للفطريات مع تخليق الإرغوستيرول، وترتبط بالإرغوستيرول لتعطيل سلامة غشاء الخلية الفطرية، أو تستهدف المكونات الخاصة بجدار الخلية أو البروتينات الخلوية الأخرى.
- تعمل الأدوية المضادة للبروتوزوان على زيادة المستويات الخلوية لأنواع الأكسجين التفاعلية، وتتداخل مع تكرار الحمض النووي الأولي (النووي مقابل الحمض النووي الريبي، على التوالي)، وتعطل إزالة السموم من الهيم.
- تعمل الأدوية المضادة للديدان على تعطيل تكوين النبيب الدقيقة للديدان والبروتوزوان؛ وتمنع انتقال الخلايا العصبية؛ وتمنع تكوين ATP اللاهوائي و/أو الفسفرة التأكسدية؛ وتحفز تدفق الكالسيوم في الديدان الشريطية، مما يؤدي إلى التشنجات والشلل؛ وتتداخل مع تخليق الحمض النووي الريبي في البلهارسيات.
- تمنع الأدوية المضادة للفيروسات دخول الفيروس، وتمنع إزالة الطلاء الفيروسي، وتمنع التخليق الحيوي للحمض النووي، وتمنع الهروب الفيروسي من الإندوسومات في الخلايا المضيفة، وتمنع إطلاق الفيروس من الخلايا المصابة.
- نظرًا لأنه يمكن أن يتحور بسهولة ليصبح مقاومًا للأدوية، يتم علاج فيروس نقص المناعة البشرية عادةً بمزيج من العديد من الأدوية المضادة للفيروسات القهقرية، والتي قد تشمل مثبطات النسخ العكسي ومثبطات البروتياز ومثبطات الإنتيغراز والأدوية التي تتداخل مع الارتباط الفيروسي والاندماج بدء العدوى.
الحواشي
- 1 مراكز السيطرة على الأمراض والوقاية منها. «حمى الوادي: الوعي هو المفتاح» www.cdc.gov/features/valleyfever/ تم الوصول إليه في 1 يونيو 2016.
- 2 ب. تشو وآخرون. «مشتق بنزيميدازول الذي يظهر نشاطًا مضادًا للأورام يمنع نشاط EGFR و HER2 وينظم DR5 في خلايا سرطان الثدي.» موت الخلايا والمرض 6 (2015): e1686
- 3 جيه - إكس. بان وآخرون. «نيكلوساميد، عامل قديم مضاد للديدان، يوضح النشاط المضاد للأورام عن طريق منع مسارات الإشارات المتعددة للخلايا الجذعية السرطانية.» المجلة الصينية للسرطان 31 رقم 4 (2012): 178—184.
- 4 إف إمبيري وآخرون. «حياة جديدة لدواء قديم: عقار نيكلوساميد المضاد للديدان يثبط استشعار النصاب الزنجاري الكاذب». العوامل المضادة للميكروبات والعلاج الكيميائي 57 رقم 2 (2013): 996-1005.
- (5) أ. جورجيت وآخرون «النيكلوساميد هو ناقل للبروتون ويستهدف الإندوسومات الحمضية بتأثيرات واسعة مضادة للفيروسات.» مسببات الأمراض في منظمة أطباء بلا حدود 8 رقم 10 (2012): 1002976.
- 6 م. أبزوغ. «الفيروسات المعوية: مشاكل تحتاج إلى علاجات». مجلة العدوى 68 رقم. S1 (2014): 108—14.
- 7 بي إل بيرلمان. «مثبطات البروتياز لعلاج عدوى التهاب الكبد الوبائي C المزمن من النمط الجيني -1: معيار الرعاية الجديد.» الأمراض المعدية لانسيت 12 رقم 9 (2012): 717-728.


