14.3: الأدوية التي تستهدف الكائنات الدقيقة الأخرى
- Page ID
- 195380
أهداف التعلم
- وصف آليات العمل المرتبطة بالأدوية التي تمنع التركيب الحيوي لجدار الخلية، وتخليق البروتين، ووظيفة الغشاء، وتخليق الحمض النووي، ومسار التمثيل الغذائي.
تعتبر السمية الانتقائية من الصفات المهمة للدواء المضاد للميكروبات، مما يعني أنه يقتل بشكل انتقائي أو يمنع نمو الأهداف الميكروبية بينما يسبب ضررًا ضئيلًا أو معدومًا للمضيف. معظم الأدوية المضادة للميكروبات المستخدمة حاليًا في العيادة مضادة للبكتيريا لأن الخلية بدائية النواة توفر تنوعًا أكبر من الأهداف الفريدة للسمية الانتقائية، مقارنة بالفطريات والطفيليات والفيروسات. كل فئة من الأدوية المضادة للبكتيريا لها طريقة عمل فريدة (الطريقة التي يؤثر بها الدواء على الميكروبات على المستوى الخلوي)، ويتم تلخيصها في الشكل\(\PageIndex{1}\) والجدول\(\PageIndex{1}\).
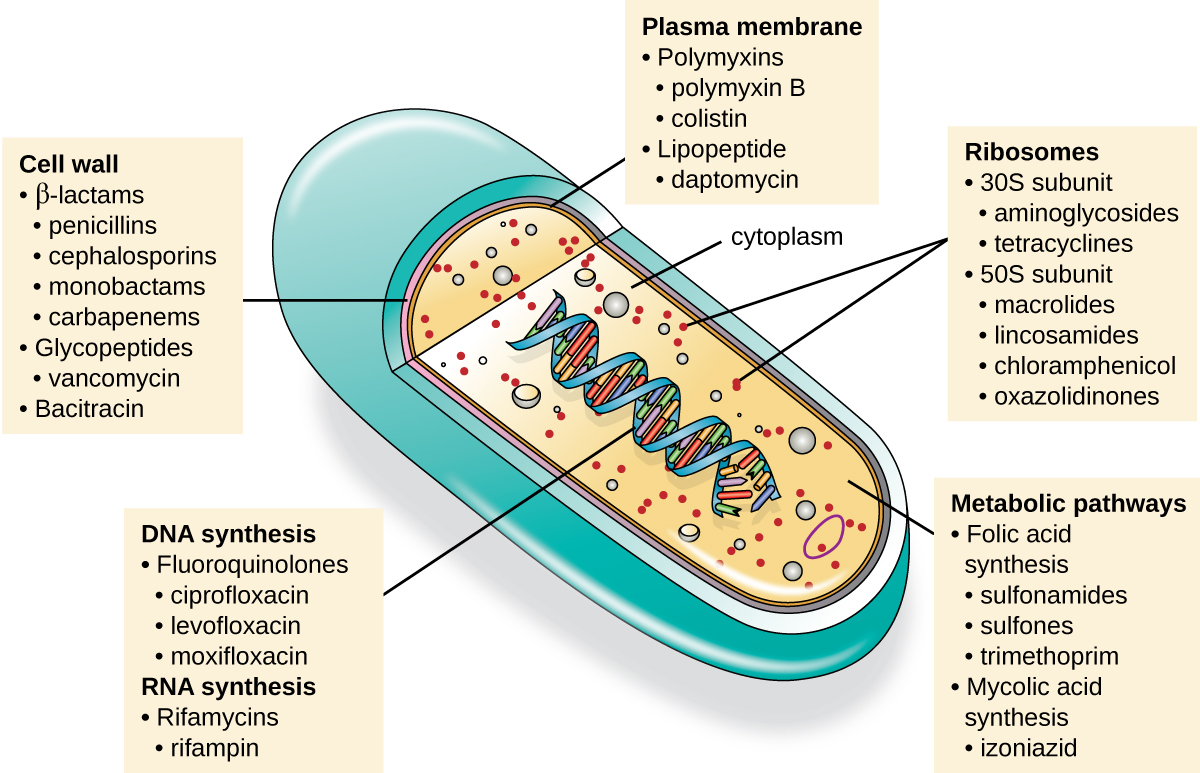
| وضع العمل | الهدف | فئة الدواء |
|---|---|---|
| تمنع التخليق الحيوي لجدار الخلية | بروتينات ربط البنسلين | بيتا لاكتام: البنسلين والسيفالوسبورين والمونوباكتام والكاربابينيمات |
| وحدات ببتيدوجليكان الفرعية | جليكوببتيد | |
| نقل الوحدة الفرعية الببتيدوغليكان | باسيتراسين | |
| تمنع التخليق الحيوي للبروتينات | وحدة فرعية ريبوسومية ثلاثية الأبعاد | الأمينوغليكوزيدات والتتراسيكلين |
| الوحدة الفرعية الريبوسومية 50S | الماكروليدات واللينكوساميدات والكلورامفينيكول والأوكسازوليدينونات | |
| تعطيل الأغشية | ليبوبوليساكاريد والأغشية الداخلية والخارجية | بوليميكسين B، كوليستين، دابتومايسين |
| تمنع تخليق الحمض النووي | رنا | ريفامايسين |
| الحمض النووي | الفلوروكينولونات | |
| مضادات الأيض | إنزيم تخليق حمض الفوليك | السلفوناميدات، تريميثوبريم |
| إنزيم تخليق حمض الميكوليك | هيدرازيد حمض إيسونيكوتينك | |
| مثبط سينثاز المتفطرة الأدينوزين ثلاثي الفوسفات (ATP) | سينثاز الميكوبكتريا ATP | ديارلكينولين |
مثبطات التخليق الحيوي لجدار الخلية
هناك عدة فئات مختلفة من مضادات الجراثيم تمنع خطوات التخليق الحيوي للببتيدوجليكان، مما يجعل الخلايا أكثر عرضة للتحلل الاسموزي (الجدول\(\PageIndex{2}\)). لذلك، فإن مضادات البكتيريا التي تستهدف التخليق الحيوي لجدار الخلية تكون مبيدة للجراثيم في عملها. نظرًا لأن الخلايا البشرية لا تصنع الببتيدوجليكان، فإن طريقة العمل هذه هي مثال ممتاز على السمية الانتقائية.
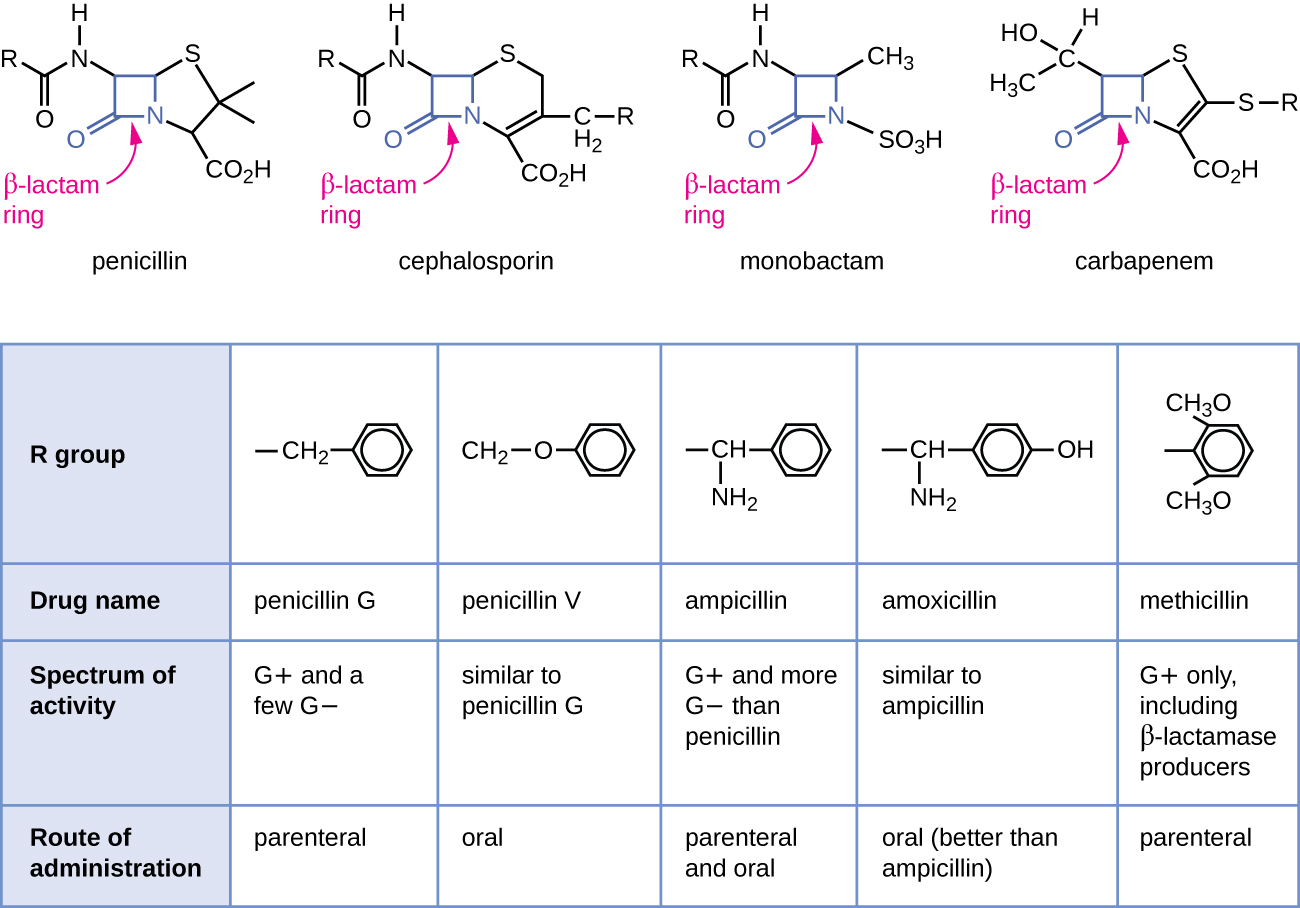
يعتبر البنسلين، أول مضاد حيوي تم اكتشافه، واحدًا من العديد من مضادات الجراثيم ضمن فئة تسمى بيتا لاكتامز. تشمل هذه المجموعة من المركبات البنسلين والسيفالوسبورين والمونوباكتام والكاربابينيمات، وتتميز بوجود حلقة بيتا لاكتام موجودة داخل البنية المركزية لجزيء الدواء (الشكل\(\PageIndex{2}\)). تمنع مضادات البكتيريا بيتا لاكتام التشابك بين سلاسل الببتيد أثناء التخليق الحيوي للببتيدوجليكان الجديد في جدار الخلية البكتيرية. إنهم قادرون على منع هذه العملية لأن بنية بيتا لاكتام تشبه بنية مكون الوحدة الفرعية للببتيدوجليكان الذي يتم التعرف عليه من خلال إنزيم ترانسبيتيداز المتشابك، والمعروف أيضًا باسم بروتين ربط البنسلين (PBP). على الرغم من أن حلقة بيتا لاكتام يجب أن تظل دون تغيير حتى تحتفظ هذه الأدوية بنشاطها المضاد للبكتيريا، فقد سمحت التغييرات الكيميائية الإستراتيجية لمجموعات R بتطوير مجموعة متنوعة من أدوية بيتا لاكتام شبه الاصطناعية مع زيادة الفاعلية، وتوسيع نطاق النشاط، وأعمار نصف عمر أطول للأفضل الجرعات، من بين خصائص أخرى.
يعتبر البنسلين G والبنسلين V من المضادات الحيوية الطبيعية من الفطريات ويفعلان بشكل أساسي ضد مسببات الأمراض البكتيرية إيجابية الجرام، وعدد قليل من مسببات الأمراض البكتيرية سالبة الجرام مثل Pasteurella multocida. \(\PageIndex{2}\)يلخص الشكل التطور شبه الصناعي لبعض البنسلين. أدت إضافة مجموعة أمينية (-NH 2) إلى البنسلين G إلى إنشاء الأمينوبينيسيلين (أي الأمبيسلين والأموكسيسيلين) التي زادت من طيف النشاط ضد المزيد من مسببات الأمراض سالبة الجرام. علاوة على ذلك، أدت إضافة مجموعة الهيدروكسيل (-OH) إلى الأموكسيسيلين إلى زيادة استقرار الحمض، مما يسمح بتحسين الامتصاص الفموي. الميثيسيلين هو بنسلين شبه صناعي تم تطويره لمعالجة انتشار الإنزيمات (البنسلينازات) التي كانت تثبط نشاط البنسلين الأخرى. أدى تغيير مجموعة R من البنسلين G إلى مجموعة ثنائي ميثوكسي فينيل الأكثر ضخامة إلى توفير الحماية لحلقة بيتا لاكتام من التدمير الإنزيمي بواسطة البنسلينازات، مما أعطانا أول بنسلين مقاوم للبنسليناز.
على غرار البنسلين، تحتوي السيفالوسبورينات على حلقة بيتا لاكتام (الشكل\(\PageIndex{2}\)) وتمنع نشاط الترانسبيتيداز للبروتينات الرابطة للبنسلين. ومع ذلك، يتم دمج حلقة بيتا لاكتام من السيفالوسبورين في حلقة مكونة من ستة أعضاء، بدلاً من الحلقة المكونة من خمسة أعضاء الموجودة في البنسلين. يوفر هذا الاختلاف الكيميائي للسيفالوسبورين مقاومة متزايدة للتعطيل الإنزيمي بواسطة بيتا لاكتاماز. تم عزل عقار السيفالوسبورين سي في الأصل عن فطر السيفالوسبوريوم أكريمونيوم في الخمسينيات من القرن الماضي وله طيف مماثل من النشاط لنشاط البنسلين ضد البكتيريا الإيجابية للجرام ولكنه نشط ضد البكتيريا سالبة الجرام أكثر من البنسلين. الفرق الهيكلي المهم الآخر هو أن السيفالوسبورين C يمتلك مجموعتين R، مقارنة بمجموعة R واحدة فقط للبنسلين، وهذا يوفر تنوعًا أكبر في التعديلات الكيميائية وتطوير السيفالوسبورين شبه الصناعي. تعد عائلة السيفالوسبورين شبه الاصطناعية أكبر بكثير من البنسلين، وقد تم تصنيف هذه الأدوية إلى أجيال بناءً على طيف نشاطها بشكل أساسي، حيث يزداد طيفها من السيفالوسبورين ضيق الطيف من الجيل الأول إلى الجيل الرابع واسع الطيف السيفالوسبورين. تم تطوير الجيل الخامس الجديد من السيفالوسبورين الذي ينشط ضد المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA).
تحتوي الكاربابينيمات والمونوباكتام أيضًا على حلقة بيتا لاكتام كجزء من تركيبتها الأساسية، كما أنها تمنع نشاط ترانسبيتيداز للبروتينات الرابطة للبنسلين. المونوباكتام الوحيد المستخدم سريريًا هو أزتريونام. إنه مضاد للجراثيم ضيق الطيف وله نشاط فقط ضد البكتيريا سالبة الجرام. في المقابل، تشتمل عائلة الكاربابينيم على مجموعة متنوعة من الأدوية شبه الاصطناعية (إيميبينيم وميروبينيم ودوريبينيم) التي توفر نشاطًا واسعًا جدًا ضد مسببات الأمراض البكتيرية إيجابية الجرام وسالبة الجرام.
تم اكتشاف عقار فانكومايسين، وهو عضو في فئة من المركبات تسمى الجليكوبيبتيدات، في الخمسينيات كمضاد حيوي طبيعي من الأكتينوميسيت أميكولاتوبسيس أورينتاليس. على غرار بيتا لاكتامز، يثبط الفانكومايسين التخليق الحيوي لجدار الخلية وهو مبيد للجراثيم. ومع ذلك، وعلى النقيض من بيتا لاكتامز، فإن بنية الفانكومايسين لا تشبه بنية وحدات الببتيدوجليكان الفرعية لجدار الخلية ولا تعمل بشكل مباشر على تعطيل بروتينات ربط البنسلين. بدلاً من ذلك، يعتبر الفانكومايسين جزيئًا كبيرًا ومعقدًا يرتبط بنهاية سلسلة الببتيد لسلائف جدار الخلية، مما يخلق انسدادًا هيكليًا يمنع الوحدات الفرعية لجدار الخلية من الاندماج في العمود الفقري المتنامي لـ N-acetylglucosamine وحمض N-acetylmuramic (NAM-NAG) للبتيدوجليكان هيكل (نقل الجليكوزيل). كما يمنع فانكومايسين من الناحية الهيكلية عملية النقل. يعتبر الفانكومايسين مبيد للجراثيم ضد مسببات الأمراض البكتيرية الإيجابية للجرام، ولكنه غير فعال ضد البكتيريا سالبة الجرام بسبب عدم قدرته على اختراق الغشاء الخارجي الواقي.
يتكون عقار الباسيتراسين من مجموعة من المضادات الحيوية الببتيد المتشابهة هيكليًا المعزولة في الأصل من Bacillus subtilis. يمنع الباسيتراسين نشاط جزيء معين من غشاء الخلية المسؤول عن حركة سلائف الببتيدوجليكان من السيتوبلازم إلى السطح الخارجي للخلية، مما يمنع في النهاية اندماجها في جدار الخلية. يعتبر الباسيتراسين فعالاً ضد مجموعة واسعة من البكتيريا، بما في ذلك الكائنات الحية التي تحمل علامات الجرام والتي توجد على الجلد، مثل المكورات العنقودية والمكورات العقدية. على الرغم من أنه يمكن تناوله عن طريق الفم أو عن طريق الحقن العضلي في بعض الحالات، فقد ثبت أن الباسيتراسين سام للكلى (يضر الكلى). لذلك، يتم دمجه بشكل أكثر شيوعًا مع النيومايسين والبوليميكسين في المراهم الموضعية مثل نيوسبورين.
| آلية العمل | فئة الدواء | أدوية محددة | طبيعي أو شبه صناعي | طيف النشاط |
|---|---|---|---|---|
| تتفاعل مباشرة مع PBPs وتمنع نشاط الترانسبيتيداز | البنسلين | البنسلين G، البنسلين V | طبيعي | طيف ضيق ضد البكتيريا الموجبة للجرام وبعض البكتيريا سالبة الجرام |
| أمبيسيلين، أموكسيسيلين | شبه صناعي | طيف ضيق ضد البكتيريا الموجبة للجرام ولكن مع زيادة الطيف السالب للجرام | ||
| ميثيسيلين | شبه صناعي | طيف ضيق ضد البكتيريا الإيجابية للجرام فقط، بما في ذلك السلالات المنتجة للبنسليناز | ||
| السيفالوسبورين | سيفالوسبورين C | طبيعي | طيف ضيق يشبه البنسلين ولكن مع زيادة الطيف السلبي للجرام | |
| الجيل الأول من السيفالوسبورين | شبه صناعي | طيف ضيق يشبه السيفالوسبورين C | ||
| الجيل الثاني من السيفالوسبورين | شبه صناعي | طيف ضيق ولكن مع زيادة الطيف السلبي الجرام مقارنة بالجيل الأول | ||
| الجيل الثالث والرابع من السيفالوسبورين | شبه صناعي | طيف واسع ضد البكتيريا الموجبة للجرام والبكتيريا السالبة للجرام، بما في ذلك بعض منتجي بيتا لاكتاماز | ||
| الجيل الخامس من السيفالوسبورين | شبه صناعي | طيف واسع ضد البكتيريا الموجبة للجرام والبكتيريا سالبة الجرام، بما في ذلك MRSA | ||
| مونوباكتامز | أزتريونام | شبه صناعي | طيف ضيق ضد البكتيريا سالبة الجرام، بما في ذلك بعض منتجي بيتا لاكتاماز | |
| الكاربابينيمات | إيميبينيم، ميروبينيم، دوريبينيم | شبه صناعي | أوسع طيف من بيتا لاكتامز ضد البكتيريا الإيجابية والجرام وسلبية الجرام، بما في ذلك العديد من منتجي بيتا لاكتاماز | |
| الجزيئات الكبيرة التي ترتبط بسلسلة الببتيد من وحدات الببتيدوجليكان الفرعية، مما يمنع نقل الجليكوزيل ونقل الببتيد | جليكوببتيد | فانكومايسين | طبيعي | طيف ضيق ضد البكتيريا إيجابية الجرام فقط، بما في ذلك السلالات المقاومة للأدوية المتعددة |
| منع نقل وحدات الببتيدوجليكان الفرعية عبر الغشاء السيتوبلازمي | باسيتراسين | باسيتراسين | طبيعي | طيف واسع ضد البكتيريا الموجبة للجرام والبكتيريا سالبة الجرام |
التمارين\(\PageIndex{1}\)
وصف طريقة عمل بيتا لاكتامز.
مثبطات التخليق الحيوي للبروتين
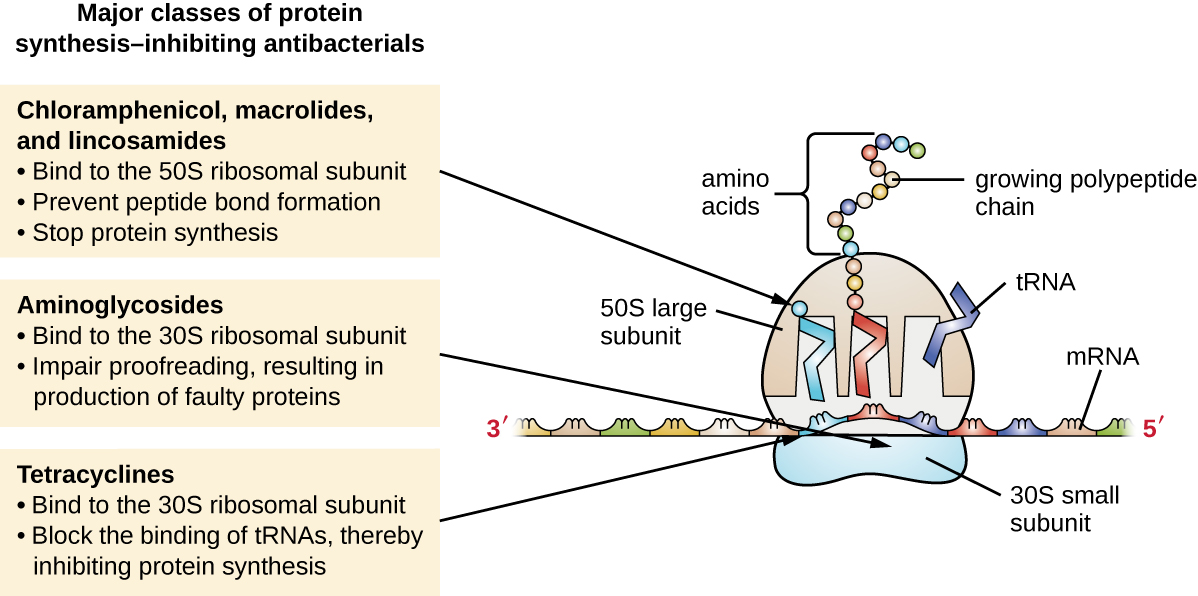
تختلف الريبوسومات السيتوبلازمية الموجودة في الخلايا الحيوانية (الثمانينيات) هيكليًا عن تلك الموجودة في الخلايا البكتيرية (70S)، مما يجعل التخليق الحيوي للبروتين هدفًا انتقائيًا جيدًا للأدوية المضادة للبكتيريا. تمت مناقشة عدة أنواع من مثبطات التخليق الحيوي للبروتين في هذا القسم ويتم تلخيصها في الشكل\(\PageIndex{3}\).
مثبطات تخليق البروتين التي تربط الوحدة الفرعية 30S
الأمينوغليكوزيدات هي أدوية كبيرة مضادة للبكتيريا شديدة القطبية ترتبط بالوحدة الفرعية 30S من الريبوسومات البكتيرية، مما يضعف قدرة التدقيق اللغوي لمركب الريبوسوم. يتسبب هذا الضعف في عدم التطابق بين الكودونات ومضادات الأكسدة، مما يؤدي إلى إنتاج بروتينات تحتوي على أحماض أمينية غير صحيحة وبروتينات مختصرة تدخل في الغشاء السيتوبلازمي. يؤدي اضطراب الغشاء السيتوبلازمي بواسطة البروتينات المعيبة إلى قتل الخلايا البكتيرية. تعتبر الأمينوغليكوزيدات، التي تشمل أدوية مثل الستربتومايسين والجنتاميسين والنيومايسين والكانامايسين، مضادات بكتيرية قوية واسعة الطيف. ومع ذلك، فقد ثبت أن الأمينوغليكوزيدات سامة للكلى (ضارة بالكلى)، وسامة للأعصاب (ضارة بالجهاز العصبي)، وسامة للأذن (ضارة بالأذن).
فئة أخرى من المركبات المضادة للبكتيريا التي ترتبط بالوحدة الفرعية 30S هي التتراسيكلين. على عكس الأمينوغليكوزيدات، فإن هذه الأدوية مضادة للجراثيم وتمنع تخليق البروتين عن طريق منع ارتباط الحمض النووي الريبوزي مع الريبوسوم أثناء الترجمة. تم اكتشاف التتراسيكلين الطبيعي الذي تنتجه سلالات مختلفة من Streptomyces لأول مرة في الأربعينيات، كما تم إنتاج العديد من التتراسيكلين شبه الصناعي، بما في ذلك الدوكسيسيكلين والتيجيسيكلين. على الرغم من أن التتراسيكلين واسع الطيف في تغطيته لمسببات الأمراض البكتيرية، إلا أن الآثار الجانبية التي يمكن أن تحد من استخدامها تشمل السمية الضوئية وتغير اللون الدائم للأسنان النامية وسمية الكبد بجرعات عالية أو في المرضى الذين يعانون من ضعف الكلى.
مثبطات تخليق البروتين التي تربط الوحدة الفرعية لـ 50S
هناك عدة فئات من الأدوية المضادة للبكتيريا التي تعمل من خلال الارتباط بالوحدة الفرعية 50S من الريبوسومات البكتيرية. تحتوي عقاقير الماكروليد المضادة للبكتيريا على بنية حلقية كبيرة ومعقدة وهي جزء من فئة أكبر من المستقلبات الثانوية المنتجة بشكل طبيعي والتي تسمى البوليكيتيد، وهي مركبات معقدة يتم إنتاجها بطريقة تدريجية من خلال الإضافة المتكررة لوحدات ثنائية الكربون بواسطة آلية مماثلة لتلك المستخدمة في الدهون تخليق الحمض. الماكروليدات هي أدوية مضادة للجراثيم واسعة الطيف تمنع استطالة البروتينات عن طريق تثبيط تكوين رابطة الببتيد بين مجموعات محددة من الأحماض الأمينية. كان الماكروليد الأول هو الاريثروميسين. تم عزله في عام 1952 عن Streptomyces erythreus ويمنع انتقاله. تشمل الماكروليدات شبه الاصطناعية أزيثروميسين وتليثروميسين. وبالمقارنة مع الاريثروميسين، يتمتع أزيثروميسين بنطاق أوسع من النشاط، وآثار جانبية أقل، وفترة نصف عمر أطول بكثير (1.5 ساعة للإريثروميسين مقابل 68 ساعة للأزيثروميسين) مما يسمح بتناول جرعات مرة واحدة يوميًا ودورة علاج قصيرة لمدة 3 أيام (أي تركيبة Zpac) لمعظم حالات العدوى. تيليثروميسين هو أول مادة شبه صناعية ضمن الفئة المعروفة باسم الكيتوليدات. على الرغم من أن التليثروميسين يُظهر مزيدًا من الفاعلية والنشاط ضد مسببات الأمراض المقاومة للماكروليدات، فقد حصرت إدارة الغذاء والدواء الأمريكية (FDA) استخدامه لعلاج الالتهاب الرئوي المكتسب من المجتمع وتتطلب أقوى علامة «تحذير الصندوق الأسود» للدواء بسبب السمية الكبدية الخطيرة.
تشمل اللينكوساميدات اللينكومايسين المنتج بشكل طبيعي والكليندامايسين شبه الصناعي. على الرغم من تميزها هيكليًا عن الماكروليدات، إلا أن اللينكوساميدات تتشابه في طريقة عملها مع الماكروليدات من خلال الارتباط بالوحدة الفرعية الريبوسومية 50S ومنع تكوين رابطة الببتيد. تنشط لينكوساميدات بشكل خاص ضد عدوى المكورات العقدية والمكورات العنقودية.
يمثل عقار الكلورامفينيكول فئة أخرى متميزة هيكليًا من مضادات البكتيريا التي ترتبط أيضًا بالريبوسوم 50S، مما يثبط تكوين رابطة الببتيد. تم اكتشاف الكلورامفينيكول، الذي أنتجته Streptomyces venezuelae، في عام 1947؛ وفي عام 1949، أصبح أول مضاد حيوي واسع الطيف تمت الموافقة عليه من قبل إدارة الغذاء والدواء. على الرغم من أنه مضاد حيوي طبيعي، إلا أنه يتم تصنيعه بسهولة وكان أول دواء مضاد للبكتيريا يتم إنتاجه صناعيًا. نتيجة لإنتاجه الضخم وتغطيته واسعة الطيف وقدرته على اختراق الأنسجة بكفاءة، تم استخدام الكلورامفينيكول تاريخيًا لعلاج مجموعة واسعة من الالتهابات، من التهاب السحايا إلى حمى التيفوئيد إلى التهاب الملتحمة. لسوء الحظ، أدت الآثار الجانبية الخطيرة، مثل متلازمة الطفل الرمادي القاتلة، وقمع إنتاج نخاع العظام، إلى الحد من دوره السريري. يسبب الكلورامفينيكول أيضًا فقر الدم بطريقتين مختلفتين. تتضمن إحدى الآليات استهداف ريبوسومات الميتوكوندريا داخل الخلايا الجذعية المكونة للدم، مما يتسبب في قمع عكسي يعتمد على الجرعة لإنتاج خلايا الدم. بمجرد إيقاف جرعات الكلورامفينيكول، يعود إنتاج خلايا الدم إلى طبيعته. تسلط هذه الآلية الضوء على التشابه بين ريبوسومات السبعينيات للبكتيريا وريبوسومات السبعينيات داخل الميتوكوندريا الخاصة بنا. الآلية الثانية لفقر الدم هي خصوصية (أي أن الآلية غير مفهومة)، وتنطوي على فقدان قاتل لا رجعة فيه لإنتاج خلايا الدم يعرف باسم فقر الدم اللاتنسجي. لا تعتمد آلية فقر الدم اللاتنسجي هذه على الجرعة ويمكن أن تتطور بعد توقف العلاج. بسبب مخاوف السمية، أصبح استخدام الكلورامفينيكول في البشر نادرًا الآن في الولايات المتحدة ويقتصر على الالتهابات الشديدة التي لا يمكن علاجها بالمضادات الحيوية الأقل سمية. نظرًا لأن آثاره الجانبية أقل حدة في الحيوانات، فإنه يستخدم في الطب البيطري.
تعد الأوكسازوليدينونات، بما في ذلك اللينزوليد، فئة جديدة واسعة الطيف من مثبطات تخليق البروتين الاصطناعي التي ترتبط بالوحدة الفرعية الريبوسومية 50S لكل من البكتيريا الإيجابية بالجرام والبكتيريا سالبة الجرام. ومع ذلك، تبدو آلية عملها مختلفة إلى حد ما عن تلك الخاصة بمثبطات تخليق البروتين الأخرى المرتبطة بوحدات 50S الفرعية التي تمت مناقشتها بالفعل. بدلاً من ذلك، يبدو أنها تتداخل مع تكوين مجمع البدء (ارتباط الوحدة الفرعية لـ 50S، والوحدة الفرعية 30S، وعوامل أخرى) للترجمة، وتمنع نقل البروتين المتنامي من موقع الريبوسومال A إلى موقع P. \(\PageIndex{3}\)يلخص الجدول مثبطات تخليق البروتين.
| الهدف الجزيئي | آلية العمل | فئة الدواء | أدوية محددة | مضاد للجراثيم أو مبيد للجراثيم | طيف النشاط |
|---|---|---|---|---|---|
| الوحدة الفرعية 30S | يسبب عدم التطابق بين الكودونات ومضادات الأكواد، مما يؤدي إلى خلل في البروتينات التي تدخل في الغشاء السيتوبلازمي وتعطله | أمينوغليكوزيد | ستربتومايسين، جنتاميسين، نيومايسين، كانامايسين | مبيد للجراثيم | طيف واسع |
| يمنع ارتباط الحمض النووي الريبوزي مع الريبوسوم | التتراسيكلين | التتراسيكلين، الدوكسيسيكلين، التيسيكلين | مضاد للجراثيم | طيف واسع | |
| الوحدة الفرعية 50S | يمنع تكوين رابطة الببتيد بين الأحماض الأمينية | الماكروليدات | الاريثروميسين، أزيثروميسين، تيليثروميسين | مضاد للجراثيم | طيف واسع |
| لينكوساميدس | لينكومايسين، كليندامايسين | مضاد للجراثيم | طيف ضيق | ||
| لا ينطبق | الكلورامفينيكول | مضاد للجراثيم | طيف واسع | ||
| يتداخل مع تكوين مجمع البدء بين الوحدات الفرعية 50S و 30S وعوامل أخرى. | أوكسازوليدينونات | لينزوليد | مضاد للجراثيم | طيف واسع |
التمارين\(\PageIndex{2}\)
قارن وقارن بين الأنواع المختلفة من مثبطات تخليق البروتين.
مثبطات وظيفة الغشاء
تستهدف مجموعة صغيرة من مضادات البكتيريا الغشاء البكتيري كطريقة عملها (الجدول\(\PageIndex{4}\)). البوليميكسين عبارة عن مضادات حيوية طبيعية متعددة الببتيد تم اكتشافها لأول مرة في عام 1947 كمنتجات لـ Bacillus polymyxa؛ تم استخدام البوليميكسين B والبوليميكسين E (الكوليستين) سريريًا فقط. إنها محبة للدهون ولها خصائص تشبه المنظفات وتتفاعل مع مكون عديد السكاريد الشحمي في الغشاء الخارجي للبكتيريا سالبة الجرام، مما يؤدي في النهاية إلى تعطيل كل من أغشيتها الخارجية والداخلية وقتل الخلايا البكتيرية. لسوء الحظ، فإن آلية استهداف الغشاء ليست سمية انتقائية، وهذه الأدوية تستهدف أيضًا وتتلف غشاء الخلايا في الكلى والجهاز العصبي عند تناولها بشكل منهجي. بسبب هذه الآثار الجانبية الخطيرة وسوء امتصاصها من الجهاز الهضمي، يتم استخدام البوليميكسين B في مراهم المضادات الحيوية الموضعية التي لا تستلزم وصفة طبية (مثل نيوسبورين)، وكان الكوليستين الفموي يستخدم تاريخيًا فقط لإزالة تلوث الأمعاء لمنع الالتهابات الناشئة عن ميكروبات الأمعاء في المرضى الذين يعانون من نقص المناعة أو لأولئك الذين يخضعون لجراحات معينة في البطن. ومع ذلك، أدى ظهور وانتشار مسببات الأمراض المقاومة للأدوية المتعددة إلى زيادة استخدام الكوليستين الوريدي في المستشفيات، غالبًا كدواء الملاذ الأخير لعلاج الالتهابات الخطيرة. الدابتومايسين المضاد للبكتيريا هو ليبوببتيد دوري ينتجه Streptomyces roseosporus ويبدو أنه يعمل مثل البوليميكسين، حيث يدخل في غشاء الخلية البكتيرية ويعطله. ومع ذلك، وعلى النقيض من البوليميكسين B والكوليستين، اللذين يستهدفان البكتيريا سالبة الجرام فقط، فإن الدابتومايسين يستهدف على وجه التحديد البكتيريا الإيجابية للجرام. عادة ما يتم إعطاؤه عن طريق الوريد ويبدو أنه جيد التحمل، مما يدل على سمية عكسية في عضلات الهيكل العظمي.
| آلية العمل | فئة الدواء | أدوية محددة | طيف النشاط | الاستخدام السريري |
|---|---|---|---|---|
| يتفاعل مع عديد السكاريد الدهني في الغشاء الخارجي للبكتيريا سالبة الجرام، مما يقتل الخلية من خلال الاضطراب النهائي للغشاء الخارجي والغشاء السيتوبلازمي | البوليميكسين | بوليميكسين ب | طيف ضيق ضد البكتيريا سالبة الجرام، بما في ذلك السلالات المقاومة للأدوية المتعددة | مستحضرات موضعية للوقاية من الالتهابات في الجروح |
| بوليميكسين (كوليستين) | طيف ضيق ضد البكتيريا سالبة الجرام، بما في ذلك السلالات المقاومة للأدوية المتعددة | الجرعات الفموية لتطهير الأمعاء لمنع العدوى في المرضى الذين يعانون من نقص المناعة أو المرضى الذين يخضعون لجراحة/إجراءات جراحية. | ||
| الجرعات الوريدية لعلاج الالتهابات الجهازية الخطيرة التي تسببها مسببات الأمراض المقاومة للأدوية المتعددة | ||||
| يدخل في الغشاء السيتوبلازمي للبكتيريا الإيجابية للجرام، مما يؤدي إلى تعطيل الغشاء وقتل الخلية | ليبوببتيد | دابتومايسين | طيف ضيق ضد البكتيريا الإيجابية للجرام، بما في ذلك السلالات المقاومة للأدوية المتعددة | التهابات الجلد والبنية الجلدية المعقدة وتجرثم الدم الناجم عن مسببات الأمراض الإيجابية بالجرام، بما في ذلك MRSA |
التمارين\(\PageIndex{3}\)
كيف تمنع البوليميكسين وظيفة الغشاء؟
مثبطات تخليق الحمض النووي
تعمل بعض الأدوية المضادة للبكتيريا عن طريق تثبيط تخليق الحمض النووي (الجدول\(\PageIndex{5}\)). على سبيل المثال، ميترونيدازول هو عضو شبه اصطناعي من عائلة نيترويميدازول وهو أيضًا مضاد للبروتوزوان. يتداخل مع تكرار الحمض النووي في الخلايا المستهدفة. عقار ريفامبين هو عضو شبه اصطناعي من عائلة ريفاميسين ويعمل عن طريق منع نشاط بوليميراز الحمض النووي الريبي في البكتيريا. تختلف إنزيمات بوليميراز الحمض النووي الريبي في البكتيريا من الناحية الهيكلية عن تلك الموجودة في حقيقيات النوى، مما يوفر سمية انتقائية ضد الخلايا البكتيرية. يتم استخدامه لعلاج مجموعة متنوعة من الالتهابات، ولكن استخدامه الأساسي، غالبًا في كوكتيل مع أدوية أخرى مضادة للبكتيريا، هو ضد المتفطرات التي تسبب مرض السل. على الرغم من انتقائية آليته، يمكن أن يحفز الريفامبين إنزيمات الكبد على زيادة التمثيل الغذائي للأدوية الأخرى التي يتم تناولها (العداء)، مما يؤدي إلى السمية الكبدية (سمية الكبد) والتأثير السلبي على التوافر البيولوجي والتأثير العلاجي للأدوية المصاحبة.
أحد أفراد عائلة الكينولون، وهي مجموعة من مضادات الميكروبات الاصطناعية، هو حمض الناليديكسيك. تم اكتشافه في عام 1962 كمنتج ثانوي أثناء تخليق الكلوروكين، وهو دواء مضاد للملاريا. يمنع حمض الناليديكسيك بشكل انتقائي نشاط جيراز الحمض النووي البكتيري، مما يمنع تكرار الحمض النووي. أدت التعديلات الكيميائية على العمود الفقري الأصلي للكينولون إلى إنتاج الفلوروكينولونات، مثل السيبروفلوكساسين والليفوفلوكساسين، والتي تمنع أيضًا نشاط جيراز الحمض النووي. يعتبر السيبروفلوكساسين والليفوفلوكساسين فعالين ضد طيف واسع من البكتيريا الإيجابية أو السلبية للجرام، وهما من بين المضادات الحيوية الأكثر شيوعًا المستخدمة لعلاج مجموعة واسعة من الالتهابات، بما في ذلك التهابات المسالك البولية والتهابات الجهاز التنفسي والتهابات البطن والتهابات الجلد. ومع ذلك، على الرغم من سميتها الانتقائية ضد جيراز الحمض النووي، فإن الآثار الجانبية المرتبطة بالفلوروكينولونات المختلفة تشمل السمية الضوئية، والسمية العصبية، والسمية القلبية، واختلال التمثيل الغذائي للجلوكوز، وزيادة خطر تمزق الأوتار.
| آليات العمل | فئة الدواء | أدوية محددة | طيف النشاط | الاستخدام السريري |
|---|---|---|---|---|
| يمنع نشاط بوليميراز الحمض النووي الريبي البكتيري ويمنع النسخ، مما يقتل الخلية | ريفامايسين | ريفامبين | طيف ضيق مع نشاط ضد أعداد إيجابية الجرام وأعداد محدودة من البكتيريا سالبة الجرام. كما أنها نشطة ضد المتفطرة السلية. | العلاج المركب لعلاج مرض السل |
| يمنع نشاط جيراز الحمض النووي ويمنع تكرار الحمض النووي، مما يقتل الخلية | الفلوروكينولونات | سيبروفلوكساسين، أوفلوكساسين، موكسيفلوكساسين | طيف واسع ضد البكتيريا الموجبة للجرام والبكتيريا سالبة الجرام | مجموعة متنوعة من الالتهابات الجلدية والجهازية |
التمارين\(\PageIndex{4}\)
لماذا لا تستهدف مثبطات تخليق الحمض النووي البكتيري الخلايا المضيفة؟
مثبطات مسارات التمثيل الغذائي
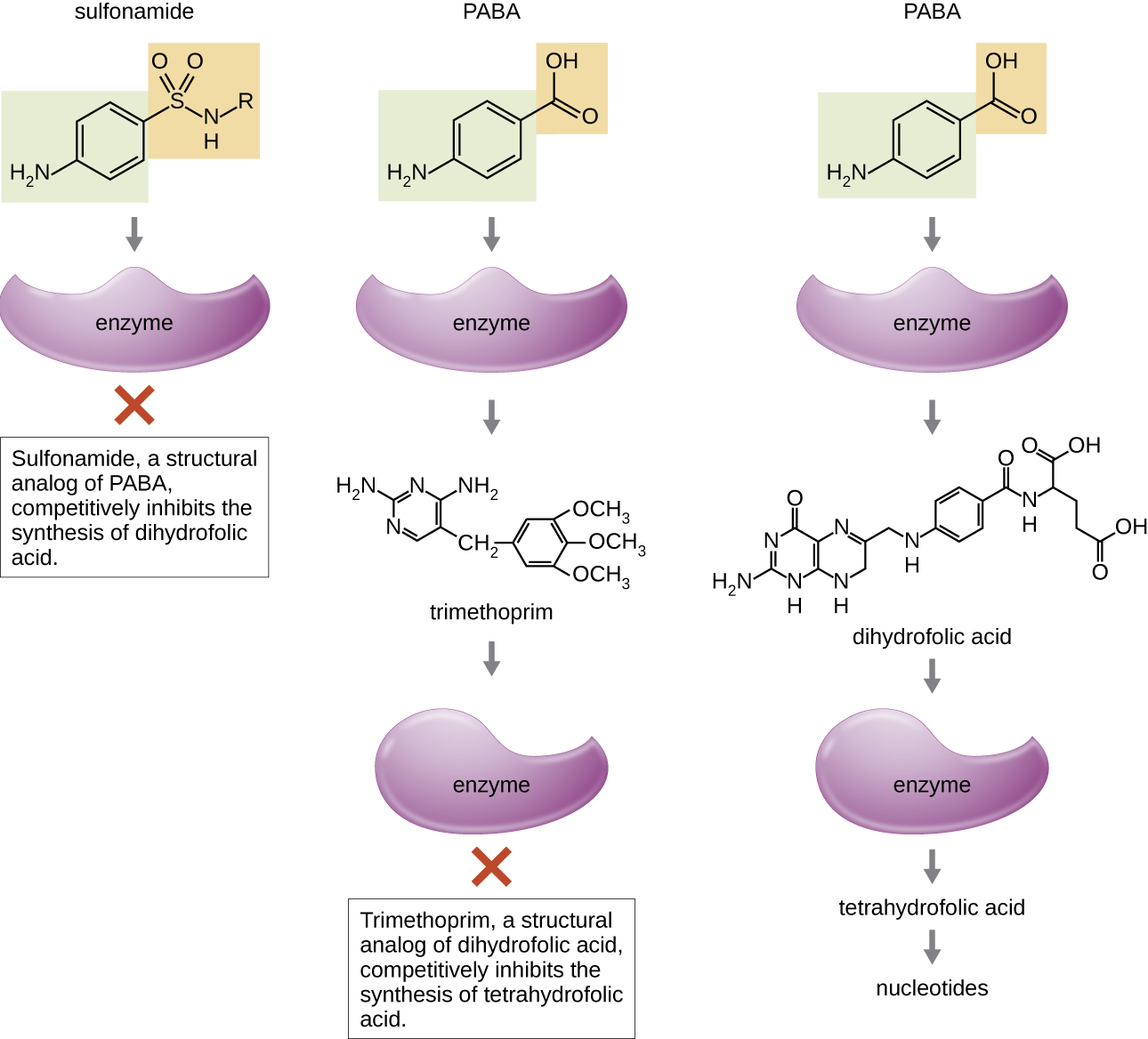
تتحكم بعض الأدوية الاصطناعية في الالتهابات البكتيرية من خلال العمل كمضادات الأيض ومثبطات تنافسية للإنزيمات الأيضية البكتيرية (الجدول\(\PageIndex{6}\)). تعتبر السلفوناميدات (أدوية السلفا) أقدم العوامل الاصطناعية المضادة للبكتيريا وهي نظائر هيكلية لحمض بارا أمينوبنزويك (PABA)، وهو وسيط مبكر في تخليق حمض الفوليك (الشكل\(\PageIndex{4}\)). من خلال تثبيط الإنزيم المشارك في إنتاج حمض الديهيدروفوليك، تمنع السلفوناميدات التخليق الحيوي البكتيري لحمض الفوليك، وبالتالي البيريميدين والبيورينات اللازمة لتخليق الحمض النووي. توفر آلية العمل هذه تثبيطًا للجراثيم للنمو ضد مجموعة واسعة من مسببات الأمراض الإيجابية والجرام. نظرًا لأن البشر يحصلون على حمض الفوليك من الطعام بدلاً من تصنيعه داخل الخلايا، فإن السلفوناميدات تكون سامة بشكل انتقائي للبكتيريا. ومع ذلك، فإن ردود الفعل التحسسية لأدوية السلفا شائعة. تتشابه السلفونات من الناحية الهيكلية مع السلفوناميدات ولكنها ليست شائعة الاستخدام اليوم باستثناء علاج مرض هانسن (الجذام).
تريميثوبريم هو مركب صناعي مضاد للميكروبات يعمل كمضاد للأيض في نفس مسار تخليق حمض الفوليك مثل السلفوناميدات. ومع ذلك، فإن تريميثوبريم هو نظير هيكلي لحمض ثنائي هيدروفوليك ويمنع خطوة لاحقة في مسار التمثيل الغذائي (الشكل\(\PageIndex{4}\)). يستخدم تريميثوبريم مع عقار السلفا سلفاميثوكسازول لعلاج التهابات المسالك البولية والتهابات الأذن والتهاب الشعب الهوائية. كما تمت مناقشته، فإن الجمع بين تريميثوبريم وسلفاميثوكسازول هو مثال على التآزر المضاد للبكتيريا. عند استخدامه بمفرده، فإن كل مضاد للأيض يقلل فقط من إنتاج حمض الفوليك إلى مستوى يحدث فيه تثبيط جرثومي للنمو. ومع ذلك، عند استخدامه معًا، يؤدي تثبيط كلتا الخطوتين في مسار التمثيل الغذائي إلى تقليل تخليق حمض الفوليك إلى مستوى قاتل للخلية البكتيرية. نظرًا لأهمية حمض الفوليك أثناء نمو الجنين، يجب التفكير بعناية في أدوية السلفا واستخدام تريميثوبريم أثناء الحمل المبكر.
عقار أيزونيازيد هو مضاد للأيض له سمية محددة للبكتيريا الفطرية وقد استخدم منذ فترة طويلة مع ريفامبين أو ستربتومايسين في علاج مرض السل. يتم إعطاؤه كعقار أولي يتطلب التنشيط من خلال عمل إنزيم البيروكسيديز البكتيري داخل الخلايا، وتشكيل إيزونيازيد - نيكوتيناميد أدينين ثنائي النوكليوتيد (NAD) وإيزونيازيد-نيكوتيناميد أدينين ثنائي النوكليوتيد الفوسفات (NADP)، مما يمنع في النهاية تخليق حمض الميكوليك، وهو ضروري لجدران الخلايا الفطرية. تشمل الآثار الجانبية المحتملة لاستخدام أيزونيازيد السمية الكبدية والسمية العصبية والسمية الدموية (فقر الدم).
| هدف مسار التمثيل الغذائي | آلية العمل | فئة الدواء | أدوية محددة | طيف النشاط |
|---|---|---|---|---|
| تخليق حمض الفوليك | يمنع الإنزيم المشارك في إنتاج حمض ثنائي هيدروفوليك | السلفوناميدات | سولفاميثوكسازول | طيف واسع ضد البكتيريا الموجبة للجرام والبكتيريا سالبة الجرام |
| السلفونات | دابسون | |||
| يمنع الإنزيم المشارك في إنتاج حمض تتراهيدروفوليك | لا ينطبق | تريميثوبريم | طيف واسع ضد البكتيريا الموجبة للجرام والبكتيريا سالبة الجرام | |
| تخليق حمض الميكوليك | يتداخل مع تخليق حمض الميكوليك | لا ينطبق | أيزونيازيد | طيف ضيق ضد المتفطرة spp.، بما في ذلك مرض السل |
التمارين\(\PageIndex{5}\)
كيف تستهدف السلفوناميدات والتريميثوبريم البكتيريا بشكل انتقائي؟
مثبط سينثاس ATP
يستخدم البيداكيلين، الذي يمثل فئة المركبات الاصطناعية المضادة للبكتيريا والتي تسمى الدياريلكينولونات، طريقة عمل جديدة تمنع نمو البكتيريا الفطرية على وجه التحديد. على الرغم من أن الآلية المحددة لم يتم توضيحها بعد، يبدو أن هذا المركب يتداخل مع وظيفة تخليق ATP، ربما عن طريق التدخل في استخدام التدرج الأيوني للهيدروجين لتخليق ATP عن طريق الفسفرة التأكسدية، مما يؤدي إلى انخفاض إنتاج ATP. نظرًا لآثاره الجانبية، بما في ذلك السمية الكبدية وعدم انتظام ضربات القلب المحتمل، فإن استخدامه يقتصر على حالات السل الخطيرة وغير القابلة للعلاج.
التركيز السريري: الجزء 2
عند قراءة التاريخ الصحي لماريسا بشكل شامل، لاحظ الطبيب أنه أثناء دخولها المستشفى في فيتنام، خضعت للقسطرة وتلقت الأدوية المضادة للميكروبات سيفتازيديم وميترونيدازول. عند معرفة ذلك، أمر الطبيب بإجراء فحص بالأشعة المقطعية لبطن ماريسا لاستبعاد التهاب الزائدة الدودية؛ كما طلب الطبيب فحص الدم لمعرفة ما إذا كان لديها ارتفاع في عدد خلايا الدم البيضاء، وأمر بإجراء اختبار تحليل البول وزراعة البول للبحث عن وجود خلايا الدم البيضاء وخلايا الدم الحمراء والبكتيريا .
جاءت عينة بول ماريسا إيجابية لوجود البكتيريا، مما يشير إلى عدوى المسالك البولية (UTI). وصف الطبيب سيبروفلوكساسين. في هذه الأثناء، تم زرع بولها لزراعة البكتيريا لمزيد من الاختبارات.
التمارين\(\PageIndex{6}\)
- ما أنواع مضادات الميكروبات التي توصف عادةً لعلاج عدوى المسالك البولية؟
- استنادًا إلى الأدوية المضادة للميكروبات التي تم إعطاؤها لها في فيتنام، أي من مضادات الميكروبات لعلاج التهاب المسالك البولية تتوقع أن تكون غير فعالة؟
المفاهيم الأساسية والملخص
- تُظهر المركبات المضادة للبكتيريا سمية انتقائية، ويرجع ذلك إلى حد كبير إلى الاختلافات بين بنية الخلايا بدائية النواة وبنية الخلايا حقيقية النواة.
- تتداخل مثبطات تخليق جدار الخلية، بما في ذلك بيتا لاكتام، والجليكوبيبتيدات، والباسيتراسين، في تخليق الببتيدوجليكان، مما يجعل الخلايا البكتيرية أكثر عرضة للتحلل الاسموزي.
- هناك مجموعة متنوعة من مثبطات تخليق البروتين البكتيري واسعة الطيف التي تستهدف بشكل انتقائي ريبوسوم 70S بدائية النواة، بما في ذلك تلك التي ترتبط بالوحدة الفرعية 30S (الأمينوغليكوزيدات والتتراسيكلين) وغيرها التي ترتبط بالوحدة الفرعية 50S (الماكروليدات، لينكوساميدات، كلورامفينيكول، وأوكسازوليدينونات).
- البوليميكسينات عبارة عن مضادات حيوية متعددة الببتيد محبة للدهون تستهدف مكون عديد السكاريد الشحمي في البكتيريا سالبة الجرام وتعطل في النهاية سلامة الأغشية الخارجية والداخلية لهذه البكتيريا.
- تستهدف مثبطات تخليق الحمض النووي الريفاميسين والفلوروكينولونات نسخ الحمض النووي الريبي البكتيري وتكرار الحمض النووي، على التوالي.
- بعض الأدوية المضادة للبكتيريا هي مضادات الأيض، وتعمل كمثبطات تنافسية للإنزيمات الأيضية البكتيرية. السلفوناميدات والتريميثوبريم هي مضادات الأيض التي تتداخل مع تخليق حمض الفوليك البكتيري. الإيزونيازيد هو أحد مضادات الأيض التي تتداخل مع تخليق حمض الميكوليك في المتفطرات.


