14.5: اختبار فعالية مضادات الميكروبات
- Page ID
- 195399
أهداف التعلم
- شرح مفهوم مقاومة الأدوية
- وصف كيفية تطور الكائنات الحية الدقيقة أو اكتساب مقاومة الأدوية
- وصف الآليات المختلفة لمقاومة الأدوية المضادة للميكروبات
مقاومة مضادات الميكروبات ليست ظاهرة جديدة. في الطبيعة، تتطور الميكروبات باستمرار من أجل التغلب على المركبات المضادة للميكروبات التي تنتجها الكائنات الحية الدقيقة الأخرى. لقد وفر التطور البشري للأدوية المضادة للميكروبات واستخدامها السريري على نطاق واسع ببساطة ضغطًا انتقائيًا آخر يعزز المزيد من التطور. يمكن للعديد من العوامل المهمة تسريع تطور مقاومة الأدوية. ويشمل ذلك الإفراط في استخدام مضادات الميكروبات وإساءة استخدامها، والاستخدام غير المناسب لمضادات الميكروبات، والجرعات العلاجية الفرعية، وعدم امتثال المريض لدورة العلاج الموصى بها.
يمكن أن يؤدي تعرض العامل الممرض لمركب مضاد للميكروبات إلى اختيار طفرات الكروموسومات التي تمنح المقاومة، والتي يمكن أن تنتقل عموديًا إلى الأجيال الميكروبية اللاحقة وتصبح في النهاية سائدة في مجموعة ميكروبية تتعرض بشكل متكرر لمضادات الميكروبات. بدلاً من ذلك، توجد العديد من الجينات المسؤولة عن مقاومة الأدوية في البلازميدات أو في التحويلات التي يمكن نقلها بسهولة بين الميكروبات من خلال النقل الأفقي للجينات (انظر كيف تحقق بدائيات النواة اللاجنسية التنوع الجيني). تتمتع عمليات النقل أيضًا بالقدرة على نقل جينات المقاومة بين البلازميدات والكروموسومات لزيادة تعزيز انتشار المقاومة.
آليات مقاومة الأدوية
هناك العديد من الآليات الشائعة لمقاومة الأدوية، والتي تم تلخيصها في الشكل\(\PageIndex{1}\). وتشمل هذه الآليات التعديل الأنزيمي للدواء، وتعديل الهدف المضاد للميكروبات، ومنع تغلغل الدواء أو تراكمه.
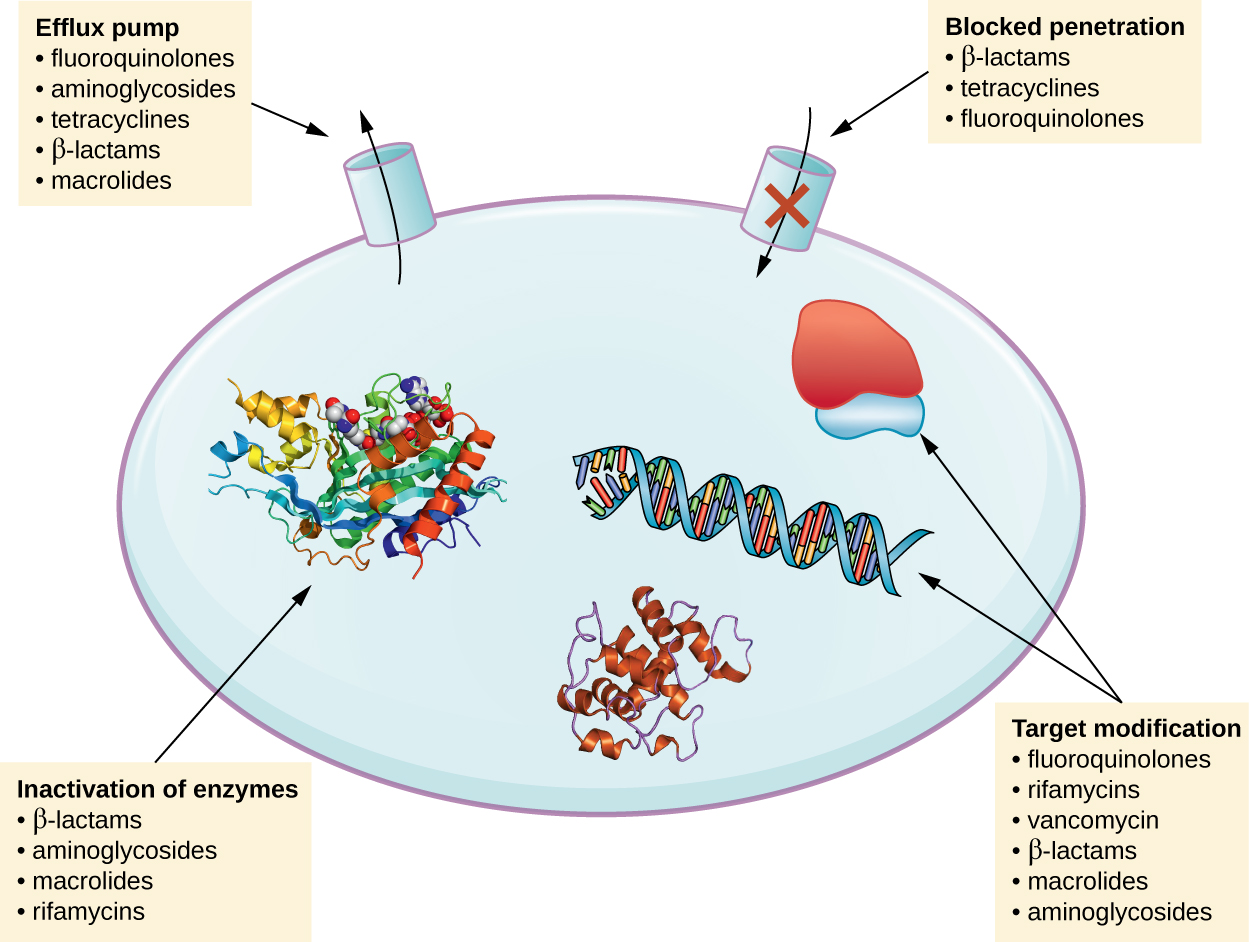
تعديل الدواء أو تعطيله
قد تقوم جينات المقاومة بترميز الإنزيمات التي تقوم بتعديل مضاد الميكروبات كيميائيًا، وبالتالي تعطيله، أو تدمير مضاد للميكروبات من خلال التحلل المائي. تحدث مقاومة العديد من أنواع مضادات الميكروبات من خلال هذه الآلية. على سبيل المثال، يمكن أن تحدث مقاومة الأمينوغليكوزيد من خلال النقل الإنزيمي للمجموعات الكيميائية إلى جزيء الدواء، مما يضعف ارتباط الدواء بهدفه البكتيري. بالنسبة إلى بيتا لاكتام، يمكن أن تشمل المقاومة البكتيرية التحلل المائي الإنزيمي لرابطة بيتا لاكتام داخل حلقة بيتا لاكتام لجزيء الدواء. بمجرد كسر رابطة بيتا لاكتام، يفقد الدواء نشاطه المضاد للبكتيريا. تتوسط آلية المقاومة هذه بيتا لاكتاماز، وهي الآلية الأكثر شيوعًا لمقاومة بيتا لاكتام. يحدث تعطيل الريفامبين بشكل شائع من خلال تحلل الجليكوسيل أو الفسفرة أو الريبوسيل ثنائي فوسفات الأدينوزين (ADP)، ويمكن أن تحدث مقاومة الماكروليدات واللينكوساميدات أيضًا بسبب التعطيل الإنزيمي للدواء أو تعديله.
منع الامتصاص الخلوي أو التدفق
قد تقوم الميكروبات بتطوير آليات مقاومة تتضمن تثبيط تراكم دواء مضاد للميكروبات، مما يمنع الدواء من الوصول إلى هدفه الخلوي. هذه الاستراتيجية شائعة بين مسببات الأمراض سالبة الجرام ويمكن أن تنطوي على تغييرات في تكوين الدهون في الغشاء الخارجي، وانتقائية قناة البورين، و/أو تركيزات قناة البورين. على سبيل المثال، تتمثل الآلية الشائعة لمقاومة الكاربابينيم بين Pseudomonas aeruginosa في تقليل كمية بورين OPRD، وهو البوابة الرئيسية لدخول الكاربابينيمات من خلال الغشاء الخارجي لهذا العامل الممرض. بالإضافة إلى ذلك، تنتج العديد من البكتيريا المسببة للأمراض إيجابية الجرام وسالبة الجرام مضخات التدفق التي تنقل بنشاط دواءً مضادًا للميكروبات خارج الخلية وتمنع تراكم الدواء إلى مستوى قد يكون مضادًا للبكتيريا. على سبيل المثال، عادة ما تحدث مقاومة بيتا لاكتام والتتراسيكلين والفلوروكينولونات من خلال التدفق النشط خارج الخلية، ومن الشائع جدًا أن تكون لمضخة تدفق واحدة القدرة على نقل أنواع متعددة من مضادات الميكروبات.
تعديل الهدف
نظرًا لأن الأدوية المضادة للميكروبات لها أهداف محددة جدًا، فإن التغييرات الهيكلية لتلك الأهداف يمكن أن تمنع ارتباط الدواء، مما يجعل الدواء غير فعال. من خلال الطفرات العفوية في الجينات التي ترمز إلى أهداف الأدوية المضادة للبكتيريا، تتمتع البكتيريا بميزة تطورية تسمح لها بتطوير مقاومة للأدوية. آلية تطوير المقاومة هذه شائعة جدًا. يمكن للتغيرات الجينية التي تؤثر على الموقع النشط للبروتينات الرابطة للبنسلين (PBPs) أن تمنع ارتباط أدوية بيتا لاكتام وتوفر مقاومة لأدوية متعددة ضمن هذه الفئة. هذه الآلية شائعة جدًا بين سلالات المكورات العقدية الرئوية، التي تغير PBPs الخاصة بها من خلال الآليات الوراثية. في المقابل، تقوم سلالات المكورات العنقودية الذهبية بتطوير مقاومة للميثيسيلين (MRSA) من خلال الاستحواذ على PBP جديد منخفض التقارب، بدلاً من التغيير الهيكلي لـ PBP الموجود لديها. لا يوفر هذا PBP الجديد منخفض التقارب مقاومة للميثيسيلين فحسب، بل يوفر مقاومة لجميع أدوية بيتا لاكتام تقريبًا، باستثناء الجيل الخامس الأحدث من السيفالوسبورين المصمم خصيصًا لقتل MRSA. تشمل الأمثلة الأخرى لاستراتيجية المقاومة هذه التعديلات في
- وحدات الريبوسوم الفرعية، التي توفر مقاومة للماكروليدات والتتراسيكلين والأمينوغليكوزيدات؛
- هيكل ليبوبوليساكاريد (LPS)، الذي يوفر مقاومة للبوليميكسين؛
- بوليميراز الحمض النووي الريبي، الذي يوفر مقاومة للريفامبين؛
- جيراز الحمض النووي، الذي يوفر مقاومة للفلوروكينولونات؛
- الإنزيمات الأيضية، التي توفر مقاومة لأدوية السلفا والسلفونات والتريميثوبريم؛
- يعمل الببتيدوجليكان على توحيد سلاسل الببتيد، مما يوفر مقاومة للجليكوببتيد.
الإنتاج الزائد المستهدف أو التحويل الأنزيمي
عندما يعمل دواء مضاد للميكروبات كمضاد للأيض، ويستهدف إنزيمًا معينًا لتثبيط نشاطه، فهناك طرق إضافية قد تحدث بها مقاومة الميكروبات. أولاً، قد يفرط الميكروب في إنتاج الإنزيم المستهدف بحيث تكون هناك كمية كافية من الإنزيم الخالي من مضادات الميكروبات لتنفيذ التفاعل الأنزيمي المناسب. ثانيًا، قد تقوم الخلية البكتيرية بتطوير مجرى جانبي يتحايل على الحاجة إلى الإنزيم المستهدف الوظيفي. تم العثور على كلتا الاستراتيجيتين كآليات لمقاومة السلفوناميد. وقد ثبت أن مقاومة الفانكومايسين بين بكتيريا S. aureus تنطوي على انخفاض الارتباط المتقاطع لسلاسل الببتيد في جدار الخلية البكتيرية، مما يوفر زيادة في أهداف الفانكومايسين للربط بها في جدار الخلية الخارجي. يوفر الارتباط المتزايد للفانكومايسين في جدار الخلية الخارجي انسدادًا يمنع جزيئات الدواء الحرة من الاختراق إلى حيث يمكنها منع تخليق جدار الخلية الجديد.
تقليد الهدف
تتضمن آلية المقاومة التي تم اكتشافها مؤخرًا والتي تسمى محاكاة الهدف إنتاج البروتينات التي تربط وتحبس الأدوية، مما يمنع الأدوية من الارتباط بهدفها. على سبيل المثال، تنتج المتفطرة السلية بروتينًا يحتوي على تكرار خماسي الببتيد العادي الذي يبدو أنه يحاكي بنية الحمض النووي. يعمل هذا البروتين على ربط الفلوروكينولونات وعزلها ومنعها من الارتباط بالحمض النووي، مما يوفر مقاومة مرض السل للفلوروكينولونات. لقد وجد أن البروتينات التي تحاكي الموقع A للريبوسوم البكتيري تساهم في مقاومة الأمينوغليكوزيد أيضًا. 1
التمارين الرياضية\(\PageIndex{1}\)
ضع قائمة بالعديد من الآليات لمقاومة الأدوية.
الميكروبات المقاومة للأدوية المتعددة والمقاومة المتقاطعة
من منظور إكلينيكي، تتمثل أكبر مخاوفنا في الميكروبات المقاومة للأدوية المتعددة (MDRs) والمقاومة المتصالبة. تُعرف أجهزة MDRs بالعامية باسم «الجراثيم الخارقة» وتحمل آلية (آليات) مقاومة واحدة أو أكثر، مما يجعلها مقاومة لمضادات الميكروبات المتعددة. في المقاومة المتقاطعة، تمنح آلية مقاومة واحدة مقاومة للعديد من الأدوية المضادة للميكروبات. على سبيل المثال، يعد امتلاك مضخة تدفق يمكنها تصدير العديد من الأدوية المضادة للميكروبات طريقة شائعة لمقاومة الميكروبات لأدوية متعددة باستخدام آلية مقاومة واحدة. في السنوات الأخيرة، ظهرت العديد من الجراثيم الخارقة المهمة سريريًا، وتفيد تقارير مراكز مكافحة الأمراض والوقاية منها (CDC) أن الجراثيم الخارقة مسؤولة عن أكثر من 2 مليون إصابة في الولايات المتحدة سنويًا، مما أدى إلى وفاة ما لا يقل عن 23000 شخص. 2 تم تسمية العديد من الجراثيم الفائقة التي تمت مناقشتها في الأقسام التالية بمسببات ESKAPE. يشير هذا الاختصار إلى أسماء مسببات الأمراض (المكورات المعوية، والمكورات العنقودية الذهبية، والكلبسيلة الرئوية، وأسينتوباكتر باومانيي، وبيودوموناس أيروجينوسا، وإنتيروباكتر spp.) ولكن من المناسب أيضًا أن تكون هذه الأسماء مناسبة أيضًا. مسببات الأمراض قادرة على «الهروب» من العديد من الأشكال التقليدية للعلاج المضاد للميكروبات. على هذا النحو، قد يكون من الصعب علاج العدوى بمسببات ESKAPE وتسبب عددًا كبيرًا من التهابات المستشفيات.
المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA)
تم تصميم الميثيسيلين، وهو بنسلين شبه صناعي، لمقاومة التعطيل بواسطة بيتا لاكتاماز. لسوء الحظ، بعد وقت قصير من إدخال الميثيسيلين إلى الممارسة السريرية، ظهرت سلالات مقاومة للميثيسيلين من S. aureus وبدأت في الانتشار. زودت آلية المقاومة، والاستحواذ على PBP جديد منخفض التقارب، S. aureus بمقاومة لجميع بيتا لاكتامز المتاحة. تعتبر سلالات S. aureus (MRSA) المقاومة للميثيسيلين من مسببات الأمراض الانتهازية المنتشرة على نطاق واسع وتشكل مصدر قلق خاص للجلد والتهابات الجروح الأخرى، ولكنها قد تسبب أيضًا الالتهاب الرئوي وتسمم الدم. على الرغم من أنها كانت في الأصل مشكلة في أماكن الرعاية الصحية (MRSA المكتسبة من المستشفى [HA-MRSA])، إلا أنها تُكتسب الآن أيضًا من خلال الاتصال بأفراد مصابين من عامة الناس، يُطلق عليهم اسم MRSA المرتبط بالمجتمع (CA-MRSA). ما يقرب من ثلث السكان يحملون S. aureus كعضو في الميكروبات الأنفية الطبيعية دون مرض، وحوالي 6٪ من هذه السلالات مقاومة للميثيسيلين. 3 4
حمض كلافولانيك: مساعد البنسلين الصغير
مع إدخال البنسلين في أوائل الأربعينيات، وإنتاجه بكميات كبيرة لاحقًا، بدأ المجتمع يفكر في المضادات الحيوية كعلاجات معجزة لمجموعة واسعة من الأمراض المعدية. لسوء الحظ، في وقت مبكر من عام 1945، تم توثيق مقاومة البنسلين لأول مرة وبدأت في الانتشار. أكثر من 90% من عزلات S. aureus السريرية الحالية تقاوم البنسلين. 5
على الرغم من أن تطوير عقاقير جديدة مضادة للميكروبات هو أحد الحلول لهذه المشكلة، فقد اكتشف العلماء أساليب جديدة، بما في ذلك تطوير مركبات تعمل على تعطيل آليات المقاومة. يمثل تطوير حمض الكلافولانيك مثالًا مبكرًا على هذه الاستراتيجية. حمض كلافولانيك هو جزيء تنتجه بكتيريا Streptococcus clavuligerus. يحتوي على حلقة بيتا لاكتام، مما يجعله مشابهًا من الناحية الهيكلية للبنسلين وغيره من بيتا لاكتام، ولكنه لا يُظهر أي فعالية سريرية عند تناوله بمفرده. بدلاً من ذلك، يرتبط حمض الكلافولانيك بشكل لا رجعة فيه داخل الموقع النشط لـ بيتا لاكتاماز ويمنعه من تعطيل البنسلين الذي تتم إدارته بشكل مشترك.
تم تطوير حمض Clavulanic لأول مرة في السبعينيات وتم تسويقه بكميات كبيرة مع الأموكسيسيلين بدءًا من الثمانينيات تحت اسم العلامة التجارية Augmentin. كما هو الحال عادةً، سرعان ما ظهرت مقاومة لمزيج حمض أموكسيسيلين-كلافولانيك. تنجم المقاومة في الغالب عن زيادة البكتيريا في إنتاج بيتا لاكتاماز وغزو التأثيرات المثبطة لحمض الكلافولانيك، مما يؤدي إلى تحوير بيتا لاكتاماز بحيث لا يتم تثبيطه بحمض الكلافولانيك، أو من الحصول على بيتا لاكتاماز جديد لا يثبطه حمض الكلافولانيك. على الرغم من مخاوف المقاومة المتزايدة، يمثل حمض الكلافولانيك ومثبطات بيتا لاكتاماز ذات الصلة (سولباكتام وتازوباكتام) استراتيجية جديدة مهمة: تطوير مركبات تثبط بشكل مباشر الإنزيمات التي تمنح مقاومة مضادات الميكروبات.
المكورات المعوية المقاومة للفانكومايسين والمكورات العنقودية الذهبية
الفانكومايسين فعال فقط ضد الكائنات الحية المصابة بالجرام، ويستخدم لعلاج التهابات الجروح والتهابات الصرف الصحي والتهاب الشغاف والتهاب السحايا التي تسببها مسببات الأمراض المقاومة للمضادات الحيوية الأخرى. يعتبر أحد خطوط الدفاع الأخيرة ضد هذه العدوى المقاومة، بما في ذلك MRSA. مع ارتفاع مقاومة المضادات الحيوية في السبعينيات والثمانينيات من القرن الماضي، زاد استخدام الفانكومايسين، وليس من المستغرب أن نرى ظهور وانتشار المكورات المعوية المقاومة للفانكومايسين (VRE)، والمكورات المعوية المقاومة للفانكومايسين (VRSA)، وداء S. aureus (VISA) الوسيطة للفانكومايسين (VISA). آلية مقاومة الفانكومايسين بين المكورات المعوية هي تعديل الهدف الذي يتضمن تغييرًا هيكليًا في مكون الببتيد في وحدات الببتيدوجليكان الفرعية، مما يمنع الفانكومايسين من الارتباط. عادة ما تنتشر هذه السلالات بين المرضى في البيئات السريرية عن طريق الاتصال بالعاملين في مجال الرعاية الصحية والأسطح الملوثة والمعدات الطبية.
تختلف سلالات VISA و VRSA عن بعضها البعض في آلية المقاومة ودرجة المقاومة التي تمنحها كل آلية. تُظهر سلالات VISA مقاومة متوسطة، بحد أدنى من التركيز المثبط (MIC) يبلغ 4-8 ميكروغرام/مل، وتتضمن الآلية زيادة في أهداف الفانكومايسين. تقلل سلالات VISA من تشابك سلاسل الببتيد في جدار الخلية، مما يوفر زيادة في أهداف الفانكومايسين التي تحبس الفانكومايسين في جدار الخلية الخارجي. في المقابل، تكتسب سلالات VRSA مقاومة الفانكومايسين من خلال النقل الأفقي لجينات المقاومة من VRE، وهي فرصة يتم توفيرها للأفراد المصابين بشكل مشترك بكل من VRE و MRSA. يُظهر VRSA مستوى أعلى من المقاومة، مع وجود ميكروفونات متوسطة الدخل تبلغ 16 ميكروغرام/مل أو أعلى. 6 في حالة جميع الأنواع الثلاثة من البكتيريا المقاومة للفانكومايسين، يعد التحديد السريري السريع ضروريًا حتى يمكن تنفيذ الإجراءات المناسبة للحد من الانتشار. تعتبر الأكسازوليدينونات مثل لينزوليد مفيدة في علاج مسببات الأمراض الانتهازية المقاومة للفانكومايسين، وكذلك MRSA.
بيتا لاكتاماز ذات الطيف الممتد - مسببات الأمراض التي تنتج جرامًا سالبة الجرام
تُظهر مسببات الأمراض سالبة الجرام التي تنتج بيتا لاكتاماز طيفًا ممتدًا (eSBLs) مقاومة تتجاوز البنسلين فقط. يوفر طيف بيتا لاكتامز المعطل بواسطة eSBLs مقاومة لجميع البنسلين والسيفالوسبورين والمونوباكتام ومجموعات مثبطات بيتا لاكتاماز، ولكن ليس الكاربابينيمات. مصدر قلق أكبر هو أن الجينات المشفرة لـ eSBL توجد عادة في البلازميدات المتنقلة التي تحتوي أيضًا على جينات لمقاومة فئات الأدوية الأخرى (مثل الفلوروكينولونات والأمينوغليكوزيدات والتتراسيكلين)، ويمكن أن تنتشر بسهولة إلى البكتيريا الأخرى عن طريق النقل الأفقي للجينات. هذه البكتيريا المقاومة للأدوية المتعددة هي أعضاء في الميكروبات المعوية لبعض الأفراد، ولكنها أيضًا أسباب مهمة للعدوى الانتهازية في المرضى الذين يدخلون المستشفى، والذين يمكن أن تنتقل منهم إلى أشخاص آخرين.
بكتيريا سالبة الجرام المقاومة للكاربابينيم
يعد حدوث البكتيريا المعوية المقاومة للكاربابينيم (CRE) ومقاومة الكاربابينيم بين البكتيريا الأخرى سالبة الجرام (مثل P. aeruginosa و Acinetobacter baumannii و Stenotrophomonas maltophila) مصدر قلق متزايد في مجال الرعاية الصحية. تطور مسببات الأمراض هذه مقاومة للكاربابينيمات من خلال مجموعة متنوعة من الآليات، بما في ذلك إنتاج الكاربابينيماز (بيتا لاكتاماز واسع الطيف الذي يعطل جميع بيتا لاكتام، بما في ذلك الكاربابينيمات)، والتدفقات النشطة للكاربابينيمات خارج الخلية، و/أو منع دخول الكاربابينيم عبر قنوات البورين. على غرار المخاوف المتعلقة بـ ESBLs، عادة ما تكون مسببات الأمراض المقاومة للكاربابينيم وسالبة الجرام مقاومة لفئات متعددة من مضادات البكتيريا، بل إن بعضها طور مقاومة شاملة (مقاومة لجميع مضادات البكتيريا المتاحة). عادة ما تحدث العدوى بمسببات الأمراض المقاومة للكاربابينيم وسلبية الجرام في أماكن الرعاية الصحية من خلال التفاعل مع الأفراد الملوثين أو الأجهزة الطبية، أو نتيجة للجراحة.
المتفطرة السلية المقاومة للأدوية المتعددة
إن ظهور المتفطرة السلية المقاومة للأدوية المتعددة (MDR-TB) والبكتيريا المتفطرة السلية المقاومة للأدوية (XDR-TB) هو أيضًا مصدر قلق عالمي كبير. وتقاوم سلالات السل المقاوم للأدوية المتعددة كلاً من الريفامبين والإيزونيازيد، وهي التركيبة الدوائية التي توصف عادة لعلاج السل. بالإضافة إلى ذلك، تقاوم سلالات XDR-TB أي دواء من الفلوروكينولون وواحد على الأقل من ثلاثة أدوية أخرى (أميكاسين أو كانامايسين أو كابريوميسين) تستخدم كخط علاج ثانٍ، مما يترك لهؤلاء المرضى خيارات علاجية قليلة جدًا. كلا النوعين من مسببات الأمراض يمثلان مشكلة خاصة لدى الأشخاص الذين يعانون من نقص المناعة، بمن فيهم أولئك الذين يعانون من عدوى فيروس نقص المناعة البشرية غالبًا ما ينتج تطور المقاومة في هذه السلالات عن الاستخدام غير الصحيح لمضادات الميكروبات لعلاج السل واختيار المقاومة.
التمارين الرياضية\(\PageIndex{2}\)
كيف تؤدي مقاومة الأدوية إلى البكتيريا الخارقة؟
لمعرفة المزيد عن أهم 18 تهديدًا مقاومًا للأدوية في الولايات المتحدة، تفضل بزيارة موقع CDC على الويب.
زراعة المصانع ومقاومة الأدوية
على الرغم من أن تربية الحيوانات كانت لفترة طويلة جزءًا رئيسيًا من الزراعة في أمريكا، إلا أن ظهور عمليات تغذية الحيوانات المركزة (CAFoS) منذ الخمسينيات من القرن الماضي قد أدى إلى بعض القضايا البيئية الجديدة، بما في ذلك تلوث المياه والهواء بالنفايات البيولوجية، والقضايا الأخلاقية المتعلقة بحقوق الحيوان ترتبط أيضًا بنمو الحيوانات بهذه الطريقة. بالإضافة إلى ذلك، تتضمن الزيادة في CAFOs الاستخدام المكثف للأدوية المضادة للميكروبات في تربية الماشية. تُستخدم مضادات الميكروبات لمنع تطور الأمراض المعدية في الأحياء القريبة من CAFOs؛ ومع ذلك، فإن غالبية مضادات الميكروبات المستخدمة في الزراعة في المصانع هي لتعزيز النمو - وبعبارة أخرى، لزراعة حيوانات أكبر.
لا تزال الآلية الكامنة وراء هذا النمو المعزز غير واضحة. قد لا تكون هذه المضادات الحيوية بالضرورة هي نفسها تلك المستخدمة سريريًا للبشر، ولكنها مرتبطة هيكليًا بالأدوية المستخدمة للبشر. ونتيجة لذلك، يمكن أن يختار استخدام الأدوية المضادة للميكروبات في الحيوانات مقاومة مضادات الميكروبات، حيث تصبح هذه البكتيريا المقاومة مقاومة للتقاطع مع الأدوية المستخدمة عادة في البشر. على سبيل المثال، يبدو أن استخدام التيلوزين في الحيوانات يختار البكتيريا المقاومة أيضًا للماكروليدات الأخرى، بما في ذلك الإريثروميسين، الذي يشيع استخدامه في البشر.
تزداد تركيزات السلالات البكتيرية المقاومة للأدوية الناتجة عن CAFOs في المياه والتربة المحيطة بهذه المزارع. إذا لم تكن هذه البكتيريا المقاومة مسببة للأمراض بشكل مباشر في البشر، فقد تعمل كمستودع للعناصر الوراثية المتنقلة التي يمكنها بعد ذلك تمرير جينات المقاومة إلى مسببات الأمراض البشرية. لحسن الحظ، عادةً ما تؤدي عملية الطهي إلى تعطيل أي مضادات للميكروبات متبقية في اللحوم، لذلك لا يتناول البشر عادةً هذه الأدوية بشكل مباشر. ومع ذلك، يدعو الكثير من الناس إلى الاستخدام الأكثر حكمة لهذه الأدوية، وربما فرض رسوم استخدام المزارعين للحد من الاستخدام العشوائي. في الواقع، في عام 2012، نشرت إدارة الغذاء والدواء الأمريكية إرشادات للمزارعين الذين يتخلصون طوعًا من استخدام الأدوية المضادة للميكروبات إلا تحت إشراف بيطري وعند الضرورة لضمان صحة الحيوان. على الرغم من أن اتباع الإرشادات يعد أمرًا طوعيًا في هذا الوقت، إلا أن إدارة الغذاء والدواء الأمريكية توصي بما تسميه الاستخدام «الحكيم» للأدوية المضادة للميكروبات في الحيوانات المنتجة للأغذية في محاولة لتقليل مقاومة مضادات الميكروبات.
التركيز السريري: الجزء 3
لسوء الحظ، لم يتم علاج عدوى المسالك البولية لماريسا بعلاج سيبروفلوكساسين. أظهرت الاختبارات المعملية أن إصابتها بالعدوى كانت بسبب سلالة من الكلبسيلة الرئوية ذات المقاومة الكبيرة لمضادات الميكروبات. تضمن ملف مقاومة هذا الكليمونيا الرئوية مقاومة فئة الكاربابينيم من مضادات الجراثيم، وهي مجموعة من بيتا لاكتام مخصصة عادةً لعلاج البكتيريا شديدة المقاومة. K. pneumoniae هو قضيب انتهازي مغلف سالب الجرام قد يكون عضوًا في الميكروبات الطبيعية في الأمعاء، ولكنه قد يسبب أيضًا عددًا من الأمراض، بما في ذلك الالتهاب الرئوي والتهابات المسالك البولية.
تم إجراء اختبارات معملية محددة للبحث عن إنتاج الكاربابينيماز على عينات ماريسا وجاءت إيجابية. وبناءً على هذه النتيجة، وبالاقتران مع تاريخها الصحي، تم الاشتباه في إنتاج كاربابينيماز المعروف باسم نيودلهي ميتالو--لاكتاماز (NDM). على الرغم من أن أصل NDM carbapenemase غير معروف تمامًا، إلا أن العديد من المرضى المصابين بالسلالات المحتوية على NDM لديهم تاريخ سفر يشمل دخول المستشفى في الهند أو البلدان المجاورة.
التمارين الرياضية\(\PageIndex{1}\)
كيف سيحدد الأطباء أنواع الأدوية المضادة للميكروبات التي يجب إعطاؤها؟
المفاهيم الأساسية والملخص
- مقاومة مضادات الميكروبات آخذة في الارتفاع وهي نتيجة اختيار السلالات المقاومة للأدوية في البيئات السريرية، والإفراط في استخدام مضادات الجراثيم وإساءة استخدامها، واستخدام جرعات العلاج الفرعي من الأدوية المضادة للبكتيريا، وضعف امتثال المرضى للعلاجات الدوائية المضادة للبكتيريا.
- غالبًا ما يتم نقل جينات مقاومة الأدوية على البلازميدات أو في عمليات النقل التي يمكن أن تخضع للنقل الرأسي بسهولة وبين الميكروبات من خلال النقل الأفقي للجينات.
- تشمل الأنماط الشائعة لمقاومة الأدوية المضادة للميكروبات تعديل الدواء أو تعطيله، ومنع امتصاص الخلايا أو التدفق، وتعديل الهدف، وزيادة الإنتاج المستهدف أو تجاوز الإنزيمات، وتقليد الهدف.
- تظهر سلالات ميكروبية إشكالية تظهر مقاومة واسعة النطاق لمضادات الميكروبات؛ يمكن أن تتواجد العديد من هذه السلالات كأعضاء في الميكروبات الطبيعية لدى الأفراد ولكن يمكن أن تسبب أيضًا عدوى انتهازية. غالبًا ما يحدث انتقال العديد من هذه السلالات الميكروبية عالية المقاومة في البيئات السريرية، ولكن يمكن أيضًا أن يكون مكسبًا من المجتمع.
الحواشي
- 1 دي إتش فونغ، إيه إم بيرغويس. «اختلاط الركيزة لإنزيم مقاومة المضادات الحيوية للأمينوغليكوزيد عبر التقليد المستهدف.» مجلة EMBO 21 رقم 10 (2002): 2323-2331.
- 2 مراكز السيطرة على الأمراض والوقاية منها. «مقاومة المضادات الحيوية/مضادات الميكروبات». http://www.cdc.gov/drugresistance/index.html. تم الوصول إليه في 2 يونيو 2016.
- 3 أ. س. كالوخي وآخرون. «الحساسية لأدوية السل المقاومة للأدوية المتعددة واختبار التشخيص الجزيئي: مراجعة الأدبيات. المجلة الأمريكية للعلوم الطبية 345 رقم 2 (2013): 143—148.
- 4 مراكز للسيطرة على الأمراض والوقاية منها. «المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA): معلومات عامة حول MRSA في المجتمع.» http://www.cdc.gov/mrsa/community/index.html. تم الوصول إليه في 2 يونيو 2016
- 5 إف دي لوي. «مقاومة مضادات الميكروبات: مثال المكورات العنقودية الذهبية». مجلة التحقيقات السريرية 111 رقم 9 (2003): 1265—1273.
- 6 مراكز للسيطرة على الأمراض والوقاية منها. «العدوى المرتبطة بالرعاية الصحية (HIA): معلومات عامة حول VISA/VRSA.» www.cdc.gov/hai/organisms/vis... visa_vrsa.html. تم الوصول إليه في 2 يونيو 2016.


