11.5: الطفرات
- Page ID
- 194657
أهداف التعلم
- قارن الطفرات النقطية وطفرات تغيير الإطار
- وصف الاختلافات بين سوء الفهم والهراء والطفرات الصامتة
- وصف الاختلافات بين الإصلاح بالضوء والظلام
- اشرح كيف تعمل الطفرات المختلفة
- اشرح لماذا يمكن استخدام اختبار Ames للكشف عن المواد المسببة للسرطان
- تحليل تسلسلات الحمض النووي وتحديد أمثلة لأنواع الطفرات
الطفرة هي تغيير وراثي في تسلسل الحمض النووي للكائن الحي. قد يكون للكائن الحي الناتج، والذي يُطلق عليه اسم الطافر، تغييرًا واضحًا في النمط الظاهري مقارنة بالنوع البري، وهو النمط الظاهري الأكثر شيوعًا في الطبيعة. يتم منح التغيير في تسلسل الحمض النووي إلى mRNA من خلال النسخ، وقد يؤدي إلى تغيير تسلسل الأحماض الأمينية في البروتين عند الترجمة. نظرًا لأن البروتينات تؤدي الغالبية العظمى من الوظائف الخلوية، فإن التغيير في تسلسل الأحماض الأمينية في البروتين قد يؤدي إلى تغيير النمط الظاهري للخلية والكائن الحي.
آثار الطفرات على تسلسل الحمض النووي
هناك عدة أنواع من الطفرات التي يتم تصنيفها وفقًا لكيفية تغيير جزيء الحمض النووي. يؤثر أحد الأنواع، الذي يُطلق عليه اسم الطفرة النقطية، على قاعدة واحدة ويحدث غالبًا عندما يتم استبدال قاعدة واحدة أو استبدالها بقاعدة أخرى. تنتج الطفرات أيضًا عن إضافة قاعدة واحدة أو أكثر، تُعرف باسم الإدراج، أو إزالة قاعدة واحدة أو أكثر، تُعرف باسم الحذف.
التمارين\(\PageIndex{1}\)
ما نوع الطفرة التي تحدث عندما يكون للجين عدد أقل من النيوكليوتيدات في تسلسله؟
آثار الطفرات على بنية البروتين ووظيفته
قد يكون للطفرات النقطية مجموعة واسعة من التأثيرات على وظيفة البروتين (الشكل\(\PageIndex{1}\)). نتيجة لانحطاط الشفرة الوراثية، ستؤدي الطفرة النقطية عادةً إلى دمج نفس الحمض الأميني في البولي ببتيد الناتج على الرغم من تغيير التسلسل. لن يكون لهذا التغيير أي تأثير على بنية البروتين، وبالتالي يُطلق عليه اسم الطفرة الصامتة. تؤدي الطفرة الخاطئة إلى دمج حمض أميني مختلف في البولي ببتيد الناتج. يعتمد تأثير الطفرة غير المنطقية على مدى اختلاف الحمض الأميني الجديد كيميائيًا عن الحمض الأميني من النوع البري. من المهم أيضًا تحديد موقع الحمض الأميني المتغير داخل البروتين. على سبيل المثال، إذا كان الحمض الأميني المتغير جزءًا من الموقع النشط للإنزيم، فقد يكون تأثير الطفرة غير المنطقية كبيرًا. تؤدي العديد من الطفرات غير المنطقية إلى بروتينات لا تزال تعمل، على الأقل إلى حد ما. في بعض الأحيان قد تكون آثار الطفرات غير المنطقية واضحة فقط في ظل ظروف بيئية معينة؛ تسمى هذه الطفرات الخاطئة الطفرات الشرطية. وفي حالات نادرة، قد تكون الطفرة غير المنطقية مفيدة. في ظل الظروف البيئية المناسبة، قد يمنح هذا النوع من الطفرات الكائن الحي الذي يؤويه ميزة انتقائية. هناك نوع آخر من الطفرات النقطية، يسمى الطفرة غير المنطقية، يحول الكودون الذي يقوم بترميز الحمض الأميني (كودون الإحساس) إلى كودون توقف (كودون هراء). تؤدي الطفرات غير المنطقية إلى تخليق بروتينات أقصر من النوع البري ولا تعمل عادةً.
تتسبب عمليات الحذف والإدراج أيضًا في تأثيرات مختلفة. نظرًا لأن الكودونات عبارة عن ثلاثة توائم من النيوكليوتيدات، فإن عمليات الإدخال أو الحذف في مجموعات من ثلاثة نيوكليوتيدات قد تؤدي إلى إدخال أو حذف واحد أو أكثر من الأحماض الأمينية وقد لا تسبب آثارًا كبيرة على وظائف البروتين الناتج. ومع ذلك، فإن طفرات تغيير الإطار، الناتجة عن إدخال أو حذف عدد من النيوكليوتيدات التي ليست من مضاعفات ثلاثة، تمثل مشكلة كبيرة نظرًا لحدوث تحول في إطار القراءة (الشكل\(\PageIndex{1}\)). نظرًا لأن الريبوسومات تقرأ الحمض النووي الريبوزي (mRNA) في الكودونات الثلاثية، يمكن أن تغير طفرات الإطار كل حمض أميني بعد نقطة الطفرة. قد يتضمن إطار القراءة الجديد أيضًا رمز توقف قبل نهاية تسلسل الترميز. وبالتالي، فإن البروتينات المصنوعة من الجينات التي تحتوي على طفرات متغيرة الإطار تكون دائمًا غير فعالة.
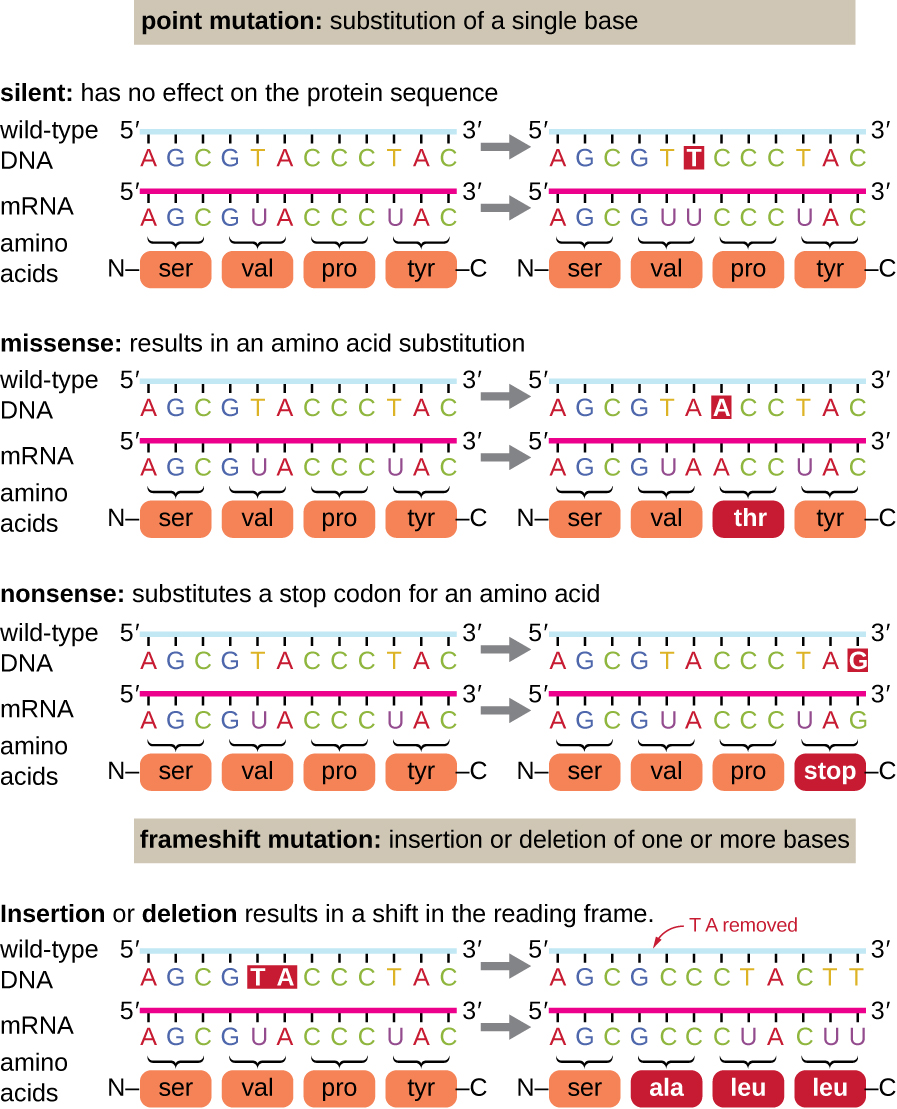
التمارين\(\PageIndex{2}\)
- ما هي الأسباب التي تجعل تغيير النوكليوتيدات في جين البروتين قد لا يكون له أي تأثير على النمط الظاهري لهذا الجين؟
- هل من الممكن إدخال ثلاثة نيوكليوتيدات معًا بعد النوكليوتيد الخامس في جين ترميز البروتين لإنتاج بروتين أقصر من المعتاد؟ كيف أو كيف لا؟
طفرة مفيدة
منذ الإبلاغ عن أول حالة إصابة بفيروس نقص المناعة البشرية (HIV) في عام 1981، توفي ما يقرب من 40 مليون شخص بسبب عدوى فيروس نقص المناعة البشرية (1)، الفيروس الذي يسبب متلازمة نقص المناعة المكتسب (الإيدز). يستهدف الفيروس الخلايا التائية المساعدة التي تلعب دورًا رئيسيًا في سد الاستجابة المناعية الفطرية والتكيفية، وإصابة وقتل الخلايا المشاركة عادةً في استجابة الجسم للعدوى. لا يوجد علاج لعدوى فيروس نقص المناعة البشرية، ولكن تم تطوير العديد من الأدوية لإبطاء أو منع تطور الفيروس. على الرغم من أن الأفراد في جميع أنحاء العالم قد يكونون مصابين، فإن أعلى معدل انتشار بين الأشخاص الذين تتراوح أعمارهم بين 15 و 49 عامًا هو في أفريقيا جنوب الصحراء الكبرى، حيث يصاب شخص واحد تقريبًا من كل 20 شخصًا، وهو ما يمثل أكثر من 70٪ من الإصابات في جميع أنحاء العالم 2 (الشكل\(\PageIndex{2}\)). لسوء الحظ، يعد هذا أيضًا جزءًا من العالم حيث تفتقر إلى استراتيجيات الوقاية والأدوية لعلاج العدوى.
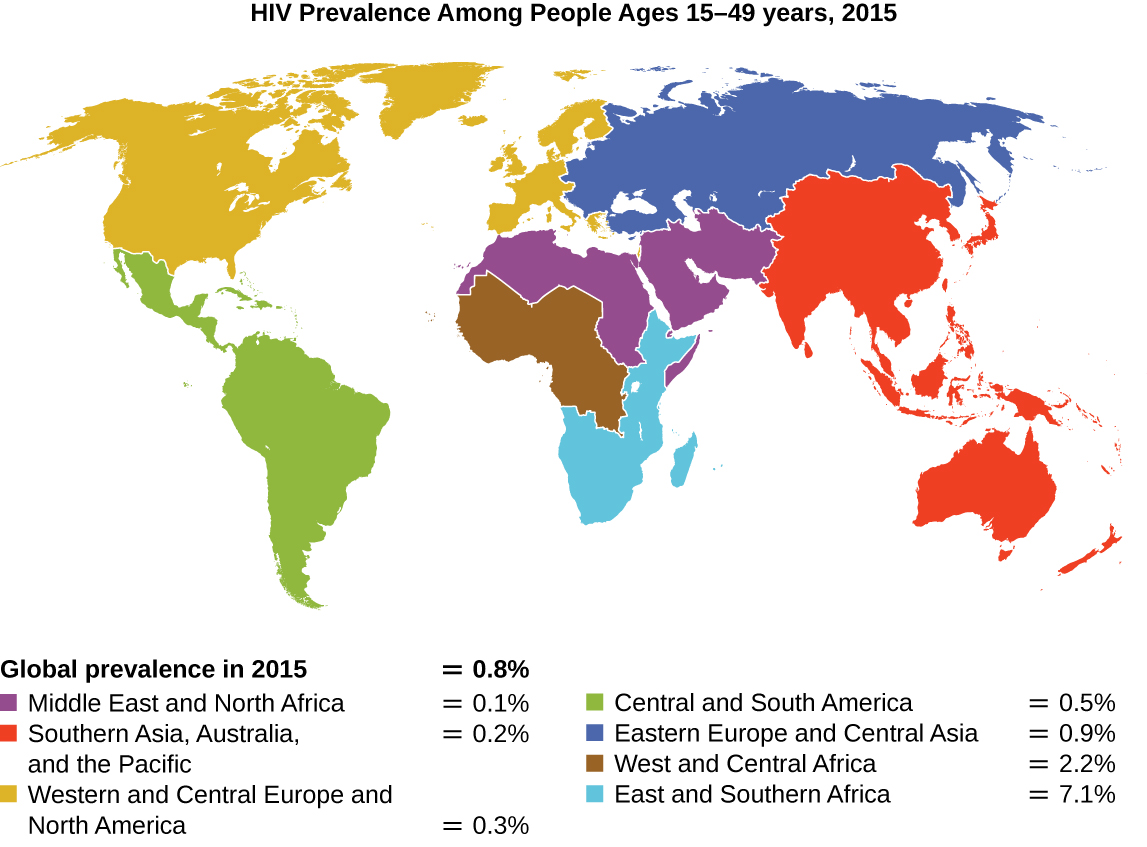
في السنوات الأخيرة، أثار اكتشاف عدد قليل من الأفراد من شمال أوروبا الذين يقاومون عدوى فيروس نقص المناعة البشرية. في عام 1998، نشر عالم الوراثة الأمريكي ستيفن جيه أوبراين في المعاهد الوطنية للصحة (NIH) وزملاؤه نتائج تحليلهم الجيني لأكثر من 4000 فرد. أشارت هذه الدراسات إلى أن العديد من الأفراد من أصل أوراسي (حتى 14٪ في بعض المجموعات العرقية) لديهم طفرة حذف، تسمى CCR5-Delta 32، في الجين المشفر CCR5. CCR5 هو مستقبل مشترك موجود على سطح الخلايا التائية وهو ضروري للعديد من سلالات الفيروس لدخول الخلية المضيفة. تؤدي الطفرة إلى إنتاج مستقبل لا يمكن لفيروس نقص المناعة البشرية الارتباط به بشكل فعال وبالتالي يمنع دخول الفيروس. لقد قلل الأشخاص المتجانسون لهذه الطفرة بشكل كبير من القابلية للإصابة بفيروس نقص المناعة البشرية، وأولئك الذين يعانون من الزيجوت المتغاير لديهم بعض الحماية من العدوى أيضًا.
ليس من الواضح سبب حمل الأشخاص المنحدرين من أصل أوروبي شمالي، على وجه التحديد، لهذه الطفرة، ولكن يبدو أن انتشارها أعلى في شمال أوروبا وينخفض بشكل مطرد في عدد السكان مع تحرك المرء جنوبًا. تشير الأبحاث إلى أن الطفرة كانت موجودة منذ ما قبل ظهور فيروس نقص المناعة البشرية وربما تم اختيارها في السكان الأوروبيين نتيجة التعرض للطاعون أو الجدري. قد تحمي هذه الطفرة الأفراد من الطاعون (الذي تسببه بكتيريا Yersinia pestis) والجدري (الناجم عن فيروس الجدري) لأن هذا المستقبل قد يكون متورطًا أيضًا في هذه الأمراض. إن عمر هذه الطفرة هو موضوع نقاش، لكن التقديرات تشير إلى أنها ظهرت قبل 1875 عامًا إلى 225 عامًا، وربما انتشرت من شمال أوروبا من خلال غزوات الفايكنج.
وقد أدى هذا الاكتشاف المثير إلى طرق جديدة في أبحاث فيروس نقص المناعة البشرية، بما في ذلك البحث عن أدوية لمنع ارتباط CCR5 بفيروس نقص المناعة البشرية لدى الأفراد الذين يفتقرون إلى الطفرة. على الرغم من إمكانية إجراء اختبار الحمض النووي لتحديد الأفراد الذين يحملون طفرة CCR5-Delta 32، إلا أن هناك حالات موثقة لأفراد متجانسين للطفرة المصابة بفيروس نقص المناعة البشرية. لهذا السبب، لا ينصح مسؤولو الصحة العامة بإجراء اختبار الحمض النووي للطفرة على نطاق واسع حتى لا نشجع السلوك المحفوف بالمخاطر لدى أولئك الذين يحملون الطفرة. ومع ذلك، لا يزال تثبيط ارتباط فيروس نقص المناعة البشرية بـ CCR5 يمثل استراتيجية صالحة لتطوير العلاجات الدوائية للمصابين بفيروس نقص المناعة البشرية.
أسباب الطفرات
يمكن أن تتسبب الأخطاء في عملية تكرار الحمض النووي في حدوث طفرات عفوية. معدل الخطأ في بوليميراز الحمض النووي هو قاعدة واحدة غير صحيحة لكل مليار زوج أساسي منسوخ. يمكن أن يتسبب التعرض للطفرات في حدوث طفرات مستحثة، وهي أنواع مختلفة من العوامل الكيميائية أو الإشعاع (الجدول\(\PageIndex{1}\)). يمكن أن يؤدي التعرض للمطفرات إلى زيادة معدل الطفرة أكثر من 1000 مرة. غالبًا ما تكون الطفرات أيضًا مواد مسرطنة، وهي عوامل تسبب السرطان. ومع ذلك، في حين أن جميع المواد المسرطنة تقريبًا مسببة للطفرات، إلا أن جميع الطفرات ليست بالضرورة مواد مسرطنة.
مطفرات كيميائية
تتفاعل أنواع مختلفة من الطفرات الكيميائية مباشرة مع الحمض النووي إما عن طريق العمل كنظائر نيوكليوزيد أو عن طريق تعديل قواعد النوكليوتيدات. تتشابه المواد الكيميائية التي تسمى نظائر النيوكليوزيد من الناحية الهيكلية مع قواعد النوكليوتيدات العادية ويمكن دمجها في الحمض النووي أثناء النسخ المتماثل (الشكل\(\PageIndex{3}\)). تحفز هذه النظائر الأساسية الطفرات لأنها غالبًا ما تحتوي على قواعد اقتران أساسية مختلفة عن القواعد التي تحل محلها. يمكن للمطفرات الكيميائية الأخرى تعديل قواعد الحمض النووي العادية، مما يؤدي إلى قواعد الاقتران الأساسية المختلفة. على سبيل المثال، يعمل حمض النيتروز على إزالة السيتوزين وتحويله إلى يوراسيل. ثم يقترن يوراسيل بالأدينين في جولة لاحقة من النسخ المتماثل، مما يؤدي إلى تحويل زوج GC الأساسي إلى زوج AT الأساسي. يعمل حمض النيتروز أيضًا على إزالة الأمينين إلى هيبوكسانثين، والذي يتزاوج أساسًا مع السيتوزين بدلاً من الثايمين، مما يؤدي إلى تحويل زوج أساسي من TA إلى زوج أساسي من CG.
تعمل الطفرات الكيميائية المعروفة باسم العوامل البينية بشكل مختلف. تنزلق هذه الجزيئات بين القواعد النيتروجينية المكدسة في اللولب المزدوج للحمض النووي، مما يشوه الجزيء ويخلق تباعدًا غير نمطي بين أزواج قاعدة النوكليوتيدات (الشكل\(\PageIndex{4}\)). نتيجة لذلك، أثناء تكرار الحمض النووي، قد يتخطى بوليميراز الحمض النووي تكرار العديد من النيوكليوتيدات (إنشاء حذف) أو إدخال نيوكليوتيدات إضافية (إنشاء إدخال). قد تؤدي أي من النتيجتين إلى طفرة في الإطار. تعتبر منتجات الاحتراق مثل الهيدروكربونات العطرية متعددة الحلقات عوامل إقحام خطيرة بشكل خاص يمكن أن تؤدي إلى سرطانات ناجمة عن الطفرات. تُستخدم العوامل المحركة لبروميد الإيثيديوم والأكريدين البرتقالي بشكل شائع في المختبر لتلطيخ الحمض النووي للتصور وهي مطفرات محتملة.
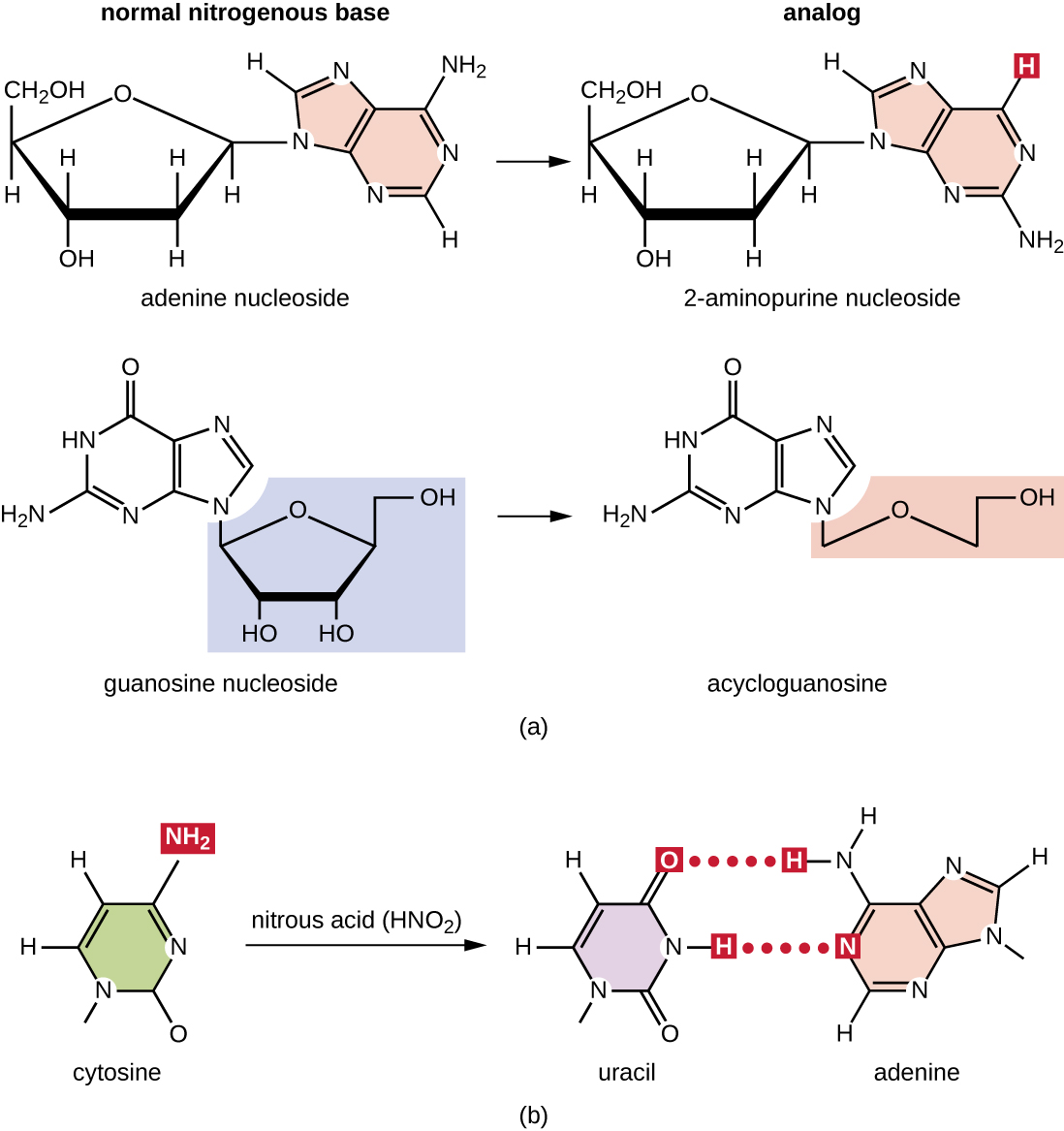
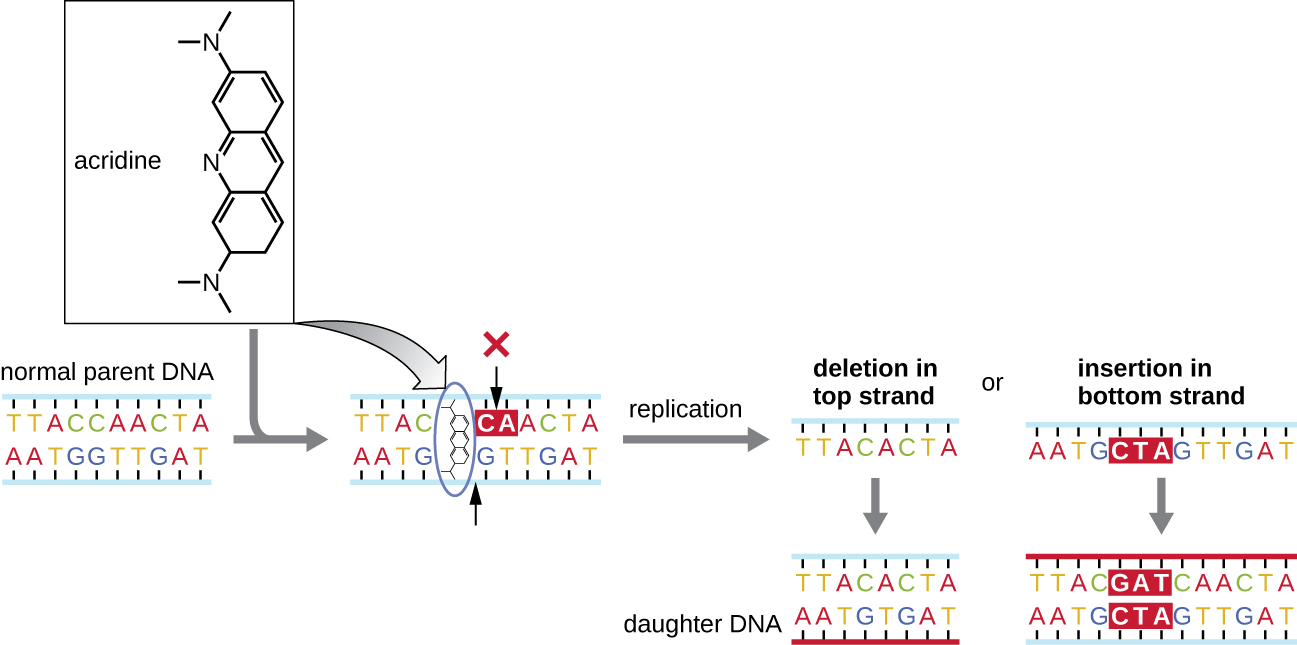
الإشعاع
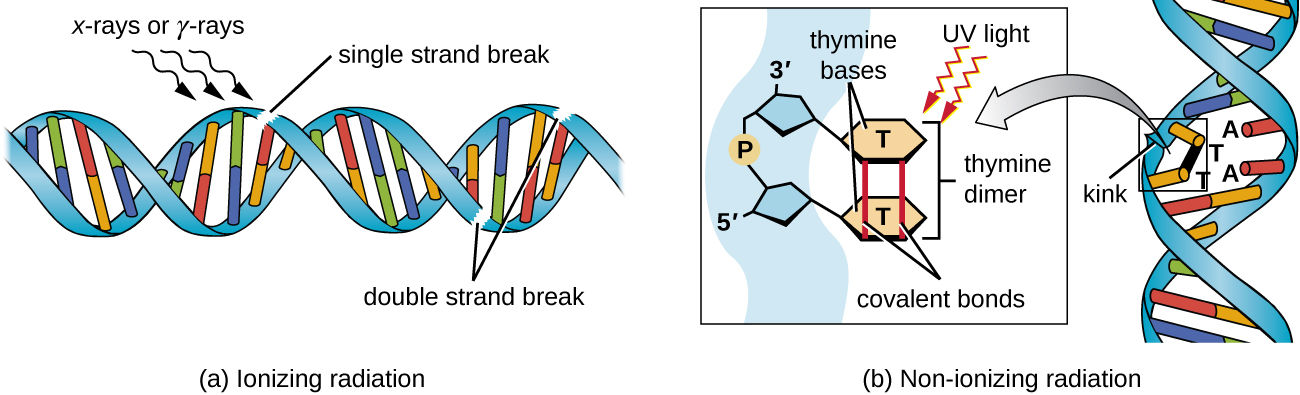
يمكن أن يؤدي التعرض للإشعاع المؤين أو غير المؤين إلى حدوث طفرات في الحمض النووي، ولكن بآليات مختلفة. يمكن للإشعاع المؤين القوي مثل الأشعة السينية وأشعة جاما أن يتسبب في حدوث فواصل مفردة ومزدوجة في العمود الفقري للحمض النووي من خلال تكوين جذور الهيدروكسيل عند التعرض للإشعاع (الشكل\(\PageIndex{5}\)). يمكن للإشعاع المؤين أيضًا تعديل القواعد؛ على سبيل المثال، تحويل السيتوزين إلى اليوراسيل، على غرار عمل حمض النيتروز. 3 يستخدم التعرض للإشعاع المؤين لقتل الميكروبات لتعقيم الأجهزة الطبية والأطعمة، بسبب تأثيره الكبير غير المحدد في إتلاف الحمض النووي والبروتينات والمكونات الخلوية الأخرى (انظر استخدام الطرق الفيزيائية للسيطرة على الكائنات الحية الدقيقة).
الإشعاع غير المؤين، مثل الأشعة فوق البنفسجية، ليس نشطًا بما يكفي لبدء هذه الأنواع من التغييرات الكيميائية. ومع ذلك، يمكن للإشعاع غير المؤين أن يحفز تكوين دايمر بين قاعدتين متجاورتين من البيريميدين، وهما عادة قاعدتان من الثيامين، داخل خيط النيوكليوتيد. أثناء تكوين ثايمر الثيامين، يصبح الثيامين المتجاوران مرتبطين تساهميًا، وإذا تُرك دون إصلاح، فسيتوقف كل من تكرار الحمض النووي ونسخه في هذه المرحلة. قد يستمر بوليميراز الحمض النووي وينسخ الديمر بشكل غير صحيح، مما قد يؤدي إلى تحول الإطار أو طفرات نقطية.
| عوامل مطفرة | وضع العمل | التأثير على الحمض النووي | نوع الطفرة الناتجة |
|---|---|---|---|
| نظائر النوكليوسيد | |||
| 2-أمينوبورين | يتم إدراجها بدلاً من A ولكن الأزواج الأساسية مع C | يحول زوج AT إلى زوج أساسي من GC | نقطة |
| 5-بروموراسيل | يتم إدراجها بدلاً من T ولكن الأزواج الأساسية مع G | يحول زوج AT إلى زوج أساسي من GC | نقطة |
| عامل تعديل النوكليوتيدات | |||
| أكسيد النيتروز | يحدد C إلى U | يحول GC إلى زوج AT الأساسي | نقطة |
| عوامل الإقحام | |||
| برتقال الأكريدين وبروميد الإيثيديوم والهيدروكربونات العطرية متعددة الحلقات | يشوه اللولب المزدوج ويخلق تباعدًا غير عادي بين النيوكليوتيدات | يقدم عمليات الحذف والإدخالات الصغيرة | تحول الإطار |
| إشعاع مؤين | |||
| الأشعة السينية والأشعة | يشكل جذور الهيدروكسيل | يتسبب في تكسر الحمض النووي بخيط واحد ومزدوج | قد تؤدي آليات الإصلاح إلى حدوث طفرات |
| الأشعة السينية والأشعة | يعدل القواعد (على سبيل المثال، تصنيف C إلى U) | يحول GC إلى زوج AT الأساسي | نقطة |
| إشعاع غير مؤين | |||
| فوق البنفسجي | يشكل مخفتات البيريميدين (عادة ثيمين) | يسبب أخطاء تكرار الحمض النووي | تحول الإطار أو النقطة |
التمارين\(\PageIndex{3}\)
- كيف يقوم النظير الأساسي بإدخال طفرة؟
- كيف يقوم العامل الاستقرائي بإدخال طفرة؟
- ما نوع المطفرات التي تسبب تراكم الثايمين؟
إصلاح الحمض النووي
عملية تكرار الحمض النووي دقيقة للغاية، ولكن يمكن أن تحدث الأخطاء تلقائيًا أو تسببها الطفرات. يمكن أن تؤدي الأخطاء غير المصححة إلى عواقب وخيمة على النمط الظاهري. طورت الخلايا العديد من آليات الإصلاح لتقليل عدد الطفرات التي لا تزال قائمة.
التدقيق اللغوي
يتم تصحيح معظم الأخطاء التي حدثت أثناء تكرار الحمض النووي على الفور بواسطة معظم بوليميرات الحمض النووي من خلال وظيفة تسمى التدقيق اللغوي. في التدقيق اللغوي، يقوم بوليميراز الحمض النووي بقراءة القاعدة المضافة حديثًا، مما يضمن أنها مكملة للقاعدة المقابلة في خيط القالب قبل إضافة القاعدة التالية. في حالة إضافة قاعدة غير صحيحة، يقوم الإنزيم بعمل قطع لإطلاق النوكليوتيد الخاطئ ويتم إضافة قاعدة جديدة.
إصلاح عدم التطابق
يتم تصحيح بعض الأخطاء التي حدثت أثناء النسخ المتماثل بعد وقت قصير من نقل جهاز النسخ المتماثل. هذه الآلية تسمى إصلاح عدم التطابق. تتعرف الإنزيمات المشاركة في هذه الآلية على النوكليوتيد المضاف بشكل غير صحيح وتستخرجه وتستبدله بالقاعدة الصحيحة. أحد الأمثلة على ذلك هو إصلاح عدم التطابق الموجه بالميثيل في E. coli. الحمض النووي هو نصف ميثيل. هذا يعني أن الخيط الأبوي يتم ميثيله بينما لا يتم ميثله في حبلا الابنة المركب حديثًا. يستغرق الأمر عدة دقائق قبل أن يتم ميثيل الشريط الجديد. يجب أن ترتبط البروتينات و mUTL و UtM بالموقع نصف الميثيلي حيث يوجد النوكليوتيد غير الصحيح. يقطع MuTh الخصلة غير الميثيلية (الخصلة الجديدة). يزيل إكسونوكلياز جزءًا من الخيط (بما في ذلك النوكليوتيد غير الصحيح). ثم يتم ملء الفجوة المتكونة بواسطة الحمض النووي POL III والليغاز.
إصلاح مخففات الثايمين
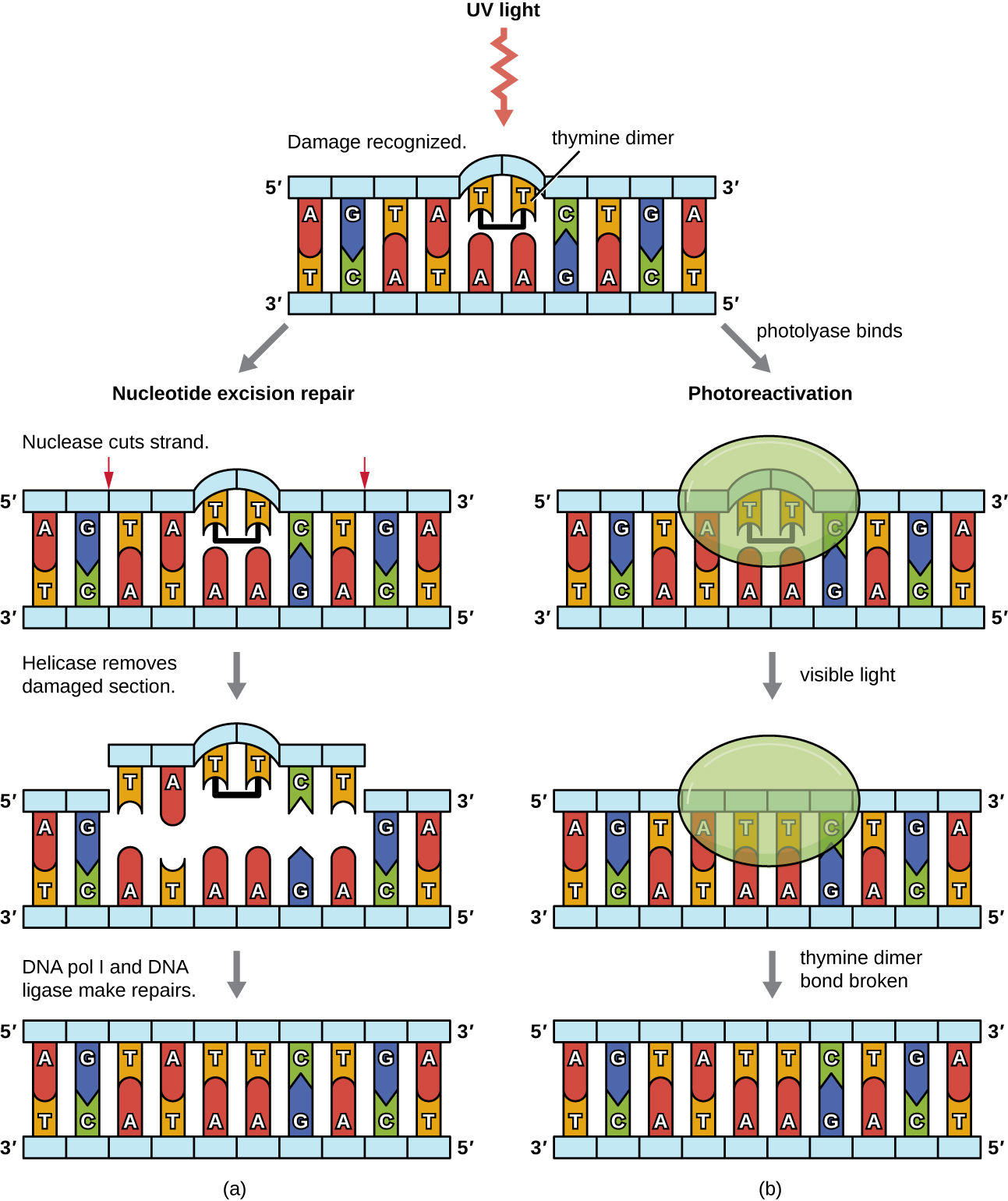
نظرًا لأن إنتاج مخففات الثايمين أمر شائع (لا تستطيع العديد من الكائنات الحية تجنب الأشعة فوق البنفسجية)، فقد تطورت الآليات لإصلاح هذه الآفات. في إصلاح استئصال النوكليوتيدات (يُطلق عليه أيضًا الإصلاح الداكن)، تقوم الإنزيمات بإزالة ثنائي البيريميدين واستبداله بالنيوكليوتيدات الصحيحة (الشكل\(\PageIndex{6}\)). في E. coli، يتم فحص الحمض النووي بواسطة مركب إنزيمي. إذا تم العثور على تشوه في اللولب المزدوج تم إدخاله بواسطة ثنائي البيريميدين، فإن مركب الإنزيم يقطع العمود الفقري لفوسفات السكر عدة قواعد في أعلى وأسفل الديمر، ثم تتم إزالة جزء الحمض النووي بين هاتين القطعتين إنزيميًا. يستبدل DNA pol I النيوكليوتيدات المفقودة بالنيوكليوتيدات الصحيحة ويغلق ليغاز الحمض النووي الفجوة في العمود الفقري لسكر الفوسفات.
يحدث الإصلاح المباشر (المعروف أيضًا باسم الإصلاح الضوئي) لمخفتات الثايمين من خلال عملية إعادة التنشيط الضوئي في وجود الضوء المرئي. يتعرف إنزيم يسمى فوتولياز على التشوه في حلزون الحمض النووي الناجم عن ديمر الثيامين ويرتبط بالديمر. بعد ذلك، في ظل وجود الضوء المرئي، يغير إنزيم فوتولياز الشكل ويكسر ثنائي الثيامين، مما يسمح للثيامين مرة أخرى بالاقتران بشكل صحيح مع الأدينين على الخصلة التكميلية. يبدو أن إعادة التنشيط الضوئي موجودة في جميع الكائنات الحية، باستثناء الثدييات المشيمية، بما في ذلك البشر. يعد التنشيط الضوئي مهمًا بشكل خاص للكائنات الحية المعرضة بشكل مزمن للأشعة فوق البنفسجية، مثل النباتات والبكتيريا التي تقوم بعملية التمثيل الضوئي والطحالب والشعاب المرجانية، لمنع تراكم الطفرات الناتجة عن تكوين ثيمين دايمر.
التمارين\(\PageIndex{4}\)
- في أثناء إصلاح عدم التطابق، كيف يتعرف الإنزيم على الخصلة الجديدة وما هي الخصلة القديمة؟
- ما نوع الطفرة التي يقوم Photolyase بإصلاحها؟
تحديد الطفرات البكتيرية
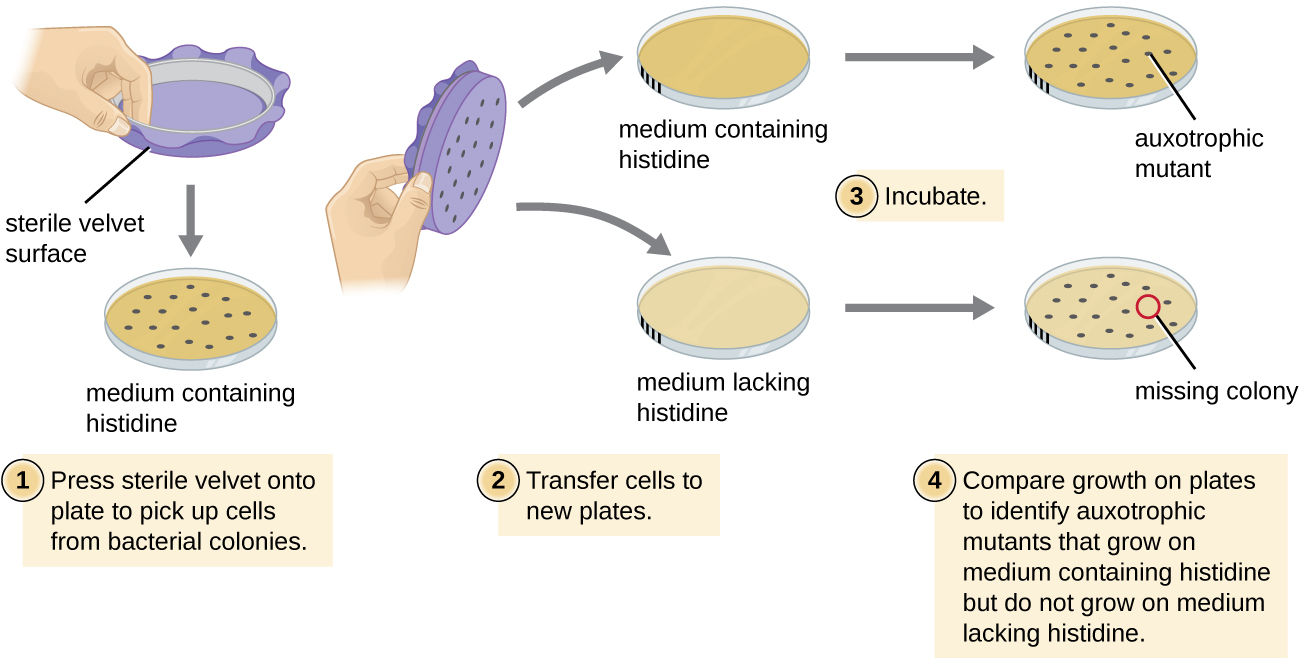
إحدى التقنيات الشائعة المستخدمة لتحديد الطفرات البكتيرية تسمى الطلاء بالنسخ المتماثلة. تُستخدم هذه التقنية للكشف عن الطفرات الغذائية، التي تسمى الأوكسوتروفس، والتي لها طفرة في جين يشفر إنزيمًا في مسار التخليق الحيوي لمغذيات معينة، مثل الأحماض الأمينية. ونتيجة لذلك، في حين تحتفظ الخلايا البرية بالقدرة على النمو بشكل طبيعي على وسط يفتقر إلى العناصر الغذائية المحددة، فإن الأصداف غير قادرة على النمو على مثل هذه الوسيلة. أثناء الطلاء بالنسخ المتماثلة (الشكل\(\PageIndex{7}\))، يتم تحوير مجموعة من الخلايا البكتيرية ثم طلاءها كخلايا فردية على لوحة معقدة كاملة من الناحية الغذائية والسماح لها بالنمو لتصبح مستعمرات. تتم إزالة الخلايا من هذه المستعمرات من هذه اللوحة الرئيسية، غالبًا باستخدام المخمل المعقم. ثم يتم ضغط هذا المخمل، الذي يحتوي على خلايا، في نفس الاتجاه على ألواح من وسائط مختلفة. يجب أيضًا أن تكون لوحة واحدة على الأقل كاملة من الناحية الغذائية لضمان نقل الخلايا بشكل صحيح بين الصفائح. تفتقر اللوحات الأخرى إلى مغذيات محددة، مما يسمح للباحث باكتشاف العديد من الطفرات السمعية غير القادرة على إنتاج مغذيات محددة. يمكن استخدام الخلايا من المستعمرة المقابلة على اللوحة الكاملة من الناحية الغذائية لاستعادة الطافرة لمزيد من الدراسة.
التمارين\(\PageIndex{5}\)
لماذا يتم طلاء الخلايا على لوحة كاملة من الناحية الغذائية بالإضافة إلى الألواح التي تعاني من نقص المغذيات عند البحث عن متحولة؟
اختبار أميس
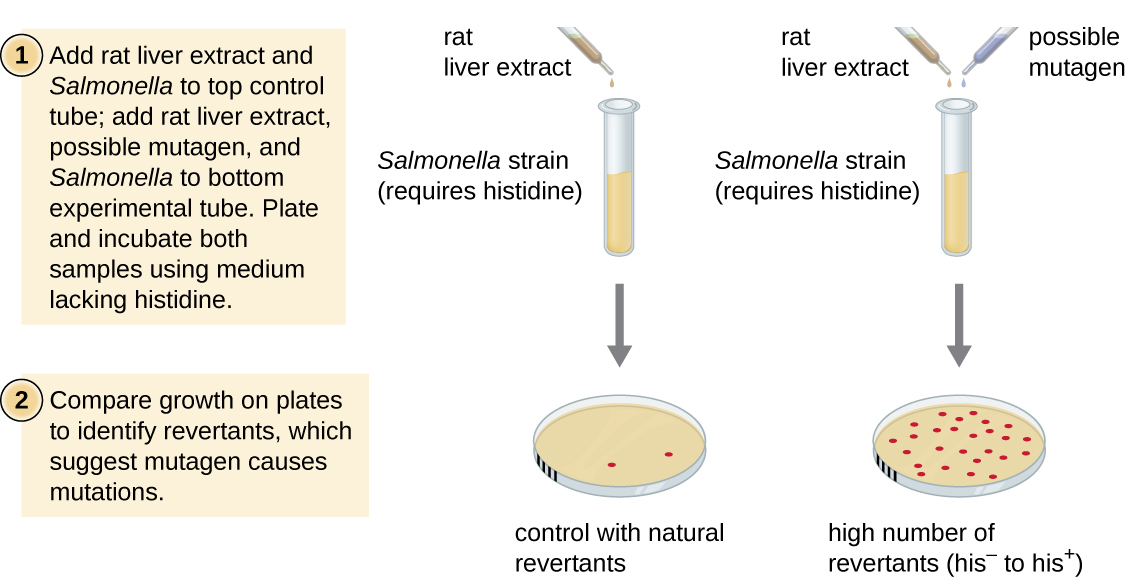
اختبار أميس، الذي طوره بروس أميس (1928—) في السبعينيات، هو طريقة تستخدم البكتيريا للفحص السريع وغير المكلف للإمكانات المسببة للسرطان للمركبات الكيميائية الجديدة. يقيس الاختبار معدل الطفرة المرتبط بالتعرض للمركب، والذي، إذا ارتفع، قد يشير إلى أن التعرض لهذا المركب يرتبط بزيادة خطر الإصابة بالسرطان. يستخدم اختبار أميس ككائن اختباري سلالة من السالمونيلا التيفيموريوم وهي عبارة عن هيستيدين أوكسوتروف، غير قادرة على تخليق الهيستيدين الخاص بها بسبب طفرة في جين أساسي مطلوب لتخليقه. بعد التعرض لطفرة محتملة، يتم طلاء هذه البكتيريا على وسط يفتقر إلى الهيستيدين، ويتم تسجيل عدد الطفرات التي تستعيد القدرة على تخليق الهستيدين ومقارنتها بعدد هذه الطفرات التي تنشأ في غياب المطفرات المحتملة (الشكل\(\PageIndex{8}\)). المواد الكيميائية الأكثر تطفرًا ستجلب المزيد من الطفرات باستخدام تخليق الهيستيدين المستعاد في اختبار أميس. نظرًا لأن العديد من المواد الكيميائية ليست مسببة للطفرات بشكل مباشر ولكن يتم استقلابها إلى أشكال مطفرة بواسطة إنزيمات الكبد، يتم تضمين مستخلص كبد الفئران بشكل شائع في بداية هذه التجربة لمحاكاة التمثيل الغذائي للكبد. بعد إجراء اختبار Ames، يتم اختبار المركبات التي تم تحديدها على أنها مطفرة لمزيد من الاختبار لخصائصها المسببة للسرطان المحتملة باستخدام نماذج أخرى، بما في ذلك النماذج الحيوانية مثل الفئران والجرذان.
التمارين\(\PageIndex{6}\)
- ما الطفرة المستخدمة كمؤشر لمعدل الطفرة في اختبار أميس؟
- لماذا يمكن أن يعمل اختبار أميس كاختبار للسرطان؟
المفاهيم الأساسية والملخص
- الطفرة هي تغيير وراثي في الحمض النووي. قد تؤدي الطفرة إلى تغيير في تسلسل الأحماض الأمينية للبروتين، مما قد يؤثر على وظيفته.
- تؤثر الطفرة النقطية على زوج أساسي واحد. قد تتسبب الطفرة النقطية في حدوث طفرة صامتة إذا كان كودون mRNA يرمز إلى نفس الحمض الأميني، أو طفرة غير منطقية إذا كان كودون mRNA يرمز إلى حمض أميني مختلف، أو طفرة غير منطقية إذا أصبح كودون mRNA كودون توقفًا.
- قد تحتفظ الطفرات غير المنطقية بالوظيفة، اعتمادًا على كيمياء الحمض الأميني الجديد وموقعه في البروتين. تنتج الطفرات غير المنطقية بروتينات مقطوعة وغير وظيفية في كثير من الأحيان.
- تنتج طفرة الإطار عن إدخال أو حذف عدد من النيوكليوتيدات التي لا تكون من مضاعفات ثلاثة. يؤدي التغيير في إطار القراءة إلى تغيير كل حمض أميني بعد نقطة الطفرة وينتج عنه بروتين غير وظيفي.
- تحدث الطفرات العفوية من خلال أخطاء تكرار الحمض النووي، بينما تحدث الطفرات المستحثة من خلال التعرض للمطفرات.
- غالبًا ما تكون العوامل المطفرة مسببة للسرطان ولكن ليس دائمًا. ومع ذلك، فإن جميع المواد المسرطنة تقريبًا مسببة للطفرات.
- تشمل الطفرات الكيميائية النظائر الأساسية والمواد الكيميائية التي تعدل القواعد الحالية. في كلتا الحالتين، يتم إدخال الطفرات بعد عدة جولات من تكرار الحمض النووي.
- يؤدي الإشعاع المؤين، مثل الأشعة السينية وأشعة جاما، إلى كسر العمود الفقري للفوسفوديستر للحمض النووي ويمكنه أيضًا تعديل القواعد كيميائيًا لتغيير قواعد الاقتران الأساسية.
- قد يؤدي الإشعاع غير المؤين مثل الأشعة فوق البنفسجية إلى إدخال مخفتات البيريميدين (الثيامين)، والتي قد تؤدي، أثناء تكرار الحمض النووي ونسخه، إلى حدوث تحول في الإطار أو طفرات نقطية.
- تمتلك الخلايا آليات لإصلاح الطفرات التي تحدث بشكل طبيعي. بوليميراز الحمض النووي له نشاط تدقيق. إصلاح عدم التطابق هو عملية لإصلاح القواعد المدمجة بشكل غير صحيح بعد اكتمال نسخ الحمض النووي.
- يمكن أيضًا إصلاح مخففات البيريميدين. في إصلاح استئصال النوكليوتيدات (الإصلاح الداكن)، تتعرف الإنزيمات على التشوه الناتج عن ثنائي البيريميدين وتستبدل الخصلة التالفة بالقواعد الصحيحة، باستخدام خيط الحمض النووي غير التالف كقالب. قد تستخدم البكتيريا والكائنات الحية الأخرى أيضًا الإصلاح المباشر، حيث يقوم إنزيم فوتولياز، في وجود الضوء المرئي، بتفكيك البيريميدين.
- من خلال مقارنة النمو على الصفيحة الكاملة ونقص النمو في الوسائط التي تفتقر إلى مغذيات محددة، يمكن تحديد طفرات معينة لفقدان الوظيفة تسمى الأوكسوتروفس.
- اختبار Ames هو طريقة غير مكلفة تستخدم البكتيريا المساعدة لقياس الطفرات الجينية لمركب كيميائي. الطفرات هي مؤشر على إمكانية الإصابة بالسرطان.
الحواشي
- 1 منظمة الصحة العالمية «بيانات المرصد الصحي العالمي (GHO)، فيروس نقص المناعة البشرية/الإيدز». http://www.who.int/gho/hiv/en/. تم الوصول إليه في 5 أغسطس 2016.
- 2 منظمة الصحة العالمية «بيانات المرصد الصحي العالمي (GHO)، فيروس نقص المناعة البشرية/الإيدز». http://www.who.int/gho/hiv/en/. تم الوصول إليه في 5 أغسطس 2016.
- 3 كيه آر تيندال وآخرون «التغييرات في تسلسل قاعدة الحمض النووي الناتجة عن طفرات أشعة جاما في Lambda Phage والنبوءة.» علم الوراثة 118 رقم 4 (1988): 551-560.


