11.4: تخليق البروتين (الترجمة)
- Page ID
- 194645
أهداف التعلم
- وصف الشفرة الجينية وشرح سبب اعتبارها عالمية تقريبًا
- شرح عملية الترجمة ووظائف الآلية الجزيئية للترجمة
- قارن الترجمة في حقيقيات النواة وبدايات النواة
يستهلك تخليق البروتينات طاقة الخلية أكثر من أي عملية أيضية أخرى. في المقابل، تمثل البروتينات كتلة أكبر من أي جزيء كبير آخر من الكائنات الحية. إنها تؤدي تقريبًا كل وظيفة من وظائف الخلية، وتعمل كعناصر وظيفية (مثل الإنزيمات) وعناصر هيكلية. تتضمن عملية الترجمة، أو تخليق البروتين، الجزء الثاني من التعبير الجيني، فك تشفير رسالة mRNA بواسطة ريبوسوم إلى منتج متعدد الببتيد.
الشفرة الجينية
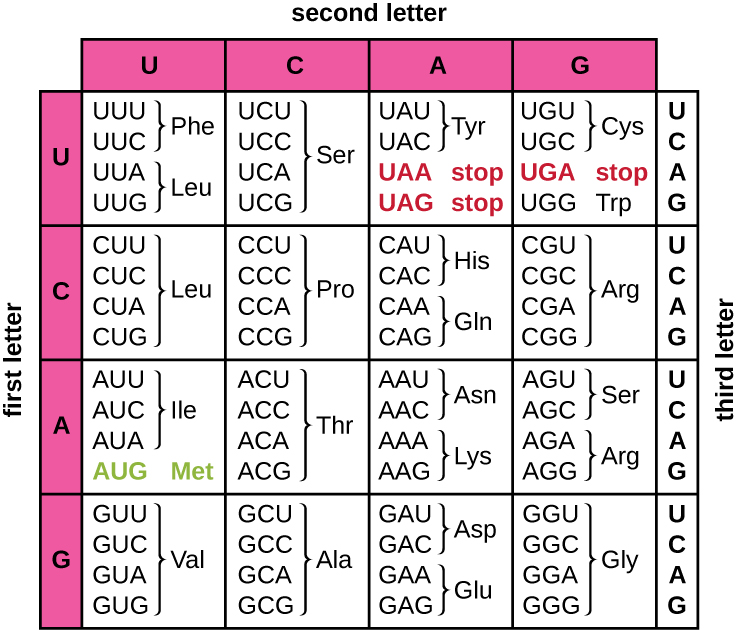
تعمل ترجمة قالب mRNA على تحويل المعلومات الجينية القائمة على النيوكليوتيد إلى «لغة» الأحماض الأمينية لإنشاء منتج بروتيني. يتكون تسلسل البروتين من 20 حمضًا أمينيًا شائعًا. يتم تعريف كل حمض أميني داخل mRNA بواسطة ثلاثة توائم من النيوكليوتيدات تسمى الكودون. تسمى العلاقة بين كودون mRNA والحمض الأميني المقابل له بالشفرة الجينية.
يعني رمز النوكليوتيد الثلاثي أن هناك ما مجموعه 64 تركيبة ممكنة (4 3، مع أربعة نيوكليوتيدات مختلفة ممكنة في كل من المواضع الثلاثة المختلفة داخل الكودون). هذا الرقم أكبر من عدد الأحماض الأمينية ويتم ترميز حمض أميني معين بأكثر من كودون واحد (الشكل\(\PageIndex{1}\)). هذا التكرار في الشفرة الجينية يسمى الانحطاط. عادةً، في حين أن الموضعين الأولين في الكودون مهمان لتحديد الحمض الأميني الذي سيتم دمجه في بولي ببتيد متزايد، فإن الموضع الثالث، المسمى بموضع التذبذب، يكون أقل أهمية. في بعض الحالات، إذا تم تغيير النوكليوتيد في الموضع الثالث، فإن نفس الحمض الأميني لا يزال مدمجًا.
في حين أن 61 رمزًا من أصل 64 رمزًا محتملًا للأحماض الأمينية، فإن ثلاثة من الكودونات الـ 64 لا ترمز إلى الأحماض الأمينية؛ فهي تنهي تخليق البروتين، وتطلق البولي ببتيد من آلية الترجمة. هذه تسمى «رمز التوقف» أو رمز الهراء. كودون آخر، AUG، له أيضًا وظيفة خاصة. بالإضافة إلى تحديد ميثيونين الأحماض الأمينية، فإنه عادةً ما يكون بمثابة كودون البدء لبدء الترجمة. يتم تعيين إطار القراءة، وهو الطريقة التي يتم بها تجميع النيوكليوتيدات في mRNA في رموز، للترجمة بواسطة رمز بدء AUG بالقرب من نهاية 5' من mRNA. كل مجموعة من ثلاثة نيوكليوتيدات تتبع كودون البداية هذا هي كودون في رسالة mRNA.
الشفرة الجينية عالمية تقريبًا. مع بعض الاستثناءات، تستخدم جميع الأنواع تقريبًا نفس الشفرة الجينية لتخليق البروتين، وهو دليل قوي على أن جميع أشكال الحياة الموجودة على الأرض تشترك في أصل مشترك. ومع ذلك، فقد لوحظت أحماض أمينية غير عادية مثل السيلينوسيستين والبيروليسين في الأركيا والبكتيريا. في حالة السيلينوسيستين، فإن الكودون المستخدم هو UGA (عادة ما يكون كودون توقف). ومع ذلك، يمكن لـ UGA ترميز السيلينوسيستين باستخدام بنية الحلقة الجذعية (المعروفة باسم تسلسل إدخال السيلينوسيستين، أو عنصر SECIS)، والتي توجد في المنطقة الثالثة غير المترجمة من mRNA. يستخدم البيروليسين كودون إيقاف مختلف، UAG. يتطلب دمج البيروليسين جين PylS و RNA انتقالًا فريدًا (tRNA) مع مضاد CUA.
التمارين\(\PageIndex{1}\)
- كم عدد القواعد الموجودة في كل كودون؟
- ما هي الأحماض الأمينية التي تم ترميزها بواسطة codon AAU؟
- ماذا يحدث عند الوصول إلى رمز التوقف؟
آلات تخليق البروتين
بالإضافة إلى قالب mRNA، تساهم العديد من الجزيئات والجزيئات الكبيرة في عملية الترجمة. يختلف تكوين كل مكون باختلاف الأصناف؛ على سبيل المثال، قد تتكون الريبوسومات من أعداد مختلفة من الحمض النووي الريبوزي (RNAs) والببتيدات المتعددة اعتمادًا على الكائن الحي. ومع ذلك، فإن الهياكل والوظائف العامة لآلات تخليق البروتين قابلة للمقارنة من البكتيريا إلى الخلايا البشرية. تتطلب الترجمة إدخال قالب mRNA، والريبوسومات، والترانا، والعوامل الأنزيمية المختلفة.
الريبوسومات
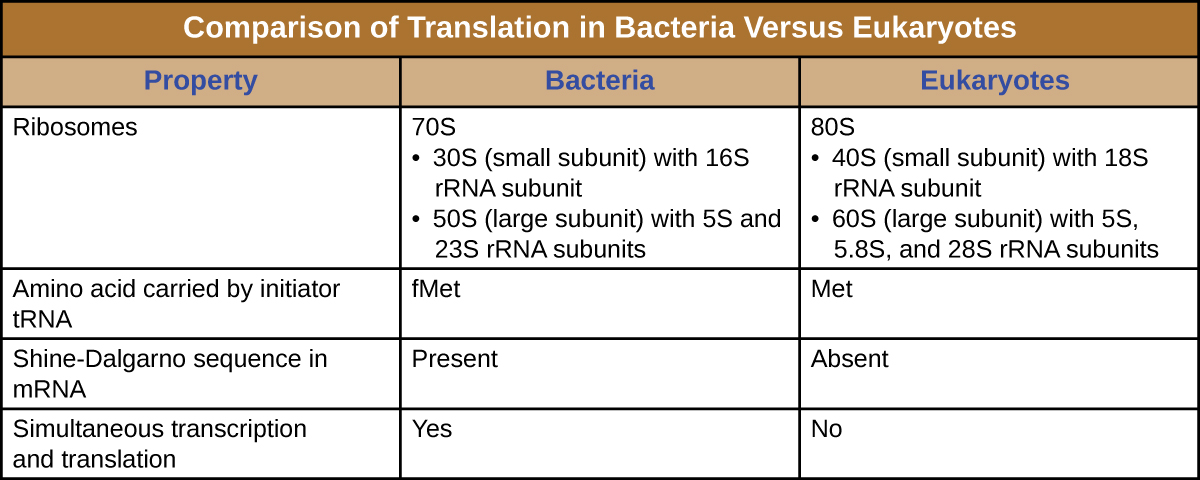
الريبوسوم عبارة عن جزيء كبير معقد يتكون من الحمض الريبي التحفيزي (يسمى الريبوزيمات) و RRNAs الهيكلية، بالإضافة إلى العديد من الببتيدات المتعددة المتميزة. تشكل RNAs الناضجة حوالي 50٪ من كل ريبوسوم. تحتوي بدائيات النواة على ريبوسومات من نوع 70S، بينما تحتوي حقيقيات النوى على ريبوسومات 80S في السيتوبلازم والشبكة الإندوبلازمية الخشنة، وريبوسومات 70S في الميتوكوندريا والبلاستيدات الخضراء. تتفكك الريبوسومات إلى وحدات فرعية كبيرة وصغيرة عندما لا تقوم بتجميع البروتينات وإعادة الارتباط أثناء بدء الترجمة. في E. coli، توصف الوحدة الفرعية الصغيرة بأنها 30S (التي تحتوي على الوحدة الفرعية 16S RNA)، والوحدة الفرعية الكبيرة هي 50S (التي تحتوي على وحدات 5S و 23S rRNA الفرعية)، ليصبح المجموع 70S (وحدات Svedberg ليست مضافة). تحتوي ريبوسومات حقيقية النواة على وحدة فرعية صغيرة من طراز 40S (تحتوي على الوحدة الفرعية RRNA 18S) ووحدة فرعية كبيرة من طراز 60S (تحتوي على وحدات فرعية من RNA 5S و 5.8S و 28S)، ليصبح المجموع الثمانينيات. الوحدة الفرعية الصغيرة مسؤولة عن ربط قالب mRNA، بينما تربط الوحدة الفرعية الكبيرة trNAs (التي تمت مناقشتها في القسم الفرعي التالي).
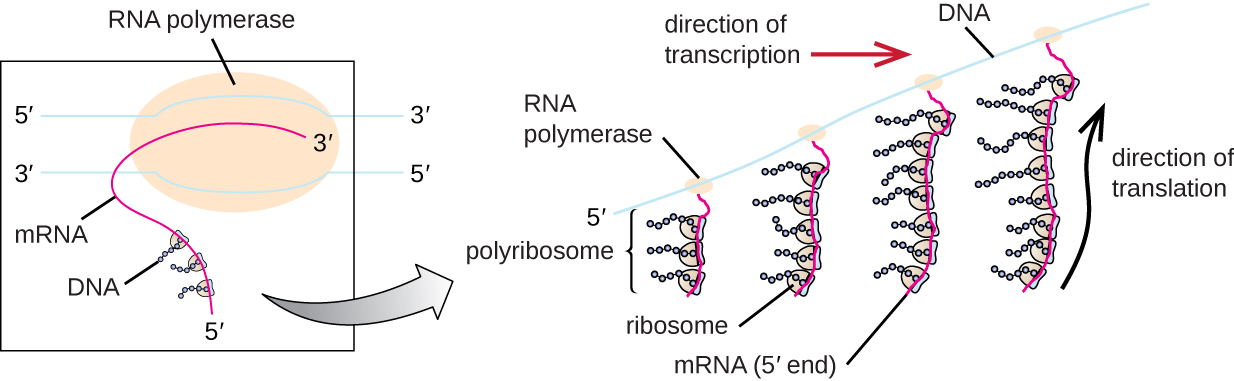
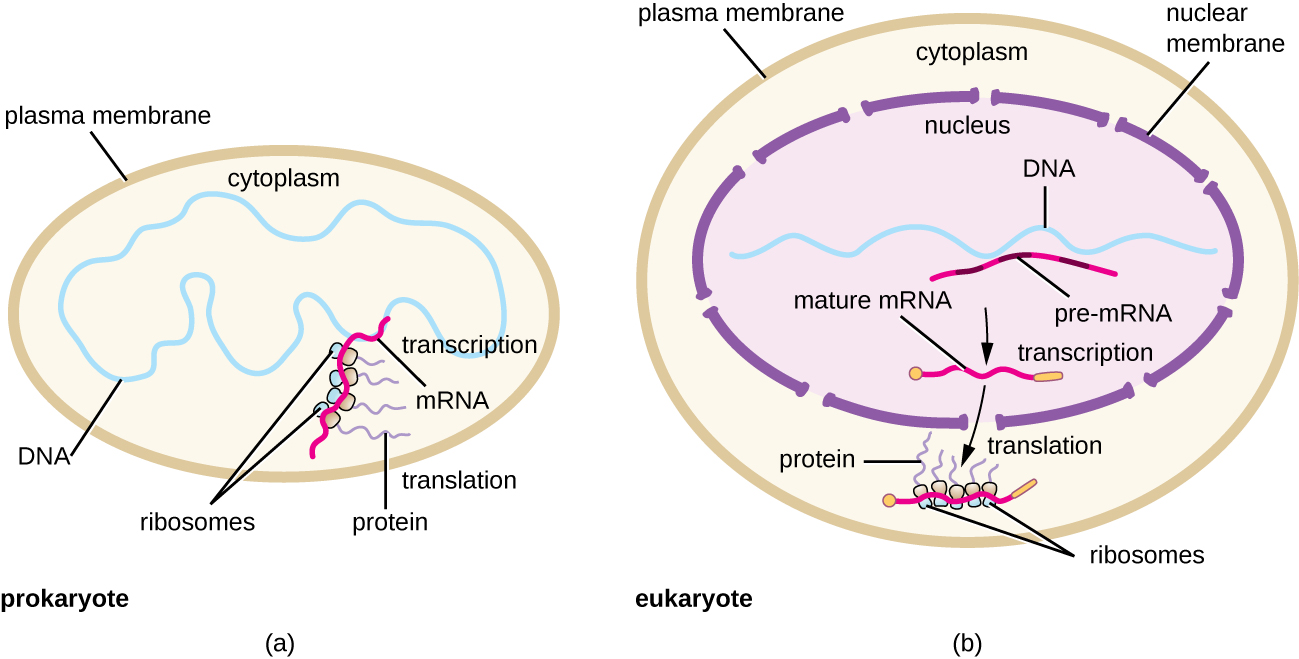
تتم ترجمة كل جزيء من mRNA في وقت واحد بواسطة العديد من الريبوسومات، وكلها تقوم بتجميع البروتين في نفس الاتجاه: قراءة mRNA من 5 إلى 3 «وتوليف البولي ببتيد من نهاية N إلى نهاية C. يُطلق على البنية الكاملة التي تحتوي على mRNA مع العديد من الريبوسومات المرتبطة اسم بوليريبوسوم (أو بوليسوم). في كل من البكتيريا والعتيقة، قبل حدوث الإنهاء النسخي، يتم بالفعل استخدام كل نسخة من ترميز البروتين لبدء تخليق نسخ عديدة من بولي ببتيد (بولي ببتيد) مشفر لأن عمليات النسخ والترجمة يمكن أن تحدث بشكل متزامن، لتشكيل بوليريبوسومات (الشكل \(\PageIndex{2}\)). السبب وراء إمكانية حدوث النسخ والترجمة في وقت واحد هو أن كلتا العمليتين تحدثان في نفس الاتجاه من 5 إلى 3 بوصات، وكلاهما يحدث في سيتوبلازم الخلية، ولأن نسخة الحمض النووي الريبي لا تتم معالجتها بمجرد نسخها. يسمح هذا لخلية بدائية النواة بالاستجابة للإشارة البيئية التي تتطلب بروتينات جديدة بسرعة كبيرة. في المقابل، في الخلايا حقيقية النواة، لا يمكن النسخ والترجمة المتزامنة. على الرغم من أن البوليريبوسومات تتشكل أيضًا في حقيقيات النوى، إلا أنها لا تستطيع القيام بذلك حتى يكتمل تخليق الحمض النووي الريبي ويتم تعديل جزيء الحمض النووي الريبي ونقله خارج النواة.
نقل الحمض النووي الريبي
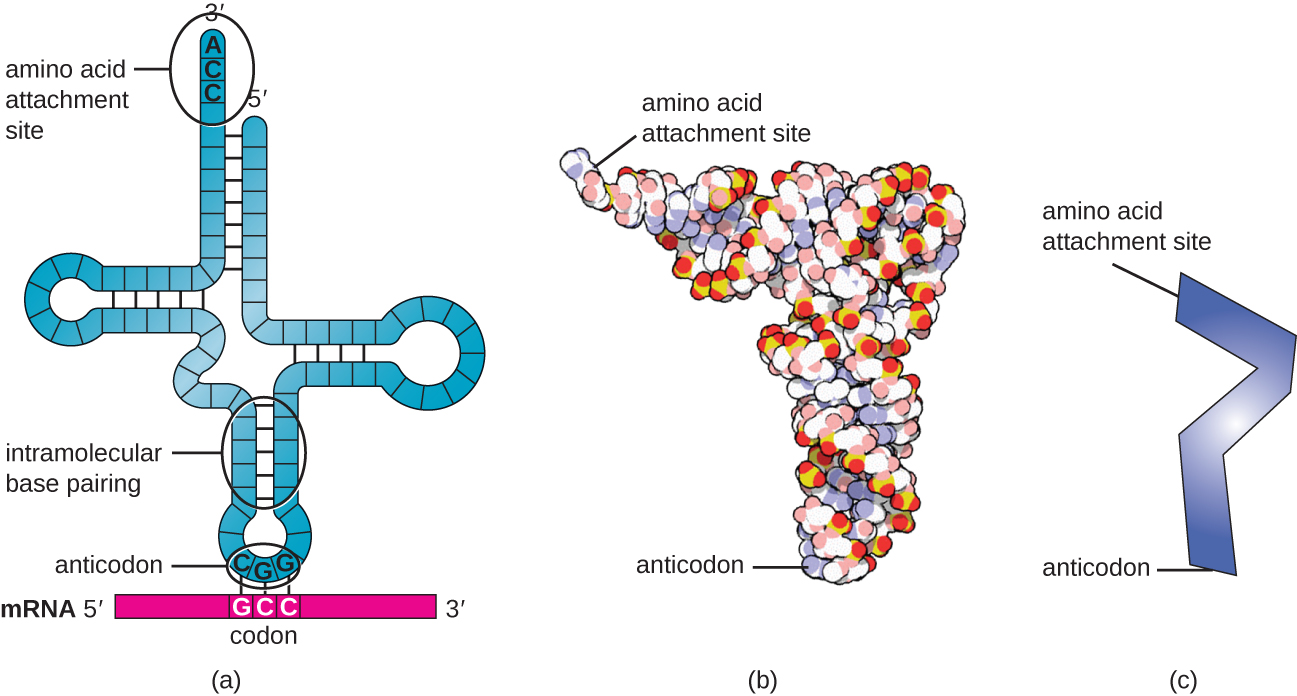
الحمض النووي الريبي المنقول (trNAs) عبارة عن جزيئات RNA هيكلية، واعتمادًا على الأنواع، توجد العديد من الأنواع المختلفة من الحمض النووي الريبي في السيتوبلازم. عادة ما تحتوي الأنواع البكتيرية على ما بين 60 و 90 نوعًا. يعمل كل نوع من أنواع الحمض النووي الريبي كمحولات، ويرتبط بكودون معين في قالب mRNA ويضيف الأحماض الأمينية المقابلة إلى سلسلة البولي ببتيد. لذلك، فإن الحمض النووي الريبي هو الجزيئات التي «تترجم» بالفعل لغة الحمض النووي الريبي إلى لغة البروتينات. كجزيئات محول للترجمة، من المدهش أن الحمض النووي الريبي يمكن أن يلائم الكثير من الخصوصية في مثل هذه الحزمة الصغيرة. يتفاعل جزيء الحمض النووي الريبي مع ثلاثة عوامل: تخليق الحمض النووي الريبي الأميني والريبوسومات وmRNA.
تأخذ الحمض النووي الريبي الناضج هيكلًا ثلاثي الأبعاد عندما تكون القواعد التكميلية مكشوفة في ارتباط الهيدروجين بجزيء الحمض النووي الريبي أحادي الجديلة مع بعضها البعض (الشكل\(\PageIndex{3}\)). يضع هذا الشكل موقع ربط الأحماض الأمينية، والذي يُطلق عليه طرف ربط الأحماض الأمينية CCA، وهو تسلسل السيتوسين-السيتوسين-الأدينين في الطرف الثالث من الحمض النووي الريبي، ومضاد الكودونات في الطرف الآخر. مضاد الكودون هو تسلسل ثلاثي النوكليوتيد يرتبط بكودون mRNA من خلال الاقتران الأساسي التكميلي.
يُضاف الحمض الأميني إلى نهاية جزيء الحمض النووي الريبي من خلال عملية «شحن» الحمض الريبي الريبي، حيث يتم ربط كل جزيء من الحمض الأميني الريبي بحمضه الأميني الصحيح أو المتماثل بواسطة مجموعة من الإنزيمات تُسمى تخليق الحمض النووي الريبي أمينوسيل. يوجد نوع واحد على الأقل من تخليق الحمض النووي الريبي الأميني لكل من الأحماض الأمينية العشرين. خلال هذه العملية، يتم تنشيط الحمض الأميني أولاً عن طريق إضافة أحادي فوسفات الأدينوزين (AMP) ثم يتم نقله إلى الحمض الريبي الريبي، مما يجعله الحمض الريبي المشحون، ويتم إطلاق AMP.
التمارين\(\PageIndex{2}\)
- وصف هيكل وتكوين الريبوسوم الأولي.
- في أي اتجاه يتم قراءة قالب mRNA؟
- وصف بنية ووظيفة الحمض النووي الريبي (tRNA).
آلية تخليق البروتين
تتشابه الترجمة في بدائيات النواة وحقائق النوى. سنستكشف هنا كيفية حدوث الترجمة في E. coli، وهي بدائية نموذجية، ونحدد أي اختلافات بين الترجمة البكتيرية وترجمة حقيقية النواة.
المبادرة
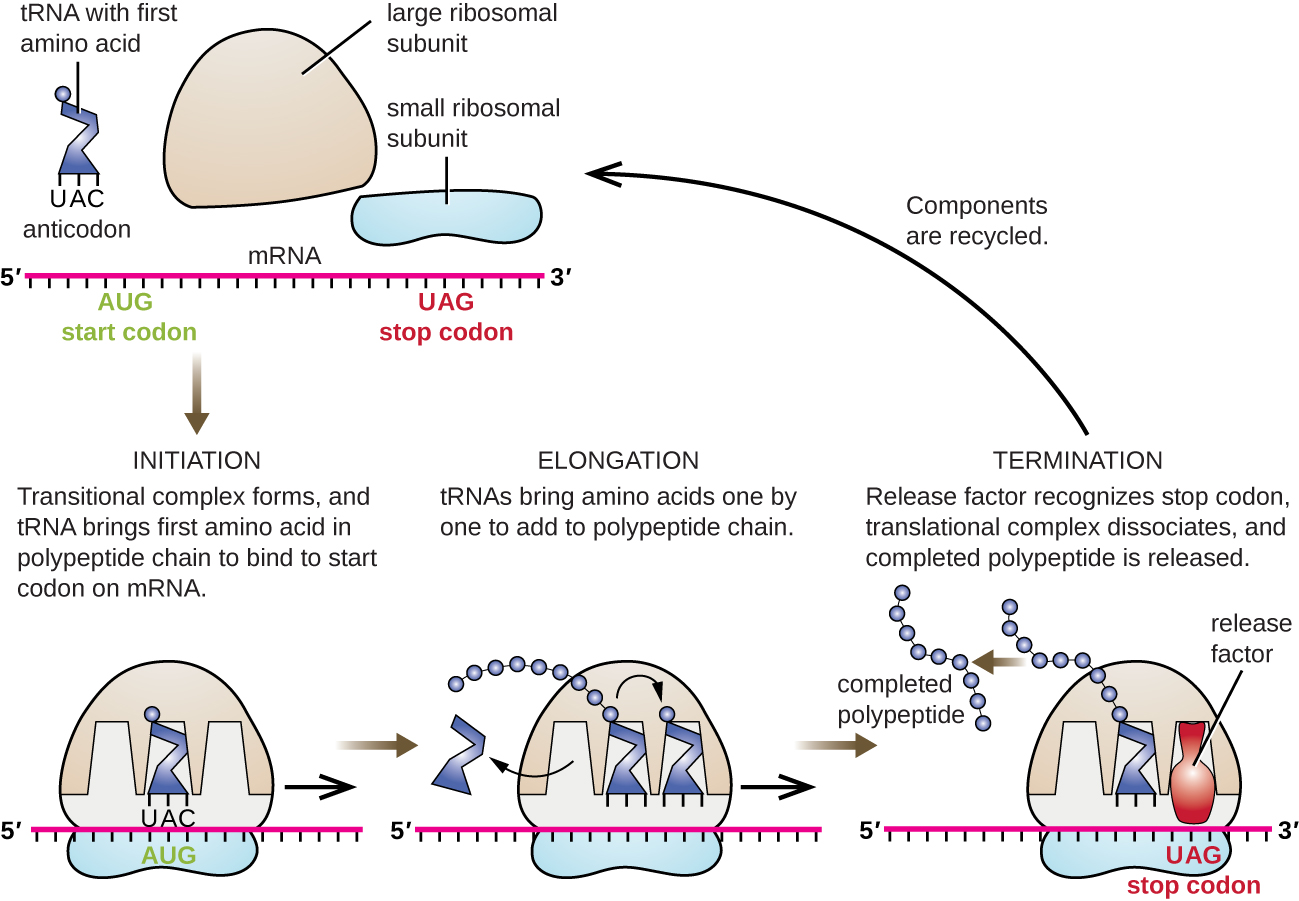
يبدأ بدء تخليق البروتين بتكوين مجمع البدء. في الإشريكية القولونية، يتضمن هذا المركب ريبوسوم 30S الصغير، ونموذج mRNA، وثلاثة عوامل بدء تساعد الريبوسوم على التجميع بشكل صحيح، وثلاثي فوسفات الجوانوزين (GTP) الذي يعمل كمصدر للطاقة، وحائز خاص على الحمض الريبي الريبوزي (RNA) الذي يحمل N -formyl-methionine (Fmet-trNA fMet) ) (الشكل\(\PageIndex{4}\)). يتفاعل الحمض النووي الريبي البادئ مع رمز البدء على AUG الخاص بـ mRNA ويحمل ميثيونين مُعد (fMet). نظرًا لمشاركته في البدء، يتم إدخال fMET في بداية (نهاية N) لكل سلسلة بولي ببتيد يتم تصنيعها بواسطة E. coli. في E. coli mRNA، يتفاعل التسلسل الرائد في الجزء العلوي من أول كودون AUG، ويسمى تسلسل Shine-Dalgarno (المعروف أيضًا باسم موقع الربط الريبوسومي AGGAGG)، من خلال الاقتران الأساسي التكميلي مع جزيئات الرنا الريبوزي التي تشكل الريبوسوم. يقوم هذا التفاعل بتثبيت الوحدة الفرعية الريبوسومية 30S في الموقع الصحيح على قالب mRNA. عند هذه النقطة، ترتبط الوحدة الفرعية الريبوسومية 50S بعد ذلك بمجمع البدء، وتشكل ريبوسوم سليمًا.
في حقيقيات النوى، يتشابه التكوين المركب لبدء التشغيل، مع وجود الاختلافات التالية:
- الحمض النووي الريبي البادئ عبارة عن الحمض النووي الريبي المتخصص المختلف الذي يحمل الميثيونين، ويسمى Met-Trnai
- بدلاً من الارتباط بـ mRNA في تسلسل Shine-Dalgarno، يتعرف مجمع البدء حقيقي النواة على غطاء 5 بوصات من mRNA حقيقي النواة، ثم يتتبع على طول mRNA في اتجاه 5 إلى 3 بوصات حتى يتم التعرف على كودون بدء AUG. عند هذه النقطة، ترتبط الوحدة الفرعية 60S بمجمع MET-Trnai و mRNA والوحدة الفرعية 40S.
الاستطالة
في بدائيات النواة وحقيقيات النوى، تكون أساسيات استطالة الترجمة هي نفسها. في الإشريكية القولونية، يشكل ارتباط الوحدة الفرعية الريبوسومية 50S لإنتاج الريبوسوم السليم ثلاثة مواقع ريبوزومية مهمة وظيفيًا: يربط موقع A (أمينوسيل) الحمض النووي الريبوزي المشحون الوارد. يربط موقع P (peptidyl) الحمض النووي الريبي المشحون الذي يحمل الأحماض الأمينية التي شكلت روابط ببتيد مع سلسلة البولي ببتيد المتنامية ولكنها لم تنفصل بعد عن الحمض الريبي الريبي المقابل لها. يقوم موقع E (exit) بإطلاق الحمض الريبي النووي الريبوزي المنفصل بحيث يمكن إعادة شحنها بالأحماض الأمينية الحرة. هناك استثناء واحد ملحوظ لخط التجميع هذا من الحمض النووي الريبي: أثناء التكوين المعقد لبدء التشغيل، تدخل البكتيريا fMet−trNA fMet أو met-Trnai حقيقية النواة إلى موقع P مباشرة دون الدخول أولاً إلى موقع A، مما يوفر موقعًا مجانيًا A جاهزًا لقبول الحمض النووي الريبي المقابل للكودون الأول بعد أغسطس.
تستمر الاستطالة بحركات أحادية الكودون للريبوسوم تسمى كل منها حدث النقل. أثناء كل حدث نقل، تدخل TRNAs المشحونة في موقع A، ثم تنتقل إلى موقع P، ثم تنتقل أخيرًا إلى موقع E لإزالتها. تحدث الحركات أو الخطوات الريبوسومية من خلال التغييرات التوافقية التي تدفع الريبوسوم بثلاث قواعد في الاتجاه الثلاثي. تتكون روابط الببتيد بين المجموعة الأمينية للحمض الأميني المرتبط بـ trNA في الموقع A ومجموعة الكربوكسيل من الأحماض الأمينية المرتبطة بـ tRNA في الموقع P. يتم تحفيز تكوين كل رابطة ببتيد بواسطة ببتيديل ترانسفيراز، وهو ريبوزيم قائم على الحمض النووي الريبي مدمج في الوحدة الفرعية الريبوسومية 50S. يرتبط الحمض الأميني المرتبط بـ tRNA في موقع P أيضًا بسلسلة البولي ببتيد المتنامية. عندما يخطو الريبوسوم عبر الحمض النووي الريبوزي، يدخل الحمض النووي الريبوزي السابق الموجود في موقع P إلى الموقع E، وينفصل عن الحمض الأميني، ويتم طرده. تتطلب العديد من الخطوات أثناء الاستطالة، بما في ذلك ربط الحمض الريبي الأميني المشحون بموقع A والانتقال، طاقة مشتقة من التحلل المائي GTP، والذي يتم تحفيزه بواسطة عوامل استطالة محددة. ومن المثير للدهشة أن جهاز ترجمة E. coli يستغرق 0.05 ثانية فقط لإضافة كل حمض أميني، مما يعني أنه يمكن ترجمة 200 بروتين من الأحماض الأمينية في 10 ثوانٍ فقط.
الإنهاء
يحدث إنهاء الترجمة عند مواجهة رمز هراء (UAA أو UAG أو UGA) لا يوجد له ترنا مكمل. عند التوافق مع موقع A، يتم التعرف على هذه الرموز التافهة من خلال عوامل الإطلاق في بدائيات النواة وحقيقيات النواة التي تؤدي إلى انفصال الأحماض الأمينية في موقع P عن الحمض النووي الريبي الخاص به، مما يؤدي إلى إطلاق بولي ببتيد مصنوع حديثًا. تنفصل الوحدات الفرعية الريبوسومية الصغيرة والكبيرة عن mRNA وعن بعضها البعض؛ ويتم تجنيدها على الفور تقريبًا في مجمع ترجمة آخر.
باختصار، هناك العديد من الميزات الرئيسية التي تميز التعبير الجيني بدائية النواة عن تلك الموجودة في حقيقيات النوى. هذه موضحة في الشكل\(\PageIndex{5}\) ومدرجة في الشكل\(\PageIndex{6}\).
استهداف البروتين وطيه وتعديله
أثناء الترجمة وبعدها، قد تحتاج الببتيدات المتعددة إلى التعديل قبل أن تكون نشطة بيولوجيًا. تتضمن تعديلات ما بعد الترجمة ما يلي:
- إزالة تسلسلات الإشارات المترجمة - ذيول قصيرة من الأحماض الأمينية التي تساعد في توجيه البروتين إلى مقصورة خلوية معينة
- «الطي» المناسب للبولي ببتيد وربط وحدات فرعية متعددة من البولي ببتيد، غالبًا ما يتم تسهيلها بواسطة بروتينات مرافقة، في هيكل ثلاثي الأبعاد متميز
- المعالجة المحللة للبروتين لبولي ببتيد غير نشط لإطلاق مكون بروتين نشط، و
- تعديلات كيميائية مختلفة (مثل الفسفرة أو الميثيل أو الجليكوسيل) للأحماض الأمينية الفردية.
التمارين\(\PageIndex{3}\)
- ما مكونات مجمع البدء للترجمة في بدائيات النواة؟
- ما الفرق بين بدء الترجمة بدائية النواة وترجمة حقيقية النواة؟
- ماذا يحدث في كل موقع من المواقع الثلاثة النشطة للريبوسوم؟
- ما الذي يسبب إنهاء الترجمة؟
المفاهيم الأساسية والملخص
- في الترجمة، يتم تصنيع الببتيدات المتعددة باستخدام تسلسلات mRNA والآلات الخلوية، بما في ذلك الحمض النووي الريبي الذي يطابق أكواد mRNA مع الأحماض الأمينية المحددة والريبوسومات المكونة من الحمض النووي الريبي والبروتينات التي تحفز التفاعل.
- تتدهور الشفرة الجينية حيث أن العديد من أكواد mRNA ترمز لنفس الأحماض الأمينية. الشفرة الجينية عالمية تقريبًا بين الكائنات الحية.
- تتكون كل من الريبوسومات بدائية النواة (70S) والسيتوبلازمية حقيقية النواة (80S) من وحدة فرعية كبيرة ووحدة فرعية صغيرة بأحجام مختلفة بين المجموعتين. تتكون كل وحدة فرعية من rRNA والبروتين. تشبه الريبوسومات العضوية في الخلايا حقيقية النواة الريبوسومات بدائية النواة.
- يوجد حوالي 60 إلى 90 نوعًا من الحمض النووي الريبي في البكتيريا. يحتوي كل الحمض النووي الريبوزي على مضاد ثلاثي النوكليوتيد بالإضافة إلى موقع ربط لحمض أميني كوجنيت. جميع الحمض النووي الريبي الذي يحتوي على مضاد محدد سيحمل نفس الحمض الأميني.
- يحدث بدء الترجمة عندما ترتبط الوحدة الفرعية الريبوسومية الصغيرة بعوامل البدء و tRNA البادئ عند رمز البداية لـ mRNA، متبوعًا بالارتباط بمجمع البدء للوحدة الفرعية الريبوسومية الكبيرة.
- في الخلايا بدائية النواة، يتم ترميز كودون البدء لـ N-formyl-methionine الذي يحمله البادئ الخاص trNA. في الخلايا حقيقية النواة، يرمز كودون البدء للميثيونين الذي يحمله البادئ الخاص rNA. بالإضافة إلى ذلك، في حين أن الربط الريبوسومي للحمض النووي الريبوزي في بدائيات النواة يتم تسهيله من خلال تسلسل Shine-Dalgarno داخل mRNA، فإن الريبوسومات حقيقية النواة ترتبط بغطاء 5' من mRNA.
- خلال مرحلة الاستطالة للترجمة، يرتبط الحمض الريبي النووي المشحون بـ mRNA في موقع A للريبوسوم؛ يتم تحفيز رابطة الببتيد بين الحمضين الأمينيين المتجاورين، مما يؤدي إلى كسر الرابطة بين الحمض الأميني الأول والحمض الريبي النووي الريبوزي الخاص به؛ يقوم الريبوسوم بتحريك كودون واحد على طول mRNA؛ ويتم نقل الحمض الريبوزي الأول من موقع P للريبوسوم إلى الموقع E ويترك المركب الريبوسومي.
- يحدث إنهاء الترجمة عندما يواجه الريبوسوم كودون الإيقاف، والذي لا يرمز إلى الحمض النووي الريبي. تتسبب عوامل الإطلاق في إطلاق البولي ببتيد، وتفكك مركب الريبوسوم.
- في بدائيات النواة، قد يقترن النسخ والترجمة، مع بدء ترجمة جزيء mRNA بمجرد أن يسمح النسخ بالتعرض الكافي للحمض النووي الريبوزي (mRNA) لربط الريبوسوم، قبل إنهاء النسخ. لا يقترن النسخ والترجمة في حقيقيات النوى لأن النسخ يحدث في النواة، بينما تحدث الترجمة في السيتوبلازم أو بالاشتراك مع الشبكة الإندوبلازمية الخشنة.
- غالبًا ما تتطلب الببتيدات المتعددة تعديلًا أو أكثر بعد الترجمة لتصبح نشطة بيولوجيًا.


