8.2: תמלול פרוקריוטי
- Page ID
- 208474
ב אי - קולי, כמו בפרוקריוטים אחרים, יש רק פולימראז RNA אמיתי אחד (לא כולל פולימראז RNA מיוחד, פרימאז, שמייצר פריימרים קצרים של RNA לשכפול DNA). הפולימראז הוא הולואנזים מרובה יחידות המורכב בעיקר משתי יחידות משנה α, יחידת משנה β, יחידת משנה β ', יחידת משנה ω ותת-יחידה σ. יחידות המשנה α הן בעיקר מבניות, המרכיבות את ההולואנזים וגורמים רגולטוריים נלווים. יחידת המשנה β מכילה את פעילות הפולימראז המזרזת את הסינתזה של RNA, בעוד שיחידת המשנה β 'משמשת לקשירה לא ספציפית ל-DNA. יחידת המשנה ω מעורבת בהרכבה של ההולואנזים ועשויה גם למלא תפקיד בשמירה על השלמות המבנית של פולימראז ה- RNA. לבסוף, יש את תת-היחידה σ, שאינה נשארת קשורה קשר הדוק לאנזים הליבה (αββ'ω) למעט כאשר עוזרים ליזום שעתוק, ומשמשת לזיהוי האמרגן על ידי הפחתת הזיקה של RNAP ל-DNA באופן כללי, אך הגדלת הזיקה של RNAP לרצפי מקדם DNA ספציפיים. מדוע להפחית את הזיקה ל- DNA לא ספציפי? כאשר ה-RNAP אינו בשימוש, הוא לא רק צף בנוקלאופלזמה: הוא קשור די חזק לאורך ה-DNA. כאשר הסיגמה קשורה, הזיקה המופחתת מאפשרת להולואנזים RNAP לנוע לאורך ה-DNA ולסרוק אחר רצפי פרומטור. ישנם איזופורמים מרובים של תת-היחידה σ( כגון sigma-70 שהוזכר לעיל), שכל אחד מהם מזהה רצפי פרומטור שונים. כל האיזופורמים מבצעים את אותה פונקציה בסיסית של איתור נכון של ה- RNAP לתחילת הגן, וכל האיזופורמים נשארים מחוברים להולואנזים למטרה חולפת אחת בלבד, ולאחר מכן הם משתחררים (בדרך כלל לאחר תמלול כעשרה נוקלאוטידים).
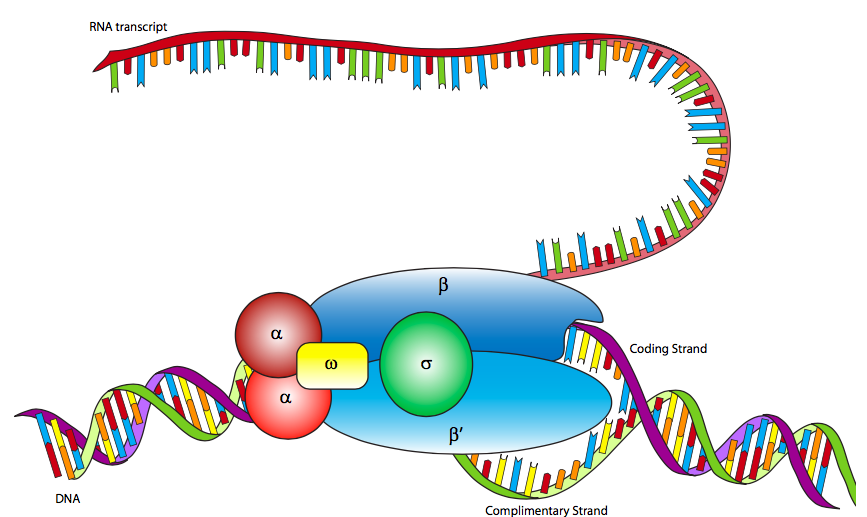
למרות שהתגלה RNA פולימראז בשנת 1960, ה- E. coli RNAP טרם מופה בהצלחה על ידי קריסטלוגרפיה של קרני רנטגן. עם זאת, הוא דומה מאוד ל- RNAP של המין הארכאי, Thermophilus aquaticus, שהוא יציב ביותר (= קל יותר להתגבש) ועבורו הובהר מבנה קריסטלוגרפי רנטגן. הנתונים ממבנה ה- Taq RNAP וניתוחים מיקרוסקופיים אלקטרונים של E. coli RNAP מייצרים הולואנזים בצורת לובסטר. המשטח הפנימי של הטופר מרופד בחומצות אמינו טעונות חיוביות שיכולות לקיים אינטראקציה עם ה-DNA הטעון שלילי, וכאשר ההולואנזים קושר תת-יחידת סיגמא, שני חצאי הטופר (שנוצרו בעיקר על ידי יחידות המשנה של בטא ובטא) מתקרבים זה לזה כדי ליצור אינטראקציה עם ה-DNA.
ריפמיצינים הם סוג של אנטיביוטיקה הכוללת ריפמיצין B, המיוצר על ידי החיידק Streptomyces Mediterranei (אגב רק אנטיביוטיקה אחת מני רבות שמקורן בסוג Streptomyces), וריפמפיצין, בן דודו הסינתטי. הם פועלים על ידי קשירה בתוך תעלת ה- DNA-RNA ליד האתר הפעיל של פולימראז RNA, המונע באופן סטרילי הוספת נוקלאוטידים לגדיל ה- RNA. אם האורגניזם אינו יכול לתמלל RNA, הוא אינו יכול להשתמש ב- RNA כדי ליצור את האנזימים וחלבונים אחרים הנחוצים לחיים, ומת. אתר הקישור לריפמיצין שמור מאוד ברוב הפרוקריוטים אך לא באיקריוטים, כך שהאנטיביוטיקה הורגת חיידקים במיוחד עם סיכוי קטן לפגיעה באיקריוטים.
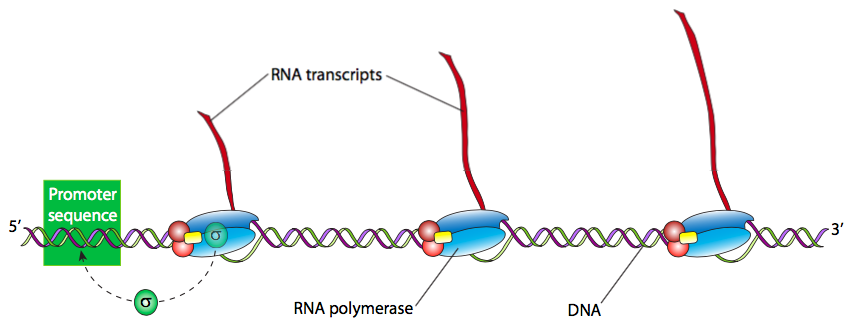
לאחר שההולואנזים זיהה ונקשר בחוזקה ל-DNA באתר האמרגן, השלב הבא הוא "להמיס" את ה-DNA (לשבור את קשרי ה-H ולהפריד את גדילי הסליל הכפול) באזור זה כך שה-RNAP יוכל להמשיך במורד הזרם, לקרוא את גדיל ה-DNA של התבנית ולייצר את ה-RNA החדש. לעתים קרובות יש צורך בתמלילי RNA רבים של גן כדי לייצר מספר רב של חלבונים פעילים בפרק זמן קצר. לכן לגנים פעילים מאוד בתעתיק יש לעתים קרובות פולימראזות RNA מרובות הקוראות אותן, אחת אחרי השנייה. באופן כללי, פולימראז RNA צריך לעבד רק כ-15 נוקלאוטידים לפני שיש מקום ל-RNAP אחר יכול לקשור את האמרגן ולהתחיל תמליל נוסף.
הפרדת גדילים היא תהליך קשה מבחינה אנרגטית בשל כוחם של קשרי ה- H המשולבים בין הגדילים, ולעתים קרובות RNAP עשוי לבצע מספר ניסיונות הפלה קצרי מועד לפני שלבסוף יחטט את הסליל הכפול ארוך ורחוק מספיק כדי לאפשר ל- RNAP להתייצב ולתמלל ברציפות לאתר העצירה.
שלב ההתארכות של השעתוק ממשיך בכיוון 5' עד 3', כלומר נוקלאוטידים חדשים מתווספים ל-3'-OH של הגדיל הגדל. התארכות היא תהליך סטוכסטי שבו אחד הריבונוקלאוטידים הצפים החופשיים השופעים יורד לאתר הפעיל של RNAP מול תבנית ה-DNA. אם זהו הנוקלאוטיד הנכון (משלים לתבנית), אז ייווצרו באופן זמני קשרי H, המייצבים את הנוקלאוטיד החדש במקום מספיק זמן כדי שה- RNAP יזרז יצירת קשר פוספודיאסטר בין 3'-OH של ה- RNA- התקדמות ו- 5'-פוספט של הנוקלאוטיד. עם זאת, אם זהו הנוקלאוטיד הלא נכון, קשרי ה- H הנכונים אינם נוצרים, והנוקלאוטיד בדרך כלל מתנתק מהאתר הפעיל לפני של-RNAP יש סיכוי לקשור אותו לגדיל ה- RNA הגדל. ברור שזו לא מערכת מושלמת, ולמעשה, שיעור השגיאות בתעתיק גבוה למדי בכ-1 מכל 10000 נוקלאוטידים. למרבה המזל, התא בדרך כלל מוציא עותקים רבים של RNA מכל גן נתון במהירות רבה (כ-80 נוקלאוטידים בשנייה), שרובם נטולי שגיאות או שיש להם שגיאות שאינן משפיעות על תפקוד החלבון של המוצר הסופי. יתר על כן, בניגוד ל-DNA, שבו שגיאות שכפול עוברות מדור אחד של תאים לדור, RNA אינו אמצעי אחסון, ואופיו החולף אומר שאפילו מוטציות המשפיעות קשות על תפקוד החלבון משפיעות רק על מעט החלבונים המתורגמים מ- RNA אחד, לא החלבונים הנוצרים מ- RNA אחרים העשויים מאותו גן תבנית, הרבה פחות מהדורות הבאים. במילים אחרות, כדי לא להתאים ביטוי מהסרט כדורי בשר, "זה פשוט לא משנה."
בסופו של דבר, ה-RNA פולימראז מגיע לקצה הגן ומפסיק לתמלל. אתר הסיום מסומן בדרך כלל על ידי רצף של 4-10 שאריות אדנין (A) על גדיל התבנית, ולחלקם יש אזור עשיר ב-G-C פלינדרומי היוצר לולאת סיכת ראש ממש במעלה הזרם של סדרת האדנינים. במקרה הראשון, חושבים שהמחרוזת המתקבלת של זוגות בסיסים A-U אינה יציבה ועלולה להוביל לכך שה-RNAP וגדיל ה-RNA החדש נופלים מה-DNA של התבנית, ובמקביל, מבנה סיכת השיער עלול לגרום ל-RNAP לעצור או להשהות, וזה יכול גם להוביל להתנתקות מה-DNA. רק כמחצית מכל אתרי סיום התעתיק מסומנים בדרך זו, ולאחרים אין לולאות סיכת ראש משמעותיות או רצפים הניתנים לזיהוי בקלות מלבד סדרה של אזורים עשירים ב- G-C. בסוג זה של אתר סיום, הקו-פקטור האנזימטי, rho, נדרש לסיום, ולכן זה ידוע בשם סיום תלוי rho. Rho הוא חלבון קושר RNA עם פעילות הליקאז, ולכן מניחים שהוא משפיע על סיום על ידי אילוץ גדיל ה- RNA מתבנית ה- DNA.


