14.5: בדיקת היעילות של חומרים אנטי-מיקרוביאליים
- Page ID
- 209071
מטרות למידה
- הסבר את הרעיון של עמידות לתרופות
- תאר כיצד מיקרואורגניזמים מפתחים או רוכשים עמידות לתרופות
- תאר את המנגנונים השונים של עמידות לתרופות אנטי-מיקרוביאליות
עמידות אנטי-מיקרוביאלית אינה תופעה חדשה. בטבע, חיידקים מתפתחים כל הזמן על מנת להתגבר על התרכובות האנטי-מיקרוביאליות המיוצרות על ידי מיקרואורגניזמים אחרים. התפתחות אנושית של תרופות אנטי-מיקרוביאליות והשימוש הקליני הנרחב בהן פשוט סיפקו לחץ סלקטיבי נוסף המקדם אבולוציה נוספת. מספר גורמים חשובים יכולים להאיץ את התפתחות העמידות לתרופות. אלה כוללים שימוש יתר ושימוש לרעה בתרופות אנטי-מיקרוביאליות, שימוש לא הולם בתרופות אנטי-מיקרוביאליות, מינון תת-תרפויטי ואי עמידה בחולה במהלך הטיפול המומלץ.
חשיפה של פתוגן לתרכובת אנטי-מיקרוביאלית יכולה לבחור עבור מוטציות כרומוזומליות המעניקות עמידות, שניתן להעביר אנכית לדורות החיידקים הבאים ובסופו של דבר להפוך לשליטה באוכלוסיית חיידקים שנחשפת שוב ושוב לאנטי-מיקרוביאלית. לחלופין, גנים רבים האחראים לעמידות לתרופות נמצאים על פלסמידים או בטרנספוזונים שניתן להעביר בקלות בין חיידקים באמצעות העברת גנים אופקית (ראה כיצד פרוקריוטים א-מיניים משיגים גיוון גנטי). לטרנספוזונים יש גם את היכולת להעביר גנים של עמידות בין פלסמידים לכרומוזומים כדי לקדם עוד יותר את התפשטות ההתנגדות.
מנגנונים להתנגדות לתרופות
ישנם מספר מנגנונים נפוצים לעמידות לתרופות, אשר מסוכמים באיור\(\PageIndex{1}\). מנגנונים אלה כוללים שינוי אנזימטי של התרופה, שינוי המטרה האנטי-מיקרוביאלית ומניעת חדירה או הצטברות של תרופות.
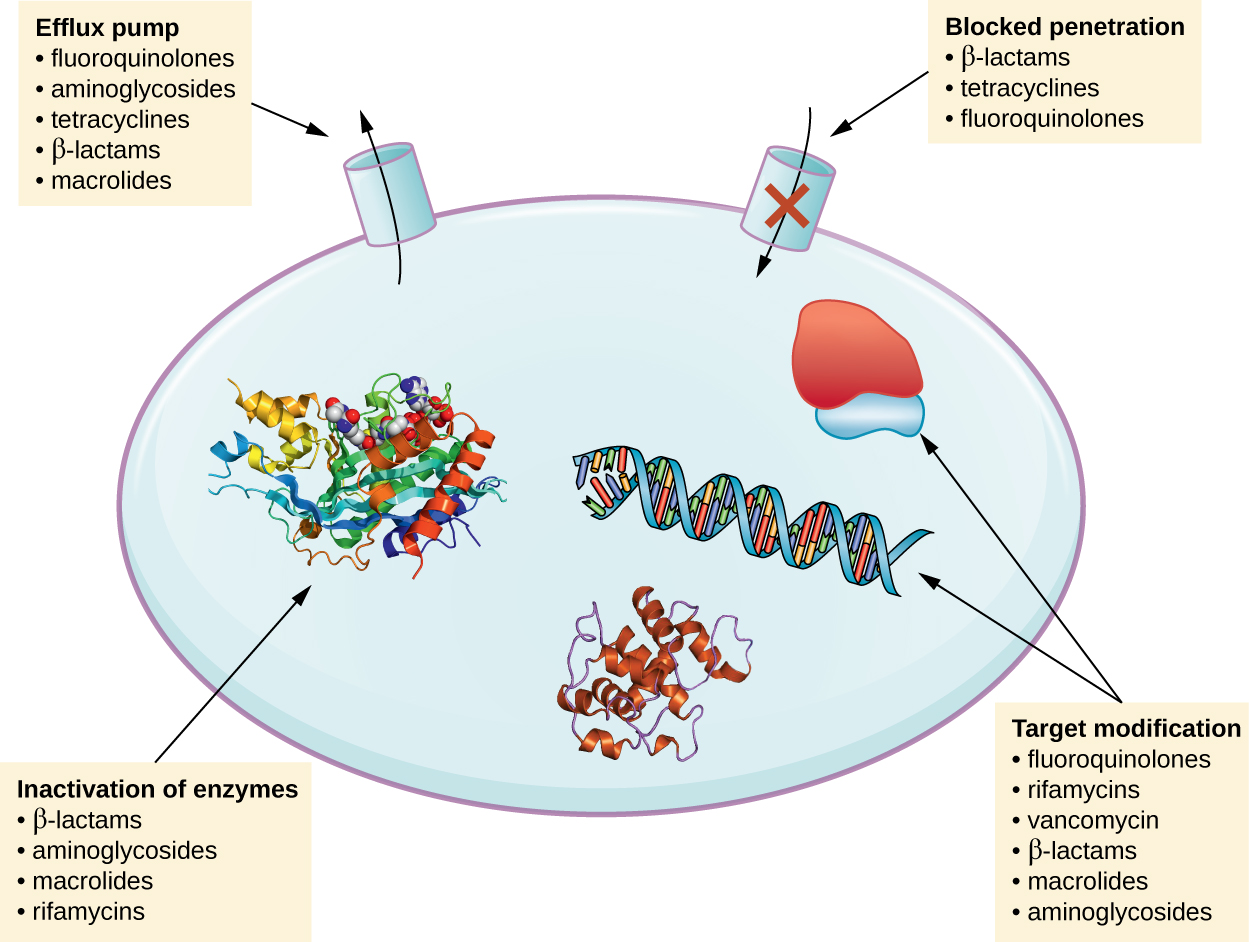
שינוי או השבתה של תרופות
גנים של עמידות עשויים לקודד לאנזימים שמשנים כימית חומר אנטי-מיקרוביאלי, ובכך משביתים אותו, או הורסים חומר אנטי-מיקרוביאלי באמצעות הידרוליזה. עמידות לסוגים רבים של מיקרוביאלים מתרחשת באמצעות מנגנון זה. לדוגמה, עמידות לאמינוגליקוזיד יכולה להתרחש באמצעות העברה אנזימטית של קבוצות כימיות למולקולת התרופה, ופוגעת בקשירת התרופה למטרה החיידקית שלה. עבור β-lactams, עמידות לחיידקים יכולה לכלול הידרוליזה אנזימטית של הקשר β-lactam בתוך טבעת β-lactam של מולקולת התרופה. לאחר שבירת הקשר β-lactam, התרופה מאבדת את פעילותה האנטיבקטריאלית. מנגנון התנגדות זה מתווך על ידי β-lactamases, שהם המנגנון הנפוץ ביותר של עמידות β-lactam. השבתה של ריפמפין מתרחשת בדרך כלל באמצעות גליקוזילציה, זרחון או ריבוזילציה של אדנוסין דיפוספט (ADP), ועמידות בפני מקרולידים ולינקוסאמידים יכולה להתרחש גם עקב השבתה אנזימטית של התרופה או שינוי.
מניעת ספיגה סלולרית או זרימה
חיידקים עשויים לפתח מנגנוני עמידות הכוללים עיכוב הצטברות של תרופה אנטי-מיקרוביאלית, אשר לאחר מכן מונעת מהתרופה להגיע ליעד הסלולרי שלה. אסטרטגיה זו נפוצה בקרב פתוגנים גרם שליליים ויכולה לכלול שינויים בהרכב השומנים של הממברנה החיצונית, סלקטיביות תעלות פורין ו/או ריכוזי תעלות פורין. לדוגמה, מנגנון נפוץ של עמידות לקרבפנם בקרב Pseudomonas aeruginosa הוא הפחתת כמות הפורין OPRD שלו, שהוא פורטל הכניסה העיקרי לקרבפנים דרך הממברנה החיצונית של פתוגן זה. בנוסף, חיידקים פתוגניים גרם חיוביים וגרם שליליים רבים מייצרים משאבות זרימה המעבירות באופן פעיל תרופה אנטי-מיקרוביאלית אל מחוץ לתא ומונעות הצטברות של תרופה לרמה שתהיה אנטיבקטריאלית. לדוגמה, עמידות ל-β-lactams, tetracyclines ו-fluoroquinolones מתרחשת בדרך כלל באמצעות זרימה פעילה אל מחוץ לתא, וזה די נפוץ שלמשאבת זרימה אחת יש את היכולת להעביר מספר סוגים של חומרים אנטי-מיקרוביאליים.
שינוי יעד
מכיוון שלתרופות אנטי-מיקרוביאליות יש מטרות מאוד ספציפיות, שינויים מבניים ביעדים אלה יכולים למנוע קשירת תרופות, מה שהופך את התרופה ללא יעילה. באמצעות מוטציות ספונטניות בגנים המקודדים למטרות תרופות אנטיבקטריאליות, לחיידקים יש יתרון אבולוציוני המאפשר להם לפתח עמידות לתרופות. מנגנון זה של התפתחות ההתנגדות הוא די נפוץ. שינויים גנטיים המשפיעים על האתר הפעיל של חלבונים המחייבים פניצילין (PBPs) יכולים לעכב את הקישור של תרופות β-lactam ולספק עמידות לתרופות מרובות בתוך מחלקה זו. מנגנון זה נפוץ מאוד בקרב זנים של Streptococcus pneumoniae, המשנים את ה- PBPs שלהם באמצעות מנגנונים גנטיים. לעומת זאת, זנים של Staphylococcus aureus מפתחים עמידות למתיצילין (MRSA) באמצעות רכישת PBP חדש בעל זיקה נמוכה, במקום לשנות מבנית את ה- PBPs הקיימים שלהם. לא רק ש- PBP החדש בעל זיקה נמוכה מספק עמידות למתיצילין, אלא שהוא מספק עמידות כמעט לכל תרופות β-lactam, למעט הצפלוספורינים החדשים מהדור החמישי שתוכננו במיוחד להרוג MRSA. דוגמאות נוספות לאסטרטגיית התנגדות זו כוללות שינויים
- יחידות משנה ריבוזום, המספקות עמידות למקרולידים, טטרציקלינים ואמינוגליקוזידים;
- מבנה ליפופוליסכריד (LPS), המספק עמידות לפולימיקסינים;
- RNA פולימראז, המספק עמידות לריפמפין;
- DNA gyrase, המספק עמידות בפני פלואורוקווינולונים;
- אנזימים מטבוליים, המספקים עמידות לתרופות סולפה, סולפונים וטרימתופרים; ו
- שרשראות פפטיד של יחידת משנה פפטידוגליקן, המספקות עמידות לגליקופפטידים.
ייצור יתר של יעד או מעקף אנזימטי
כאשר תרופה אנטי-מיקרוביאלית מתפקדת כאנטי-מטבוליט, המכוונת לאנזים ספציפי כדי לעכב את פעילותו, ישנן דרכים נוספות שבהן עלולה להתרחש עמידות מיקרוביאלית. ראשית, החיידק עלול לייצר יתר על המידה את אנזים המטרה כך שיש כמות מספקת של אנזים נטול מיקרוביאלי כדי לבצע את התגובה האנזימטית הנכונה. שנית, התא החיידקי עשוי לפתח מעקף העוקף את הצורך באנזים המטרה התפקודי. שתי האסטרטגיות הללו נמצאו כמנגנונים של עמידות לסולפונמיד. עמידות לוונקומיצין בקרב S. aureus הוכח ככרוך בירידה בהצמדה צולבת של שרשראות פפטידים בדופן התא החיידקי, המספקת עלייה ביעדים של ונקומיצין להיקשר אליהם בדופן התא החיצונית. קשירה מוגברת של ונקומיצין בדופן התא החיצונית מספקת חסימה המונעת ממולקולות תרופות חופשיות לחדור למקום שבו הן יכולות לחסום סינתזה חדשה של דופן התא.
חיקוי יעד
מנגנון עמידות שהתגלה לאחרונה הנקרא חיקוי מטרה כרוך בייצור חלבונים הקושרים ומפרקים תרופות, ומונעים מהתרופות להיקשר למטרה שלהן. לדוגמה, שחפת Mycobacterium מייצרת חלבון עם חזרות פנטפפטיד קבועות שנראה כי הוא מחקה את מבנה ה- DNA. חלבון זה קושר פלואורוקווינולונים, מעכב אותם ומונע מהם להיקשר ל-DNA, ומספק עמידות לשחפת לפלואורוקווינולונים. חלבונים המחקים את אתר A של הריבוזום החיידקי נמצאו תורמים גם לעמידות לאמינוגליקוזידים. 1
תרגיל \(\PageIndex{1}\)
ציין מספר מנגנונים לעמידות לתרופות.
חיידקים עמידים לריבוי תרופות והתנגדות צולבת
מנקודת מבט קלינית, החששות הגדולים ביותר שלנו הם חיידקים עמידים לריבוי תרופות (MDR) ועמידות צולבת. MDRs ידועים בכינויו "superbugs" ונושאים מנגנון התנגדות אחד או יותר, מה שהופך אותם לעמידים בפני חומרים אנטי-מיקרוביאליים מרובים. בהתנגדות צולבת, מנגנון התנגדות יחיד מעניק עמידות לתרופות אנטי-מיקרוביאליות מרובות. לדוגמה, משאבת זרימה שיכולה לייצא תרופות אנטי-מיקרוביאליות מרובות היא דרך נפוצה לחיידקים להיות עמידים לתרופות מרובות באמצעות מנגנון עמידות יחיד. בשנים האחרונות צצו כמה חיידקי-על חשובים מבחינה קלינית, וה- CDC מדווח כי סופרבוגים אחראים ליותר מ -2 מיליון זיהומים בארה"ב מדי שנה, וכתוצאה מכך לפחות 23,000 הרוגים. 2 כמה מחיידקי העל שנדונו בסעיפים הבאים זכו לכינוי הפתוגנים של ESKAPE. ראשי תיבות זה מתייחס לשמות הפתוגנים (Enterococcus faecium, סטפילוקוקוס אאורוס, קלבסיאלה דלקת ריאות, Acinetobacter baumannii, Pseudomonas aeruginosa ו- Enterobacter spp.) אך זה מתאים גם לכך שפתוגנים אלה מסוגלים "לברוח" מצורות קונבנציונאליות רבות של טיפול אנטי-מיקרוביאלי. ככאלה, זיהומים על ידי פתוגנים של ESKAPE יכולים להיות קשים לטיפול והם גורמים למספר רב של זיהומים נוזוקומיאליים.
סטפילוקוקוס אאורוס עמיד למתיצילין (MRSA)
מתיצילין, פניצילין חצי סינתטי, תוכנן להתנגד לאי-אקטיבציה על ידי β-lactamases. לרוע המזל, זמן קצר לאחר הכנסת מתיצילין לפרקטיקה הקלינית, זנים עמידים למתיצילין של S. aureus הופיעו והחלו להתפשט. מנגנון ההתנגדות, רכישת PBP חדש בעל זיקה נמוכה, סיפק S. aureus עם עמידות לכל β-lactams הזמינים. זנים של עמיד למתיצילין S. aureus (MRSA) הם פתוגנים אופורטוניסטיים נפוצים ודאגה מיוחדת לדלקות עור ופצעים אחרים, אך עלולים גם לגרום לדלקת ריאות וספטימיה. למרות שבמקור הייתה בעיה במסגרות הבריאות (MRSA שנרכש על ידי בית חולים [HA-MRSA]), זיהומי MRSA נרכשים כעת גם באמצעות מגע עם חברים מזוהמים בציבור הרחב, הנקראים MRSA הקשורים לקהילה (CA-MRSA). כשליש מהאוכלוסייה נושאים S. aureus כחבר במיקרוביוטה האף הרגילה שלהם ללא מחלה, וכ -6% מהזנים הללו עמידים למתיצילין. 3 4
חומצה קלבולנית: העוזר הקטן של פניצילין
עם כניסתו של פניצילין בתחילת שנות הארבעים, והייצור ההמוני שלאחר מכן, החברה החלה לחשוב על אנטיביוטיקה כתרופות פלא למגוון רחב של מחלות זיהומיות. לרוע המזל, כבר בשנת 1945 תועדה לראשונה עמידות לפניצילין והחלה להתפשט. יותר מ -90% מהבידודים הקליניים הנוכחיים של S. aureus עמידים בפני פניצילין. 5
למרות שפיתוח תרופות אנטי-מיקרוביאליות חדשות הוא פתרון אחד לבעיה זו, מדענים בחנו גישות חדשות, כולל פיתוח תרכובות המפעילות מנגנוני עמידות. התפתחות חומצה קלבולנית מייצגת דוגמה מוקדמת לאסטרטגיה זו. חומצה קלבולנית היא מולקולה המיוצרת על ידי החיידק סטרפטוקוקוס clavuligerus. הוא מכיל טבעת β-lactam, מה שהופך אותו לדומה מבחינה מבנית לפניצילין ו- β-lactams אחרים, אך אינו מראה יעילות קלינית כאשר הוא מנוהל בכוחות עצמו. במקום זאת, חומצה קלבולנית נקשרת באופן בלתי הפיך בתוך האתר הפעיל של β-lactamases ומונעת מהם להשבית פניצילין מנוהל.
חומצה קלבולנית פותחה לראשונה בשנות השבעים ושווקה המונית בשילוב עם אמוקסיצילין החל משנות השמונים תחת שם המותג אוגמנטין. כפי שקורה בדרך כלל, עד מהרה הופיעה עמידות לשילוב החומצה האמוקסיצילין-קלבולנית. עמידות נובעת לרוב מחיידקים המגבירים את הייצור של β-lactamase שלהם ומציפים את ההשפעות המעכבות של חומצה קלבולנית, המוטנטים את β-lactamase שלהם כך שהיא כבר לא מעוכבת על ידי חומצה קלבולנית, או מרכישת β-lactamase חדש שאינו מעוכב על ידי חומצה clavulanic. למרות חששות ההתנגדות הגוברים, חומצה קלבולנית ומעכבי β-lactamase קשורים (sulbactam ו- tazobactam) מייצגים אסטרטגיה חדשה וחשובה: פיתוח תרכובות המעכבות ישירות אנזימים המעניקים עמידות מיקרוביאלית.
אנטרוקוקים עמידים לוונקומיצין וסטפילוקוקוס אאורוס
Vancomycin יעיל רק כנגד אורגניזמים חיוביים לגרם, והוא משמש לטיפול בדלקות פצעים, דלקות ספיגה, אנדוקרדיטיס ודלקת קרום המוח הנגרמות על ידי פתוגנים העמידים לאנטיביוטיקה אחרת. זה נחשב לאחד מקווי ההגנה האחרונים מפני זיהומים עמידים כאלה, כולל MRSA. עם עליית העמידות לאנטיביוטיקה בשנות ה-70 וה-80, השימוש בוונקומיצין גדל, ואין זה מפתיע שראינו את הופעתם והתפשטותם של אנטרוקוקים עמידים לוונקומיצין (VRE), עמידים לוונקומיצין S. aureus (VRSA) ו-Vancomycin ביניים S. aureus (VISA). מנגנון העמידות לוונקומיצין בקרב אנטרוקוקים הוא שינוי מטרה הכולל שינוי מבני במרכיב הפפטיד של יחידות המשנה של הפפטידוגליקן, המונע את קישור הוונקומיצין. זנים אלה מופצים בדרך כלל בקרב חולים במסגרות קליניות על ידי מגע עם עובדי שירותי בריאות ומשטחים מזוהמים וציוד רפואי.
זני VISA ו- VRSA נבדלים זה מזה במנגנון ההתנגדות ובמידת ההתנגדות שכל מנגנון מעניק. זני VISA מפגינים עמידות בינונית, עם ריכוז מעכב מינימלי (MIC) של 4-8 מיקרוגרם/מ"ל, והמנגנון כרוך בעלייה ביעדי הוונקומיצין. זני VISA מפחיתים את ההצלבה של שרשראות פפטידים בדופן התא, ומספקים עלייה במטרות הוונקומיצין הלוכדות ונקומיצין בדופן התא החיצונית. לעומת זאת, זני VRSA רוכשים עמידות לוונקומיצין באמצעות העברה אופקית של גנים עמידות מ-VRE, הזדמנות הניתנת אצל אנשים שנדבקו יחד עם VRE ו-MRSA. VRSA מפגינים רמת התנגדות גבוהה יותר, עם מיקרופונים של 16 מיקרוגרם/מ"ל ומעלה. 6 במקרה של כל שלושת סוגי החיידקים העמידים לוונקומיצין, יש צורך בזיהוי קליני מהיר כך שניתן יהיה ליישם נהלים מתאימים להגבלת התפשטות. האוקסזולידינונים כמו linezolid שימושיים לטיפול בפתוגנים עמידים לוונקומיצין, אופורטוניסטים, כמו גם MRSA.
ספקטרום מורחב β-lactamase המייצר פתוגנים גראם שליליים
פתוגנים גראם שליליים המייצרים β-lactamases בספקטרום מורחב (ESBLs) מראים עמידות הרבה מעבר לפניצילינים בלבד. הספקטרום של β-lactams שהופעל על ידי ESBLs מספק עמידות לכל הפניצילינים, הצפלוספורינים, המונובקטמים ושילובי מעכבי β-lactamase, אך לא לקרבפנמים. דאגה גדולה עוד יותר היא שהגנים המקודדים ל- ESBLs נמצאים בדרך כלל על פלסמידים ניידים המכילים גם גנים לעמידות לתרופות אחרות (למשל, פלואורוקווינולונים, אמינוגליקוזידים, טטרציקלינים), ועשויים להתפשט בקלות לחיידקים אחרים על ידי העברת גנים אופקית. חיידקים עמידים לריבוי תרופות אלה הם חברים במיקרוביוטה במעי של אנשים מסוימים, אך הם גם גורמים חשובים לזיהומים אופורטוניסטיים בקרב חולים המאושפזים, מהם הם יכולים להתפשט לאנשים אחרים.
חיידקים גראם-שליליים עמידים לקרבפנם
התרחשותם של עמידות לקרבפנם Enterobacteriaceae (CRE) ועמידות לקרבפנם בקרב חיידקים גרם שליליים אחרים (למשל, P. aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophila) היא דאגה גוברת בתחום הבריאות. פתוגנים אלה מפתחים עמידות לקרבפנמים באמצעות מגוון מנגנונים, כולל ייצור של קרבפנמזות (β-lactamases רחב-ספקטרום המבטלות את כל β-lactams, כולל קרבפנמים), זרימה פעילה של קרבפנמים אל מחוץ לתא ו/או מניעת כניסת קרבפנם דרך תעלות פורין. בדומה לחששות עם ESBLs, פתוגנים עמידים לקרבפנם, גרם שליליים, עמידים בדרך כלל בפני מספר סוגים של אנטיבקטריאלים, וחלקם אף פיתחו עמידות פאן (עמידות לכל האנטיבקטריאלים הזמינים). זיהומים עם פתוגנים עמידים לקרבפנם, גרם שליליים מתרחשים בדרך כלל במסגרות בריאות באמצעות אינטראקציה עם אנשים מזוהמים או מכשירים רפואיים, או כתוצאה מניתוח.
שחפת מיקובקטריום עמידה בפני תרופות
הופעתה של שחפת Mycobacterium עמידה לריבוי תרופות (MDR-TB) ושחפת Mycobacterium עמידה לתרופות (XDR-TB) מעוררת גם דאגה עולמית משמעותית. זני MDR-TB עמידים הן לריפמפין והן לאיזוניאזיד, שילוב התרופות שנקבע בדרך כלל לטיפול בשחפת. זני XDR-TB עמידים בנוסף לכל פלואורוקווינולון ולפחות אחת משלוש תרופות אחרות (amikacin, kanamycin או capreomycin) המשמשות כקו טיפול שני, מה שמותיר לחולים אלה מעט מאוד אפשרויות טיפול. שני סוגי הפתוגנים בעייתיים במיוחד בקרב אנשים מדוכאי חיסון, כולל אלה הסובלים מהידבקות ב- HIV. התפתחות העמידות בזנים אלה נובעת לעתים קרובות משימוש לא נכון בתרופות אנטי-מיקרוביאליות לטיפול בשחפת, בחירה לעמידות.
תרגיל \(\PageIndex{2}\)
כיצד עמידות לתרופות מובילה לסופרבוגים?
למידע נוסף על 18 האיומים העמידים לתרופות בארה"ב, בקר באתר ה- CDC.
חקלאות במפעל והתנגדות לסמים
למרות שגידול בעלי חיים הוא כבר מזמן חלק מרכזי בחקלאות באמריקה, עליית פעולות האכלה מרוכזות של בעלי חיים (CAFO) מאז שנות החמישים הביאה לכמה סוגיות סביבתיות חדשות, כולל זיהום מים ואוויר בפסולת ביולוגית, וסוגיות אתיות בנוגע לזכויות בעלי חיים קשורות גם לגידול בעלי חיים בדרך זו. בנוסף, הגידול ב- CAFO כרוך בשימוש נרחב בתרופות אנטי מיקרוביאליות בגידול בעלי חיים. תרופות אנטי-מיקרוביאליות משמשות למניעת התפתחות של מחלות זיהומיות ברבעים הקרובים של CAFO; עם זאת, רוב התרופות האנטי-מיקרוביאליות המשמשות בחקלאות מפעלים נועדו לקידום צמיחה - במילים אחרות, לגידול בעלי חיים גדולים יותר.
המנגנון העומד בבסיס הצמיחה המשופרת הזו נותר לא ברור. אנטיביוטיקה זו לא בהכרח זהה לאלה המשמשים קלינית לבני אדם, אך הם קשורים מבחינה מבנית לתרופות המשמשות לבני אדם. כתוצאה מכך, שימוש בתרופות אנטי-מיקרוביאליות בבעלי חיים יכול לבחור בעמידות לאנטי-מיקרוביאלית, כאשר חיידקים עמידים אלה הופכים עמידים בפני צולבים לתרופות המשמשות בדרך כלל בבני אדם. לדוגמה, נראה כי השימוש בטילוסין בבעלי חיים בוחר לחיידקים עמידים גם בפני מקרולידים אחרים, כולל אריתרומיצין, הנפוץ בבני אדם.
ריכוזי זני החיידקים העמידים לתרופות הנוצרים על ידי CAFO גדלים במים ובאדמה המקיפים את החוות הללו. אם הם אינם פתוגניים ישירות בבני אדם, חיידקים עמידים אלה עשויים לשמש מאגר של אלמנטים גנטיים ניידים שיכולים להעביר גנים עמידים לפתוגנים אנושיים. למרבה המזל, תהליך הבישול בדרך כלל משבית את כל התרופות האנטי-מיקרוביאליות שנותרו בבשר, כך שבני אדם בדרך כלל אינם בולעים ישירות את התרופות הללו. עם זאת, אנשים רבים קוראים לשימוש מושכל יותר בתרופות אלה, ואולי גובים מחקלאים דמי משתמש כדי להפחית את השימוש ללא הבחנה. למעשה, בשנת 2012 פרסם ה- FDA הנחיות לחקלאים אשר מבטלים מרצונם את השימוש בתרופות אנטי-מיקרוביאליות למעט בפיקוח וטרינרי ובמידת הצורך כדי להבטיח את בריאות בעלי החיים. למרות שהמעקב אחר ההנחיות הוא וולונטרי בשלב זה, ה- FDA אכן ממליץ על מה שהוא מכנה שימוש "נבון" בתרופות אנטי-מיקרוביאליות בבעלי חיים המייצרים מזון במאמץ להפחית את העמידות לאנטי-מיקרוביאלית.
מיקוד קליני: חלק 3
לרוע המזל, דלקת בדרכי השתן של מריסה לא נפתרה עם טיפול בציפרופלוקסצין. בדיקות מעבדה הראו כי הזיהום שלה נגרם על ידי זן של Klebsiella pneumoniae עם עמידות מיקרוביאלית משמעותית. פרופיל העמידות של זה K. pneumoniae כלל עמידות למחלקת הקרבפנם של אנטיבקטריאלים, קבוצה של β-lactams השמורה בדרך כלל לטיפול בחיידקים עמידים מאוד. K. pneumoniae הוא מוט אופורטוניסטי, מכוסה, גרם שלילי שעשוי להיות חבר במיקרוביוטה התקינה של מערכת העיכול, אך עלול גם לגרום למספר מחלות, כולל דלקת ריאות ו- UTI.
בדיקות מעבדה ספציפיות שחיפשו ייצור קרבפנמאז בוצעו בדגימות של מריסה וחזרו חיוביות. בהתבסס על תוצאה זו, בשילוב עם ההיסטוריה הבריאותית שלה, נחשד ייצור של קרבפנמאז המכונה מטאלו-β-lactamase בניו דלהי (NDM). למרות שמקורו של ה-NDM carbapenemase אינו ידוע לחלוטין, לחולים רבים שנדבקו בזנים המכילים NDM יש היסטוריית נסיעות הכוללת אשפוזים בהודו או במדינות הסביבה.
תרגיל \(\PageIndex{1}\)
כיצד יקבעו הרופאים אילו סוגים של תרופות אנטי-מיקרוביאליות יש לתת?
מושגי מפתח וסיכום
- עמידות לאנטי-מיקרוביאלית נמצאת במגמת עלייה והיא תוצאה של בחירה של זנים עמידים לתרופות בסביבות קליניות, שימוש יתר ושימוש לרעה באנטיבקטריאלים, שימוש במינונים תת-טיפוליים של תרופות אנטיבקטריאליות ועמידה לקויה של המטופלים בטיפולים תרופתיים אנטיבקטריאליים.
- גנים של עמידות לתרופות נישאים לעתים קרובות על פלסמידים או בטרנספוזונים שיכולים לעבור העברה אנכית בקלות ובין חיידקים באמצעות העברת גנים אופקית.
- אופנים נפוצים של עמידות לתרופות אנטי-מיקרוביאליות כוללים שינוי או השבתה של תרופות, מניעת ספיגה או זרימה תאית, שינוי מטרה, ייצור יתר של מטרה או מעקף אנזימטי וחיקוי מטרה.
- צצים זנים מיקרוביאליים בעייתיים המראים עמידות נרחבת לאנטי-מיקרוביאלית; רבים מהזנים הללו יכולים להתגורר כחברים במיקרוביוטה הרגילה אצל אנשים אך גם יכולים לגרום לזיהום אופורטוניסטי. העברת רבים מהזנים המיקרוביאליים העמידים ביותר הללו מתרחשת לעתים קרובות במסגרות קליניות, אך יכולה גם להיות נרכשת בקהילה.
הערות שוליים
- די.ה. פונג 1, בבוקר ברגהויס. "הפקרות מצע של אנזים עמידות לאנטיביוטיקה של אמינוגליקוזיד באמצעות חיקוי מטרה." כתב העת אמבו 21 מס '10 (2002) :2323—2331.
- 2 מרכזים לבקרת מחלות ומניעתן. "עמידות לאנטיביוטיקה/מיקרוביאלית." http://www.cdc.gov/drugresistance/index.html. גישה ל -2 ביוני 2016.
- 3 א. ס קלוקה ואח '. "רגישות לתרופות שחפת עמידות לתרופות ובדיקות אבחון מולקולריות: סקירת הספרות. כתב העת האמריקאי למדעי הרפואה 345 מס '2 (2013): 143—148.
- 4 מרכזים לבקרת מחלות ומניעתן. "סטפילוקוקוס אאורוס עמיד למתיצילין (MRSA): מידע כללי על MRSA בקהילה." http://www.cdc.gov/mrsa/community/index.html. גישה ל -2 ביוני 2016
- 5 F.D. לואי. "עמידות אנטי-מיקרוביאלית: הדוגמה של סטפילוקוקוס אאורוס." כתב העת לחקירה קלינית 111 מס '9 (2003) :1265—1273.
- 6 מרכזים לבקרת מחלות ומניעתן. "זיהומים הקשורים לבריאות (HIA): מידע כללי על VISA/VRSA." www.cdc.gov/HAI/אורגניזמים/vis... visa_vrsa.html. גישה ל -2 ביוני 2016.


