2.2: מים
- Page ID
- 208898
האם תהית אי פעם מדוע מדענים מבלים זמן בחיפוש אחר מים בכוכבי לכת אחרים? הסיבה לכך היא שמים חיוניים לחיים; אפילו עקבות זעירים ממנו בכוכב אחר יכולים להצביע על כך שחיים יכולים או היו קיימים בכוכב הלכת ההוא. מים הם אחת המולקולות הנפוצות יותר בתאים חיים וזו הקריטית ביותר לחיים כפי שאנו מכירים אותם. כ- 60-70 אחוז מגופך מורכב ממים. בלי זה, החיים פשוט לא היו קיימים.
מים הם קוטביים
אטומי המימן והחמצן בתוך מולקולות המים יוצרים קשרים קוולנטיים קוטביים. האלקטרונים המשותפים מבלים יותר זמן הקשור לאטום החמצן מאשר לאטומי מימן. אין מטען כולל למולקולת מים, אך יש מטען חיובי קל על כל אטום מימן ומטען שלילי קל על אטום החמצן. בגלל מטענים אלה, אטומי המימן החיוביים מעט דוחים זה את זה ויוצרים את הצורה הייחודית הנראית באיור 2.1.6. כל מולקולת מים מושכת מולקולות מים אחרות בגלל המטענים החיוביים והשליליים בחלקים השונים של המולקולה. מים מושכים גם מולקולות קוטביות אחרות (כגון סוכרים) ויוצרים קשרי מימן. כאשר חומר יוצר בקלות קשרי מימן עם מים, הוא יכול להתמוסס במים ומכונה הידרופילי ("אוהב מים"). קשרי מימן אינם נוצרים בקלות עם חומרים לא קוטביים כמו שמנים ושומנים (איור\(\PageIndex{1}\)). תרכובות לא קוטביות אלו הינן הידרופוביות ("חוששות מים") ולא יתמוססו במים.

מים מייצבי טמפרטורה
קשרי המימן במים מאפשרים לו לספוג ולשחרר אנרגיית חום לאט יותר מחומרים רבים אחרים. טמפרטורה היא מדד לתנועה (אנרגיה קינטית) של מולקולות. ככל שהתנועה עולה, האנרגיה גבוהה יותר ולכן הטמפרטורה גבוהה יותר. מים סופגים אנרגיה רבה לפני שהטמפרטורה שלהם עולה. אנרגיה מוגברת משבשת את קשרי המימן בין מולקולות מים. מכיוון שניתן ליצור ולהפריע לקשרים אלו במהירות, מים סופגים עלייה באנרגיה והטמפרטורה משתנה באופן מינימלי בלבד. המשמעות היא שמים ממתנים את שינויי הטמפרטורה בתוך אורגניזמים ובסביבתם. ככל שנמשכת קלט האנרגיה, האיזון בין היווצרות קשרי מימן והרס מתנדנד לכיוון צד ההרס. יותר קשרים נשברים ממה שנוצרים. תהליך זה מביא לשחרור מולקולות מים בודדות על פני הנוזל (כגון גוף מים, עלים של צמח או עור של אורגניזם) בתהליך הנקרא אידוי. אידוי זיעה, שהוא 90 אחוז מים, מאפשר קירור של אורגניזם, מכיוון ששבירת קשרי מימן דורשת הזנת אנרגיה ומוציאה חום מהגוף.
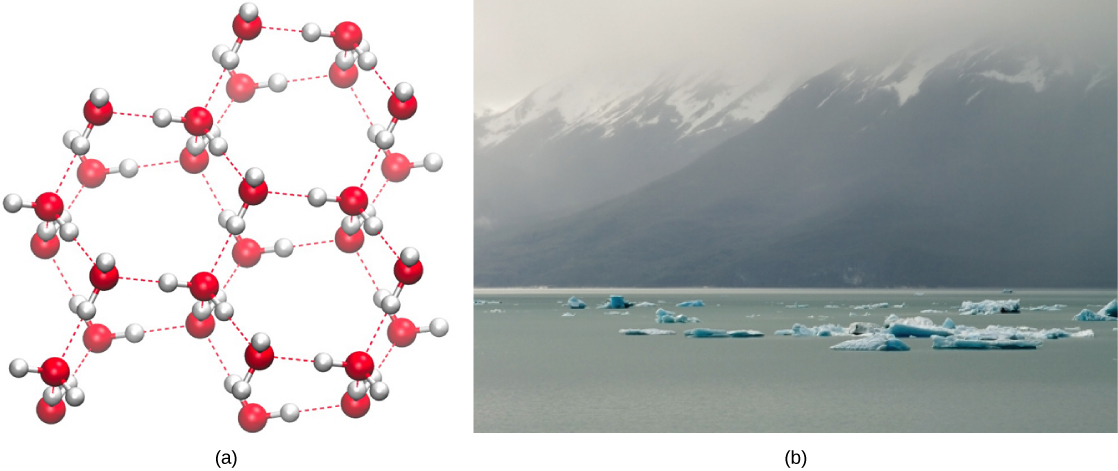
לעומת זאת, ככל שהתנועה המולקולרית יורדת והטמפרטורות יורדות, קיימת פחות אנרגיה לשבירת קשרי המימן בין מולקולות המים. קשרים אלה נשארים שלמים ומתחילים ליצור מבנה קשיח דמוי סריג (למשל קרח) (איור \(\PageIndex{2}\) א). כשהוא קפוא, הקרח פחות צפוף ממים נוזליים (המולקולות רחוקות זו מזו). המשמעות היא שקרח צף על פני גוף מים (איור \(\PageIndex{2}\) ב). באגמים, בבריכות ובאוקיינוסים, קרח ייווצר על פני המים, ויוצר מחסום מבודד כדי להגן על בעלי החיים והצומח שמתחת מפני קפיאה במים. אם זה לא היה קורה, צמחים ובעלי חיים החיים במים היו קופאים בגוש קרח ולא יכלו לנוע בחופשיות, מה שהופך את החיים בטמפרטורות קרות לקשים או בלתי אפשריים.
מושגים בפעולה

לחץ כאן לצפייה באנימציה תלת מימדית של מבנה סריג קרח. (אשראי: תמונה שנוצרה על ידי ג'יין וויטני באמצעות תוכנת דינמיקה מולקולרית חזותית (VMD) 1)
מים הם ממס מצוין
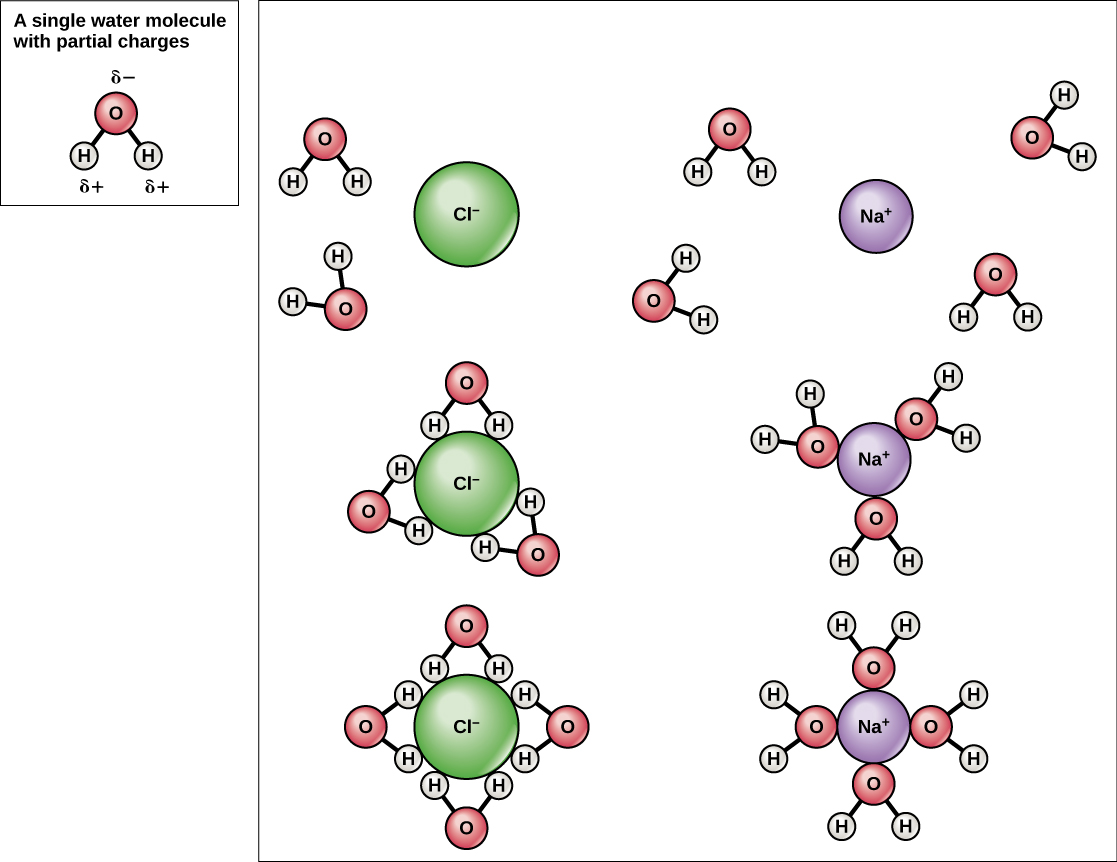
מכיוון שהמים הם קוטביים, עם מטענים חיוביים ושליליים קלים, תרכובות יוניות ומולקולות קוטביות יכולות להתמוסס בהם בקלות. מים הם, אם כן, מה שמכונה ממס - חומר המסוגל להמיס חומר אחר. החלקיקים הטעונים ייצרו קשרי מימן עם שכבה מסביב של מולקולות מים. זה מכונה כדור של הידרציה ומשמש לשמירה על החלקיקים מופרדים או מפוזרים במים. במקרה של מלח שולחן (NaCl) מעורבב במים (איור\(\PageIndex{3}\)), יוני הנתרן והכלוריד נפרדים, או מתנתקים, במים, ונוצרים כדורי הידרציה סביב היונים. יון נתרן טעון חיובי מוקף במטענים שליליים חלקית של אטומי חמצן במולקולות מים. יון כלוריד טעון שלילי מוקף במטענים החיוביים חלקית של אטומי מימן במולקולות מים. תחומי הידרציה אלה מכונים גם קליפות הידרציה. הקוטביות של מולקולת המים הופכת אותה לממס יעיל וחשובה בתפקידיה הרבים במערכות חיות.
מים מלוכדים
האם אי פעם מילאת כוס מים עד החלק העליון ואז הוספת לאט לאט עוד כמה טיפות? לפני שהם עולים על גדותיהם, המים יוצרים למעשה צורה דמוית כיפה מעל שפת הזכוכית. מים אלה יכולים להישאר מעל הזכוכית בגלל תכונת הלכידות. בלכידות, מולקולות מים נמשכות זו לזו (בגלל קשר מימן), ושומרות את המולקולות יחד בממשק הנוזל-אוויר (גז), אם כי אין יותר מקום בכוס. לכידות מולידה מתח פנים, יכולתו של חומר לעמוד בקרע כאשר הוא ממוקם תחת מתח או לחץ. כשאתה מפיל פיסת נייר קטנה על טיפת מים, הנייר צף על גבי טיפת המים, אם כי החפץ צפוף יותר (כבד יותר) מהמים. זה קורה בגלל מתח הפנים שנוצר על ידי מולקולות המים. לכידות ומתח פני השטח שומרים על מולקולות המים שלמות והפריט צף למעלה. אפשר אפילו "לצוף" מחט פלדה על גבי כוס מים אם מניחים אותה בעדינות, מבלי לשבור את מתח הפנים (איור\(\PageIndex{4}\)).

כוחות מלוכדים אלה קשורים גם לתכונת ההדבקה של המים, או למשיכה בין מולקולות מים למולקולות אחרות. זה נצפה כאשר מים "מטפסים" במעלה קש המונח בכוס מים. תבחין כי נראה שהמים גבוהים יותר בצידי הקש מאשר באמצע. הסיבה לכך היא שמולקולות המים נמשכות לקש ולכן נצמדות אליו.
כוחות מלוכדים ודביקים חשובים לקיום החיים. לדוגמה, בגלל כוחות אלה, מים יכולים לזרום מהשורשים לצמרות הצמחים כדי להאכיל את הצמח.
מושג בפעולה
למידע נוסף על מים, בקר במכון הגיאולוגי האמריקאי למדעי המים לבתי ספר: הכל על מים! אתר אינטרנט.
מאגרים, pH, חומצות ובסיסים
ה- pH של תמיסה הוא מדד לחומציות או לבסיסיות שלה. ככל הנראה השתמשת בנייר לקמוס, נייר שטופל בצבע טבעי מסיס במים, כך שהוא יכול לשמש כמחוון pH, כדי לבדוק כמה חומצה או בסיס (בסיסיות) קיימים בתמיסה. אולי אפילו השתמשת בכמה כדי לוודא שהמים בבריכת שחייה חיצונית מטופלים כראוי. בשני המקרים, בדיקת pH זו מודדת את כמות יוני המימן הקיימת בתמיסה נתונה. ריכוזים גבוהים של יוני מימן מניבים pH נמוך, בעוד שרמות נמוכות של יוני מימן גורמות ל- pH גבוה. הריכוז הכולל של יוני מימן קשור הפוך ל-pH שלו וניתן למדוד אותו בסולם ה-pH (איור\(\PageIndex{5}\)). לכן, ככל שיש יותר יוני מימן, כך ה- pH נמוך יותר; לעומת זאת, ככל שפחות יוני מימן, כך ה- pH גבוה יותר.
סולם ה-pH נע בין 0 ל-14. שינוי של יחידה אחת בסולם ה- pH מייצג שינוי בריכוז יוני המימן בפקטור 10, שינוי בשתי יחידות מייצג שינוי בריכוז יוני המימן בפקטור 100. לפיכך, שינויים קטנים ב- pH מייצגים שינויים גדולים בריכוזי יוני המימן. מים טהורים הם ניטרליים. זה לא חומצי ולא בסיסי, ויש לו pH של 7.0. כל דבר מתחת ל -7.0 (שנע בין 0.0 ל -6.9) הוא חומצי, וכל דבר מעל 7.0 (בין 7.1 ל -14.0) הוא אלקליין. הדם בעורקים שלך מעט בסיסי (pH = 7.4). הסביבה בבטן שלך חומצית מאוד (pH = 1 עד 2). מיץ תפוזים הוא חומצי קל (pH = כ -3.5), ואילו סודה לשתייה היא בסיסית (pH = 9.0).

חומצות הן חומרים המספקים יוני מימן (H +) ו- pH נמוך יותר, ואילו בסיסים מספקים יוני הידרוקסיד (OH -) ומעלים את ה- pH. ככל שהחומצה חזקה יותר, כך היא תורמת בקלות רבה יותר H +. לדוגמה, חומצה הידרוכלורית ומיץ לימון הם חומציים מאוד ומוותרים בקלות על H+ כאשר מוסיפים אותם למים. לעומת זאת, בסיסים הם אותם חומרים התורמים בקלות OH -. יוני OH - משתלבים עם H+ כדי לייצר מים, מה שמעלה את ה- pH של החומר. נתרן הידרוקסיד וחומרי ניקוי ביתיים רבים הם בסיסיים מאוד ומוותרים על OH - במהירות כאשר הם מונחים במים, ובכך מעלים את ה- pH.
רוב התאים בגופנו פועלים בתוך חלון צר מאוד בסולם ה- pH, בדרך כלל נע בין 7.2 ל -7.6. אם ה- pH של הגוף נמצא מחוץ לטווח זה, מערכת הנשימה תקלה, כמו גם איברים אחרים בגוף. תאים כבר לא מתפקדים כראוי, וחלבונים יתפרקו. סטייה מחוץ לטווח ה- pH יכולה לגרום לתרדמת או אפילו לגרום למוות.
אז איך זה שאנחנו יכולים לבלוע או לשאוף חומרים חומציים או בסיסיים ולא למות? מאגרים הם המפתח. מאגרים סופגים בקלות עודף H+ או OH -, ושומרים על ה- pH של הגוף בקפידה בטווח הצר הנ"ל. פחמן דו חמצני הוא חלק ממערכת חיץ בולטת בגוף האדם; זה שומר על ה- pH בטווח הנכון. מערכת חיץ זו כוללת חומצה פחמנית (H 2 CO 3) ואניון ביקרבונט (HCO 3 -). אם יותר מדי H+נכנס לגוף, ביקרבונט ישתלב עם ה - H+ ליצירת חומצה פחמנית ויגביל את הירידה ב- pH. באופן דומה, אם יותר מדי OH - מוכנס למערכת, חומצה פחמנית תתנתק במהירות ליוני ביקרבונט ו - H+. יוני H+ יכולים להשתלב עם יוני OH -, ולהגביל את העלייה ב- pH. בעוד שחומצה פחמנית היא מוצר חשוב בתגובה זו, נוכחותה חולפת מכיוון שהחומצה הפחמנית משתחררת מהגוף כגז פחמן דו חמצני בכל פעם שאנו נושמים. ללא מערכת חיץ זו, ה- pH בגופנו היה משתנה יותר מדי ולא היינו מצליחים לשרוד.
סיכום
למים תכונות רבות הקריטיות לשמירה על החיים. הוא קוטבי, ומאפשר יצירת קשרי מימן, המאפשרים ליונים ומולקולות קוטביות אחרות להתמוסס במים. לכן, מים הוא ממס מעולה. קשרי המימן בין מולקולות המים מעניקים למים את היכולת להחזיק חום טוב יותר מחומרים רבים אחרים. ככל שהטמפרטורה עולה, קשרי המימן בין המים נשברים ומתחדשים ללא הרף, ומאפשרים לטמפרטורה הכוללת להישאר יציבה, אם כי אנרגיה מוגברת מתווספת למערכת. כוחות הלכידות של המים מאפשרים את המאפיין של מתח פני השטח. כל המאפיינים הייחודיים הללו של מים חשובים בכימיה של אורגניזמים חיים.
ה- pH של תמיסה הוא מדד לריכוז יוני המימן בתמיסה. תמיסה עם מספר גבוה של יוני מימן היא חומצית ובעלת ערך pH נמוך. תמיסה עם מספר גבוה של יוני הידרוקסיד היא בסיסית ובעלת ערך pH גבוה. סולם ה- pH נע בין 0 ל -14, כאשר pH של 7 הוא ניטרלי. מאגרים הם פתרונות הממתנים שינויי pH כאשר מוסיפים חומצה או בסיס למערכת החיץ. מאגרים חשובים במערכות ביולוגיות בגלל יכולתם לשמור על תנאי pH קבועים.
הערות שוליים
- 1 המפרי, וו., דאלקה, א' ושולטן, ק', "VMD — דינמיקה מולקולרית חזותית", ג'יי מולק. גרפיקה, 1996, כרך 14, עמ '33-38. http://www.ks.uiuc.edu/Research/vmd/
רשימת מילים
- חומצה
- חומר התורם יוני מימן ולכן מוריד את ה- pH
- הידבקות
- המשיכה בין מולקולות מים למולקולות של חומר אחר
- בסיס
- חומר הסופג יוני מימן ולכן מעלה את ה- pH
- חיץ
- תמיסה המתנגדת לשינוי ב- pH על ידי ספיגה או שחרור של יוני מימן או הידרוקסיד
- לכידות
- הכוחות הבין-מולקולריים בין מולקולות מים הנגרמות על ידי הטבע הקוטבי של המים; יוצר מתח פנים
- אידוי
- שחרור מולקולות מים ממים נוזליים ליצירת אדי מים
- הידרופילי
- מתאר חומר שמתמוסס במים; אוהב מים
- הידרופובי
- מתאר חומר שאינו מתמוסס במים; מפחד מים
- נייר לקמוס
- נייר סינון שטופל בצבע מסיס במים טבעי כך שהוא יכול לשמש כמחוון pH
- סולם pH
- סולם הנע בין 0 ל -14 המודד את הריכוז המשוער של יוני מימן של חומר
- ממס
- חומר המסוגל להמיס חומר אחר
- מתח פני השטח
- הכוח המגובש על פני גוף נוזל המונע מהמולקולות להיפרד
- טמפרטורה
- מדד לתנועה מולקולרית


