2.1: אבני הבניין של מולקולות
- Page ID
- 208886
ברמה הבסיסית ביותר, החיים מורכבים מחומר. החומר תופס מקום ויש לו מסה. כל החומר מורכב מאלמנטים, חומרים שלא ניתן לפרק או להפוך כימית לחומרים אחרים. כל יסוד עשוי מאטומים, שלכל אחד מהם מספר קבוע של פרוטונים ותכונות ייחודיות. בסך הכל הוגדרו 118 יסודות; עם זאת, רק 92 מתרחשים באופן טבעי, ופחות מ -30 נמצאים בתאים חיים. 26 האלמנטים הנותרים אינם יציבים ולכן אינם קיימים זמן רב מאוד או שהם תיאורטיים וטרם התגלו.
כל יסוד מסומן על ידי הסמל הכימי שלו (כגון H, N, O, C ו- Na), ובעל תכונות ייחודיות. מאפיינים ייחודיים אלה מאפשרים לאלמנטים לשלב ולהיקשר זה עם זה בדרכים ספציפיות.
אטומים
אטום הוא המרכיב הקטן ביותר של יסוד השומר על כל התכונות הכימיות של אותו יסוד. לדוגמה, לאטום מימן אחד יש את כל התכונות של היסוד מימן, כמו שהוא קיים כגז בטמפרטורת החדר, והוא נקשר לחמצן ליצירת מולקולת מים. לא ניתן לפרק אטומי מימן למשהו קטן יותר תוך שמירה על תכונות המימן. אם אטום מימן היה מתפרק לחלקיקים תת-אטומיים, כבר לא היו לו תכונות של מימן.
ברמה הבסיסית ביותר, כל האורגניזמים עשויים משילוב של אלמנטים. הם מכילים אטומים המתחברים יחד ליצירת מולקולות. באורגניזמים רב-תאיים, כמו בעלי חיים, מולקולות יכולות לקיים אינטראקציה ליצירת תאים המשתלבים ליצירת רקמות המרכיבות איברים. שילובים אלה נמשכים עד שנוצרים אורגניזמים רב-תאיים שלמים.
כל האטומים מכילים פרוטונים, אלקטרונים ונויטרונים (איור\(\PageIndex{1}\)). היוצא מן הכלל היחיד הוא מימן (H), העשוי מפרוטון אחד ואלקטרון אחד. פרוטון הוא חלקיק טעון חיובי השוכן בגרעין (ליבת האטום) של אטום ובעל מסה של 1 ומטען של +1. אלקטרון הוא חלקיק טעון שלילי הנע בחלל סביב הגרעין. במילים אחרות, הוא שוכן מחוץ לגרעין. יש לו מסה זניחה ויש לו מטען של -1.
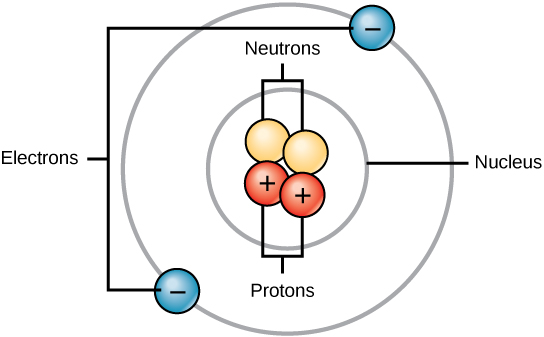
נויטרונים, כמו פרוטונים, שוכנים בגרעין האטום. יש להם מסה של 1 וללא תשלום. המטענים החיוביים (פרוטונים) ושליליים (אלקטרונים) מאזנים זה את זה באטום ניטרלי, שיש לו מטען אפס נטו.
מכיוון שלפרוטונים ונויטרונים יש מסה של 1, המסה של אטום שווה למספר הפרוטונים והנייטרונים של אותו אטום. מספר האלקטרונים אינו גורם למסה הכוללת, מכיוון שהמסה שלהם כל כך קטנה.
כאמור, לכל רכיב יש מאפיינים ייחודיים משלו. כל אחד מהם מכיל מספר שונה של פרוטונים ונויטרונים, מה שמקנה לו מספר אטומי ומספר מסה משלו. המספר האטומי של יסוד שווה למספר הפרוטונים שהיסוד מכיל. מספר המסה, או המסה האטומית, הוא מספר הפרוטונים בתוספת מספר הנויטרונים של אותו יסוד. לכן, ניתן לקבוע את מספר הנייטרונים על ידי הפחתת המספר האטומי ממספר המסה.
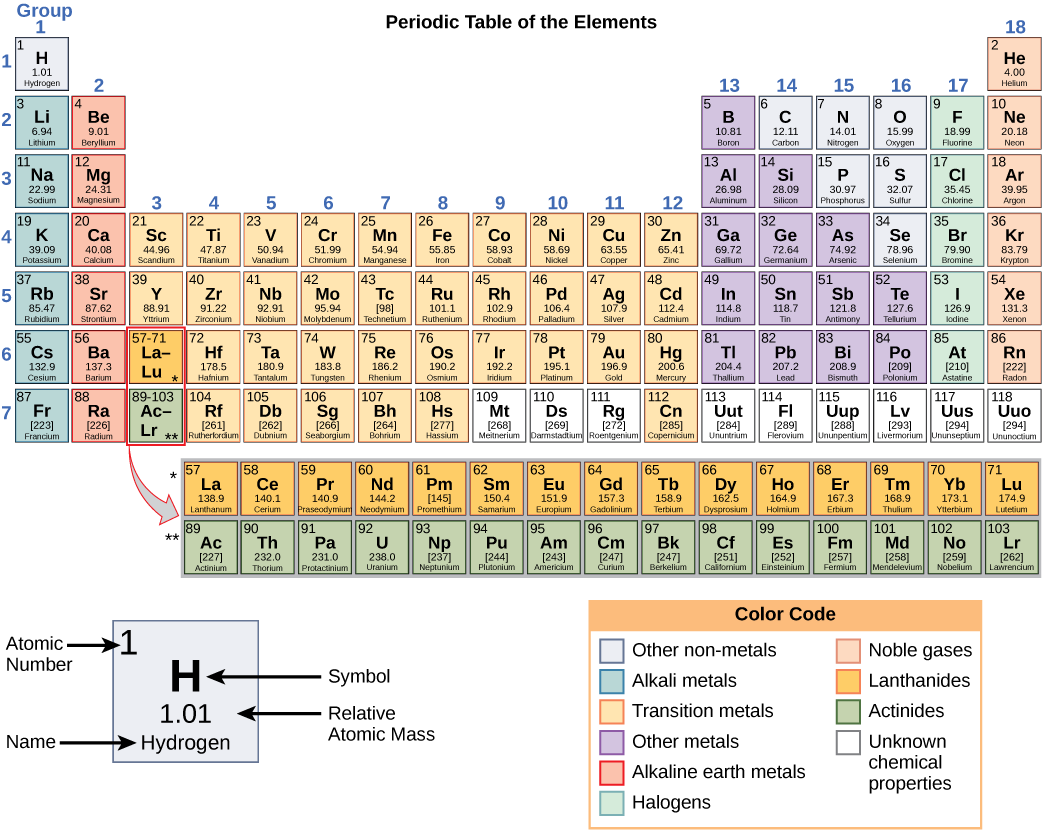
מספרים אלה מספקים מידע על האלמנטים וכיצד הם יגיבו בשילוב. לאלמנטים שונים יש נקודות התכה ורתיחה שונות, והם נמצאים במצבים שונים (נוזל, מוצק או גז) בטמפרטורת החדר. הם גם משלבים בדרכים שונות. חלקם יוצרים סוגים ספציפיים של איגרות חוב, ואילו אחרים לא. אופן השילוב שלהם מבוסס על מספר האלקטרונים הקיימים. בגלל מאפיינים אלה, היסודות מסודרים בטבלת היסודות המחזורית, תרשים של היסודות הכולל את המספר האטומי והמסה האטומית היחסית של כל יסוד. הטבלה המחזורית מספקת גם מידע מרכזי על תכונות האלמנטים (איור\(\PageIndex{2}\)) - המצוין לעתים קרובות על ידי קידוד צבע. סידור הטבלה מראה גם כיצד האלקטרונים בכל יסוד מאורגנים ומספק פרטים חשובים על האופן שבו אטומים יגיבו זה עם זה ליצירת מולקולות.
איזוטופים הם צורות שונות של אותו יסוד שיש להם מספר זהה של פרוטונים, אך מספר שונה של נויטרונים. לחלק מהיסודות, כמו פחמן, אשלגן ואורניום, יש איזוטופים טבעיים. פחמן-12, האיזוטופ הנפוץ ביותר של פחמן, מכיל שישה פרוטונים ושישה נויטרונים. לכן יש לו מספר מסה של 12 (שישה פרוטונים ושישה נויטרונים) ומספר אטומי של 6 (מה שהופך אותו לפחמן). פחמן-14 מכיל שישה פרוטונים ושמונה נויטרונים. לכן יש לו מספר מסה של 14 (שישה פרוטונים ושמונה נויטרונים) ומספר אטומי של 6, כלומר הוא עדיין היסוד פחמן. שתי צורות חלופיות אלה של פחמן הן איזוטופים. איזוטופים מסוימים אינם יציבים ויאבדו פרוטונים, חלקיקים תת אטומיים אחרים או אנרגיה ליצירת יסודות יציבים יותר. אלה נקראים איזוטופים רדיואקטיביים או רדיואיזוטופים.
חיבור אמנות
כמה נויטרונים יש (K) אשלגן 39 ואשלגן -40, בהתאמה?
אבולוציה בפעולה: תיארוך פחמן
פחמן-14 (14 C) הוא רדיואיזוטופ טבעי שנוצר באטמוספירה על ידי קרניים קוסמיות. זהו תהליך מתמשך, כך שתמיד נוצרים יותר 14 C. ככל שמתפתח אורגניזם חי, הרמה היחסית של 14 C בגופו שווה לריכוז של 14 C באטמוספרה. כאשר אורגניזם מת, הוא כבר לא בולע 14 צלזיוס, כך שהיחס יירד. 14 C מתפרק ל- 14 N בתהליך הנקרא ריקבון בטא; הוא פולט אנרגיה בתהליך איטי זה.
לאחר כ -5,730 שנים, רק מחצית מהריכוז ההתחלתי של 14 C יומר ל -14 N. הזמן שלוקח למחצית מהריכוז המקורי של איזוטופ להתפרק לצורתו היציבה יותר נקרא מחצית החיים שלו. מכיוון שזמן מחצית החיים של 14 C ארוך, הוא משמש ליישון חפצים חיים בעבר, כגון מאובנים. באמצעות היחס בין ריכוז 14 C שנמצא באובייקט לכמות 14 C שזוהתה באטמוספירה, ניתן לקבוע את כמות האיזוטופ שטרם התפרק. בהתבסס על כמות זו, ניתן לחשב את גיל המאובן לכ- 50,000 שנה (איור\(\PageIndex{3}\)). איזוטופים עם מחצית חיים ארוכה יותר, כגון אשלגן -40, משמשים לחישוב הגילאים של מאובנים ישנים יותר. באמצעות שימוש בתארוך פחמן, מדענים יכולים לשחזר את האקולוגיה והביוגיאוגרפיה של אורגניזמים החיים במהלך 50,000 השנים האחרונות.

מושג בפעולה
למידע נוסף על אטומים ואיזוטופים, וכיצד ניתן להבחין בין איזוטופ אחד למשנהו, בקר באתר זה והפעל את הסימולציה.
קשרים כימיים
האופן שבו יסודות מתקשרים זה עם זה תלוי באופן סידור האלקטרונים שלהם וכמה פתחים לאלקטרונים קיימים באזור החיצוני ביותר שבו אלקטרונים נמצאים באטום. אלקטרונים קיימים ברמות אנרגיה היוצרות קליפות סביב הגרעין. הקליפה הקרובה ביותר יכולה להכיל עד שני אלקטרונים. הקליפה הקרובה ביותר לגרעין מתמלאת תמיד ראשונה, לפני שניתן למלא כל קליפה אחרת. למימן יש אלקטרון אחד; לכן, יש לו רק נקודה אחת תפוסה בתוך הקליפה הנמוכה ביותר. להליום שני אלקטרונים; לכן הוא יכול למלא לחלוטין את הקליפה הנמוכה ביותר בשני האלקטרונים שלו. אם תסתכל על הטבלה המחזורית, תראה שמימן והליום הם שני היסודות היחידים בשורה הראשונה. הסיבה לכך היא שיש להם רק אלקטרונים בקליפה הראשונה שלהם. מימן והליום הם שני היסודות היחידים שיש להם את הקליפה הנמוכה ביותר וללא קליפות אחרות.
רמות האנרגיה השנייה והשלישית יכולות להכיל עד שמונה אלקטרונים. שמונת האלקטרונים מסודרים בארבעה זוגות ומיקום אחד בכל זוג מתמלא באלקטרון לפני השלמת זוגות כלשהם.
כאשר מסתכלים על הטבלה המחזורית שוב (איור\(\PageIndex{2}\)), תוכלו להבחין כי יש שבע שורות. שורות אלה תואמות את מספר הקליפות שיש לאלמנטים בתוך אותה שורה. לאלמנטים בשורה מסוימת יש מספר גדל והולך של אלקטרונים ככל שהעמודות מתקדמות משמאל לימין. למרות שלכל אלמנט יש מספר זהה של פגזים, לא כל הקליפות מלאות לחלוטין באלקטרונים. אם תסתכל על השורה השנייה בטבלה המחזורית, תמצא ליתיום (Li), בריליום (Be), בורון (B), פחמן (C), חנקן (N), חמצן (O), פלואור (F), וניאון (Ne). לכל אלה יש אלקטרונים שתופסים רק את הקליפות הראשונות והשניות. לליתיום יש רק אלקטרון אחד בקליפה החיצונית ביותר שלו, לבריליום יש שני אלקטרונים, לבורון יש שלושה וכן הלאה, עד שהקליפה כולה מתמלאת בשמונה אלקטרונים, כמו שקורה בניאון.
לא לכל היסודות יש מספיק אלקטרונים כדי למלא את הקליפות החיצוניות ביותר שלהם, אבל אטום הוא הכי יציב כאשר כל מיקומי האלקטרונים בקליפה החיצונית ביותר מלאים. בגלל המשרות הפנויות הללו בקליפות החיצוניות ביותר, אנו רואים היווצרות קשרים כימיים, או אינטראקציות בין שניים או יותר מאותם יסודות או שונים המביאים להיווצרות מולקולות. כדי להשיג יציבות רבה יותר, אטומים נוטים למלא לחלוטין את הקליפות החיצוניות שלהם ויתקשרו עם יסודות אחרים כדי להשיג מטרה זו על ידי שיתוף אלקטרונים, קבלת אלקטרונים מאטום אחר או תרומת אלקטרונים לאטום אחר. מכיוון שהקליפות החיצוניות ביותר של היסודות עם מספרים אטומיים נמוכים (עד סידן, עם מספר אטומי 20) יכולות להכיל שמונה אלקטרונים, זה מכונה כלל האוקטט. אלמנט יכול לתרום, לקבל או לשתף אלקטרונים עם אלמנטים אחרים כדי למלא את הקליפה החיצונית שלו ולעמוד בכלל השמינייה.
כאשר אטום אינו מכיל מספר שווה של פרוטונים ואלקטרונים, הוא נקרא יון. מכיוון שמספר האלקטרונים אינו שווה למספר הפרוטונים, לכל יון יש מטען נטו. יונים חיוביים נוצרים על ידי איבוד אלקטרונים ונקראים קטיונים. יונים שליליים נוצרים על ידי השגת אלקטרונים ונקראים אניונים.
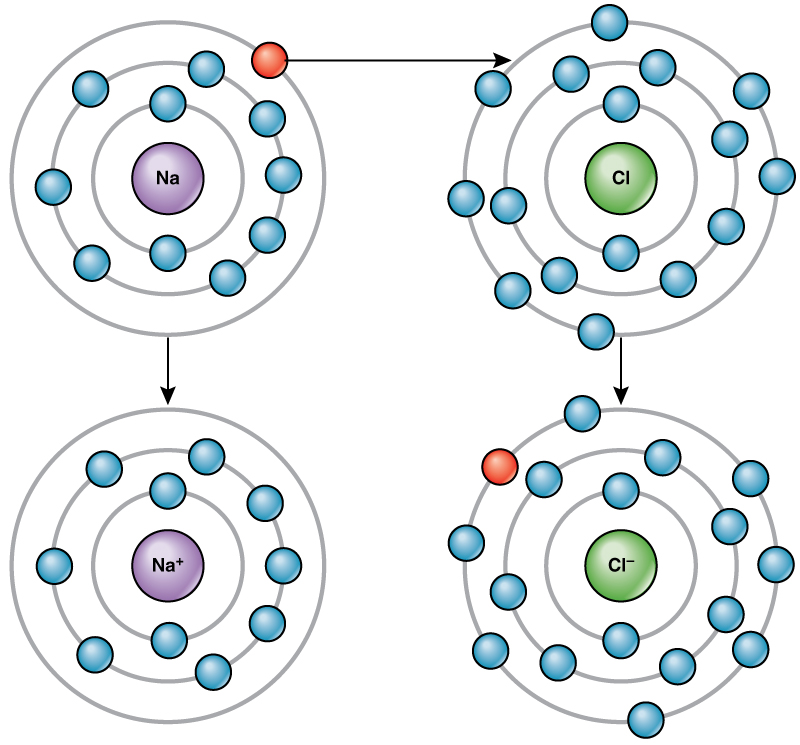
לדוגמה, לנתרן יש רק אלקטרון אחד בקליפה החיצונית ביותר שלו. נתרן לוקח פחות אנרגיה כדי לתרום את האלקטרון האחד הזה מאשר לקבל שבעה אלקטרונים נוספים למילוי הקליפה החיצונית. אם נתרן מאבד אלקטרון, יש לו כעת 11 פרוטונים ורק 10 אלקטרונים, מה שמשאיר אותו עם מטען כולל של +1. זה נקרא כיום יון נתרן.
לאטום הכלור שבעה אלקטרונים במעטפת החיצונית שלו. שוב, חסכוני יותר באנרגיה עבור כלור להשיג אלקטרון אחד מאשר לאבד שבעה. לכן, הוא נוטה להשיג אלקטרון ליצירת יון עם 17 פרוטונים ו -18 אלקטרונים, מה שמקנה לו מטען שלילי נטו (-1). זה נקרא כיום יון כלוריד. תנועה זו של אלקטרונים מאלמנט אחד למשנהו מכונה העברת אלקטרונים. כפי \(\PageIndex{4}\) שממחיש איור, לאטום נתרן (Na) יש רק אלקטרון אחד בקליפה החיצונית ביותר שלו, ואילו לאטום כלור (Cl) יש שבעה אלקטרונים בקליפה החיצונית ביותר שלו. אטום נתרן יתרום את האלקטרון האחד שלו כדי לרוקן את הקליפה שלו, ואטום כלור יקבל את האלקטרון הזה כדי למלא את הקליפה שלו, ויהפוך לכלוריד. שני היונים מספקים כעת את כלל השמינייה ויש להם קונכיות חיצוניות שלמות. מכיוון שמספר האלקטרונים כבר אינו שווה למספר הפרוטונים, כל אחד מהם הוא כעת יון ויש לו מטען +1 (נתרן) או -1 (כלוריד).
איגרות חוב יוניות
ישנם ארבעה סוגים של קשרים או אינטראקציות: אינטראקציות יוניות, קוולנטיות, מימן ואינטראקציות ואן דר ואלס. קשרים יוניים וקוולנטיים הם אינטראקציות חזקות הדורשות קלט אנרגיה גדול יותר כדי להתפרק. כאשר יסוד תורם אלקטרון מהקליפה החיצונית שלו, כמו בדוגמה של אטום הנתרן לעיל, נוצר יון חיובי. האלמנט המקבל את האלקטרון טעון כעת שלילי. מכיוון שמטענים חיוביים ושליליים מושכים, יונים אלה נשארים יחד ויוצרים קשר יוני, או קשר בין יונים. היסודות נקשרים יחד עם האלקטרון מאלמנט אחד השוהים בעיקר עם היסוד השני. כאשר יוני Na + ו- Cl - מתחברים לייצור NaCl, אלקטרון מאטום נתרן נשאר עם שבעת האחרים מאטום הכלור, ויוני הנתרן והכלוריד מושכים זה את זה בסריג של יונים עם מטען אפס נטו.
אגרות חוב קוולנטיות
סוג אחר של קשר כימי חזק בין שני אטומים או יותר הוא קשר קוולנטי. קשרים אלה נוצרים כאשר אלקטרון משותף בין שני יסודות והם הצורה החזקה והנפוצה ביותר של קשר כימי באורגניזמים חיים. קשרים קוולנטיים נוצרים בין היסודות המרכיבים את המולקולות הביולוגיות בתאים שלנו. שלא כמו קשרים יוניים, קשרים קוולנטיים אינם מתנתקים במים.
אטומי המימן והחמצן המתחברים ליצירת מולקולות מים קשורים זה לזה על ידי קשרים קוולנטיים. האלקטרון מאטום המימן מחלק את זמנו בין הקליפה החיצונית של אטום המימן לקליפה החיצונית הלא שלמה של אטום החמצן. כדי למלא לחלוטין את הקליפה החיצונית של אטום חמצן, יש צורך בשני אלקטרונים משני אטומי מימן, ומכאן הכתב "2" ב H 2 O האלקטרונים משותפים בין האטומים, ומחלקים את זמנם ביניהם כדי "למלא" את הקליפה החיצונית של כל אחד מהם. שיתוף זה הוא מצב אנרגיה נמוך יותר עבור כל האטומים המעורבים מאשר אם הם היו קיימים ללא מילוי הקליפות החיצוניות שלהם.
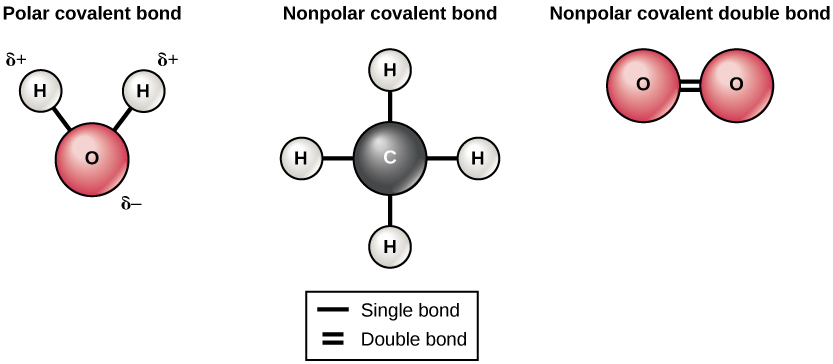
ישנם שני סוגים של קשרים קוולנטיים: קוטביים ולא קוטביים. קשרים קוולנטיים לא קוטביים נוצרים בין שני אטומים מאותו יסוד או בין יסודות שונים החולקים את האלקטרונים באופן שווה. לדוגמה, אטום חמצן יכול להיקשר לאטום חמצן אחר כדי למלא את הקליפות החיצוניות שלהם. קשר זה אינו קוטבי מכיוון שהאלקטרונים יחולקו באופן שווה בין כל אטום חמצן. שני קשרים קוולנטיים נוצרים בין שני אטומי החמצן מכיוון שחמצן דורש שני אלקטרונים משותפים כדי למלא את הקליפה החיצונית ביותר שלו. אטומי חנקן יהוו שלושה קשרים קוולנטיים (הנקראים גם קוולנטיים משולשים) בין שני אטומי חנקן מכיוון שכל אטום חנקן זקוק לשלושה אלקטרונים כדי למלא את הקליפה החיצונית ביותר שלו. דוגמה נוספת לקשר קוולנטי לא קוטבי נמצאת במולקולת המתאן (CH 4). לאטום הפחמן ארבעה אלקטרונים במעטפת החיצונית ביותר שלו והוא זקוק לארבעה נוספים כדי למלא אותו. הוא מקבל את ארבעת אלה מארבעה אטומי מימן, כל אטום מספק אחד. יסודות אלה חולקים את האלקטרונים באופן שווה, ויוצרים ארבעה קשרים קוולנטיים לא קוטביים (איור\(\PageIndex{5}\)).
בקשר קוולנטי קוטבי, האלקטרונים המשותפים לאטומים מבלים יותר זמן קרוב יותר לגרעין אחד מאשר לגרעין השני. בגלל ההתפלגות הלא שוויונית של האלקטרונים בין הגרעינים השונים, מתפתח מטען מעט חיובי (δ+) או מעט שלילי (δ—). הקשרים הקוולנטיים בין אטומי מימן וחמצן במים הם קשרים קוולנטיים קוטביים. האלקטרונים המשותפים מבלים יותר זמן ליד גרעין החמצן, ומעניקים לו מטען שלילי קטן, מאשר הם מבלים ליד גרעיני המימן, ומעניקים למולקולות אלה מטען חיובי קטן.
קשרי מימן
קשרים יוניים וקוולנטיים הם קשרים חזקים הדורשים אנרגיה ניכרת כדי להישבר. עם זאת, לא כל הקשרים בין היסודות הם קשרים יוניים או קוולנטיים. קשרים חלשים יותר יכולים להיווצר גם כן. אלה אטרקציות המתרחשות בין מטענים חיוביים לשליליים שאינם דורשים אנרגיה רבה כדי לשבור. שני קשרים חלשים המתרחשים לעתים קרובות הם קשרי מימן ואינטראקציות ואן דר ואלס. קשרים אלה מולידים את התכונות הייחודיות של המים ואת המבנים הייחודיים של DNA וחלבונים.
כאשר נוצרים קשרים קוולנטיים קוטביים המכילים אטום מימן, לאטום המימן בקשר זה יש מטען מעט חיובי. הסיבה לכך היא שהאלקטרון המשותף נמשך חזק יותר לעבר היסוד השני והרחק מגרעין המימן. מכיוון שאטום המימן חיובי מעט (δ+), הוא יימשך למטענים חלקיים שליליים שכנים (δ—). כאשר זה קורה, מתרחשת אינטראקציה חלשה בין המטען δ+ של אטום המימן של מולקולה אחת לבין המטען δ של המולקולה השנייה. אינטראקציה זו נקראת קשר מימן. סוג זה של קשר נפוץ; לדוגמה, האופי הנוזלי של המים נגרם על ידי קשרי המימן בין מולקולות מים (איור\(\PageIndex{6}\)). קשרי מימן מעניקים למים את התכונות הייחודיות המקיימות חיים. אלמלא קשירת מימן, מים היו גז ולא נוזל בטמפרטורת החדר.
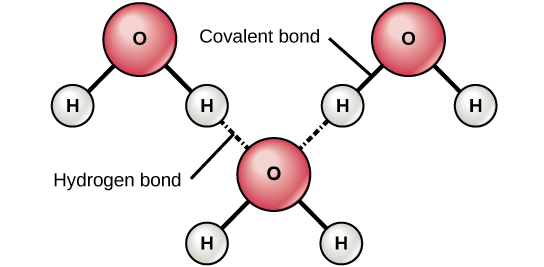
קשרי מימן יכולים להיווצר בין מולקולות שונות והם לא תמיד צריכים לכלול מולקולת מים. אטומי מימן בקשרים קוטביים בתוך כל מולקולה יכולים ליצור קשרים עם מולקולות סמוכות אחרות. לדוגמה, קשרי מימן מחזיקים יחד שני גדילים ארוכים של DNA כדי לתת למולקולת ה-DNA את המבנה הדו-גדילי האופייני לה. קשרי מימן אחראים גם לחלק מהמבנה התלת מימדי של חלבונים.
אינטראקציות של ואן דר ואלס
בדומה לקשרי מימן, אינטראקציות ואן דר ואלס הן אטרקציות חלשות או אינטראקציות בין מולקולות. הם מתרחשים בין אטומים קוטביים, קשורים קוולנטית, במולקולות שונות. חלק מהאטרקציות החלשות הללו נגרמות על ידי מטענים חלקיים זמניים הנוצרים כאשר אלקטרונים נעים סביב גרעין. אינטראקציות חלשות אלה בין מולקולות חשובות במערכות ביולוגיות.
קריירה בפעולה: טכנאי רדיוגרפיה
האם אתה או מישהו שאתה מכיר אי פעם עברת סריקת תהודה מגנטית (MRI), ממוגרפיה או צילום רנטגן? בדיקות אלה מייצרות תמונות של הרקמות והאיברים הרכים שלך (כמו עם MRI או ממוגרפיה) או העצמות שלך (כפי שקורה בצילום רנטגן) באמצעות גלי רדיו או איזוטופים מיוחדים (מסומנים רדיואקטיביים או מסומנים פלואורסצנטית) הנבלעים או מוזרקים לגוף. בדיקות אלה מספקות נתונים לאבחון מחלות על ידי יצירת תמונות של האיברים או מערכת השלד שלך.
הדמיית MRI פועלת על ידי הכפפת גרעיני מימן, הנמצאים בשפע במים ברקמות הרכות, לשדות מגנטיים משתנים, הגורמים להם לפלוט שדה מגנטי משלהם. אות זה נקרא לאחר מכן על ידי חיישנים במכונה ומתפרש על ידי מחשב ליצירת תמונה מפורטת.
כמה טכנולוגים וטכנאי רדיוגרפיה מתמחים בטומוגרפיה ממוחשבת, MRI וממוגרפיה. הם מייצרים סרטים או תמונות של הגוף המסייעים לאנשי מקצוע רפואיים לבחון ולאבחן. רדיולוגים עובדים ישירות עם מטופלים, מסבירים מכונות, מכינים אותם לבחינות ומבטיחים שגופם או חלקי גופם ממוקמים נכון כדי לייצר את התמונות הדרושות. לאחר מכן רופאים או רדיולוגים מנתחים את תוצאות הבדיקה.
טכנאי רדיוגרפיה יכולים לעבוד בבתי חולים, במשרדי רופאים או במרכזי הדמיה מיוחדים. הכשרה להיות טכנאי רדיוגרפיה מתרחשת בבתי חולים, מכללות ואוניברסיטאות המציעים תעודות, תארים עמיתים או תואר ראשון ברדיוגרפיה.
סיכום
חומר הוא כל דבר שתופס מקום ויש לו מסה. זה מורכב מאטומים של יסודות שונים. לכל 92 היסודות המופיעים באופן טבעי יש איכויות ייחודיות המאפשרות להם להשתלב בדרכים שונות ליצירת תרכובות או מולקולות. אטומים, המורכבים מפרוטונים, נויטרונים ואלקטרונים, הם היחידות הקטנות ביותר של יסוד השומרות על כל התכונות של אותו יסוד. ניתן לתרום או לחלוק אלקטרונים בין אטומים ליצירת קשרים, כולל קשרים יוניים, קוולנטיים ומימן, כמו גם אינטראקציות של ואן דר ואלס.
חיבורי אמנות
איור\(\PageIndex{2}\): כמה נויטרונים יש (K) אשלגן 39 ואשלגן -40, בהתאמה?
- תשובה
-
אשלגן 39 יש עשרים נויטרונים. לאשלגן -40 יש עשרים ואחד נויטרונים.
רשימת מילים
- אניון
- יון שלילי שנוצר על ידי השגת אלקטרונים
- מספר אטומי
- מספר הפרוטונים באטום
- קטיון
- יון חיובי שנוצר על ידי איבוד אלקטרונים
- קשר כימי
- אינטראקציה בין שניים או יותר מאותם יסודות או שונים המביאה להיווצרות מולקולות
- קשר קוולנטי
- סוג של קשר חזק בין שניים או יותר מאותם יסודות או שונים; נוצר כאשר אלקטרונים משותפים בין יסודות
- אלקטרון
- חלקיק טעון שלילי השוכן מחוץ לגרעין במסלול האלקטרונים; חסר מסה תפקודית ובעל מטען של -1
- העברת אלקטרונים
- תנועת האלקטרונים מאלמנט אחד למשנהו
- יסוד
- אחד מ -118 חומרים ייחודיים שלא ניתן לפרק לחומרים קטנים יותר ולשמור על המאפיין של אותו חומר; לכל יסוד יש מספר מוגדר של פרוטונים ותכונות ייחודיות
- קשר מימן
- קשר חלש בין אטומי מימן טעונים באופן חיובי חלקית לבין יסודות או מולקולות טעונות שליליות חלקית
- יון
- אטום או תרכובת שאינם מכילים מספר שווה של פרוטונים ואלקטרונים, ולכן יש להם מטען נטו
- קשר יוני
- קשר כימי שנוצר בין יונים של מטענים מנוגדים
- איזוטופ
- צורה אחת או יותר של יסוד שיש לו מספר שונה של נויטרונים
- מספר המוני
- מספר הפרוטונים בתוספת נויטרונים באטום
- חומר
- כל דבר שיש לו מסה ותופס מקום
- נויטרון
- חלקיק ללא מטען השוכן בגרעין האטום; יש מסה של 1
- קשר קוולנטי לא קוטבי
- סוג של קשר קוולנטי שנוצר בין אטומים כאשר אלקטרונים מחולקים באופן שווה בין אטומים, וכתוצאה מכך אין אזורים עם מטענים חלקיים כמו בקשרים קוולנטיים קוטביים
- גרעין
- (כימיה) המרכז הצפוף של אטום המורכב מפרוטונים ו (למעט במקרה של אטום מימן) נויטרונים
- כלל שמינייה
- קובע כי הקליפה החיצונית ביותר של יסוד עם מספר אטומי נמוך יכולה להכיל שמונה אלקטרונים
- טבלה מחזורית של אלמנטים
- תרשים ארגוני של אלמנטים, המציין את המספר האטומי ומספר המסה של כל אלמנט; מספק גם מידע מרכזי על תכונות האלמנטים
- קשר קוולנטי קוטבי
- סוג של קשר קוולנטי שבו אלקטרונים נמשכים לכיוון אטום אחד והרחק מאחר, וכתוצאה מכך אזורים טעונים מעט חיוביים ומעט שליליים של המולקולה
- פרוטון
- חלקיק טעון חיובי השוכן בגרעין האטום; יש מסה של 1 ומטען של +1
- איזוטופ רדיואקטיבי
- איזוטופ הפולט באופן ספונטני חלקיקים או אנרגיה ליצירת יסוד יציב יותר
- אינטראקציה של ואן דר ואלס
- משיכה חלשה או אינטראקציה בין מולקולות הנגרמות על ידי אטומים טעונים מעט חיוביים או טעונים מעט שלילי


