10.3: פעילויות אכיפה
- Page ID
- 208223
אכיפה אזרחית
התקנות חייבות להיות ניתנות לאכיפה כדי להיות יעילות, ול- FDA יש הרבה כלים לעידוד ציות. המפתח ל- FDA הוא בריאות ובטיחות הציבור של המוצר. הליכי אכיפה מתקיימים בדרך כלל לאחר שנחשבה בדיקה ל- OAI. הבדיקות, באמצעות מרכזים מתאימים, יכולות להיות כל שנתיים או כפי שצוין על ידי בעיה שה- FDA נודע לה. ישנן שתי קטגוריות רחבות של פעולות אכיפה; אזרחית ופלילית.
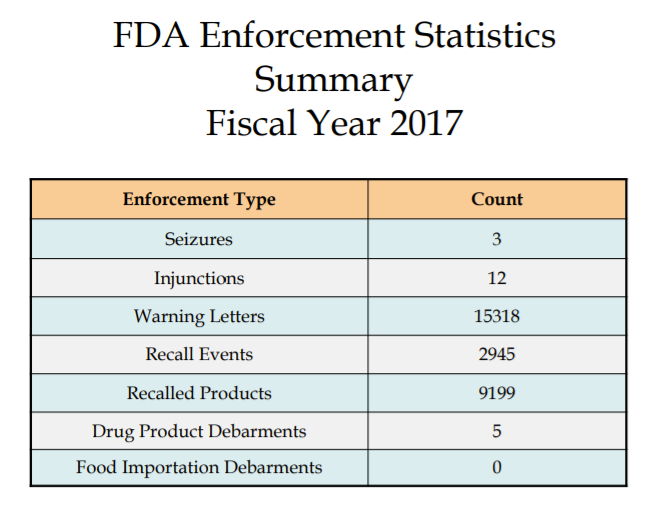
ההנחיות לפעולות האכיפה שה- FDA נוקט ניתן למצוא בדף האינטרנט של בדיקות, ציות, אכיפה וחקירה פלילית (ICECI). ה- FDA מפרסם פעילויות אכיפה בדוחות שנתיים לאתר האינטרנט שלו. תסתכל מסביב ולראות אילו סוגים של פעילויות אכיפה הם הבולטים ביותר. את הנתונים הסטטיסטיים לשנת 2017 ניתן למצוא כאן: https://www.fda.gov/downloads/ICECI/EnforcementActions/UCM592790.pdf
בדיקות
ל- FDA יש את הסמכות החוקית לבדוק חברות תרופות, והוא יכול לעשות זאת ללא הודעה מוקדמת. ההנחיות לבדיקות מתפרסמות בדף האינטרנט של בדיקות, ציות, אכיפה וחקירה פלילית (ICECI). הנחיות בדיקה שונות קובעות סוגי מוצרים שונים. https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-references
- מדריך פעולות בדיקות: www.fda.gov/בדיקות-תאימות-אכיפה-וחקירות-פליליות/בדיקה-הפניות/חקירות-פעולות-ידנית
- מדריכי פיקוח: www.fda.gov/בדיקות-תאימות-אכיפה-וחקירות/פיקוחקים/פיקוח/מדריכי בדיקה
- מדריכי פיקוח חוץ: www.fda.gov/בדיקות-תאימות-אכיפה-וחקירות-פליליות/פיקוח/פיקוח/בדיקות זרות
ה- FDA מבצע בדיקות שגרתיות (כל שנתיים) לצורך עמידה בתקנות CGMP, GLP, GCP ומערכת האיכות. הם גם מבצעים בדיקות ממוקדות המבוססות על אירועי אכיפה אחרים כגון מעקב אחר אירועי זיכרון או מכתבי אזהרה. כאשר ה- FDA נכנס למתקן לבדיקה, הם מספקים את מסמך בקשת הבדיקה (FDA 482) וכן מספקים זיהוי. אם הם מסרבים להיכנס, ה- FDA יכול לקבל צו חיפוש מבית משפט פדרלי.
היקף הבדיקה מבוסס בעיקר על סיבת הביקור וההיסטוריה של המתקן. המגבלות היחידות שיש ל- FDA בבדיקות מתייחסות למידע פיננסי, נתוני מכירות (שאינם קשורים למשלוח), נתוני כוח אדם (שאינם קשורים להכשרה) ונתוני מחקר (שאינם קשורים לאישור מוצרים).
במהלך הבדיקות, ה- FDA בוחן שבע מערכות כדי לקבוע אם הן 'בשליטה':
- אחריות ניהולית
- בקרת עיצוב
- פעולה מתקנת ומונעת (CAPA)
- בקרות ייצור ותהליכים
- רשומות ובקרות לשינוי מסמכים
- בקרות חומרים
- בקרות מתקנים וציוד
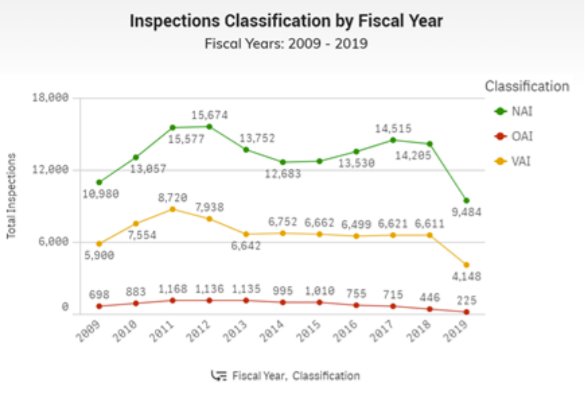
סיווג פיקוח
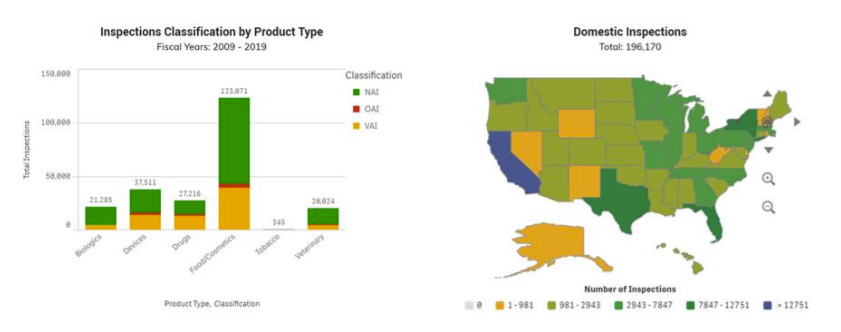
לאחר בדיקה, ה- FDA קובע אם האזורים המוערכים תואמים את החוקים והתקנות החלים. ה- FDA ומאגר סיווג הפיקוח מסווג את הבדיקה לפי כל אזור פרויקט באחת משלוש סיווגים. מאגר סיווג הפיקוח מציג רק בדיקות שנערכו על ידי ה- FDA. www.fda.gov/inspections-תאימות - אכיפה-וחקירות פליליות/הפניית בדיקה/בדיקה-סיווג-מסד נתונים
ה- FDA מבצע בדיקות מדוקדקות של מתקנים המבצעים מחקרי מעבדה לא קליניים כדי לקבוע תאימות לחלק 58 (תרגול מעבדה טוב למחקרי מעבדה לא קליניים) בכותרת 21 של ה- CFR. מחקרי מעבדה לא קליניים הם ניסויים שבהם מאמרי בדיקה נלמדים באופן פרוספקטיבי במערכות בדיקה, כגון בעלי חיים, צמחים, מיקרואורגניזמים בתנאי מעבדה כדי לקבוע את בטיחותם. למידע נוסף כאן: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-references/nonclinical-laboratories-inspected-under-good-laboratory-practices
שלושת סיווגי הבדיקה המוצגים הם:
- לא צוינה פעולה (NAI) שמשמעותה שלא נמצאו תנאים או פרקטיקות מעוררות התנגדות במהלך הבדיקה (או שהתנאים המעוררים התנגדות שנמצאו אינם מצדיקים פעולה רגולטורית נוספת),
- פעולה מרצון צוינה (VAI) שמשמעותה נמצאו תנאים או פרקטיקות מעוררות התנגדות, אך הסוכנות אינה מוכנה לנקוט או להמליץ על כל פעולה מנהלית או רגולטורית, או
- פעולה רשמית מצוינת (OAI), כלומר פעולות רגולטוריות או מנהליות ימליצו.
בדיקות וטופס 483
ניאוף ומיתוג שגוי הן שתי ההפרות הנפוצות ביותר שנמצאו במהלך בדיקה. מתקני תרופות וחברות ביוטכנולוגיה נבדקים מעת לעת על ידי ה- FDA. כל הפרת CGMP שהפקחים מוצאים נרשמת בטפסים, המכונים "483's", ואם אין תגובה לנושאי הציות לתקנות, נשלח מכתב אזהרה רשמי לחברה.
483 הוא תוצאה של בדיקה והודעה על אי ציות לתקנות. זוהי רשימה של פריטים ספציפיים שנראו בסוף הבדיקה ומונפקת על ידי החוקר. לאחר בדיקה, המפקח נפגש עם מנהל המתקנים כדי לטפל בכמה שיותר מהבעיות לפני כתיבת ה- 483. המפקח מציע הזדמנות לתקן מצב מיד לאחר הבדיקה ומסמכים תאימות וסעדים, או פתרונות והסכמים עתידיים. לאחר כתיבת המכתב והתקבל על ידי החברה, יש לחברה 15 ימי עבודה להגיב מרצון ל- 483 בכתב עם תוכנית פעולה. אם ה- 483 שהונפק אינו מתוקן במהירות, ה- FDA יכול להגיב במכתב אזהרה (ראה להלן).
יצוין כי הנפקת טופס 483 אינה אומרת באופן אוטומטי כי חברה אינה עומדת בתאימות GMP. בנוסף, אורך הטופס אינו אינדיקטור אמין לחומרת ההפרות שנצפו. יש לראות את הטופס בצורה ביקורתית, וחברות שמרגישות שקיבלו 483 המכילות תצפיות מפוקפקות על סטיות GMP צריכות לדון בנושא עם המפקח, מנהל המחוז, המנהל האזורי או אפילו מרכז ההנפקה במידת הצורך.
חברות אינן נדרשות להגיב ל- 483. עם זאת, התגובה שלהם מומלץ. אם חברה מקבלת יותר מדי 483s ואינה מספקת ל- FDA תגובות נאותות לטפסים אלה, הם נתונים למכתב אזהרה או אמצעי ענישה נוספים כמפורט להלן.
הקמת דוחות בדיקה
לאחר שה- FDA סוגר בדיקה, הם משחררים דוח הקמת פיקוח (EIR). זהו דו"ח רשמי בכתב המסכם את הממצאים בראיות תומכות. בדוח זה, ה- FDA מסווג את הבדיקה כמצוין ללא פעולה (NAI), אינדיקציה לפעולה מרצון (VAI) או פעולה רשמית שצוינה (OAI). אם צוין OAI, פעילויות אכיפה עשויות להיות רשומות או מתוכננות להגיע. דוחות בדיקה ונתונים: https://datadashboard.fda.gov/ora/cd/inspections.htm
בדיקות ומכתבי אזהרה
כאשר ה- FDA מגלה כי יצרן הפר באופן משמעותי את תקנות ה- FDA, ה- FDA מודיע ליצרן, לרוב, בצורה של מכתב אזהרה. מכתב האזהרה מזהה את ההפרה ומבהיר כי על החברה לתקן את הבעיה ומספק הנחיות ומסגרת זמן לחברה ליידע את ה- FDA על תוכניות התיקון שלה. לאחר מכן ה- FDA בודק כדי לוודא שתיקוני החברה נאותים.
עניינים המתוארים במכתבי אזהרה של ה- FDA עשויים להיות כפופים לאינטראקציה שלאחר מכן בין ה- FDA לבין מקבל המכתב שאולי שינה את הסטטוס הרגולטורי של הנושאים שנדונו במכתב. מכתב אזהרה שהונפק על ידי ה- FDA הוא תקשורת ייעוץ בלתי פורמלית מרצון ומציע לחברה אפשרות לתקן את המצב הרגולטורי. המטרה הכוללת של מכתב אזהרה היא לעודד ציות מרצון. אם הנושא אינו מסכן את הציבור באופן מיידי, ניתן לכתוב מכתב אזהרה לפני אמצעי ענישה אחרים. היבט חשוב במכתב אזהרה הוא קביעת תיעוד של 'הודעה מוקדמת' במהלך הליכים משפטיים. עם זאת, כאשר הוא מונפק, מכתב אזהרה מתפרסם מיד באתר ה- FDA ומשותף בין סוכנויות רגולטוריות.
- צפה במכתבי אזהרה כלליים של ה- FDA: www.fda.gov/בדיקות-תאימות-אכיפה-חקירות פליליות/תאימות-פעולות-ופעילויות/מכתבי אזהרה
- צפה במכתבי אזהרה של ה- FDA לטבק: www.fda.gov/בדיקות-תאימות-אכיפה-חקירות פליליות/מכתבי אזהרה/מכתבי אזהרה/טבק קמעונאי-אזהרה-מכתבי אזהרה
- צפו במכתבי אזהרה לשיווק תרופות ופרסום: www.fda.gov/drugs/אכיפהפעילויות-fda/אזהרה-מכתבים-הודעה-אותיות-חברות פרמצבטיקה
סגירת מכתב אזהרה
ה- FDA רשאי להוציא מכתב סגירה של מכתב אזהרה לאחר השלמת הערכה וקבע כי פעולות מתקנות בוצעו על ידי חברה בתגובה למכתב אזהרה. הפעולות המתקנות חייבות להתבצע ואומתו על ידי ה- FDA, בדרך כלל באמצעות בדיקת מעקב. אם מכתב האזהרה מכיל הפרות שמטבען אינן ניתנות לתיקון, לא יונפק מכתב סגירה. בדיקות עתידיות של ה- FDA ופעילויות רגולטוריות עשויות להעריך עוד יותר את התאמתם וקיימותם של תיקונים אלה. אם יש להבחין בהפרות במהלך בדיקה שלאחר מכן או באמצעים אחרים, ניתן לנקוט בפעולות אכיפה ללא הודעה מוקדמת.
בדיקות ומכתבים ללא כותרת
מכתבים ללא כותרת הם צורת התקשורת הפחות קשה עם ה- FDA. בדומה למכתבי אזהרה, המכתבים ללא כותרת יכולים להודיע לחברה על הפרה שעשויה שלא להגיע לסף סוגיה רגולטורית. שלא כמו מכתב אזהרה, מכתב ללא כותרת אינו כולל הצהרה המזהירה את הפרט או המשרד כי אי תיקון מיידי של ההפרה עלול לגרום לפעולות אכיפה. F עם זאת, חברות מעודדות לטפל בכל בעיה שכן הדבר מהווה "הודעה מוקדמת" וזו הסיבה שעליך להגיב. https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/issuance-untitled-letters. למידע נוסף על אזהרה ומכתבים ללא כותרת: https://www.fda.gov/media/71878/download
בדיקות והודעות לעיתונות
ה- FDA יכול גם להנפיק הודעות לעיתונות שליליות או הודעות רישום פדרליות. במקרה של פגם חמור, ה- FDA יכול להעמיד לדין פלילי, לתפוס חומרים ולבצע צווי מניעה נגד חברה ואנשים פרטיים. (fda.gov). הודעות לעיתונות עדכניות: www.fda.gov/inspections-תאימות-אכיפה-חקירות פליליות/חקירות פליליות/הודעות לעיתונות
התקפים
אם חברה מסרבת להיזכר, ה- FDA יכול להביא נגדו תיק תפיסה או צו מניעה לטיפול בהפרות גם אם המוצרים אינם פגומים. לאחר מכן, הם יכולים לעתור לבית המשפט לצו המאפשר לפקידים פדרליים להשתלט על סמים "מזויפים" ולהשמידם. תהליך זה מאפשר ל- FDA למנוע באופן מיידי מחברה להפיץ תרופות פגומות ועלולות להזיק לצרכנים. גם תיקי תפיסה וגם צו מניעה גורמים לעתים קרובות לצווי בית משפט המחייבים חברות לנקוט בצעדים רבים לתיקון הפרות. צעדים אלה עשויים לכלול שכירת מומחים חיצוניים שיסייעו בפתרון הבעיה, כתיבת נהלים חדשים והכשרת עובדים. במקרים מסוימים, הפרות עלולות להפוך לתיקים פליליים, מה שמאפשר ל- FDA לבקש קנסות וזמן מאסר.
צווי מניעה
אם חברה מפרה את חוק ה- FD&C, ה- FDA רשאי להגיש צו מניעה נגד החברה. צו מניעה זה הוא הליך שיפוטי אזרחי ומשמש בדרך כלל כאשר מזוהה סכנה בריאותית משמעותית עם מוצר. ה- FDA עשוי לבקש צו הרחקה זמני, צו מניעה זמני או צו מניעה קבוע. המפתח כאן הוא שה- FDA יוכל לפעול במהירות בכדי לגרום למוצר להפסיק להגיע ללקוחות ללא ריקול (אשר ל- FDA אין סמכות במקרים מסוימים). ה- FDA משתמש גם בשיטת אכיפה זו אם החברה התעלמה מכתבי אזהרה חוזרים ונשנים. אם החברה מטפלת בסוגיות, ניתן להסיר את צו ההרחקה הזמני.
עונשים על כסף אזרחי
לחוק ה- FD&C, כמו גם ל- PHSA, יש הוראות לעונש כספי אזרחי. הנחיות בנושא CMP ניתנות ב- 21 CFR 17.2. חפש את CFR באתר ה- FDA, ושים לב CMPs הם די קשים! עונשים מסוימים עולים על מיליון דולר בגין עבירות מצטברות.
פסילת חוקרים קליניים
ה- FDA מסדיר מחקרים מדעיים שנועדו לפתח ראיות התומכות בבטיחות ויעילות של תרופות מחקר (בני אדם ובעלי חיים), מוצרים ביולוגיים ומכשירים רפואיים. רופאים ומומחים מוסמכים אחרים ("חוקרים קליניים") המבצעים מחקרים אלה נדרשים לציית לחוקים ולתקנות החלים שנועדו להבטיח את שלמות הנתונים הקליניים עליהם מבוססים אישורי מוצרים, ולמחקר הכולל נבדקים אנושיים, לסייע בהגנה על זכויותיהם, בטיחותם ורווחתם של אותם נבדקים. במצבים מסוימים, בהם ה- FDA טוען שחוקר קליני הפר את התקנות החלות, ה- FDA יכול לפסול חוקר קליני ולמנוע ממנו לספק נתונים קליניים לכל הגשת מוצר. בדרך כלל, מידע על חוקרים קליניים מתקבל באמצעות בדיקת BIMO. https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/clinical-investigators-disqualification-proceedings
ביטול
ל- FDA יש סמכות ביטול של אנשים או חברות מתעשיית התרופות. פירוק פירושו שהם כבר לא יכולים לייצר תרופה מאושרת. חברות מחוסרות אינן יכולות עוד לייצר, ולא להגיש בקשות נוספות לתרופות. בשנת 2018, ה- FDA דחה לראשונה ישות תאגידית. קרא עוד כאן: https://www.federalregister.gov/documents/2018/03/01/2018-04195/meunerie-sawyerville-inc-denial-of-hearing-final-debarment-order.
אנשים שנמחקו יכולים להיות כפופים גם לעונשים על כסף אזרחי. ראה רשימת הוצאות באתר ה- FDA. תשימו לב שזו רשימה ארוכה להחריד! https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/fda-debarment-list-drug-product-applications
אכיפה פלילית
חקירות פליליות נעשות על ידי משרד החקירות הפליליות (OCI). חשוב לזכור שכאשר אנו דנים בתקנות ה- FDA בנושא מזון ותרופות, אנו מתכוונים לחוקים. לחוקי עבירה יש עונשים רבים, שיכולים לנוע בין קנסות לכלא. בדוק את הנמלטים המבוקשים ביותר של ה- FDA כאן: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/criminal-investigations/office-criminal-investigations-most-wanted-fugitives
צו הסכמה
חברות המפרות שוב ושוב את דרישות CGMP עשויות להיאלץ לבצע שינויים באמצעות הוצאת צו הסכמה. צו ההסכמה נחתם על ידי הבכיר בחברה, התובע האמריקאי ובית המשפט המחוזי בארה"ב. הצו מוגש אז לבית המשפט והוא מוגש מאוחר יותר ל- FDA. נאכף על ידי בתי המשפט הפדרליים, גזירות הסכמה כוללות בדרך כלל קנסות, החזרים לממשלה בגין עלויות בדיקה ועונשים על אי ציות. צווי הסכמה יכולים להיות קבועים. עם זאת, אם חברה נענתה, היא יכולה לעתור לבית המשפט להסיר את הצו.
בחן את הידע שלך!
קרא כאן סיפור מובלט באתר OCI: "4 באפריל 2016: תושב קרלסבד לשעבר נכלא למכירה של מכשירים רפואיים "גל אנרגיה" שלא אושרו.
- במה מואשם דוד פרז?
- למה זה בניגוד לחוק? אתה יכול להתייחס לחוק?
- כמה זמן גזר דין הוא קיבל? אם הוא לא קיבל עסקת טיעון ונמצא אשם בבית משפט, כמה זמן היה עונשו המרבי?
- האם אתה מסכים עם האישום והעונש שלו? תסבירי.


