12.3: מיקרופילמנטים של אקטין
- Page ID
- 208460
מיקרופילמנטים ידועים גם בשם חוטי אקטין, אקטין נימה ו- f-actin, והם הניגודים הציטו-שלדיים של חוטי הביניים. גדילים אלה מורכבים מיחידות משנה קטנות של אקטין כדורי (g-actin) הנערמות זו על זו עם נקודות מגע קטנות יחסית. אתה יכול לדמיין שני כדורי טניס, האחד מטושטש והשני מכוסה בווי סקוטש. גם אם אתה דוחף חזק כדי לרסק אותם יחד, אזור המגע בין הכדורים (כלומר השטח הזמין לקשר H בין יחידות משנה) קטן למדי בהשוואה לשטח הפנים הכולל, או לאזור המגע בין יחידות משנה IF. הם יחזיקו יחד, אבל הם יכולים גם להתפרק עם מעט כוח יחסית. השווה זאת עם חוטי ביניים, שעשויים להיות מיוצגים כשני סרטים של ווים או לולאות סקוטש. נדרשת עבודה רבה יותר כדי לפרק אותם. מכיוון שיש פחות קשרי H לשבור, ניתן לפרק את המיקרופילמנטים במהירות רבה, מה שהופך אותו מתאים ליישומים דינמיים במיוחד.
כאשר יחידות המשנה של האקטין מתאחדות ליצירת מיקרופילמנטים, הן מקיימות אינטראקציה כיוונית. כלומר, ליחידות משנה יש "עליון" ו"תחתון ", והחלק העליון של יחידת משנה אחת תמיד מתקשר עם החלק התחתון של אחר. אם נעבור ליחידת המשנה "התחתונה" ביותר של נימה, הקצה הפתוח נקרא קצה מינוס (-), ואילו הקצה הנגדי, שבדרך אגב רואה פעולה נוספת, נקרא סוף פלוס (+). אומרים שגם למיקרופילמנטים יש קוטביות, אך שוב זה רק במובן של כיוון, ואין לו שום קשר למטען חשמלי. מיקרופילמנטים בודדים יכולים להתקיים, אך רוב המיקרופילמנטים in vivo הם זוגות מעוותים. שלא כמו DNA; עם זאת, זוגות מיקרופילמנט אינם אנטי-מקבילים: לשני הגדילים יש אותה כיווניות.
היווצרות חוטים מ- g-actin היא תהליך תלוי ATP, אם כי לא במובן המקובל של ניצול האנרגיה המשתחררת בהידרוליזה. במקום זאת, יחידות המשנה של האקטין הכדוריות ייקשרו רק עם תת-יחידת g-actin אחרת אם היא קשרה לראשונה ATP. אם ה-g-actin קשר ADP, אז תחילה עליו להחליף את ה-ADP ב-ATP לפני שניתן להוסיף אותו על נימה. זה משנה את הקונפורמציה של יחידת המשנה כדי לאפשר אינטראקציה בעלת זיקה גבוהה יותר. זמן קצר לאחר מכן, הידרוליזה של ה- ATP ל- ADP (עם שחרור P i) מחלישה את הזיקה אך אינה גורמת ישירות לפירוק קישור תת-היחידה. ההידרוליזה נוצרת על ידי האקטין עצמו, שיש לו פעילות אנזימטית ATPase זו מובנית.
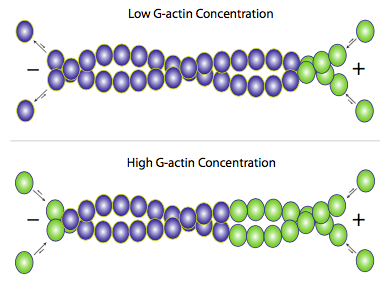
למרות ש- f-actin קיים בעיקר כזוג חוטים מעוותים זה סביב זה, תוספת של אקטין חדש מתרחשת על ידי הוספת מונומרים בודדים של g-actin לכל נימה (איור). \(\PageIndex{3}\) ניתן להשתמש בחלבוני עזר כדי לסייע או לעכב את הבנייה או הפירוק של החוטים, אך המנגנון העיקרי הוא בעצם ויסות עצמי. כאשר רמות ה-g-actin החופשיות גבוהות, התארכות של חוטי אקטין מועדפת, וכאשר ריכוז ה-g-actin יורד, דה-פולימריזציה של f-actin שולטת. עם זאת, בתנאים פיזיולוגיים ממוצעים, מה שנראה לעתים קרובות במיקרופילמנטים של אקטין הוא אפקט הנקרא דריכה. מכיוון שאקטין מתווסף בעיקר לקצה אחד אך מוסר מהקצה השני, ההשפעה נטו היא שכל מונומר אקטין נתון בחוט נימה נע למעשה מקצה (+) לקצה (-) גם אם אורך החוט לכאורה אינו משתנה.
ברוב סוגי התאים, הריכוז הגדול ביותר של מבנים ציטושלד מבוססי אקטין נמצא בפריפריה של התא ולא לכיוון המרכז. זה מתאים היטב לנטייה של קצוות התא להיות דינמיים יותר, להסתגל כל הזמן לחוש ולהגיב לסביבתו. ברור שהפילמור והדה-פולימריזציה של חוטי אקטין מהירים בהרבה מאשר עבור חוטי ביניים. החריג הגדול לכלל האקטין-בפריפריה נמצא בתאי שריר. חוטי אקטין, והחלבונים המוטוריים של המיוסין שעובדים עליהם, הם הבסיס להתכווצות תאי השריר, ומגדילים את רוב תאי השריר, לא רק את הפריפריה. נדון בתפקיד האקטין בשני סוגי תנועת התאים בהמשך הפרק.


