2.2: Maji
- Page ID
- 174280
Je! Umewahi kujiuliza kwa nini wanasayansi wanatumia muda wakitafuta maji kwenye sayari nyingine? Ni kwa sababu maji ni muhimu kwa maisha; hata athari za dakika zake kwenye sayari nyingine zinaweza kuonyesha kwamba maisha yanaweza au yalikuwepo kwenye sayari hiyo. Maji ni mojawapo ya molekuli nyingi zaidi katika seli zilizo hai na moja muhimu zaidi kwa maisha kama tunavyoijua. Takriban asilimia 60—70 ya mwili wako imeundwa na maji. Bila hivyo, maisha hayatakuwapo.
Maji ni polar
Atomi za hidrojeni na oksijeni ndani ya molekuli za maji huunda vifungo vya covalent vya Elektroni zilizoshirikiwa hutumia muda mwingi unaohusishwa na atomi ya oksijeni kuliko zinavyofanya na atomi za hidrojeni. Hakuna malipo ya jumla kwa molekuli ya maji, lakini kuna chaji kidogo chanya kwenye kila atomi ya hidrojeni na chaji kidogo hasi kwenye atomu ya oksijeni. Kwa sababu ya mashtaka hayo, kidogo chanya atomi hidrojeni kurudiana kila mmoja na kuunda sura ya kipekee kuonekana katika Kielelezo 2.1.6. Kila molekuli ya maji huvutia molekuli nyingine za maji kwa sababu ya mashtaka mazuri na hasi katika sehemu mbalimbali za molekuli. Maji pia huvutia molekuli nyingine za polar (kama vile sukari), na kutengeneza vifungo vya hidrojeni. Wakati dutu hii inaunda vifungo vya hidrojeni kwa maji, inaweza kufuta ndani ya maji na inajulikana kama hydrophilic (“upendo wa maji”). Vifungo vya hidrojeni hazipatikani kwa urahisi na vitu visivyo na nonpolar kama mafuta na mafuta (Kielelezo\(\PageIndex{1}\)). Misombo hii isiyo ya kawaida ni hydrophobic (“kuogopa maji”) na haitapasuka katika maji.

Maji Hutulia Joto
Vifungo vya hidrojeni ndani ya maji huruhusu kunyonya na kutolewa nishati ya joto polepole zaidi kuliko vitu vingine vingi. Joto ni kipimo cha mwendo (nishati ya kinetic) ya molekuli. Kama mwendo unavyoongezeka, nishati ni ya juu na hivyo joto ni kubwa zaidi. Maji inachukua nishati kubwa kabla ya joto lake kuongezeka. Kuongezeka kwa nishati huvunja vifungo vya hidrojeni kati ya molekuli za maji. Kwa sababu vifungo hivi vinaweza kuundwa na kuvurugika haraka, maji inachukua ongezeko la nishati na mabadiliko ya joto tu kidogo. Hii ina maana kwamba maji hupunguza mabadiliko ya joto ndani ya viumbe na katika mazingira yao. Kama pembejeo ya nishati inaendelea, uwiano kati ya malezi ya dhamana ya hidrojeni na uharibifu hugeuka kuelekea upande wa uharibifu. Vifungo zaidi ni kuvunjwa kuliko ni sumu. Utaratibu huu unasababisha kutolewa kwa molekuli ya maji ya mtu binafsi kwenye uso wa kiowevu (kama vile mwili wa maji, majani ya mmea, au ngozi ya kiumbe) katika mchakato unaoitwa uvukizi. Uvukizi wa jasho, ambayo ni asilimia 90 ya maji, inaruhusu baridi ya kiumbe, kwa sababu kuvunja vifungo vya hidrojeni kunahitaji pembejeo ya nishati na huchukua joto mbali na mwili.
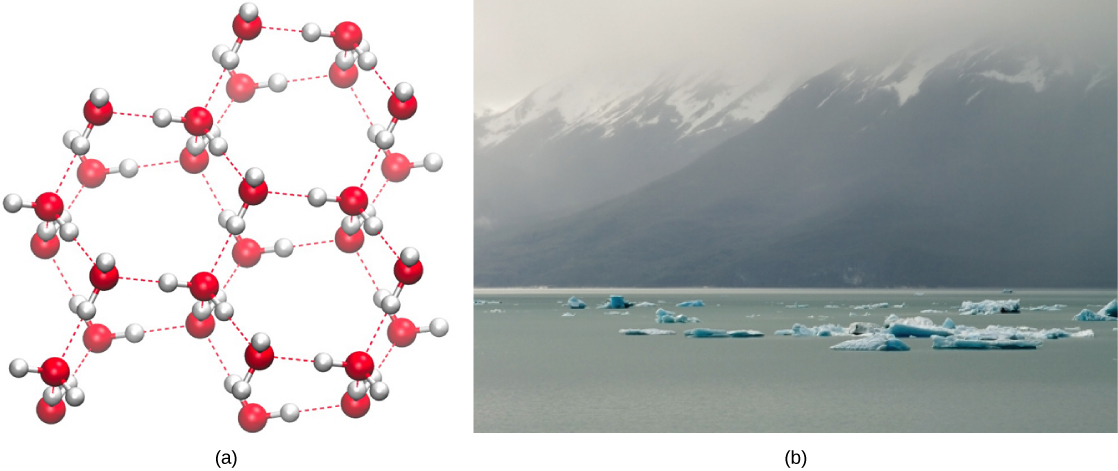
Kinyume chake, kama mwendo wa Masi unapungua na joto hupungua, nishati ndogo iko sasa kuvunja vifungo vya hidrojeni kati ya molekuli za maji. Hizi vifungo kubaki intact na kuanza kuunda rigid, lattice-kama muundo (kwa mfano, barafu) (Kielelezo\(\PageIndex{2}\) a). Wakati waliohifadhiwa, barafu ni ndogo kuliko maji ya kioevu (molekuli ni mbali zaidi). Hii ina maana kwamba barafu inaelea juu ya uso wa mwili wa maji (Kielelezo\(\PageIndex{2}\) b). Katika maziwa, mabwawa, na bahari, barafu itaunda juu ya uso wa maji, na kujenga kizuizi cha kuhami kulinda maisha ya wanyama na mimea chini kutoka kufungia ndani ya maji. Ikiwa halikutokea, mimea na wanyama wanaoishi katika maji wangeweza kufungia kwenye kizuizi cha barafu na hakuweza kusonga kwa uhuru, na kufanya maisha katika joto la baridi kuwa vigumu au haiwezekani.
Maji Ni kutengenezea bora
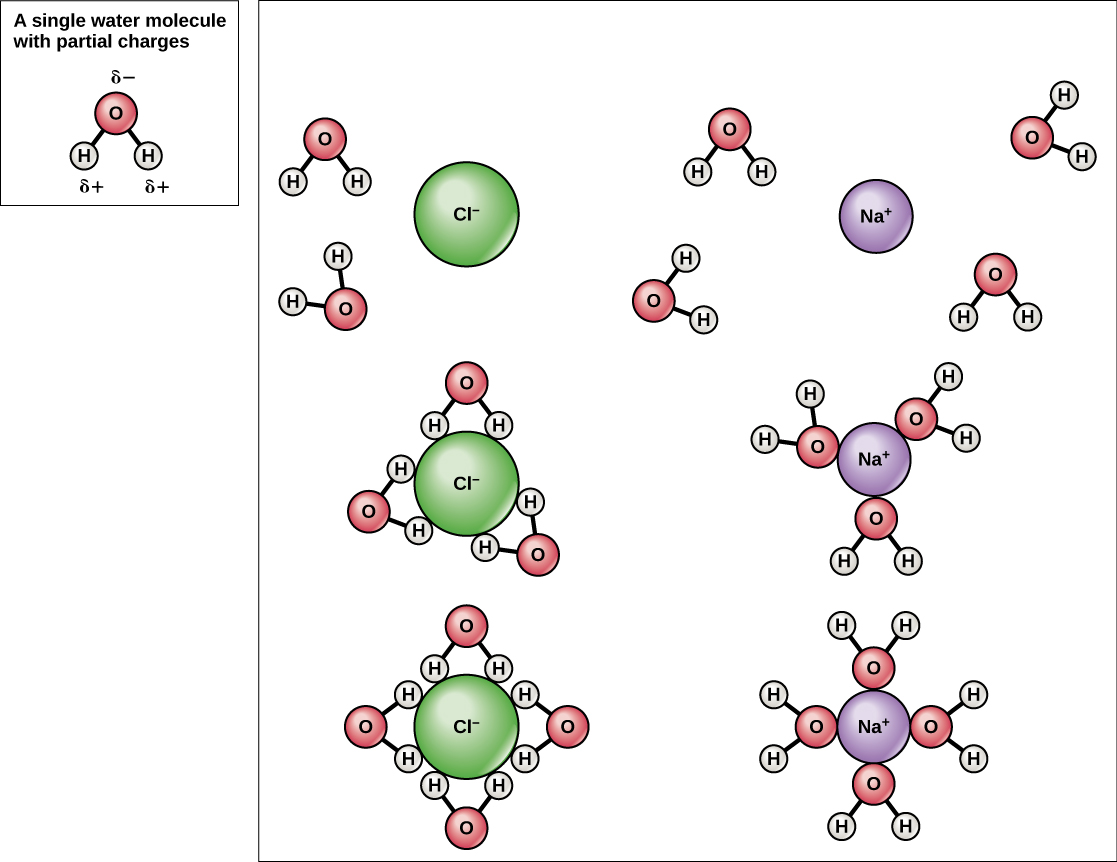
Kwa sababu maji ni polar, na mashtaka kidogo mazuri na hasi, misombo ya ionic na molekuli za polar zinaweza kufuta kwa urahisi ndani yake. Kwa hiyo, maji ni nini kinachojulikana kama kutengenezeza-dutu inayoweza kufuta dutu nyingine. Chembe za kushtakiwa zitaunda vifungo vya hidrojeni na safu inayozunguka ya molekuli za maji. Hii inajulikana kama nyanja ya hydration na hutumikia kuweka chembe kutenganishwa au kutawanyika ndani ya maji. Katika kesi ya chumvi ya meza (NaCl) iliyochanganywa katika maji (Kielelezo\(\PageIndex{3}\)), ions ya sodiamu na kloridi hutenganishwa, au hutenganisha, ndani ya maji, na nyanja za taratibu zinaundwa karibu na ions. Ioni ya sodiamu iliyosababishwa vizuri imezungukwa na mashtaka ya sehemu hasi ya atomi za oksijeni katika molekuli za Ioni ya kloridi iliyosababishwa vibaya imezungukwa na mashtaka ya sehemu nzuri ya atomi za hidrojeni katika molekuli za Sehemu hizi za usawaji pia hujulikana kama shells za hydration. Polarity ya molekuli ya maji inafanya kuwa kutengenezea kwa ufanisi na ni muhimu katika majukumu yake mengi katika mifumo ya maisha.
Maji ni mshikamano
Je, umewahi kujaza glasi ya maji hadi juu sana na kisha polepole aliongeza matone machache zaidi? Kabla ya kuongezeka, maji huunda sura kama dome juu ya mdomo wa kioo. Maji haya yanaweza kukaa juu ya kioo kwa sababu ya mali ya mshikamano. Katika mshikamano, molekuli ya maji huvutiwa na kila mmoja (kwa sababu ya kuunganisha hidrojeni), kuweka molekuli pamoja kwenye interface ya kioevu-hewa (gesi), ingawa hakuna nafasi zaidi katika kioo. Ushirikiano hutoa mvutano wa uso, uwezo wa dutu kuhimili kupasuka wakati umewekwa chini ya mvutano au dhiki. Unapoacha chakavu kidogo cha karatasi kwenye droplet ya maji, karatasi inaelea juu ya droplet ya maji, ingawa kitu ni denser (nzito) kuliko maji. Hii hutokea kwa sababu ya mvutano wa uso unaoundwa na molekuli za maji. Ushirikiano na mvutano wa uso huweka molekuli za maji zisizofaa na kipengee kinachozunguka juu. Inawezekana hata “kuelea” sindano ya chuma juu ya glasi ya maji ikiwa unaiweka kwa upole, bila kuvunja mvutano wa uso (Kielelezo\(\PageIndex{4}\)).

Vikosi hivi vya ushirikiano vinahusiana pia na mali ya maji ya kujitoa, au kivutio kati ya molekuli za maji na molekuli nyingine. Hii inazingatiwa wakati maji “hupanda” juu ya majani yaliyowekwa kwenye kioo cha maji. Utaona kwamba maji inaonekana kuwa ya juu pande za majani kuliko katikati. Hii ni kwa sababu molekuli ya maji huvutiwa na majani na hivyo kuambatana nayo.
Vikosi vya ushirikiano na wambiso ni muhimu kwa kuendeleza maisha. Kwa mfano, kwa sababu ya majeshi haya, maji yanaweza kuzunguka kutoka mizizi hadi juu ya mimea ili kulisha mmea.
DHANA KATIKA HATUA
Ili kujifunza zaidi kuhusu maji, tembelea Sayansi ya Maji ya Utafiti wa Kijiolojia ya Marekani kwa Shule: All About Water! tovuti.
Buffers, pH, asidi, na besi
PH ya suluhisho ni kipimo cha asidi yake au alkalinity. Pengine umetumia karatasi ya litmus, karatasi ambayo imetibiwa na rangi ya asili ya mumunyifu wa maji ili iweze kutumika kama kiashiria cha pH, ili kupima kiasi gani cha asidi au msingi (alkalinity) kilichopo katika suluhisho. Unaweza kuwa hata kutumika baadhi ya kuhakikisha maji katika bwawa la kuogelea nje ni vizuri kutibiwa. Katika hali zote mbili, mtihani huu wa pH hupima kiasi cha ioni za hidrojeni zilizopo katika suluhisho lililopewa. Viwango vya juu vya ioni hidrojeni huzaa pH ya chini, ilhali viwango vya chini vya ioni hidrojeni husababisha pH ya juu. Mkusanyiko wa jumla wa ions hidrojeni ni inversely kuhusiana na pH yake na inaweza kupimwa kwa kiwango cha pH (Kielelezo\(\PageIndex{5}\)). Kwa hiyo, ions zaidi ya hidrojeni sasa, chini ya pH; kinyume chake, ions chache za hidrojeni, juu ya pH.
Kiwango cha pH kinaanzia 0 hadi 14. Mabadiliko ya kitengo kimoja kwenye kiwango cha pH inawakilisha mabadiliko katika mkusanyiko wa ioni za hidrojeni kwa sababu ya 10, mabadiliko katika vitengo viwili inawakilisha mabadiliko katika mkusanyiko wa ioni za hidrojeni kwa sababu ya 100. Hivyo, mabadiliko madogo katika pH yanawakilisha mabadiliko makubwa katika viwango vya ioni za hidrojeni. Maji safi ni neutral. Sio tindikali wala msingi, na ina pH ya 7.0. Kitu chochote chini ya 7.0 (kuanzia 0.0 hadi 6.9) ni tindikali, na chochote juu ya 7.0 (kutoka 7.1 hadi 14.0) ni alkali. Damu katika mishipa yako ni alkali kidogo (pH = 7.4). Mazingira ndani ya tumbo lako ni tindikali sana (pH = 1 hadi 2). Juisi ya machungwa ni tindikali kali (pH = takriban 3.5), wakati soda ya kuoka ni ya msingi (pH = 9.0).

Asidi ni dutu zinazotoa ioni za hidrojeni (H +) na pH ya chini, ilhali besi hutoa ioni za hidroksidi (OH —) na kuongeza pH. Nguvu ya asidi, kwa urahisi hutoa H +. Kwa mfano, asidi hidrokloriki na juisi ya limao ni tindikali sana na huacha kwa urahisi H + wakati umeongezwa kwa maji. Kinyume chake, besi ni vitu wale ambao kwa urahisi kuchangia OH -. OH — ions huchanganya na H + kuzalisha maji, ambayo huwafufua pH ya dutu. Hidroksidi ya sodiamu na cleaners wengi wa kaya ni alkali sana na kuacha OH — haraka wakati kuwekwa katika maji, na hivyo kuongeza pH.
Seli nyingi katika miili yetu zinafanya kazi ndani ya dirisha nyembamba sana la kiwango cha pH, kwa kawaida kuanzia 7.2 hadi 7.6 tu. Ikiwa pH ya mwili iko nje ya aina hii, matatizo ya mfumo wa kupumua, kama vile viungo vingine katika mwili. Viini hazifanyi kazi vizuri, na protini zitavunja. Kupotoka nje ya pH mbalimbali inaweza kusababisha coma au hata kusababisha kifo.
Hivyo ni jinsi gani kwamba tunaweza kumeza au kuingiza vitu tindikali au msingi na si kufa? Buffers ni muhimu. Buffersurahisi kunyonya ziada H + au OH —, kuweka pH ya mwili kwa makini iimarishwe katika aforementioned mbalimbali nyembamba. Dioksidi kaboni ni sehemu ya mfumo maarufu wa buffer katika mwili wa binadamu; inaweka pH ndani ya upeo sahihi. Mfumo huu wa buffer unahusisha asidi kaboni (H 2 CO 3) na bicarbonate (HCO 3 -) anion. Ikiwa H nyingi huingia mwili, bicarbonate itachanganya na H + ili kuunda asidi ya kaboni na kupunguza kupungua kwa pH. Vivyo hivyo, kama OH sana — ni kuletwa katika mfumo, asidi kaboniki haraka dissociate katika bicarbonate na H + ions. H + ions inaweza kuchanganya na OH — ions, kupunguza ongezeko la pH. Ilhali asidi kaboniki ni bidhaa muhimu katika mmenyuko huu, uwepo wake ni wa kidunia kwa sababu asidi kaboni hutolewa mwilini kama gesi ya dioksidi kaboni kila wakati tunapopumua. Bila mfumo huu buffer, pH katika miili yetu ingekuwa fluctuate sana na sisi bila kushindwa kuishi.
Muhtasari
Maji ina mali nyingi ambazo ni muhimu kwa kudumisha maisha. Ni polar, kuruhusu kuundwa kwa vifungo vya hidrojeni, ambayo inaruhusu ions na molekuli nyingine za polar kufuta katika maji. Kwa hiyo, maji ni kutengenezea bora. Vifungo vya hidrojeni kati ya molekuli za maji huwapa maji uwezo wa kushikilia joto bora kuliko vitu vingine vingi. Kadiri joto linapoongezeka, vifungo vya hidrojeni kati ya maji vinaendelea kuvunja na mageuzi, kuruhusu joto la jumla kubaki imara, ingawa nishati iliyoongezeka huongezwa kwenye mfumo. Majeshi ya ushirikiano wa maji yanaruhusu mali ya mvutano wa uso. Mali hizi zote za kipekee za maji ni muhimu katika kemia ya viumbe hai.
PH ya suluhisho ni kipimo cha mkusanyiko wa ions hidrojeni katika suluhisho. Suluhisho na idadi kubwa ya ions hidrojeni ni tindikali na ina thamani ya chini ya pH. Suluhisho na idadi kubwa ya ions hidroksidi ni ya msingi na ina thamani ya juu ya pH. Kiwango cha pH kinaanzia 0 hadi 14, na pH ya 7 kuwa neutral. Buffers ni ufumbuzi kwamba wastani pH mabadiliko wakati asidi au msingi ni aliongeza kwa mfumo buffer. Vikwazo ni muhimu katika mifumo ya kibaiolojia kwa sababu ya uwezo wao wa kudumisha hali ya pH mara kwa mara.
maelezo ya chini
- 1 Humphrey, W., Dalke, A. na Schulten, K., “VMD-Visual Masi Dynamics”, J. Graphics, 1996, vol. 14, pp. 33-38. http://www.ks.uiuc.edu/Research/vmd/
faharasa
- asidi
- Dutu kwamba donates ions hidrojeni na hivyo lowers pH
- ushikamano
- mvuto kati ya molekuli ya maji na molekuli ya dutu mbalimbali
- msingi
- Dutu kwamba inachukua ions hidrojeni na hivyo huwafufua pH
- bafa
- suluhisho linalopinga mabadiliko katika pH kwa kunyonya au kutolewa ioni za hidrojeni au hidroksidi
- mshikamano
- vikosi vya intermolecular kati ya molekuli za maji zinazosababishwa na asili ya maji ya polar; hujenga mvutano wa uso
- uvukizaji
- kutolewa kwa molekuli ya maji kutoka maji kioevu kuunda mvuke wa maji
- hydrofiliki
- inaelezea dutu kwamba dissolves katika maji; maji upendo
- haidrofobu
- inaelezea dutu ambayo haina kufuta katika maji; kuogopa maji
- karatasi ya litmus
- karatasi ya chujio ambayo imetibiwa na rangi ya asili ya maji ya mumunyifu, hivyo inaweza kutumika kama kiashiria cha pH
- kiwango cha pH
- kiwango kinachoanzia 0 hadi 14 ambacho kinapima ukolezi wa takriban wa ions hidrojeni ya dutu
- kiyeyusho
- dutu inayoweza kufuta dutu nyingine
- mvutano wa uso
- nguvu ya ushirikiano juu ya uso wa mwili wa kioevu ambayo inazuia molekuli kutoka kutenganisha
- joto
- kipimo cha mwendo wa Masi



