2.1: Vitalu vya Ujenzi wa Molekuli
- Page ID
- 174261
Katika ngazi yake ya msingi zaidi, maisha yanajumuisha suala. Jambo linachukua nafasi na ina wingi. Jambo lolote linajumuisha elementi, vitu ambavyo haviwezi kuvunjika au kubadilishwa kemikali kuwa vitu vingine. Kila elementi hutengenezwa kwa atomi, kila mmoja ana idadi ya mara kwa mara ya protoni na mali ya pekee. Jumla ya elementi 118 zimefafanuliwa; hata hivyo, 92 tu hutokea kwa kawaida, na chini ya 30 hupatikana katika seli zilizo hai. Vipengele 26 vilivyobaki havikuwepo na, kwa hiyo, haipo kwa muda mrefu sana au ni kinadharia na bado havijatambuliwa.
Kila kipengele kinateuliwa na ishara yake ya kemikali (kama vile H, N, O, C, na Na), na ina mali ya kipekee. Mali hizi za kipekee zinaruhusu vipengele kuchanganya na kushikamana kwa njia maalum.
Atomi
Atomu ni sehemu ndogo kabisa ya elementi inayohifadhi mali zote za kemikali za elementi hiyo. Kwa mfano, atomi moja ya hidrojeni ina mali yote ya elementi hidrojeni, kama vile ipo kama gesi kwenye joto la kawaida, na inafunga na oksijeni kuunda molekuli ya maji. Atomi za hidrojeni haziwezi kuvunjwa kuwa kitu chochote kidogo huku bado zikihifadhi tabia za hidrojeni. Ikiwa atomu ya hidrojeni ilivunjika ndani ya chembe za subatomiki, ingekuwa tena na tabia za hidrojeni.
Katika ngazi ya msingi zaidi, viumbe vyote hufanywa kwa mchanganyiko wa vipengele. Zina atomi zinazochanganya pamoja ili kuunda molekuli. Katika viumbe mbalimbali, kama vile wanyama, molekuli zinaweza kuingiliana ili kuunda seli zinazochanganya kuunda tishu, ambazo hufanya viungo. Mchanganyiko huu unaendelea mpaka viumbe vyote vya multicellular vinapoundwa.
Atomi zote zina protoni, elektroni, na nyutroni (Kielelezo\(\PageIndex{1}\)). Mbali pekee ni hidrojeni (H), ambayo hufanywa kwa protoni moja na elektroni moja. Protoni ni chembe yenye chaji chanya inayokaa katika kiini (kiini cha atomi) cha atomi na ina masi ya 1 na chaji ya +1. Elektroni ni chembe yenye chaji hasi inayosafiri angani kuzunguka kiini. Kwa maneno mengine, inakaa nje ya kiini. Ina molekuli duni na ina chaji ya —1.
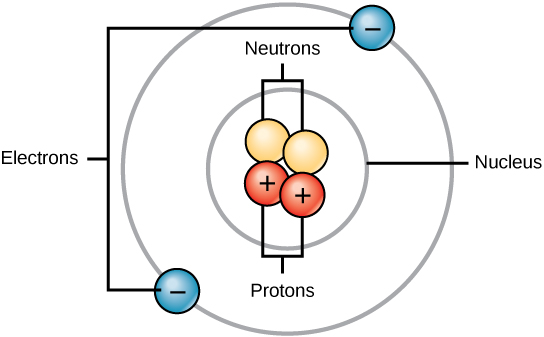
Neutroni, kama protoni, hukaa katika kiini cha atomu. Wana wingi wa 1 na hakuna malipo. Chanya (protoni) na hasi (elektroni) mashtaka yanafanana katika atomi ya neutral, ambayo ina malipo ya sifuri wavu.
Kwa sababu protoni na nyutroni kila mmoja huwa na masi ya 1, masi ya atomu ni sawa na idadi ya protoni na nyutroni za atomi hiyo. Idadi ya elektroni haifai katika wingi wa jumla, kwa sababu wingi wao ni mdogo sana.
Kama ilivyoelezwa hapo awali, kila kipengele kina mali yake ya kipekee. Kila ina idadi tofauti ya protoni na nyutroni, ikitoa namba atomia yake na namba ya wingi. Namba atomia ya elementi ni sawa na idadi ya protoni ambayo elementi ina. Nambari ya masi, au masi atomia, ni idadi ya protoni pamoja na idadi ya nyutroni za elementi hiyo. Kwa hiyo, inawezekana kuamua idadi ya neutroni kwa kuondoa namba ya atomiki kutoka namba ya wingi.
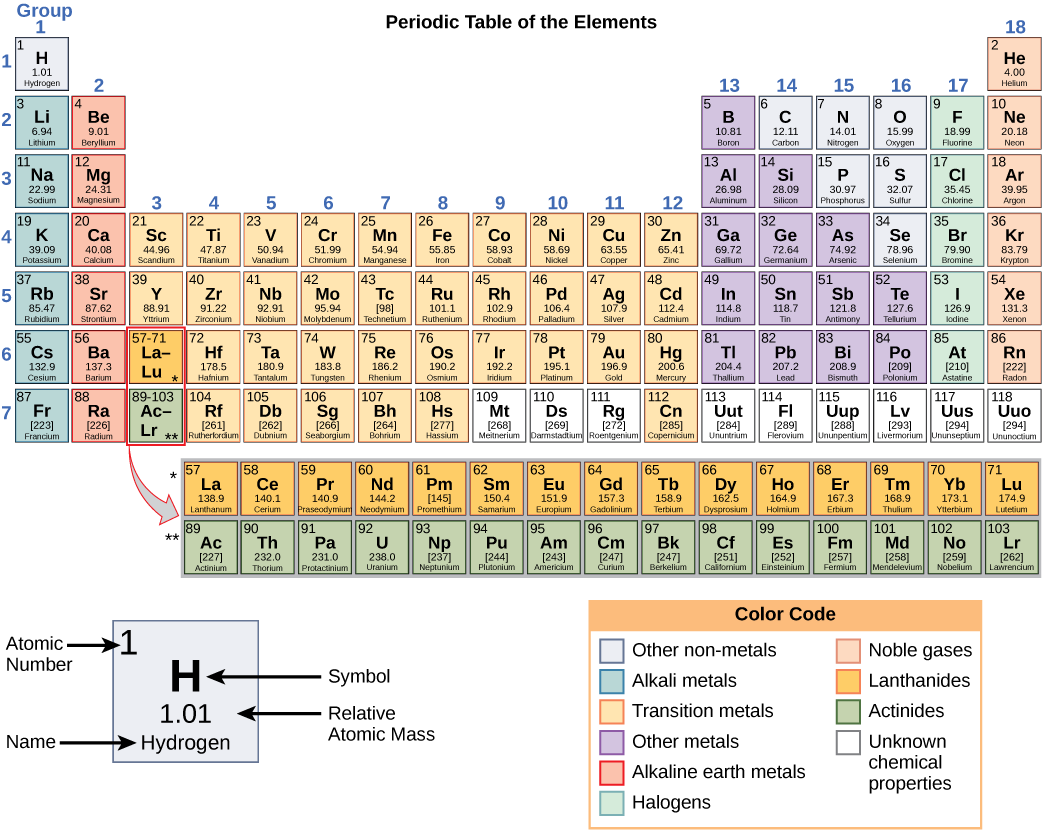
Nambari hizi hutoa taarifa kuhusu mambo na jinsi watakavyoitikia wakati wa pamoja. Mambo tofauti yana pointi tofauti za kuyeyuka na za kuchemsha, na ziko katika majimbo tofauti (kioevu, imara, au gesi) kwenye joto la kawaida. Pia huchanganya kwa njia tofauti. Baadhi huunda aina maalum za vifungo, wakati wengine hawana. Jinsi wanavyochanganya ni msingi wa idadi ya elektroni zilizopo. Kwa sababu ya sifa hizi, vipengele vinapangwa katika meza ya mara kwa mara ya elementi, chati ya elementi inayojumuisha namba ya atomia na molekuli ya atomiki ya kila elementi. Jedwali la mara kwa mara pia hutoa taarifa muhimu kuhusu mali ya vipengele (Kielelezo\(\PageIndex{2}\)) -mara nyingi huonyeshwa na coding ya rangi. Mpangilio wa meza pia unaonyesha jinsi elektroni katika kila elementi zinavyoandaliwa na hutoa maelezo muhimu kuhusu jinsi atomi zitakavyoitikia kwa kila mmoja kuunda molekuli.
Isotopi ni aina tofauti za elementi moja ambazo zina idadi sawa ya protoni, lakini idadi tofauti ya nyutroni. Vipengele vingine, kama vile kaboni, potasiamu, na uranium, vina isotopi zinazotokea kwa kawaida. Kaboni-12, isotopu ya kawaida ya kaboni, ina protoni sita na neutroni sita. Kwa hiyo, ina idadi kubwa ya 12 (protoni sita na nyutroni sita) na namba atomia ya 6 (ambayo inafanya kuwa kaboni). Kaboni-14 ina protoni sita na nyutroni nane. Kwa hiyo, ina idadi kubwa ya 14 (protoni sita na nyutroni nane) na namba atomia ya 6, maana yake bado ni elementi kaboni. Aina hizi mbili mbadala za kaboni ni isotopi. Isotopi zingine ni thabiti na zitapoteza protoni, chembe nyingine za subatomiki, au nishati ili kuunda elementi imara zaidi. Hizi huitwa isotopi za mionzi au radioisot
UHUSIANO WA S
Ni nyutroni ngapi ambazo (K) potasiamu-39 na potasiamu-40 zina, kwa mtiririko huo?
EVOLUTION KATIKA ACTION: Carbon Dating
Kaboni-14 (14 C) ni radioisotopu inayotokea kiasili inayoundwa katika angahewa na mionzi ya cosmic. Huu ni mchakato unaoendelea, hivyo zaidi ya 14 C daima inaundwa. Kama kiumbe hai kinaendelea, kiwango cha jamaa cha 14 C katika mwili wake ni sawa na mkusanyiko wa 14 C katika anga. Wakati kiumbe kinakufa, haipati tena 14 C, hivyo uwiano utapungua. 14 C kuoza kwa 14 N na mchakato unaoitwa beta kuoza; inatoa mbali nishati katika mchakato huu polepole.
Baada ya takriban miaka 5,730, nusu moja tu ya mkusanyiko wa mwanzo wa 14 C itakuwa imebadilishwa kuwa 14 N. muda unaotumika kwa nusu ya mkusanyiko wa awali wa isotopu kuoza kwa umbo lake imara zaidi inaitwa nusu ya maisha yake. Kwa sababu nusu ya maisha ya 14 C ni ndefu, hutumiwa kwa umri wa zamani vitu vilivyo hai, kama vile fossils. Kwa kutumia uwiano wa mkusanyiko wa 14 C unaopatikana katika kitu kwa kiasi cha 14 C unaogunduliwa angahewa, kiasi cha isotopu ambacho bado hakijaharibika kinaweza kuamua. Kulingana na kiasi hiki, umri wa mafuta unaweza kuhesabiwa hadi miaka 50,000 (Kielelezo\(\PageIndex{3}\)). Isotopu zilizo na maisha ya nusu ndefu, kama vile potasiamu-40, hutumiwa kuhesabu umri wa fossils za zamani. Kupitia matumizi ya dating kaboni, wanasayansi wanaweza kujenga upya mazingira na biogeography ya viumbe wanaoishi ndani ya miaka 50,000 iliyopita.

DHANA KATIKA HATUA
Ili kujifunza zaidi kuhusu atomi na isotopu, na jinsi gani unaweza kuwaambia isotopu moja kutoka kwa mwingine, tembelea tovuti hii na uendelee simulation.
Kemikali vifungo
Jinsi elementi zinavyoshirikiana hutegemea jinsi elektroni zao zinapangwa na jinsi fursa nyingi za elektroni zipo katika eneo la nje kabisa ambako elektroni zipo katika atomu. Electroni zipo katika viwango vya nishati vinavyounda maganda kuzunguka kiini. Ganda la karibu linaweza kushikilia hadi elektroni mbili. Kamba la karibu zaidi na kiini daima linajazwa kwanza, kabla ya shell nyingine yoyote inaweza kujazwa. Hidrojeni ina elektroni moja; kwa hiyo, ina doa moja tu inayotwaliwa ndani ya ganda la chini kabisa. Heliamu ina elektroni mbili; kwa hiyo, inaweza kujaza kabisa ganda la chini kabisa na elektroni zake mbili. Ukiangalia meza ya mara kwa mara, utaona kwamba hidrojeni na heliamu ni vipengele viwili pekee katika mstari wa kwanza. Hii ni kwa sababu wana elektroni tu katika ganda lao la kwanza. Hidrojeni na heli ni elementi mbili pekee ambazo zina ganda la chini kabisa na hakuna maganda mengine.
Viwango vya pili na vya tatu vya nishati vinaweza kushikilia elektroni nane. Elektroni nane hupangwa kwa jozi nne na nafasi moja katika kila jozi hujazwa na elektroni kabla ya jozi yoyote kukamilika.
Kuangalia meza ya mara kwa mara tena (Kielelezo\(\PageIndex{2}\)), utaona kuwa kuna safu saba. Safu hizi zinahusiana na idadi ya maganda ambayo elementi ndani ya mstari huo zina. Elementi ndani ya mstari fulani zina idadi kubwa ya elektroni kadiri nguzo zinavyoendelea kutoka kushoto kwenda kulia. Ingawa kila elementi ina idadi sawa ya maganda, sio maganda yote yamejazwa kabisa na elektroni. Ikiwa unatazama mstari wa pili wa meza ya mara kwa mara, utapata lithiamu (Li), beryllium (Kuwa), boroni (B), kaboni (C), nitrojeni (N), oksijeni (O), fluorine (F), na neon (Ne). Hizi zote zina elektroni zinazotumia maganda ya kwanza na ya pili tu. Lithiamu ina elektroni moja tu katika shell yake ya nje, beryllium ina elektroni mbili, boroni ina tatu, na kadhalika, mpaka shell nzima imejaa elektroni nane, kama ilivyo kwa neon.
Si elementi zote zina elektroni za kutosha kujaza maganda yao ya nje, lakini atomu iko imara zaidi wakati nafasi zote za elektroni katika ganda la nje zimejaa. Kwa sababu ya nafasi hizi katika maganda ya nje, tunaona malezi ya vifungo vya kemikali, au mwingiliano kati ya mbili au zaidi ya vipengele sawa au tofauti vinavyosababisha kuundwa kwa molekuli. Ili kufikia utulivu mkubwa atomi zitaelekea kujaza kabisa maganda yao ya nje na zitaunganishwa na elementi nyingine ili kukamilisha lengo hili kwa kugawana elektroni, kukubali elektroni kutoka atomu nyingine, au kutoa elektroni kwa atomi nyingine. Kwa sababu maganda ya nje ya elementi yenye idadi ya chini ya atomiki (hadi kalsiamu, yenye namba atomiki 20) yanaweza kushikilia elektroni nane, hii inajulikana kama utawala wa octet. Elementi inaweza kuchangia, kukubali, au kushiriki elektroni na elementi nyingine ili kujaza ganda lake la nje na kukidhi utawala wa octet.
Wakati atomu haina idadi sawa ya protoni na elektroni, inaitwa ioni. Kwa sababu idadi ya elektroni haifai idadi ya protoni, kila ion ina chaji ya wavu. Ions nzuri huundwa kwa kupoteza elektroni na huitwa cations. Ions hasi huundwa kwa kupata elektroni na huitwa anions.
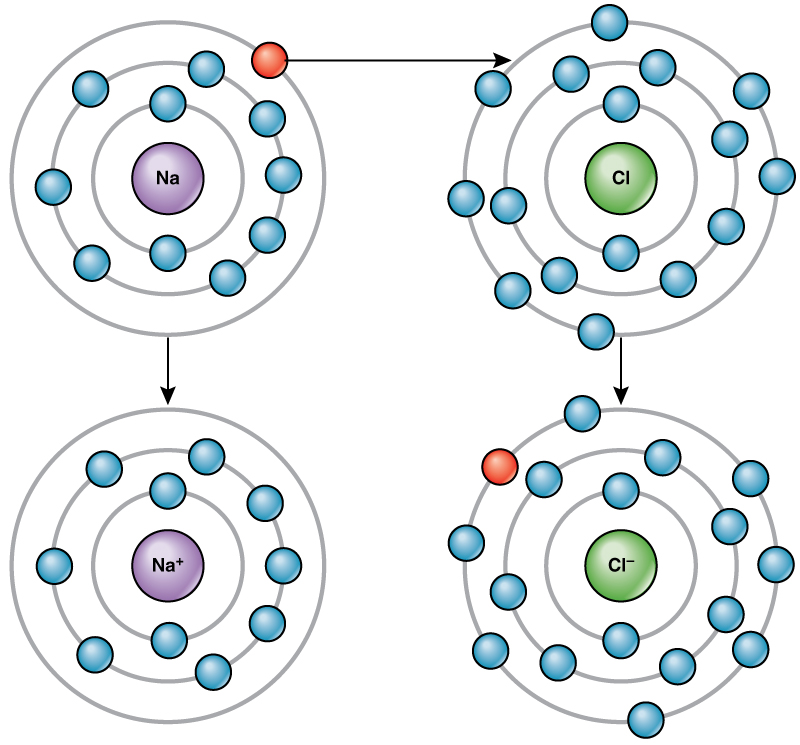
Kwa mfano, sodiamu tu ina elektroni moja katika shell yake ya nje. Inachukua nishati kidogo kwa sodiamu kuchangia hiyo elektroni moja kuliko inavyofanya ili kukubali elektroni saba zaidi kujaza ganda la nje. Ikiwa sodiamu inapoteza elektroni, sasa ina protoni 11 na elektroni 10 tu, ikiacha kwa malipo ya jumla ya +1. Sasa inaitwa ion ya sodiamu.
Atomu ya klorini ina elektroni saba katika ganda lake la nje. Tena, ni ufanisi zaidi wa nishati kwa klorini kupata elektroni moja kuliko kupoteza saba. Kwa hiyo, inaelekea kupata elektroni kuunda ioni yenye protoni 17 na elektroni 18, ikitoa chaji hasi ya wavu (—1). Sasa inaitwa ion ya kloridi. Mwendo huu wa elektroni kutoka elementi moja hadi nyingine hujulikana kama uhamisho wa elektroni. Kama Kielelezo\(\PageIndex{4}\) unaeleza, atomi ya sodiamu (Na) ina elektroni moja tu katika shell yake ya nje, wakati chembe ya klorini (Cl) ina elektroni saba katika shell yake ya nje. Atomu ya sodiamu itachangia elektroni yake moja ili kuifuta ganda lake, na atomu ya klorini itakubali elektroni hiyo kujaza ganda lake, kuwa kloridi. Ions zote mbili sasa zinakidhi utawala wa octet na zina makombora kamili ya nje. Kwa sababu idadi ya elektroni si sawa tena na idadi ya protoni, kila sasa ni ioni na ina chaji ya +1 (sodiamu) au -1 (kloridi).
Ionic vifungo
Kuna aina nne za vifungo au mwingiliano: ionic, covalent, vifungo hidrojeni, na van der Waals mwingiliano. Ionic na covalent vifungo ni mwingiliano imara ambayo yanahitaji kubwa nishati pembejeo kuvunja mbali. Wakati elementi inapochangia elektroni kutoka ganda lake la nje, kama katika mfano wa atomu ya sodiamu hapo juu, ioni chanya huundwa. Elementi inayokubali elektroni sasa inashtakiwa vibaya. Kwa sababu mashtaka mazuri na hasi huvutia, ions hizi hukaa pamoja na kuunda dhamana ya ionic, au dhamana kati ya ions. Elementi hufunga pamoja na elektroni kutoka elementi moja iliyokaa sana na elementi nyingine. Wakati Na + na Cl — ions zinachanganya kuzalisha NaCl, elektroni kutoka atomi ya sodiamu inakaa na nyingine saba kutoka atomi ya klorini, na ioni za sodiamu na kloridi huvutia kila mmoja katika kimiani ya ioni yenye malipo ya sifuri.
Covalent vifungo
Aina nyingine ya dhamana kali ya kemikali kati ya atomi mbili au zaidi ni dhamana ya covalent. Vifungo hivi vinaunda wakati elektroni inashirikiwa kati ya elementi mbili na ni aina yenye nguvu na ya kawaida ya dhamana ya kemikali katika viumbe hai. Vifungo vyema vinaunda kati ya vipengele vinavyotengeneza molekuli za kibiolojia katika seli zetu. Tofauti na vifungo vya ionic, vifungo vya covalent havijitenganishi katika maji.
Atomi za hidrojeni na oksijeni zinazochanganya kuunda molekuli za maji zimefungwa pamoja na vifungo vya covalent. Electroni kutoka atomi ya hidrojeni hugawanya muda wake kati ya ganda la nje la atomu ya hidrojeni na ganda la nje lisilokwisha la atomu ya oksijeni. Ili kujaza kabisa ganda la nje la atomu ya oksijeni, elektroni mbili kutoka atomi mbili za hidrojeni zinahitajika, kwa hiyo subscript “2” katika H 2 O. elektroni zinashirikiwa kati ya atomi, zikigawa muda wao kati yao ili “kujaza” ganda la nje la kila mmoja. Ugawaji huu ni hali ya chini ya nishati kwa atomi zote zinazohusika kuliko kama zilikuwepo bila maganda yao ya nje yaliyojaa.
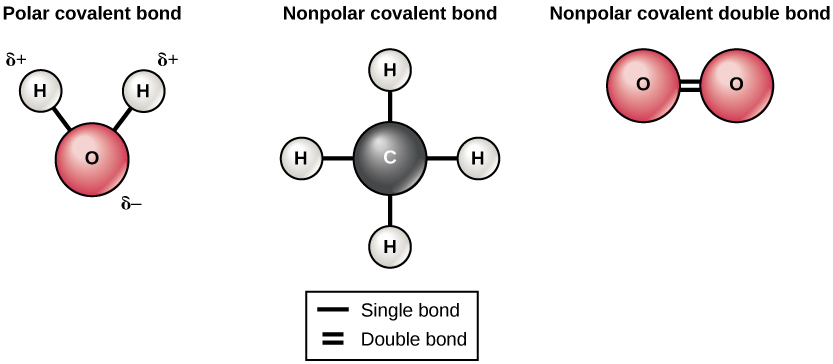
Kuna aina mbili za vifungo vya covalent: polar na nonpolar. Nonpolar covalent vifungo fomu kati ya atomi mbili ya elementi moja au kati ya mambo mbalimbali kwamba kushiriki elektroni sawa. Kwa mfano, atomu ya oksijeni inaweza kushikamana na atomi nyingine ya oksijeni ili kujaza maganda yao ya nje. Ushirika huu ni nonpolar kwa sababu elektroni itakuwa sawa kusambazwa kati ya kila atomi oksijeni. Mbili covalent vifungo fomu kati ya atomi oksijeni mbili kwa sababu oksijeni inahitaji elektroni mbili pamoja kujaza shell yake ya nje. Atomi za nitrojeni zitaunda vifungo vitatu vya covalent (pia huitwa covalent mara tatu) kati ya atomi mbili za nitrojeni kwa sababu kila atomu ya nitrojeni inahitaji elektroni tatu kujaza shell yake ya nje. Mfano mwingine wa dhamana isiyo ya kawaida ya covalent hupatikana katika molekuli ya methane (CH 4). Atomu ya kaboni ina elektroni nne katika ganda lake la nje kabisa na inahitaji nne zaidi ili kuijaza. Inapata hizi nne kutoka atomi nne za hidrojeni, kila atomu ikitoa moja. Mambo haya yote hushiriki elektroni sawa, na kuunda vifungo vinne vya nonpolar covalent (Kielelezo\(\PageIndex{5}\)).
Katika dhamana ya covalent ya polar, elektroni zilizoshirikiwa na atomi hutumia muda zaidi karibu na kiini kimoja kuliko kiini kingine. Kwa sababu ya usambazaji usio sawa wa elektroni kati ya viini tofauti, chaji kidogo chanya (δ+) au kidogo hasi (δ—) huendelea. Vifungo vya covalent kati ya atomi za hidrojeni na oksijeni katika maji ni vifungo vya polar covalent. Elektroni zilizoshirikiwa hutumia muda mwingi karibu na kiini cha oksijeni, ikitoa chaji kidogo hasi, kuliko zinazotumia karibu na viini vya hidrojeni, na kutoa molekuli hizi chaji ndogo chanya.
hidrojeni vifungo
Vifungo vya Ionic na covalent ni vifungo vikali vinavyohitaji nishati kubwa ya kuvunja. Hata hivyo, sio vifungo vyote kati ya vipengele ni vifungo vya ionic au vyema. Vifungo dhaifu vinaweza pia kuunda. Hizi ni vivutio vinavyotokea kati ya mashtaka mazuri na mabaya ambayo hayahitaji nishati nyingi kuvunja. Vifungo viwili dhaifu vinavyotokea mara nyingi ni vifungo vya hidrojeni na mwingiliano wa van der Waals Vifungo hivi vinatoa mali ya kipekee ya maji na miundo ya kipekee ya DNA na protini.
Wakati vifungo vya covalent vya polar vyenye fomu ya atomi ya hidrojeni, atomi ya hidrojeni katika dhamana hiyo ina malipo kidogo. Hii ni kwa sababu elektroni iliyoshirikiwa inavutwa kwa nguvu zaidi kuelekea elementi nyingine na mbali na kiini cha hidrojeni. Kwa sababu atomi ya hidrojeni ni chanya kidogo (δ+), itavutiwa na mashtaka ya sehemu ya jirani hasi (δ—). Hili likitokea, mwingiliano dhaifu hutokea kati ya chaji δ+ ya atomi ya hidrojeni ya molekuli moja na δ— malipo ya molekuli nyingine. Mwingiliano huu huitwa dhamana ya hidrojeni. Aina hii ya dhamana ni ya kawaida; kwa mfano, asili ya maji ya maji husababishwa na vifungo vya hidrojeni kati ya molekuli za maji (Kielelezo\(\PageIndex{6}\)). Vifungo vya hidrojeni huwapa maji mali ya pekee inayoendeleza maisha. Ikiwa haikuwa kwa ajili ya kuunganisha hidrojeni, maji ingekuwa gesi badala ya kioevu kwenye joto la kawaida.
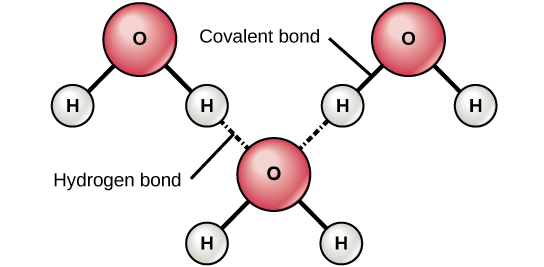
Vifungo vya hidrojeni vinaweza kuunda kati ya molekuli tofauti na hazipaswi kuingiza molekuli ya maji. Atomi za hidrojeni katika vifungo vya polar ndani ya molekuli yoyote inaweza kuunda vifungo na molekuli nyingine zilizo karibu Kwa mfano, vifungo vya hidrojeni vinashikilia pamoja vipande viwili vya muda mrefu vya DNA ili kutoa molekuli ya DNA muundo wake wa tabia mbili zilizopigwa. Vifungo vya hidrojeni pia vinahusika na baadhi ya muundo wa tatu-dimensional wa protini.
Van der Waals mwingiliano
Kama vifungo hidrojeni, van der Waals mwingiliano ni vivutio dhaifu au mwingiliano kati ya molekuli Zinatokea kati ya polar, covalently amefungwa, atomi katika molekuli tofauti. Baadhi ya vivutio hivi dhaifu husababishwa na mashtaka ya sehemu ya muda yanayotengenezwa wakati elektroni zikizunguka kiini. Ushirikiano huu dhaifu kati ya molekuli ni muhimu katika mifumo ya kibiolojia.
KAZI KATIKA ACTION: Radiography Fundi
Je, wewe au mtu yeyote unayemjua amewahi kuwa na sumaku resonance imaging (MRI) Scan, mammogram, au X-ray? Vipimo hivi huzalisha picha za tishu zako laini na viungo (kama ilivyo na MRI au mammogram) au mifupa yako (kama inatokea katika eksirei) kwa kutumia ama radiowaves au isotopu maalum (radiolabeled au fluorescently lebo) ambazo zinaingizwa au injected ndani ya mwili. Vipimo hivi hutoa data kwa ajili ya uchunguzi wa magonjwa kwa kuunda picha za viungo vyako au mfumo wa mifupa.
Upigaji picha wa MRI hufanya kazi kwa kuzingatia viini vya hidrojeni, ambazo ni nyingi katika maji katika tishu za laini, kwa kushuka kwa mashamba magnetic, ambayo huwafanya waondoe shamba lao la magnetic. Ishara hii ni kisha kusoma na sensorer katika mashine na kutafsiriwa na kompyuta ili kuunda picha ya kina.
Baadhi ya teknolojia radiografia na mafundi wataalamu katika computed tomography, MRI, na mammography. Wao huzalisha filamu au picha za mwili zinazowasaidia wataalamu wa matibabu kuchunguza na kugundua. Radiologists hufanya kazi moja kwa moja na wagonjwa, kuelezea mashine, kuwaandaa kwa ajili ya mitihani, na kuhakikisha kwamba mwili wao au sehemu za mwili wao zimewekwa kwa usahihi ili kuzalisha picha zinazohitajika. Waganga au radiologists kisha kuchambua matokeo ya mtihani.
Wataalamu wa radiografia wanaweza kufanya kazi katika hospitali, ofisi za madaktari, au vituo maalumu vya upigaji Mafunzo ya kuwa fundi wa radiografia hutokea katika hospitali, vyuo vikuu, na vyuo vikuu vinavyotoa vyeti, digrii za ushirika, au digrii za shahada katika radiography.
Muhtasari
Jambo ni kitu chochote kinachukua nafasi na kina wingi. Imeundwa na atomi za elementi tofauti. Elementi zote 92 zinazotokea kiasili zina sifa za pekee zinazowawezesha kuchanganya kwa njia mbalimbali ili kuunda misombo au molekuli. Atomi, ambazo zinajumuisha protoni, nyutroni, na elektroni, ni vitengo vidogo vya elementi vinavyohifadhi mali zote za elementi hiyo. Electroni zinaweza kuchangia au kugawanywa kati ya atomi ili kuunda vifungo, ikiwa ni pamoja na vifungo vya ioniki, covalent, na hidrojeni, pamoja na mwingiliano wa van der Waals.
Sanaa Connections
Kielelezo\(\PageIndex{2}\): Ni nyutroni ngapi ambazo (K) potasiamu-39 na potasiamu-40 zina, kwa mtiririko huo?
- Jibu
-
Potasiumi-39 ina nyutroni ishirini. Potasiumi-40 ina neutroni ishirini na moja.
faharasa
- anion
- ioni hasi iliyoundwa na kupata elektroni
- idadi ya atomiki
- idadi ya protoni katika atomu
- cation
- ioni chanya iliyoundwa na kupoteza elektroni
- kemikali dhamana
- mwingiliano kati ya mambo mawili au zaidi ya sawa au tofauti ambayo husababisha kuundwa kwa molekuli
- dhamana ya covalent
- aina ya dhamana imara kati ya mbili au zaidi ya elementi sawa au tofauti; fomu wakati elektroni zinashirikiwa kati ya elementi
- elektroni
- chembe iliyochajiwa vibaya ambayo inakaa nje ya kiini katika orbital ya elektroni; inakosa molekuli ya kazi na ina chaji ya -1
- uhamisho wa elektroni
- harakati ya elektroni kutoka kipengele kimoja hadi nyingine
- kipengee
- moja ya vitu 118 vya kipekee ambavyo haviwezi kuvunjwa kuwa vitu vidogo na kuhifadhi tabia ya dutu hiyo; kila kipengele kina idadi maalum ya protoni na mali ya kipekee
- hidrojeni dhamana
- dhamana dhaifu kati ya atomi za hidrojeni zenye kushtakiwa na sehemu za kushtakiwa vibaya au molekuli
- ioni
- atomi au kiwanja ambacho hakina idadi sawa ya protoni na elektroni, na kwa hiyo ina malipo ya wavu
- ionic dhamana
- dhamana kemikali kwamba aina kati ya ions ya mashtaka kinyume
- isotope
- aina moja au zaidi ya elementi ambayo ina idadi tofauti ya nyutroni
- idadi ya molekuli
- idadi ya protoni pamoja na nyutroni katika atomu
- jambo
- chochote ambacho kina molekuli na kinachukua nafasi
- neutroni
- chembe isiyo na chaji inayoishi katika kiini cha atomu; ina masi ya 1
- nonpolar covalent dhamana
- aina ya dhamana ya covalent ambayo huunda kati ya atomi wakati elektroni zinashirikiwa sawa kati ya atomi, na kusababisha hakuna mikoa yenye mashtaka ya sehemu kama katika vifungo vya covalent vya polar
- kiini
- (kemia) kituo chenye mnene cha atomi kilichoundwa na protoni na (isipokuwa katika kesi ya atomi ya hidrojeni) neutroni
- utawala wa nane
- inasema kwamba shell ya nje ya kipengele na idadi ya chini ya atomiki inaweza kushikilia elektroni nane
- meza ya mara kwa mara ya vipengele
- chati ya shirika ya vipengele, kuonyesha idadi ya atomiki na idadi ya wingi wa kila kipengele; pia hutoa taarifa muhimu kuhusu mali ya vipengele
- polar covalent dhamana
- aina ya dhamana ya covalent ambayo elektroni hutolewa kuelekea atomi moja na mbali na nyingine, na kusababisha mikoa kidogo ya chanya na kidogo ya kushtakiwa ya molekuli
- protoni
- chembe yenye kushtakiwa chanya ambayo inakaa katika kiini cha atomu; ina masi ya 1 na chaji ya +1
- isotopu ya mi
- isotopu ambayo kwa hiari hutoa chembe au nishati ili kuunda elementi imara zaidi
- mwingiliano wa van der Waals
- mvuto dhaifu au mwingiliano kati ya molekuli unasababishwa na atomi kidogo chanya chaji au kidogo chaji vibaya


