30.9: Kanuni ya Kuondolewa kwa Pauli
- Page ID
- 182968
Malengo ya kujifunza
Mwishoni mwa sehemu hii, utaweza:
- Eleza utungaji wa atomu pamoja na elektroni, nyutroni, na protoni zake.
- Eleza kanuni ya kutengwa kwa Pauli na matumizi yake kwa atomu.
- Taja alama za shell na subshell na nafasi zao.
- Eleza nafasi ya elektroni katika maganda tofauti ya atomu.
- Weka nafasi ya kila kipengele katika meza ya mara kwa mara kulingana na kujaza shell.
Atomi nyingi za elektroni
Atomi zote isipokuwa hidrojeni ni atomi nyingi za elektroni. Mali ya kimwili na kemikali ya vipengele ni moja kwa moja kuhusiana na idadi ya elektroni atomi ya neutral ina. Jedwali la mara kwa mara la vipengele vya makundi ya vipengele na mali sawa katika nguzo. Shirika hili la utaratibu linahusiana na idadi ya elektroni katika atomi ya neutral, inayoitwa namba atomiki,\(Z\). Tutaona katika sehemu hii kwamba kanuni ya kutengwa ni muhimu kwa maelezo ya msingi, na kwamba inatumika mbali zaidi ya eneo la fizikia atomiki.
Mwaka 1925, mwanafizikia wa Austria Wolfgang Pauli (angalia Kielelezo) alipendekeza utawala wafuatayo: Hakuna elektroni mbili zinaweza kuwa na seti sawa ya idadi ya quantum. Hiyo ni, hakuna elektroni mbili zinaweza kuwa katika hali moja. Kauli hii inajulikana kama kanuni ya kutengwa kwa Pauli, kwa sababu haihusishi elektroni kuwa katika hali ileile. Kanuni ya kutengwa kwa Pauli ni nguvu sana na inatumika kwa upana sana. Inatumika kwa chembe yoyote kufanana na nusu-muhimu ndani spin-yaani, kuwa\(s = 1/2, \, 3/2, . . .\) hivyo hakuna elektroni mbili inaweza kuwa na seti sawa ya idadi quantum.
Kanuni ya kutengwa kwa Pauli
Hakuna elektroni mbili zinaweza kuwa na seti sawa ya namba za quantum. Hiyo ni, hakuna elektroni mbili zinaweza kuwa katika hali moja.

Hebu tuchunguze jinsi kanuni ya kutengwa inatumika kwa elektroni katika atomi. Nambari za quantum zinazohusika zilielezwa katika Hesabu za Quantum na Kanuni kama\(n, \, l, \, m_l, \, s\) na\(m_s\). Kwa kuwa\(s\) ni daima\(1/2\) kwa elektroni, ni redundant\(s\) kuorodhesha, na hivyo tunaiacha na kutaja hali ya elektroni kwa seti ya namba nne\((n, \, l, \, m_l, \, m_s)\). Kwa mfano, namba za quantum\((2, \, 1, \, 0, - 1/2)\) zinataja kabisa hali ya elektroni katika atomi.
Kwa kuwa hakuna elektroni mbili zinaweza kuwa na seti sawa ya namba za quantum, kuna mipaka kwa wangapi wao wanaweza kuwa katika hali sawa ya nishati. Kumbuka kwamba\(n\) huamua hali ya nishati kwa kutokuwepo kwa shamba la magnetic. Kwa hiyo sisi kwanza kuchagua\(n\), na kisha tunaona jinsi elektroni nyingi zinaweza kuwa katika hali hii ya nishati au kiwango cha nishati. Fikiria\(n = 1\) kiwango, kwa mfano. Thamani pekee\(l\) inaweza kuwa na 0 (angalia [kiungo] kwa orodha ya maadili iwezekanavyo mara moja\(n\) inajulikana), na hivyo\(m_l\) inaweza tu kuwa 0. Makadirio ya spin\(m_s\) yanaweza kuwa ama\(+1/2\) au\(-1/2\), na hivyo kunaweza kuwa na elektroni mbili katika\(n = 1\) hali. Moja ina idadi ya quantum\((1,\space 0, \, 0, \, +1/2)\), na nyingine ina\((1, \, 0, \, 0, \, -1/2)\). Kielelezo unaeleza kwamba kunaweza kuwa na elektroni moja au mbili kuwa\(n = 1\), lakini si tatu.
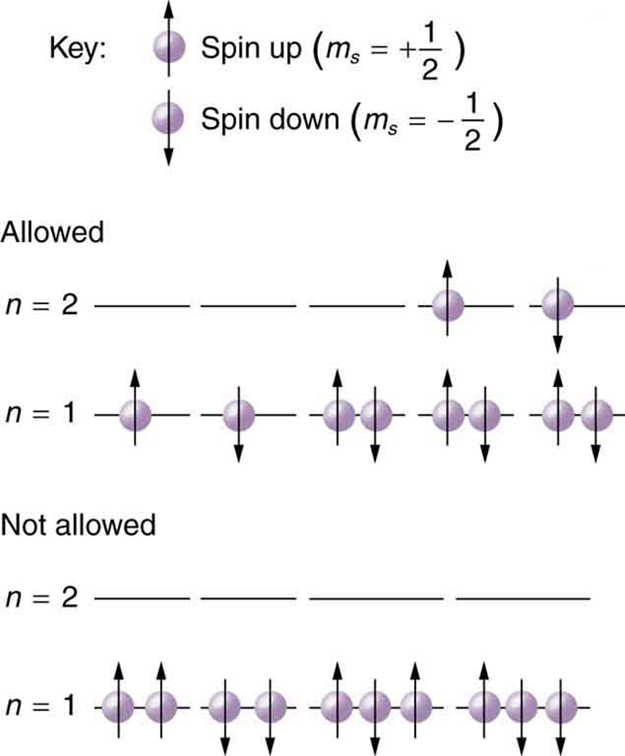
Shells na subshells
Kwa sababu ya kanuni ya kutengwa kwa Pauli, hidrojeni na heliamu pekee zinaweza kuwa na elektroni zao zote\(n = 1\) jangwani. Lithiamu (angalia meza ya mara kwa mara) ina elektroni tatu, na hivyo mtu lazima awe katika\(n = 2\) ngazi. Hii inasababisha dhana ya shells na kujaza shell. Kama sisi maendeleo juu katika idadi ya elektroni, sisi kwenda kutoka hidrojeni heliamu, lithiamu, berili, boroni, na kadhalika, na tunaona kwamba kuna mipaka kwa idadi ya elektroni kwa kila thamani ya\(n\). Maadili ya juu ya shell\(n\) yanahusiana na nguvu ya juu, na wanaweza kuruhusu elektroni zaidi kwa sababu ya mchanganyiko mbalimbali wa\(l, \, m_l\), na\(m_s\) kwamba ni iwezekanavyo. Kila thamani ya namba kuu ya quantum\(n\) hivyo inalingana na ganda la atomiki ambalo idadi ndogo ya elektroni inaweza kwenda. Shells na idadi ya elektroni ndani yao huamua mali ya kimwili na kemikali ya atomi, kwani ni elektroni za nje ambazo zinaingiliana zaidi na chochote nje ya atomu.
Mawingu uwezekano wa elektroni na thamani ya chini kabisa ya\(l\) ni karibu na kiini na, hivyo, zaidi tightly amefungwa. Hivyo wakati shells kujaza, wao kuanza na\(l = 0\), kuendelea\(l = 1\), na kadhalika. Kila thamani ya\(l\) hivyo inalingana na subshell.
Jedwali lililotolewa hapa chini linaorodhesha alama za jadi zinazotumiwa kutaja shells na subshells.
| Shell | subshell | Mkono |
|---|---|---|
| \(n\) | \(l\) | |
| 1 | 0 | \(s\) |
| 2 | 1 | \(p\) |
| 3 | 2 | \(d\) |
| 4 | 3 | \(f\) |
| 5 | 4 | \(g\) |
| 6 | \(h\) | |
| \(6^i\) | \(i\) |
Ili kutaja shells na subshells, tunaandika\(nl\) kwa nambari\(n\) na barua kwa\(l\). Kwa mfano, elektroni katika\(n = 1\) hali lazima iwe\(l = 0\) na inaashiria kama\(1s\) elektroni. elektroni mbili katika\(n = 1\) hali ni ulionyehsa kama\(1s^2\). Mfano mwingine ni elektroni katika\(n = 2\) hali na\(l = 1\), imeandikwa\(2p\) kama.Kesi ya elektroni tatu yenye namba hizi za quantum imeandikwa\(2p^3\). Nukuu hii, inayoitwa spectroscopic notation, ni ya jumla kama inavyoonekana katika Kielelezo.
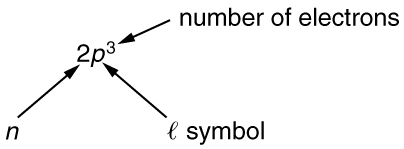
Kuhesabu idadi ya mchanganyiko iwezekanavyo wa namba za quantum zinazoruhusiwa na kanuni ya kutengwa, tunaweza kuamua ngapi elektroni inachukua kujaza kila subshell na shell.
Mfano\(\PageIndex{1}\): How Many Electrons Can Be in This Shell?
Andika orodha zote zinazowezekana za namba za quantum kwa\(n = 2\) shell, na ueleze idadi ya elektroni ambayo inaweza kuwa katika shell na kila subshells zake.
Mkakati
Kutokana\(n = 2\) na shell, sheria za idadi ya quantum kikomo\(l\) kuwa 0 au 1. Kwa hiyo shell ina subshells mbili, kinachoitwa\(2s\) na\(2p\). Kwa kuwa\(l\) subshell ya chini inajaza kwanza, tunaanza na uwezekano wa\(2s\) subshell na kisha kuendelea na\(2p\) subshell.
Suluhisho
Ni rahisi kuorodhesha idadi ya quantum iwezekanavyo katika meza, kama inavyoonyeshwa hapa chini.
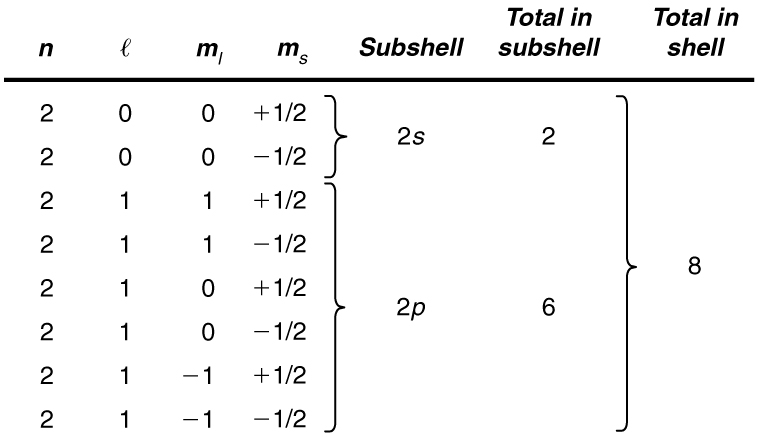
Majadiliano
Ni ngumu kufanya meza kama hii kila wakati tunataka kujua jinsi elektroni nyingi zinaweza kuwa katika shell au subshell. Kuna sheria za jumla ambazo ni rahisi kutumia, kama tutakavyoona sasa.
Idadi ya elektroni ambayo inaweza kuwa katika subshell inategemea kabisa juu ya thamani ya\(l\). Mara baada\(l\) ya kujulikana, kuna fasta idadi ya maadili ya\(m_l\), ambayo kila mmoja anaweza kuwa na maadili mawili kwa\(m_s\). Kwanza, tangu\(m_l\) huenda kutoka\(-l\)\(l\) kwa hatua za 1, kuna\(2l + 1\) uwezekano. Nambari hii imeongezeka kwa 2, kwani kila elektroni inaweza kugeuka au kupungua. Hivyo idadi kubwa ya elektroni ambayo inaweza kuwa katika subshell ni\(2(2l + 1)\).
Kwa mfano,\(2s\) subshell katika Mfano ina kiwango cha juu cha elektroni 2 ndani yake, tangu\(2(2l + 1) = 2(0 + 1) = 2\) kwa subshell hii. Vile vile,\(2p\) subshell ina kiwango cha juu cha elektroni 6, tangu\(2(2l + 1) = 2(2 + 1) = 6\). Kwa shell, idadi ya juu ni jumla ya kile kinachoweza kufaa katika subshells. Baadhi ya algebra inaonyesha kwamba idadi kubwa ya elektroni ambayo inaweza kuwa katika ganda ni\(2n^2\).
Kwa mfano, kwa shell ya kwanza\(n = 1\), na hivyo\(2n^2 = 2\). Tumeona kwamba elektroni mbili tu zinaweza kuwa katika\(n = 1\) shell. Vile vile, kwa shell ya pili\(n = 2\), na hivyo\(2n^2 = 8\). Kama inavyopatikana katika Mfano, jumla ya idadi ya elektroni katika\(n = 2\) ganda ni 8.
Mfano\(\PageIndex{2}\): Subshells and Totals for \(n = 3\)
Je! Subshells ngapi ziko kwenye\(n = 3\) shell? Kutambua kila subshell, mahesabu ya idadi ya juu ya elektroni ambayo inafaa katika kila, na kuthibitisha kwamba jumla ni\(2n^2\).
Mkakati
Subshells ni kuamua na thamani ya\(l\); hivyo, sisi kwanza kuamua\(l\) ni maadili gani ya kuruhusiwa, na kisha sisi kuomba equation “upeo idadi ya elektroni ambayo inaweza kuwa katika subshell\(= 2(2l + 1)\)" kupata idadi ya elektroni katika kila subshell.
Suluhisho
Tangu\(n = 3\), tunajua kwamba\(l\) inaweza kuwa\(0,\space 1\) au\(2\), kwa hiyo, kuna subshells tatu zinazowezekana. Katika nukuu ya kawaida, wao ni lebo\(3s, \, 3p,\) na\(3d\) subshells. Tayari tumeona kwamba elektroni 2 zinaweza kuwa katika\(s\) hali, na 6 katika\(p\) hali, lakini hebu tutumie equation “idadi kubwa ya elektroni ambayo inaweza kuwa katika subshell\(= 2(2l + 1)\)" ili kuhesabu idadi ya juu katika kila mmoja:
\[3s \, has \, l = 0; \, thus, \, 2(2l + 1) = 2(0 + 1) = 2\]
\[3p \, has \, l = 1; \, thus, \, 2(2l + 1) = 2(2 + 1) = 6\]
\[3d \, has \, l = 2; \, thus, \, 2(2l + 1) = 2(4 + 1) = 10\]
\[Total = 18\]
\[(in \, the \, n = 3 \, shell)\]
Equation “upeo wa idadi ya elektroni ambayo inaweza kuwa katika shell\(= 2n^2\)" inatoa idadi ya juu katika\(n = 3\) shell kuwa
\[Maximum \, number \, of \, electrons = 2n^2 = 2(3)^2 = 2(9) = 18.\]
Majadiliano
Idadi ya elektroni katika subshells tatu iwezekanavyo ni sawa na formula\(2n^2\). Katika kiwango cha kawaida (spectroscopic),\(n = 3\) shell iliyojaa imeonyeshwa kama\(3s^2 3p^6 3d^10\). Shells hazijaza kwa njia rahisi. Kabla ya\(n = 3\) shell imejazwa kabisa, kwa mfano, tunaanza kupata elektroni kwenye\(n = 4\) shell.
Kujaza Shell na Jedwali la Mara kwa mara
Jedwali linaonyesha usanidi wa elektroni kwa vipengele 20 vya kwanza katika meza ya mara kwa mara, kuanzia na hidrojeni na elektroni yake moja na kuishia na kalsiamu. Kanuni ya kutengwa kwa Pauli huamua idadi kubwa ya elektroni zinazoruhusiwa katika kila ganda na subshell. Lakini utaratibu ambao shells na subshells hujazwa ni ngumu kwa sababu ya idadi kubwa ya mwingiliano kati ya elektroni.
| Element | Idadi ya elektroni (Z) | Configuration hali ya ardhi |
|---|---|---|
| H | 1 | \(1s^1\) |
| Yeye | 2 | \(1s^2\) |
| Li | 3 | \(1s^2 \, 2s^1\) |
| Kuwa | 4 | \( " \, 2s^2\) |
| B | 5 | \( " \, 2s^2 \, 2p^1\) |
| C | 6 | \( " \, 2s^2 \, 2p^2\) |
| N | 7 | \( " \, 2s^2 \, 2p^3\) |
| O | 8 | \( " \, 2s^2 \, 2p^4\) |
| F | 9 | \( " \, 2s^2 \, 2p^5\) |
| Ne | 10 | \( " \, 2s^2 \, 2p^6\) |
| Na | 11 | \( " \, 2s^2 \, 2p^6 \, 3s^1\) |
| Mg | 12 | \( " \, " \, " \, 3s^2\) |
| Al | 13 | \( " \, " \, " \, 3s^2 \, 3p^1\) |
| na | 14 | \( " \, " \space" \, 3s^2 \, 3p^2\) |
| P | 15 | \( " \space " \, " \, 3s^2 \, 3p^3\) |
| S | 16 | \( " \, " \, " \, 3s^2 \, 3p^4\) |
| Cl | 17 | \( " \, " \, " \, 3s^2 \, 3p^5\) |
| Ar | 18 | \( " \, " \, " \, 3s^2 \, 3p^6\) |
| K | 19 | \( " \, " \, " \, 3s^2 \, 3p^6 \, 4s^1\) |
| Ca | 20 | \( " \, " \, " \, " \, " \, 4s^2\) |
Kuchunguza jedwali hapo juu, unaweza kuona kwamba kadiri idadi ya elektroni katika atomu inavyoongezeka kutoka 1 katika hidrojeni hadi 2 katika heliamu na kadhalika, ganda la chini la nishati linajazwa kwanza-yaani\(n = 1\) ganda linajaza kwanza, halafu\(n = 2\) ganda linaanza kujaza. Ndani ya shell, subshells kujaza kuanzia na chini kabisa\(l\), au kwa\(s\) subshell, basi, na kadhalika, kwa kawaida mpaka subshells wote ni kujazwa.\(p\) Tofauti ya kwanza kwa hii hutokea kwa potasiamu, ambapo\(4s\) subshell huanza kujaza kabla ya elektroni yoyote kuingia kwenye\(3d\) subshell. Tofauti inayofuata haionyeshwa kwenye Jedwali; hutokea kwa rubidium, ambapo\(5s\) subshell huanza kujaza kabla ya\(4d\) subshell. Sababu ya tofauti hizi ni kwamba\(l = 0\) elektroni zina uwezekano wa mawingu ambayo hupenya karibu na kiini na, kwa hiyo, hufungwa zaidi (chini katika nishati).
Kielelezo kinaonyesha meza ya mara kwa mara ya vipengele, kupitia kipengele 118. Ya maslahi maalum ni vipengele katika makundi makuu, yaani, wale walio kwenye nguzo zilizohesabiwa 1, 2, 13, 14, 15, 16, 17, na 18.
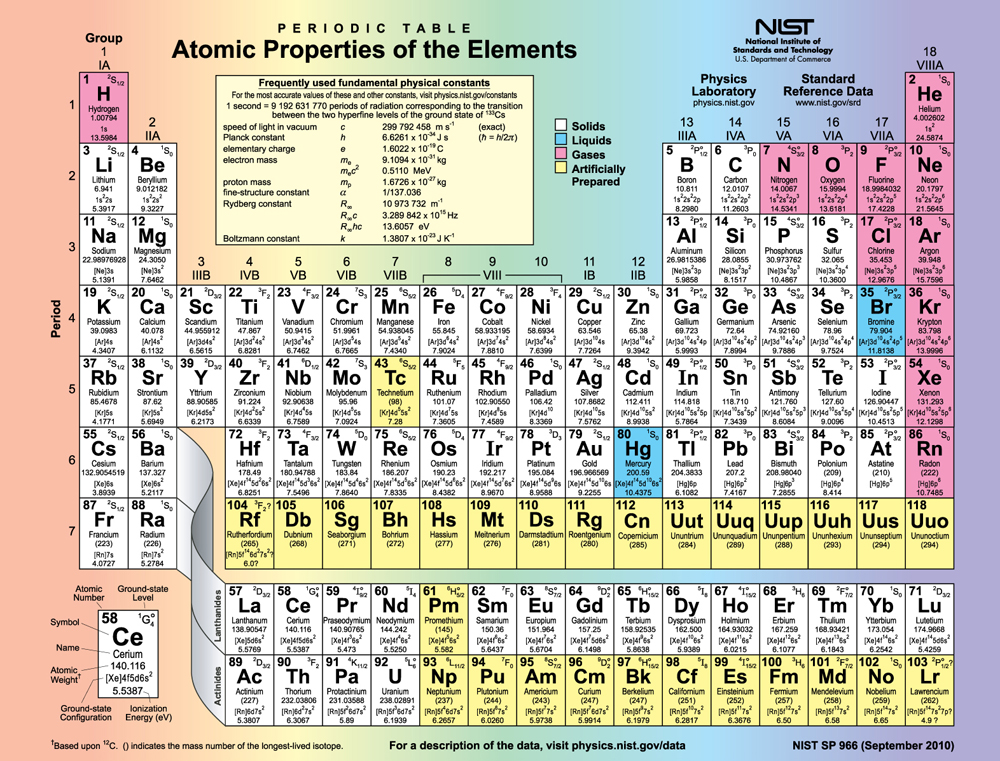
Idadi ya elektroni katika sehemu ndogo ya nje huamua tabia za kemikali za atomu, kwani ni elektroni hizi ambazo ziko mbali zaidi na kiini na hivyo huingiliana zaidi na atomi nyingine. Ikiwa subshell ya nje inaweza kukubali au kuacha elektroni kwa urahisi, basi atomi itakuwa yenye nguvu ya kemikali. Kila kikundi katika meza ya mara kwa mara kina sifa ya usanidi wake wa nje wa elektroni. Labda wengi wanaojulikana ni Kikundi cha 18 (Kikundi VIII), gesi nzuri (heliamu, neon, argon, nk). Gesi hizi zote zina sifa ya subshell iliyojaa nje ambayo imara hasa. Hii inamaanisha kuwa wana nguvu kubwa za ionization na haziacha urahisi elektroni. Zaidi ya hayo, kama walikuwa kukubali elektroni ziada, itakuwa katika ngazi ya juu sana na hivyo loosely amefungwa. Mara nyingi athari za kemikali huhusisha kugawana elektroni. Gesi nzuri zinaweza kulazimishwa katika misombo ya kemikali isiyo imara tu chini ya shinikizo la juu na joto.
Kikundi cha 17 (Kikundi cha VII) kina halojeni, kama vile fluorine, klorini, iodini na bromini, ambayo kila moja ina elektroni moja chini kuliko gesi yenye heshima ya jirani. Kila halogen ina\(p\) elektroni 5 (\(p^5\)usanidi), wakati\(p\) subshell inaweza kushikilia elektroni 6. Hii inamaanisha halojeni zina nafasi moja katika sehemu yao ya nje. Kwa hiyo hukubali kwa urahisi elektroni ya ziada (inakuwa imefungwa kwa ukali, kufunga ganda kama ilivyo katika gesi nzuri) na ni yenye nguvu sana ya kemikali. Halojeni pia ni uwezekano wa kuunda ions moja hasi, kama vile\(Cl^-\) kufaa elektroni ya ziada katika nafasi katika subshell ya nje. Kwa upande mwingine, metali za alkali, kama vile sodiamu na potasiamu, zote zina\(s\) elektroni moja katika sehemu zao za nje (\(s^1\)usanidi) na ni wanachama wa Kundi la 1 (Kikundi I). Elementi hizi huacha kwa urahisi elektroni yao ya ziada na hivyo huwa na nguvu sana ya kemikali. Kama unaweza kutarajia, wao pia huwa na kuunda ions single chanya, kama vile\(Na^+\), kwa kupoteza yao loosely amefungwa nje elektroni. Wao ni metali (conductors), kwa sababu elektroni ya nje iliyofungwa kwa uhuru inaweza kusonga kwa uhuru.
Bila shaka, makundi mengine pia yana riba. Kaboni, silicon, na germanium, kwa mfano, zina kemia zinazofanana na ziko katika Kundi la 4 (Kikundi IV). Kaboni, hasa, ni ajabu katika uwezo wake wa kuunda aina nyingi za vifungo na kuwa sehemu ya minyororo ndefu, kama vile molekuli isokaboni. Kikundi kikubwa cha kile kinachoitwa vipengele vya mpito kina sifa ya kujaza\(d\) subshells na kuvuka viwango vya nishati. Vikundi vikali, kama vile mfululizo wa lanthanide, ni ngumu zaidi-maganda yao hayajaza utaratibu rahisi. Lakini vikundi vinavyotambuliwa na wanakemia kama vile Mendeleev vina maelezo katika substructure ya atomi.
PHET EXPLORATIONS: KUJENGA CHEMBE
Kujenga atomu nje ya protoni, nyutroni, na elektroni, na kuona jinsi elementi, chaji, na mabadiliko ya molekuli. Kisha kucheza mchezo mtihani mawazo yako!

Muhtasari
- Hali ya mfumo imeelezwa kabisa na seti kamili ya namba za quantum. Seti hii imeandikwa kama\((n, \, l, \, m_i, \, m_s)\).
- Kanuni ya kutengwa kwa Pauli inasema kuwa hakuna elektroni mbili zinazoweza kuwa na seti moja ya namba za quantum; yaani hakuna elektroni mbili zinazoweza kuwa katika hali moja.
- Kuondolewa hii hupunguza idadi ya elektroni katika shells za atomiki na subshells. Kila thamani ya\(n\) sambamba na shell, na kila thamani ya\(l\) sambamba na subshell.
- Idadi kubwa ya elektroni ambayo inaweza kuwa katika subshell ni\(2(2l + 1)\).
- Idadi kubwa ya elektroni ambayo inaweza kuwa katika shell ni\(2n^2\).
maelezo ya chini
- 1 Ni jambo la kawaida kukabiliana na subshells zilizo na\(l\) zaidi ya 6, lakini wakati wa kukutana, zinaendelea kuitwa kwa utaratibu wa alfabeti.
faharasa
- idadi ya atomiki
- idadi ya protoni katika kiini cha atomi
- Kanuni ya kutengwa kwa Pauli
- kanuni ambayo inasema kwamba hakuna elektroni mbili zinaweza kuwa na seti sawa ya namba za quantum; yaani, hakuna elektroni mbili zinaweza kuwa katika hali sawa
- ganda
- wingu uwezekano kwa elektroni ambayo ina moja kuu quantum idadi
- subshell
- uwezekano wingu kwa elektroni ambayo ina moja angular kasi quantum idadi


