5.5: Uundaji wa Mipangilio ya Spectral
- Page ID
- 176087
Malengo ya kujifunza
Mwishoni mwa sehemu hii, utaweza:
- Eleza jinsi spectra ya mstari wa chafu na spectra ya mstari wa ngozi huundwa
- Eleza ni ions gani na jinsi zinavyoundwa
- Eleza jinsi mistari ya spectral na viwango vya ionization katika gesi vinaweza kutusaidia kuamua joto lake
Tunaweza kutumia mfano wa Bohr wa atomi kuelewa jinsi mistari ya spectral inavyoundwa. Dhana ya viwango vya nishati kwa njia za elektroni katika atomu inaongoza kiasili kwa ufafanuzi wa kwa nini atomi huchukua au hutoa nguvu maalum tu au wavelengths ya nuru.
Wigo wa hidrojeni
Hebu tuangalie atomi ya hidrojeni kutokana na mtazamo wa mfano wa Bohr. Tuseme boriti ya mwanga mweupe (ambayo ina photons ya wavelengths zote zinazoonekana) huangaza kupitia gesi ya hidrojeni ya atomiki. Photon ya wavelength 656 nanometers ina nishati tu ya haki ya kuongeza elektroni katika atomi ya hidrojeni kutoka pili hadi obiti ya tatu. Hivyo, kama fotoni zote za nguvu tofauti (au wavelengths au rangi) zinazotokana na atomi za hidrojeni, photoni na wavelength hii inaweza kufyonzwa na atomi hizo ambazo elektroni zinazunguka kwenye ngazi ya pili. Wakati wa kufyonzwa, elektroni kwenye ngazi ya pili itahamia ngazi ya tatu, na idadi ya photons ya wavelength hii na nishati zitapotea kutoka kwa mkondo wa jumla wa mwanga mweupe.
Photons nyingine zitakuwa na nguvu za kulia za kuongeza elektroni kutoka kwa pili hadi obiti ya nne, au kutoka kwa obiti ya kwanza hadi ya tano, na kadhalika. Photons tu na nguvu hizi halisi zinaweza kufyonzwa. Wote wa photons nyingine itakuwa mkondo nyuma atomi bila kuguswa. Hivyo, atomi hidrojeni kunyonya mwanga katika wavelengths fulani tu na kuzalisha mistari giza katika wavelengths wale katika wigo tunaona.
Tuseme tuna chombo cha gesi ya hidrojeni kwa njia ambayo mfululizo mzima wa photoni unapita, kuruhusu elektroni nyingi kuhamia ngazi za juu. Wakati sisi kuzima chanzo mwanga, elektroni hizi “kuanguka” nyuma kutoka kubwa kwa orbits ndogo na emit photons ya mwanga-lakini, tena, tu mwanga wa nguvu hizo au wavelengths kwamba yanahusiana na tofauti ya nishati kati ya orbits ruhusa. Mabadiliko ya orbital ya elektroni ya hidrojeni ambayo hutoa mistari fulani ya spectral yanaonyeshwa kwenye Kielelezo\(\PageIndex{1}\).
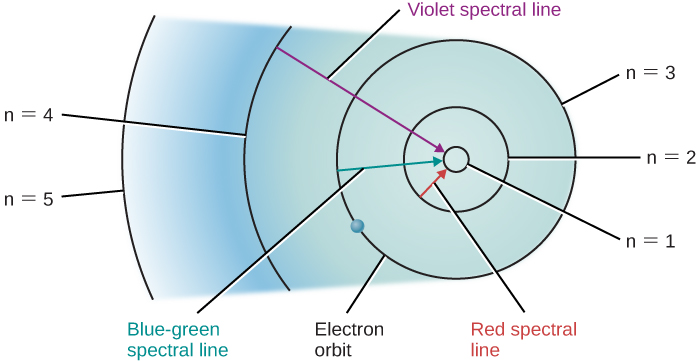
Picha zinazofanana zinaweza kuteka kwa atomi zingine isipokuwa hidrojeni. Hata hivyo, kwa sababu atomi hizi nyingine huwa na elektroni zaidi ya moja kila mmoja, njia za elektroni zao ni ngumu zaidi, na spectra ni ngumu zaidi pia. Kwa madhumuni yetu, hitimisho muhimu ni hili: kila aina ya atomu ina muundo wake wa kipekee wa njia za elektroni, na hakuna seti mbili za mizunguko ni sawa kabisa. Hii ina maana kwamba kila aina ya atomi inaonyesha seti yake ya kipekee ya mistari ya spectral, zinazozalishwa na elektroni zinazohamia kati ya seti yake ya kipekee ya orbits.
Wanaastronomia na fizikia wamefanya kazi kwa bidii kujifunza mistari inayoenda na kila elementi kwa kusoma jinsi atomi zinavyoweza kunyonya na kutoa mwanga katika maabara hapa duniani. Kisha wanaweza kutumia ujuzi huu kutambua mambo katika miili ya mbinguni. Kwa njia hii, sasa tunajua maumbo ya kemikali ya sio nyota yoyote tu, bali hata galaksi za nyota zilizo mbali sana kiasi kwamba nuru yao ilianza kuelekea kwetu muda mrefu kabla ya Dunia kuundwa.
Ngazi za Nishati na Uchochezi
Mfano wa Bohr wa atomi ya hidrojeni ulikuwa hatua kubwa mbele katika ufahamu wetu wa atomu. Hata hivyo, tunajua leo kwamba atomi haziwezi kuwakilishwa na picha rahisi sana. Kwa mfano, dhana ya njia za elektroni zilizoelezwa kwa kasi sio sahihi sana; hata hivyo, kwa kiwango cha kozi hii ya utangulizi, wazo kwamba nguvu fulani za kipekee zinaruhusiwa kwa atomi ni muhimu sana. Viwango vya nishati ambavyo tumekuwa tukijadili vinaweza kufikiriwa kama vinavyowakilisha umbali fulani wa wastani wa njia za elektroni zinazowezekana kutoka kiini atomia.
Kwa kawaida, atomi iko katika hali ya nishati ya chini kabisa, hali yake ya ardhi. Katika mfano wa Bohr wa atomi ya hidrojeni, hali ya ardhi inalingana na elektroni kuwa katika obiti ya ndani. Atomu inaweza kunyonya nishati, ambayo inaibua kwa kiwango cha juu cha nishati (sambamba, katika picha rahisi ya Bohr, kwa mwendo wa elektroni hadi obiti kubwa) —hii inajulikana kama msisimko. Atomu hiyo inasemekana kuwa katika hali ya msisimko. Kwa ujumla, atomu inabakia msisimko kwa muda mfupi tu. Baada ya muda mfupi, kwa kawaida mia milioni ya pili au hivyo, inarudi kwa hiari kwa hali yake ya ardhi, na chafu ya wakati huo huo wa mwanga. Atomu inaweza kurudi katika hali yake ya chini kabisa katika kuruka moja, au inaweza kufanya mpito katika hatua za kuruka mbili au zaidi, kuacha katika ngazi za kati njiani chini. Kwa kila kuruka, hutoa photon ya wavelength ambayo inalingana na tofauti ya nishati kati ya ngazi mwanzoni na mwisho wa kuruka hiyo.
Mchoro wa kiwango cha nishati kwa atomi ya hidrojeni na mabadiliko kadhaa ya atomiki yanavyoonekana kwenye Mchoro\(\PageIndex{2}\). Tunapopima nguvu zinazohusika kama atomi anaruka kati ya ngazi, tunaona kwamba mabadiliko kwenda au kutoka hali ya ardhi, inayoitwa mfululizo wa mistari ya Lyman, husababisha uchafu au ngozi ya photons ultraviolet. Lakini mabadiliko ya au kutoka hali ya kwanza ya msisimko (kinachoitwa n = 2 katika sehemu (a) ya Kielelezo\(\PageIndex{2}\)), inayoitwa mfululizo wa Balmer, huzalisha chafu au ngozi katika mwanga unaoonekana. Kwa kweli, ilikuwa kuelezea mfululizo huu wa Balmer kwamba Bohr kwanza alipendekeza mfano wake wa atomu.
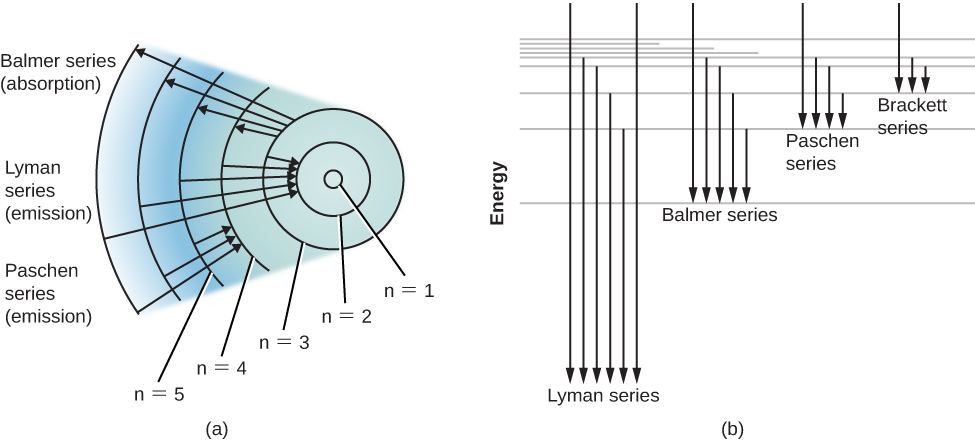
Atomi ambazo kufyonzwa fotoni maalum kutoka boriti kupita ya mwanga mweupe na hivyo kuwa msisimko kwa ujumla de-Excite wenyewe na emit mwanga huo tena katika muda mfupi sana. Unaweza kushangaa, basi, kwa nini mistari ya giza ya spectral imewahi kuzalishwa. Kwa maneno mengine, kwa nini hii mwanga reemitted haraka “kujaza” nyeusi ngozi mistari?
Fikiria boriti ya mwanga mweupe inayokuja kwako kupitia gesi ya baridi. Baadhi ya mwanga reemitted ni kweli akarudi boriti ya mwanga nyeupe unaweza kuona, lakini hii inajaza katika mistari ngozi tu kwa kiasi kidogo. Sababu ni kwamba atomi katika gesi reemit mwanga katika pande zote, na sehemu ndogo tu ya mwanga reemitted ni katika mwelekeo wa boriti ya awali (kuelekea wewe). Katika nyota, sehemu kubwa ya mwanga uliotolewa huenda katika mwelekeo unaoelekea nyuma kwenye nyota, ambayo inafanya waangalizi nje ya nyota hakuna jambo lolote.
Kielelezo\(\PageIndex{3}\) muhtasari aina mbalimbali za spectra tuna kujadiliwa. Bonde la taa la incandescent hutoa wigo unaoendelea. Wakati wigo huo unaoendelea unatazamwa kupitia wingu mwembamba wa gesi, wigo wa mstari wa ngozi unaweza kuonekana juu ya wigo unaoendelea. Kama sisi kuangalia tu wingu la atomi gesi msisimko (na hakuna chanzo kuendelea kuonekana nyuma yake), tunaona kwamba atomi msisimko kutoa mbali chafu line wigo.
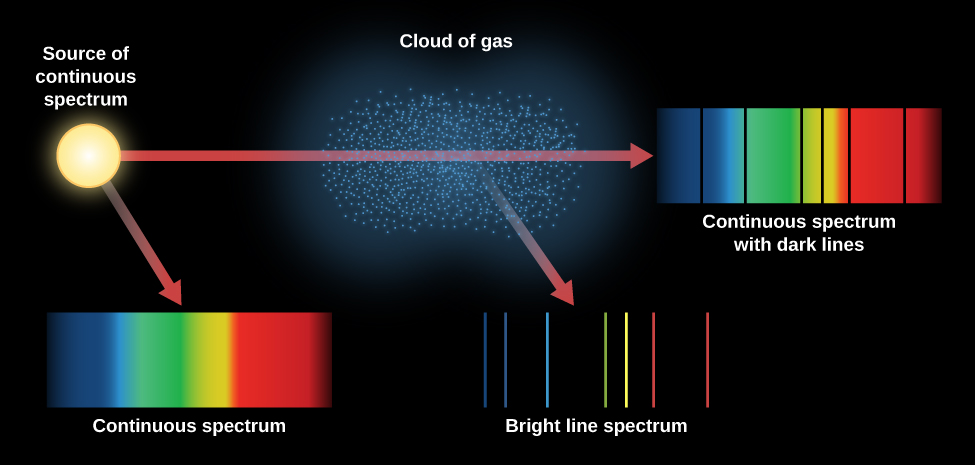
Atomi katika gesi ya moto huhamia kwa kasi ya juu na kuendelea kugongana na kila mmoja na kwa elektroni yoyote huru. Zinaweza kuwa na msisimko (elektroni zinazohamia ngazi ya juu) na de-msisimko (elektroni zinazohamia ngazi ya chini) na migongano haya pamoja na kwa kunyonya na kutoa mwanga. Kasi ya atomi katika gesi inategemea halijoto. Wakati joto ni kubwa, ndivyo kasi na nishati ya migongano. Kwa hiyo, moto wa gesi, uwezekano mkubwa zaidi kwamba elektroni zitachukua njia za nje, ambazo zinahusiana na viwango vya juu vya nishati. Hii inamaanisha kuwa kiwango ambako elektroni zinaanza kuruka kwao juu katika gesi inaweza kutumika kama kiashiria cha jinsi gesi hiyo inavyowaka. Kwa njia hii, mistari ya ngozi katika wigo huwapa wataalamu wa astronomia habari kuhusu joto la mikoa ambako mistari hutoka.
Kutumia simulation hii ya kucheza na atomi hidrojeni na kuona nini kinatokea wakati elektroni kuhamia ngazi ya juu na kisha kutoa mbali photons kama wao kwenda ngazi ya chini.
ionization
Tumeelezea jinsi kiasi fulani cha nishati kinachoweza kufyonzwa na atomu, kuinua kwa hali ya msisimko na kusonga moja ya elektroni zake mbali na kiini chake. Ikiwa nishati ya kutosha inafyonzwa, elektroni inaweza kuondolewa kabisa kutoka atomi—hii inaitwa ionization. Atomu hiyo inasemekana kuwa ionized. Kiasi cha chini cha nishati kinachohitajika kuondoa elektroni moja kutoka atomu katika hali yake ya ardhi inaitwa nishati yake ya ionization.
Bado kiasi kikubwa cha nishati kinapaswa kufyonzwa na atomi ya sasa ionized (inayoitwa ion) ili kuondoa elektroni ya ziada zaidi katika muundo wa atomu. Nguvu kubwa mfululizo zinahitajika ili kuondoa elektroni ya tatu, ya nne, ya tano-na kadhalika—kutoka atomu. Ikiwa nishati ya kutosha inapatikana, atomu inaweza kuwa ionized kabisa, kupoteza elektroni zake zote. Atomu ya hidrojeni, yenye elektroni moja tu ya kupoteza, inaweza ionized mara moja tu; atomu ya heliamu inaweza ionized mara mbili; na atomu ya oksijeni hadi mara nane. Tunapochunguza mikoa ya cosmos ambako kuna mionzi mionzi yenye nguvu, kama vile vitongoji ambako nyota za vijana za moto zimeundwa hivi karibuni, tunaona ionization nyingi zinaendelea.
Atomi ambayo imekuwa chanya ionized imepoteza malipo hasi-elektroni-kukosa elektroni-na hivyo ni kushoto na chaji chanya wavu. Kwa hiyo ina kivutio kikubwa juu ya elektroni yoyote ya bure. Hatimaye, elektroni moja au zaidi zitatekwa na atomu itakuwa neutral (au ionized kwa shahada moja chini) tena. Wakati wa mchakato wa kukamata elektroni, atomi hutoa photoni moja au zaidi. Fotoni ipi zinazotolewa hutegemea kama elektroni inatekwa mara moja hadi kiwango cha chini kabisa cha nishati ya atomi au inacha kwenye ngazi moja au zaidi ya kati njiani kwenda ngazi ya chini kabisa inayopatikana.
Kama vile uchochezi wa atomi unaweza kusababisha mgongano na atomi nyingine, ion, au elektroni (migongano na elektroni ni kawaida muhimu zaidi), hivyo inaweza ionization. Kiwango ambacho ionizations hiyo ya migongano hutokea inategemea kasi ya atomi na hivyo juu ya halijoto ya gesi-moto gesi, zaidi ya atomi zake zitakuwa ionized.
Kiwango ambacho ioni na elektroni hujiunga tena pia hutegemea kasi zao-yaani juu ya halijoto. Aidha, inategemea wiani wa gesi: wiani wa juu, nafasi kubwa ya kurejesha tena, kwa sababu aina tofauti za chembe zimejaa kwa karibu zaidi. Kutokana na ujuzi wa joto na wiani wa gesi, inawezekana kuhesabu sehemu ya atomi ambazo zimekuwa ionized mara moja, mara mbili, na kadhalika. Katika Jua, kwa mfano, tunaona kwamba wengi wa atomi za hidrojeni na heliamu katika anga yake hazina upande wowote, ambapo atomi nyingi za kalsiamu, pamoja na atomi nyingine nyingi nzito, zina ionized mara moja.
Viwango vya nishati vya atomi ionized ni tofauti kabisa na zile za atomi ileile wakati hazipatikani. Kila wakati elektroni imeondolewa kwenye atomi, viwango vya nishati vya ion, na hivyo wavelengths ya mistari ya spectral inaweza kuzalisha, mabadiliko. Hii husaidia wanaastronomia kutofautisha ions za elementi fulani. Hidrojeni ionized, isiyo na elektroni, haiwezi kuzalisha mistari ya ngozi.
Dhana muhimu na Muhtasari
Wakati elektroni zinatoka ngazi ya juu ya nishati hadi chini, photoni hutolewa, na mstari wa chafu unaweza kuonekana katika wigo. Mistari ya ngozi huonekana wakati elektroni hupata fotoni na kuhamia ngazi za juu za nishati. Kwa kuwa kila atomi ina sifa yake ya viwango vya nishati, kila mmoja anahusishwa na muundo wa kipekee wa mistari ya spectral. Hii inaruhusu wanaastronomia kuamua ni vipi elementi zilizopo kwenye nyota na katika mawingu ya gesi na vumbi kati ya nyota. Atomu katika ngazi yake ya chini kabisa ya nishati iko katika hali ya ardhi. Ikiwa elektroni iko katika obiti nyingine isipokuwa ile ya juhudi ndogo iwezekanavyo, atomu inasemekana kuwa na msisimko. Ikiwa atomu imepoteza elektroni moja au zaidi inaitwa ioni na inasemekana kuwa ionized. Spectra ya ions tofauti inaonekana tofauti na inaweza kuwaambia wanaastronomia kuhusu joto la vyanzo wanavyoangalia.
faharasa
- inayosisimua
- mchakato wa kutoa atomi au ioni kiasi cha nishati kubwa kuliko ilivyo katika hali yake ya chini kabisa ya nishati (ardhi)
- hali ya ardhi
- hali ya chini ya nishati ya atomi
- ioni
- atomu ambayo imeshtakiwa kwa umeme kwa kuongeza au kupoteza elektroni moja au zaidi
- uionishaji
- mchakato ambao atomi hupata au hupoteza elektroni


