5.4: Muundo wa Atom
- Page ID
- 176063
Malengo ya kujifunza
Mwishoni mwa sehemu hii, utaweza:
- Eleza muundo wa atomi na vipengele vya nuclei
- Eleza tabia ya elektroni ndani ya atomi na jinsi elektroni inavyoingiliana na nuru kuhamia kati ya viwango vya nishati
Wazo kwamba jambo linajumuisha chembe vidogo vinavyoitwa atomi ni angalau umri wa karne 25. Ilichukua hadi karne ya ishirini, hata hivyo, kwa wanasayansi kuvumbua vyombo vilivyowawezesha kuchunguza ndani ya atomu na kupata kwamba si, kama ilivyofikiriwa, ngumu na isiyoonekana. Badala yake, atomu ni muundo tata unaojumuisha chembe ndogo bado.
Kuchunguza Atom
Ya kwanza ya chembe hizi ndogo iligunduliwa na mwanafizikia wa Uingereza James (J. J.) Thomson mwaka 1897. Aitwaye elektroni, chembe hii inashtakiwa vibaya. (Ni mtiririko wa chembe hizi zinazozalisha mikondo ya umeme, iwe katika bolts za umeme au kwenye waya zinazoongoza kwenye taa yako.) Kwa sababu atomi katika hali yake ya kawaida ni umeme neutral, kila elektroni katika atomi lazima iwe na usawa na kiasi sawa cha chaji chanya.
Hatua inayofuata ilikuwa kuamua wapi katika atomi mashtaka mazuri na hasi yanapatikana. Mwaka wa 1911, mwanafizikia wa Uingereza Ernest Rutherford alipanga jaribio ambalo lilitoa sehemu ya jibu la swali hili. Alipiga kipande nyembamba sana cha foil ya dhahabu, tu juu ya atomi 400 nene, na boriti ya chembe za alpha (Kielelezo\(\PageIndex{1}\)). Chembe za alpha (α chembe) ni atomi za heliamu ambazo zimepoteza elektroni zao na hivyo zina chaji chanya. Wengi wa chembe hizi zilipita ingawa foil ya dhahabu kama vile na atomi ndani yake zilikuwa karibu nafasi tupu. Kuhusu 1 katika 8000 ya chembe alpha, hata hivyo, kabisa kuachwa mwelekeo na bounced nyuma kutoka foil. Rutherford aliandika, “Ilikuwa ni tukio la ajabu sana ambalo limewahi kutokea kwangu katika maisha yangu. Ilikuwa karibu kama ajabu kama wewe fired shell 15-inch katika kipande cha karatasi tishu na akarudi na kugonga wewe.”
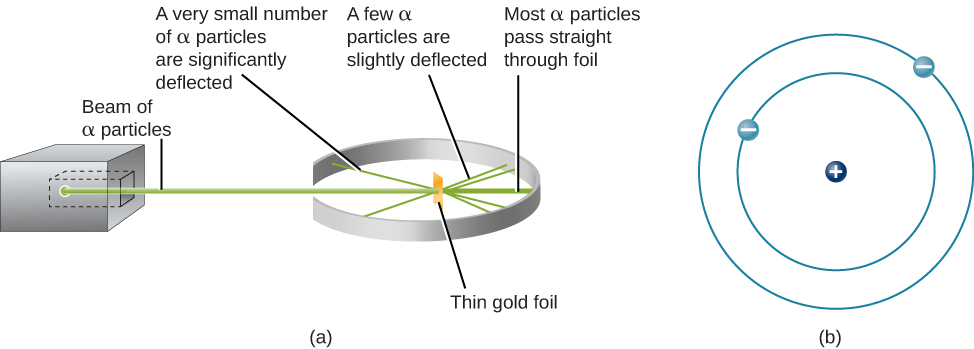
Njia pekee ya akaunti kwa chembe kwamba kuachwa mwelekeo wakati wao hit foil dhahabu ilikuwa kudhani kwamba karibu wote wa wingi, kama vile wote wa malipo chanya katika kila mtu binafsi chembe dhahabu, ni kujilimbikizia katika kituo kidogo au kiini. Wakati chanya kushtakiwa alpha chembe mgomo kiini, ni reverses mwelekeo, kama vile cue mpira reverses mwelekeo wakati mgomo mwingine billiard mpira. Mfano wa Rutherford uliweka aina nyingine ya malipo-elektroni hasi katika obiti kuzunguka kiini hiki.
Mfano wa Rutherford ulihitaji elektroni ziwe katika mwendo. Mashtaka mazuri na hasi huvutia kila mmoja, hivyo elektroni za stationary zingeanguka kwenye kiini chanya. Pia, kwa sababu elektroni zote na kiini ni ndogo mno, wengi wa atomu ni tupu, ndiyo sababu karibu chembe zote za Rutherford ziliweza kupita haki kupitia foil ya dhahabu bila kugongana na chochote. Mfano wa Rutherford ulikuwa maelezo mafanikio sana ya majaribio aliyoyafanya, ingawa hatimaye wanasayansi wangegundua kwamba hata kiini chenyewe kina muundo.
Kiini Atomiki
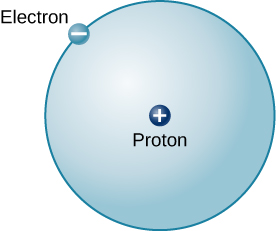
Atomi rahisi iwezekanavyo (na moja ya kawaida katika Jua na nyota) ni hidrojeni. Kiini cha hidrojeni ya kawaida kina protoni moja. Kuzunguka protoni hii ni elektroni moja. Masi ya elektroni ni karibu mara 2000 ndogo kuliko masi ya protoni; elektroni hubeba kiasi cha chaji hasa sawa na ile ya protoni lakini kinyume katika ishara (Kielelezo\(\PageIndex{2}\)). Mashtaka kinyume huvutia kila mmoja, hivyo ni nguvu ya sumakuumeme inayoshikilia protoni na elektroni pamoja, kama vile mvuto ni nguvu inayoweka sayari katika obiti kuzunguka Jua.
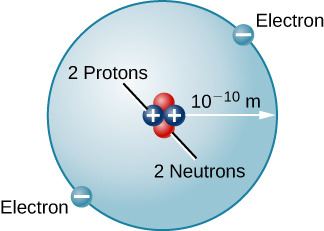
Kuna aina nyingine nyingi za atomi katika asili. Heliamu, kwa mfano, ni elementi ya pili kwa wingi katika Jua. Heliamu ina protoni mbili katika kiini chake badala ya protoni moja inayofafanua hidrojeni. Aidha kiini cha heliamu kina nyutroni mbili, chembe zenye masi zinazofanana na ile ya protoni lakini zisizo na chaji za umeme. Kuzunguka kiini hiki ni elektroni mbili, hivyo jumla ya malipo ya wavu ya atomi ya heliamu pia ni sifuri (Kielelezo\(\PageIndex{3}\)).
Kutokana na maelezo haya ya hidrojeni na heliamu, labda umefikiria mfano wa kujenga vipengele vyote (aina tofauti za atomi) tunayopata ulimwenguni. Aina ya elementi imedhamiriwa na idadi ya protoni katika kiini cha atomi. Kwa mfano, atomi yoyote yenye protoni sita ni elementi kaboni, na protoni nane ni oksijeni, na 26 ni chuma, na kwa 92 ni uranium. Duniani atomu ya kawaida ina idadi sawa ya elektroni kama protoni, na elektroni hizi hufuata ruwaza za orbital tata kuzunguka kiini. Nyota ndani ya kina, hata hivyo, ni moto kiasi kwamba elektroni zinatoka kwenye kiini na (kama tutakavyoona) zinaongoza maisha tofauti lakini yanazalisha.
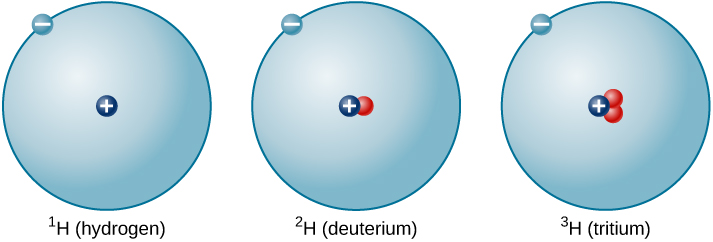
Uwiano wa nyutroni kwa protoni huongezeka kadiri idadi ya protoni inavyoongezeka, lakini kila elementi ni ya pekee. Idadi ya nyutroni si lazima sawa kwa atomi zote za elementi iliyotolewa. Kwa mfano, atomi nyingi za hidrojeni hazina nyutroni kabisa. Kuna, hata hivyo, atomi za hidrojeni zilizo na protoni moja na neutroni moja, na nyingine ambazo zina protoni moja na nyutroni mbili. Aina mbalimbali za viini vya hidrojeni zenye namba tofauti za nyutroni huitwa isotopi za hidrojeni (Kielelezo\(\PageIndex{4}\)), na elementi nyingine zote zina isotopi pia. Unaweza kufikiria isotopi kama ndugu katika elementi moja “familia” -kuhusiana kwa karibu lakini kwa sifa na tabia tofauti.
Ili kuchunguza muundo wa atomi, nenda kwenye tovuti ya Phet Build an Atom ambapo unaweza kuongeza protoni, nyutroni, au elektroni kwa mfano na jina la elementi uliloumba litaonekana. Unaweza pia kuona malipo ya wavu, namba ya wingi, iwe imara au imara, na ikiwa ni ion au atomi ya neutral.
Atom ya Bohr
Mfano wa Rutherford kwa atomi una tatizo moja kubwa. Nadharia ya Maxwell ya mionzi ya sumakuumeme inasema kwamba wakati elektroni zinabadilika ama kasi au mwelekeo wa mwendo, lazima zitoe nishati. Kuzunguka elektroni daima hubadilisha mwelekeo wao wa mwendo, hivyo wanapaswa kutoa mkondo wa nishati mara kwa mara. Kutumia nadharia ya Maxwell kwa mfano wa Rutherford, elektroni zote zinapaswa kuzunguka ndani ya kiini cha atomu kadiri zinapopoteza nishati, na kuanguka hii kunapaswa kutokea haraka sana—katika takriban sekunde 10-16.
Alikuwa mwanafizikia wa Denmark Niels Bohr (1885—1962) aliyetatua fumbo la jinsi elektroni zilizobaki katika obiti. Alikuwa anajaribu kuendeleza mfano wa atomu ambayo pia ingeelezea mara kwa mara fulani inayoonekana katika wigo wa hidrojeni. Alipendekeza kwamba wigo wa hidrojeni unaweza kueleweka kama tunadhani kwamba njia za ukubwa fulani tu zinawezekana kwa elektroni. Bohr alidhani zaidi ya kwamba kadri elektroni inakwenda katika moja tu ya njia hizi zilizoruhusiwa, huangaza hakuna nishati: nishati yake ingebadilika tu kama itahamia kutoka obiti moja hadi nyingine.
Pendekezo hili, kwa maneno ya mwanahistoria wa sayansi Abraham Pais, lilikuwa “mojawapo ya nadharia za ujasiri zilizowahi kuletwa katika fizikia.” Ikiwa kitu sawa kilikuwa kinafanya kazi katika ulimwengu wa kila siku, unaweza kuona kwamba, kama ulivyoenda kutembea baada ya darasa la astronomia, asili ilikuwezesha kutembea hatua mbili kwa dakika, hatua tano kwa dakika, na hatua 12 kwa dakika, lakini hakuna kasi kati. Haijalishi jinsi ulivyojaribu kusonga miguu yako, kasi fulani ya kutembea itaruhusiwa. Ili kufanya mambo ya ajabu zaidi, haitachukua jitihada za kutembea kwa kasi yoyote ya kuruhusiwa, lakini itakuwa vigumu kubadili kutoka kasi moja hadi nyingine. Kwa bahati nzuri, hakuna sheria hizo zinazotumika katika kiwango cha tabia ya kibinadamu. Lakini katika ngazi microscopic ya atomi, majaribio baada ya majaribio imethibitisha uhalali wa wazo la ajabu la Bohr. Mapendekezo ya Bohr yalikuwa moja ya misingi ya mfano mpya (na wa kisasa zaidi) wa ulimwengu wa subatomic unaoitwa quantum mechanics.
Katika mfano wa Bohr, ikiwa elektroni inakwenda kutoka obiti moja hadi nyingine karibu na kiini atomiki, ni lazima iache nishati fulani kwa namna ya mionzi ya sumakuumeme. Ikiwa elektroni inakwenda kutoka obiti ya ndani hadi moja mbali na kiini, hata hivyo, inahitaji nishati ya ziada. Njia moja ya kupata nishati muhimu ni kunyonya mionzi ya sumakuumeme ambayo inaweza kuwa Streaming zamani atomi kutoka chanzo nje.
Kipengele muhimu cha mfano wa Bohr ni kwamba kila moja ya mizunguko ya elektroni inaruhusiwa kuzunguka atomi iliyotolewa ina thamani fulani ya nishati; kwa hiyo tunaweza kufikiria kila obiti kama kiwango cha nishati. Kuhama kutoka obiti moja hadi nyingine (ambayo itakuwa na thamani yake maalum ya nishati) inahitaji mabadiliko katika nishati ya elektroni-mabadiliko yaliyowekwa na tofauti kati ya maadili mawili ya nishati. Ikiwa elektroni inakwenda ngazi ya chini, tofauti ya nishati itatolewa; ikiwa elektroni inakwenda ngazi ya juu, tofauti ya nishati inapaswa kupatikana kutoka mahali pengine. Kila kuruka (au mpito) kwa ngazi tofauti ina mabadiliko ya nishati ya kudumu na ya uhakika yanayohusiana nayo.
mlinganisho ghafi kwa hali hii inaweza kuwa maisha katika mnara wa vyumba anasa ambapo kodi imedhamiria kwa ubora wa maoni. Jengo hilo lina viwango fulani, vyema vya kuhesabiwa au sakafu ambazo vyumba viko. Hakuna mtu anayeweza kuishi kwenye sakafu 5.37 au 22.5. Aidha, kodi anapata juu kama wewe kwenda juu ya sakafu ya juu. Ikiwa unataka kubadilishana ghorofa kwenye ghorofa ya ishirini kwa moja kwenye ghorofa ya pili, huwezi kulipa kodi nyingi. Hata hivyo, ikiwa unataka kuondoka kutoka ghorofa ya tatu hadi sakafu ya ishirini na tano, kodi yako itaongezeka. Katika atomu, pia, mahali “nafuu” kwa elektroni kuishi ni kiwango cha chini kabisa iwezekanavyo, na nishati inahitajika kuhamia ngazi ya juu.
Hapa tuna hali moja ambapo ni rahisi kufikiria mionzi ya sumakuumeme kama chembe (fotoni) badala ya kama mawimbi. Kama elektroni zinatoka ngazi moja hadi nyingine, hutoa au kunyonya pakiti kidogo za nishati. Wakati elektroni inakwenda ngazi ya juu, inachukua photon ya nishati tu sahihi (zinazotolewa moja inapatikana). Wakati inakwenda ngazi ya chini, hutoa photon na kiasi halisi cha nishati ambayo haihitaji tena katika “hali yake ya chini ya maisha.”
Mitazamo ya photon na wimbi lazima iwe sawa: mwanga ni mwanga, bila kujali jinsi tunavyoiangalia. Hivyo, kila photon hubeba kiasi fulani cha nishati ambacho ni sawia na mzunguko (\(f\)) wa wimbi linalowakilisha. Thamani ya nishati yake (\(E\)) hutolewa na formula
\[E=hf \nonumber\]
ambapo mara kwa mara ya uwiano\(h\), inaitwa mara kwa mara Planck ya.
Mara kwa mara ni jina la Max Planck, mwanafizikia wa Ujerumani ambaye alikuwa mmoja wa waanzilishi wa nadharia ya quantum (Kielelezo\(\PageIndex{5}\)). Ikiwa vitengo vya metri vinatumiwa (yaani, ikiwa nishati inapimwa katika joules na mzunguko katika hertz), basi mara kwa mara ya Planck ina thamani\(h = 6.626 \times 10^{–34}\) joule-sekunde (J-s). Photoni za juu-nishati zinahusiana na mawimbi ya juu-frequency (ambayo yana wavelength mfupi); photoni za chini za nishati ni mawimbi ya mzunguko wa chini

Ili kuchukua mfano maalum, fikiria atomi ya kalsiamu ndani ya anga ya Jua ambamo elektroni inaruka kutoka ngazi ya chini hadi ngazi ya juu. Ili kufanya hivyo, inahitaji takriban 5 × 10 —19 joules ya nishati, ambayo inaweza kupata kwa urahisi kwa kunyonya fotoni inayopita ya nishati hiyo inayotoka ndani ya Jua. Photon hii ni sawa na wimbi la mwanga ambao mzunguko ni kuhusu 7.5 × 10 14 hertz na ambao wavelength ni kuhusu 3.9 × 10 —7 mita (393 nanometers), katika sehemu ya violet ya kina ya wigo wa mwanga unaoonekana. Ingawa inaweza kuonekana kuwa ya ajabu mwanzoni kubadili kutoka kuiga mwanga kama fotoni (au pakiti ya nishati) kuipiga picha kama wimbi, ubadilishaji huo umekuwa asili ya pili kwa wanaastronomia na inaweza kuwa chombo chenye manufaa kwa kufanya mahesabu kuhusu spectra.
Mfano\(\PageIndex{1}\): Nishati ya photon
Sasa kwa kuwa tunajua jinsi ya kuhesabu wavelength na mzunguko wa photon, tunaweza kutumia habari hii, pamoja na mara kwa mara ya Planck, kuamua ni kiasi gani cha nishati kila photon hubeba. Ni kiasi gani cha nishati ambacho photon nyekundu ya wavelength 630 nm ina?
Suluhisho
Kwanza, kama tulivyojifunza mapema, tunaweza kupata mzunguko wa photon:
\[f= \frac{c}{ \lambda} = \frac{3 \times 10^8 \text{ m/s}}{630 \times 10^{–9} \text{ m}} = 4.8 \times 10^{14} \text{ Hz} \nonumber\]
Kisha, tunaweza kutumia mara kwa mara ya Planck kuamua nishati (kumbuka kwamba Hz ni sawa na 1/s):
\[E=hf= \left( 6.626 \times 10^{–34} \text{ J-s} \right) \left( 4.8 \times 10^{14} (1/\text{s}) \right)=3.2 \times 10^{–19} \text{ J} \nonumber\]
Zoezi\(\PageIndex{1}\)
Nishati ya photon ya njano na mzunguko wa 5.5 × 10 14 Hz ni nini?
- Jibu
-
\[E=hf= \left(6.626 \times10^{–34} \right) \left(5.5 \times 10^{14} \right) = 3.6 \times 10^{–19} \text{ J} \nonumber\]
Dhana muhimu na Muhtasari
Atomi hujumuisha kiini kilicho na protoni moja au zaidi yenye chaji chanya. Atomi zote isipokuwa hidrojeni zinaweza pia kuwa na neutroni moja au zaidi katika kiini. Hasi kushtakiwa electro ns obiti kiini. Idadi ya protoni inafafanua elementi (hidrojeni ina protoni moja, heliamu ina mbili, na kadhalika) ya atomu. Viini vyenye idadi sawa ya protoni lakini namba tofauti za nyutroni ni isotopi tofauti za elementi moja. Katika mfano wa Bohr wa atomi, elektroni kwenye orbits zilizoruhusiwa (au viwango vya nishati) hazitoi mionzi yoyote ya sumakuumeme. Lakini wakati elektroni zinatoka ngazi za chini hadi zile za juu, zinapaswa kunyonya photon ya nishati ya haki tu, na wanapoondoka ngazi za juu hadi za chini, hutoa photon ya nishati sahihi tu. Nishati ya photon imeshikamana na mzunguko wa wimbi la umeme linalowakilisha kwa formula ya Planck,\(E=hf\).
faharasa
- kiwango cha nishati
- kiwango fulani, au kiasi, cha nishati inayomilikiwa na atomu au ioni juu ya nishati inayo katika hali yake ya chini ya juhudi; pia kutumika kutaja majimbo ya nishati elektroni inaweza kuwa nayo katika atomu
- isotope
- yoyote ya aina mbili au zaidi za elementi moja ambazo atomi zake zina idadi sawa ya protoni lakini namba tofauti za neutroni
- kiini (ya atomi)
- sehemu kubwa ya atomi, linajumuisha zaidi ya protoni na nyutroni, na ambayo elektroni zinahusu


