16.2: Entropy
- Page ID
- 175777
- Eleza entropy
- Eleza uhusiano kati ya entropy na idadi ya microstates
- Kutabiri ishara ya mabadiliko ya entropy kwa michakato ya kemikali na kimwili
Katika 1824, akiwa na umri wa miaka 28, Nicolas Léonard Sadi Carnot (Kielelezo\(\PageIndex{2}\)) alichapisha matokeo ya utafiti wa kina kuhusu ufanisi wa inji za joto za mvuke. Katika mapitio ya baadaye ya matokeo ya Carnot, Rudolf Clausius alianzisha mali mpya ya thermodynamic inayohusiana na mtiririko wa joto unaoongozana na mchakato wa joto ambalo mchakato unafanyika. Mali hii mpya ilielezwa kama uwiano wa joto la kubadilishwa (q rev) na joto la kelvin (T). Neno mchakato wa kurekebishwa linamaanisha mchakato unaofanyika kwa kiwango cha polepole kiasi kwamba daima huwa katika usawa na mwelekeo wake unaweza kubadilishwa (unaweza “kuachwa”) na mabadiliko madogo madogo ni hali fulani. Kumbuka kwamba wazo la mchakato wa kurekebishwa ni utaratibu unaohitajika kusaidia maendeleo ya dhana mbalimbali za thermodynamic; hakuna michakato halisi inayoweza kubadilishwa kweli, badala yake huwekwa kama haiwezi kurekebishwa.

Sawa na mali nyingine za thermodynamic, kiasi hiki kipya ni kazi ya serikali, na hivyo mabadiliko yake inategemea tu juu ya majimbo ya awali na ya mwisho ya mfumo. Mnamo mwaka wa 1865, Clausius aliita jina hili entropy (S) na kuelezea mabadiliko yake kwa mchakato wowote kama yafuatayo:
\[ΔS=\dfrac{q_\ce{rev}}{T} \label{Eq1} \]
Mabadiliko ya entropy kwa mchakato halisi, usioweza kurekebishwa ni sawa na ile kwa mchakato wa kubadilishwa wa kinadharia unaohusisha majimbo sawa ya awali na ya mwisho.
Entropy na Microstates
Kufuatia kazi ya Carnot na Clausius, Ludwig Boltzmann alianzisha mfano wa takwimu za molekuli ambao ulihusisha entropy ya mfumo kwa idadi ya microstates iwezekanavyo kwa mfumo. Microstate (\(\Omega\))ni usanidi maalum wa maeneo na nguvu za atomi au molekuli zinazounda mfumo kama ifuatavyo:
\[S=k \ln \Omega \label{Eq2} \]
Hapa k ni mara kwa mara ya Boltzmann na ina thamani ya\(1.38 \times 10^{−23}\, J/K\).
Kama kwa kazi nyingine za serikali, mabadiliko katika entropy kwa mchakato ni tofauti kati ya maadili yake ya mwisho (S f) na ya awali (S i):
\[\begin{align} ΔS &=S_\ce{f}−S_\ce{i} \nonumber \\[4pt] &=k \ln \Omega_\ce{f} − k \ln \Omega_\ce{i} \nonumber \\[4pt] &=k \ln\dfrac{\Omega_\ce{f}}{\Omega_\ce{i}} \label{Eq2a} \end{align} \]
Kwa michakato inayohusisha ongezeko la idadi ya microstates ya mfumo\(\Omega_f > \Omega_i\), entropy ya mfumo huongezeka,\(ΔS > 0\). Kinyume chake, taratibu zinazopunguza idadi ya microstates katika mfumo\(\Omega_f < \Omega_i\), hutoa kupungua kwa entropy ya mfumo,\(ΔS < 0\). Hii tafsiri molekuli wadogo ya entropy hutoa kiungo kwa uwezekano kwamba mchakato kutokea kama mfano katika aya ya.
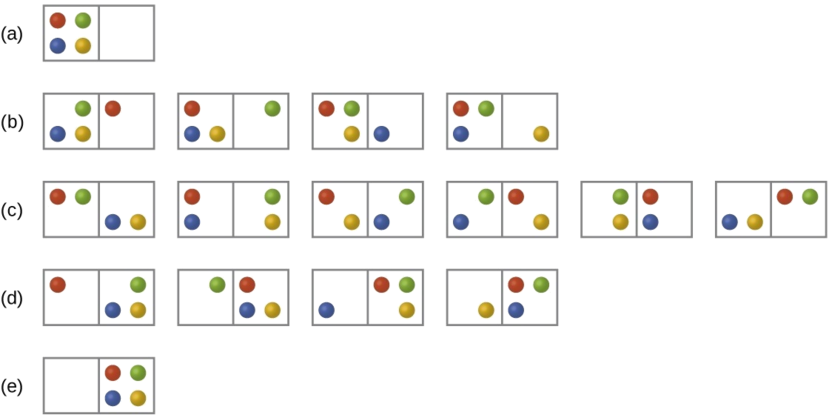
Fikiria kesi ya jumla ya mfumo zikiwemo N chembe kusambazwa kati ya masanduku n. Idadi ya microstates iwezekanavyo kwa mfumo kama huo ni n N. Kwa mfano, kusambaza chembe nne kati ya masanduku mawili itasababisha 2 4 = 16 microstates tofauti kama ilivyoonyeshwa kwenye Kielelezo\(\PageIndex{2}\). Microstates zilizo na mipangilio sawa ya chembe (bila kuzingatia utambulisho wa chembe ya mtu binafsi) huunganishwa pamoja na huitwa mgawanyo (wakati mwingine huitwa macrostates au usanidi). Uwezekano kwamba mfumo utakuwapo na vipengele vyake katika usambazaji uliotolewa ni sawia na idadi ya microstates ndani ya usambazaji. Kwa kuwa entropy huongezeka kwa logarithmically na idadi ya microstates, usambazaji unaowezekana zaidi kwa hiyo ni moja ya entropy kubwa zaidi.
Kwa mfumo huu, usanidi unaowezekana zaidi ni mojawapo ya microstates sita zinazohusiana na usambazaji (c) ambapo chembe zinashirikiwa sawasawa kati ya masanduku, yaani, usanidi wa chembe mbili katika kila sanduku. Uwezekano wa kupata mfumo katika usanidi huu ni
\[\dfrac{6}{16} = \dfrac{3}{8} \nonumber \]
Configuration angalau uwezekano wa mfumo ni moja ambayo chembe zote nne ziko katika sanduku moja, sambamba na mgawanyo (a) na (e), kila mmoja ana uwezekano wa
\[\dfrac{1}{16} \nonumber \]
Uwezekano wa kupata chembe zote katika sanduku moja tu (ama sanduku la kushoto au sanduku la kulia) ni basi
\[\left(\dfrac{1}{16}+\dfrac{1}{16}\right)=\dfrac{2}{16} = \dfrac{1}{8} \nonumber \]
Unapoongeza chembe zaidi kwenye mfumo, idadi ya microstates iwezekanavyo huongezeka kwa kiasi kikubwa (2 N). Mfumo wa macroscopic (ukubwa wa maabara) ungekuwa na kawaida hujumuisha moles ya chembe (N ~ 10 23), na idadi inayofanana ya microstates itakuwa kubwa sana. Bila kujali idadi ya chembe katika mfumo, hata hivyo, mgawanyo ambao idadi sawa ya chembe hupatikana katika kila sanduku daima ni maandalizi ya uwezekano.
Usambazaji unaowezekana zaidi kwa hiyo ni moja ya entropy kubwa zaidi.
Maelezo ya awali ya gesi bora kupanua ndani ya utupu ni mfano wa macroscopic wa mfano huu wa chembe-katika-sanduku. Kwa mfumo huu, usambazaji unaowezekana zaidi unathibitishwa kuwa moja ambayo suala hilo linaenea kwa usawa au kusambazwa kati ya flasks mbili. Mchakato wa hiari ambapo gesi iliyo na awali katika chupa moja huongezeka ili kujaza flasks zote sawa kwa hiyo hutoa ongezeko la entropy kwa mfumo.

Njia kama hiyo inaweza kutumika kuelezea mtiririko wa joto. Fikiria mfumo unao na vitu viwili, kila mmoja una chembe mbili, na vitengo viwili vya nishati (vinavyowakilishwa kama “*”) katika Kielelezo\(\PageIndex{3}\). Kitu cha moto kinajumuisha chembe A na B na awali kina vitengo vyote vya nishati. Kitu cha baridi kinajumuisha chembe C na D, ambazo awali hazina vitengo vya nishati. Usambazaji (a) inaonyesha microstates tatu iwezekanavyo kwa hali ya awali ya mfumo, na vitengo vyote vya nishati zilizomo ndani ya kitu cha moto. Ikiwa moja ya vitengo viwili vya nishati huhamishwa, matokeo yake ni usambazaji (b) yenye microstates nne. Ikiwa vitengo vyote vya nishati vinahamishwa, matokeo ni usambazaji (c) unao na microstates tatu. Na hivyo, tunaweza kuelezea mfumo huu kwa jumla ya microstates kumi. Uwezekano kwamba joto haina mtiririko wakati vitu viwili vinawasiliana, yaani, kwamba mfumo unabaki katika usambazaji (a), ni\(\frac{3}{10}\). Uwezekano mkubwa zaidi ni mtiririko wa joto ili kuzalisha moja ya usambazaji mwingine wawili, uwezekano wa pamoja kuwa\(\frac{7}{10}\). Matokeo ya uwezekano mkubwa ni mtiririko wa joto ili kuzalisha usambazaji wa sare wa nishati unaowakilishwa na usambazaji (b), uwezekano wa usanidi huu kuwa\(\frac{4}{10}\). Kama kwa mfano uliopita wa kusambaza jambo, extrapolating matibabu haya kwa makusanyo macroscopic ya chembe kwa kiasi kikubwa huongeza uwezekano wa usambazaji sare jamaa na mgawanyo mwingine. Hii inasaidia uchunguzi wa kawaida kwamba kuweka vitu vya moto na baridi katika matokeo ya mawasiliano katika mtiririko wa joto wa pekee ambao hatimaye unalinganisha joto la vitu. Na, tena, mchakato huu wa pekee pia unahusishwa na ongezeko la entropy ya mfumo.
Fikiria mfumo umeonyeshwa hapa. ni mabadiliko katika entropy kwa ajili ya mchakato kwamba waongofu mfumo kutoka usambazaji (a) kwa (c)?

Suluhisho
Tunavutiwa na mabadiliko yafuatayo:
Idadi ya awali ya microstates ni moja, sita ya mwisho:
\[\begin{align} ΔS &=k \ln\dfrac{\Omega_\ce{c}}{\Omega_\ce{a}} \nonumber \\[4pt] &= 1.38×10^{−23}\:J/K × \ln\dfrac{6}{1} \nonumber \\[4pt] &= 2.47×10^{−23}\:J/K \nonumber \end{align} \nonumber \]
Ishara ya matokeo haya ni sawa na matarajio; kwa kuwa kuna microstates zaidi iwezekanavyo kwa hali ya mwisho kuliko hali ya awali, mabadiliko katika entropy yanapaswa kuwa chanya.
Fikiria mfumo umeonyeshwa kwenye Kielelezo\(\PageIndex{3}\). Je! Ni mabadiliko gani katika entropy kwa mchakato ambapo nishati zote zinahamishwa kutoka kwenye kitu cha moto (AB) hadi kitu cha baridi (CD)?
- Jibu
-
0 J/K
Kutabiri Ishara ya Δ S
Mahusiano kati ya entropy, microstates, na juu/usambazaji wa nishati ilivyoelezwa hapo awali inaruhusu sisi kufanya generalizations kuhusu entropies jamaa ya vitu na kutabiri ishara ya mabadiliko entropy kwa michakato ya kemikali na kimwili. Fikiria mabadiliko ya awamu yaliyoonyeshwa kwenye Kielelezo\(\PageIndex{4}\). Katika awamu imara, atomi au molekuli ni vikwazo kwa nafasi karibu fasta kwa heshima kwa kila mmoja na ni uwezo wa oscillations tu kawaida kuhusu nafasi hizi. Kwa maeneo ya kimsingi ya kudumu kwa chembe za sehemu za mfumo, idadi ya microstates ni ndogo. Katika awamu ya kiowevu, atomi au molekuli ni huru kusogea juu na kuzunguka kila mmoja, ingawa zinabaki katika ukaribu wa karibu sana na kila mmoja. Hii kuongezeka kwa uhuru wa mwendo husababisha tofauti kubwa katika maeneo ya chembe iwezekanavyo, hivyo idadi ya microstates ni sawa zaidi kuliko kwa imara. Matokeo yake, S kioevu> S imara na mchakato wa kubadili dutu kutoka imara hadi kioevu (kuyeyuka) ina sifa ya ongezeko la entropy, Δ S> 0. Kwa mantiki hiyo, mchakato wa kurudi (kufungia) unaonyesha kupungua kwa entropy, Δ S <0.
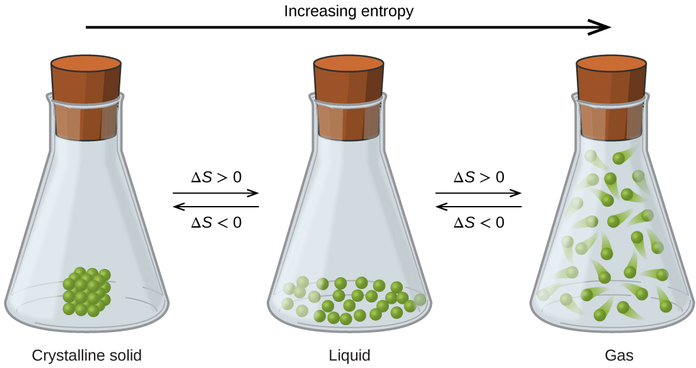
Sasa fikiria awamu ya mvuke au gesi. Atomi au molekuli huchukua kiasi kikubwa zaidi kuliko katika awamu ya kiowevu; kwa hiyo kila atomu au molekuli zinaweza kupatikana katika maeneo mengi zaidi kuliko katika awamu ya kiowevu (au imara). Kwa hiyo, kwa dutu yoyote, S gesi> S kioevu> S imara, na taratibu za uvukizi na usawazishaji vivyo hivyo huhusisha ongezeko la entropy, Δ S> 0. Vivyo hivyo, mabadiliko ya awamu ya usawa, condensation na utuaji, huhusisha kupungua kwa entropy, Δ S <0.
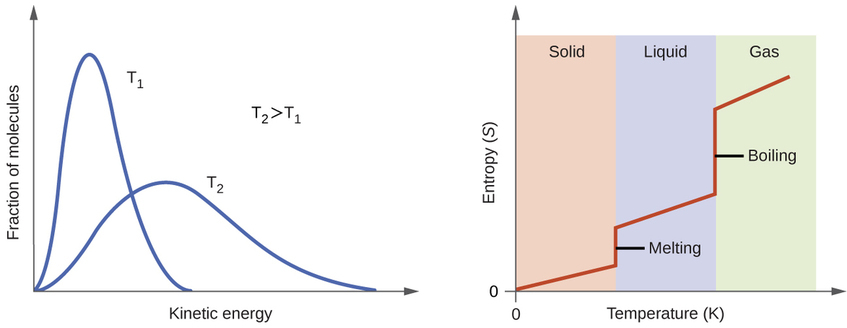
Kwa mujibu wa nadharia ya kinetic-Masi, joto la dutu ni sawa na nishati ya wastani ya kinetic ya chembe zake. Kuongeza joto la dutu itasababisha vibrations kina zaidi ya chembe katika yabisi na tafsiri ya haraka zaidi ya chembe katika vinywaji na gesi. Katika joto la juu, usambazaji wa nguvu za kinetic kati ya atomi au molekuli ya dutu hii pia ni pana (zaidi kutawanyika) kuliko joto la chini. Hivyo, entropy kwa dutu yoyote huongezeka kwa joto (Kielelezo\(\PageIndex{5}\)).
Entropy ya dutu huathiriwa na muundo wa chembe (atomi au molekuli) zinazounda dutu. Kwa upande wa dutu atomiki, atomi nzito zina entropy kubwa katika joto lililopewa kuliko atomi nyepesi, ambayo ni matokeo ya uhusiano kati ya wingi wa chembe na nafasi ya viwango vya nishati za kutafsiri (ambayo ni mada zaidi ya upeo wa matibabu yetu). Kwa molekuli, idadi kubwa ya atomi (bila kujali raia zao) huongeza njia ambazo molekuli zinaweza kutetemeka na hivyo idadi ya microstates iwezekanavyo na entropy ya mfumo.
Hatimaye, tofauti katika aina ya chembe huathiri entropy ya mfumo. Ikilinganishwa na dutu safi, ambayo chembe zote zinafanana, entropy ya mchanganyiko wa aina mbili au zaidi tofauti za chembe ni kubwa zaidi. Hii ni kwa sababu ya mwelekeo wa ziada na mwingiliano unaowezekana katika mfumo unaojumuisha vipengele visivyofanana. Kwa mfano, wakati imara hupasuka katika kioevu, chembe za uzoefu imara ni uhuru mkubwa wa mwendo na mwingiliano wa ziada na chembe za kutengenezea. Hii inalingana na usambazaji wa sare zaidi wa suala na nishati na idadi kubwa ya microstates. Kwa hiyo mchakato wa kufutwa unahusisha ongezeko la entropy, Δ S> 0.
Kuzingatia mambo mbalimbali yanayoathiri entropy inatuwezesha kufanya utabiri sahihi wa ishara ya Δ S kwa michakato mbalimbali ya kemikali na kimwili kama ilivyoonyeshwa katika Mfano.
Kutabiri ishara ya mabadiliko ya entropy kwa michakato ifuatayo. Eleza sababu ya kila utabiri wako.
- Maji moja ya kioevu kwenye joto la kawaida\(⟶\) moja maji ya kioevu mole saa 50 °C
- \(\ce{Ag+}(aq)+\ce{Cl-}(aq)⟶\ce{AgCl}(s)\)
- \(\ce{C6H6}(l)+\dfrac{15}{2}\ce{O2}(g)⟶\ce{6CO2}(g)+\ce{3H2O}(l)\)
- \(\ce{NH3}(s)⟶\ce{NH3}(l)\)
Suluhisho la Marekani
- chanya, ongezeko la joto
- hasi, kupunguza idadi ya ions (chembe) katika suluhisho, ilipungua kutawanyika kwa jambo
- hasi, wavu kupungua kwa kiasi cha aina ya gesi
- chanya, awamu ya mpito kutoka imara kwa kioevu, ongezeko la wavu katika kutawanyika kwa jambo
Kutabiri ishara ya mabadiliko ya enthalpy kwa michakato ifuatayo. Kutoa sababu ya utabiri wako.
- \(\ce{NaNO3}(s)⟶\ce{Na+}(aq)+\ce{NO3-}(aq)\)
- kufungia maji ya kioevu
- \(\ce{CO2}(s)⟶\ce{CO2}(g)\)
- \(\ce{CaCO}(s)⟶\ce{CaO}(s)+\ce{CO2}(g)\)
- Jibu
-
Chanya; Imara hupasuka ili kutoa ongezeko la ions za simu katika suluhisho.
- Jibu b
-
hasi; Kioevu kinakuwa imara zaidi.
- Jibu c
-
Chanya; imara kiasi kuamuru inakuwa gesi
- Jibu d
-
Chanya; Kuna uzalishaji wavu wa mole moja ya gesi.
Muhtasari
Entropy (\(S\)) ni kazi ya hali ambayo inaweza kuhusiana na idadi ya microstates kwa mfumo (idadi ya njia mfumo unaweza kupangwa) na kwa uwiano wa joto kubadilishwa kwa joto la kelvin. Inaweza kutafsiriwa kama kipimo cha kutawanya au usambazaji wa suala na/au nishati katika mfumo, na mara nyingi huelezewa kama inawakilisha “ugonjwa” wa mfumo. Kwa dutu fulani,\(S_{solid} < S_{liquid} \ll S_{gas}\) katika hali fulani ya kimwili katika joto fulani, entropy ni kawaida zaidi kwa atomi nzito au molekuli ngumu zaidi. Entropy huongezeka wakati mfumo unapokanzwa na wakati ufumbuzi unapounda. Kutumia miongozo hii, ishara ya mabadiliko ya entropy kwa baadhi ya athari za kemikali inaweza kutabiriwa kwa uaminifu.
Mlinganyo muhimu
- \(ΔS=\dfrac{q_\ce{rev}}{T}\)
- S = m juu ya A
- \(ΔS=k\ln\dfrac{W_\ce{f}}{W_\ce{i}}\)
faharasa
- entropy (S)
- kazi ya hali ambayo ni kipimo cha suala na/au usambazaji wa nishati ndani ya mfumo, kuamua na idadi ya microstates mfumo mara nyingi huelezewa kama kipimo cha ugonjwa wa mfumo
- microstate (W)
- inawezekana Configuration au utaratibu wa suala na nishati ndani ya mfumo
- mchakato wa kurekebishwa
- mchakato unaofanyika hivyo polepole kama kuwa na uwezo wa kugeuza mwelekeo katika kukabiliana na mabadiliko infinitesimally ndogo katika hali; kujenga nadharia ambayo inaweza tu kuwa takriban na michakato halisi kuondolewa


