9.3: Stoichiometry ya vitu vya gesi, Mchanganyiko, na athari
- Page ID
- 176885
- Tumia sheria bora ya gesi ili kukokotoa msongamano wa gesi na raia wa molar
- Kufanya mahesabu ya stoichiometric yanayohusisha vitu vya gesi
- Sheria ya Dalton ya hali ya shinikizo la sehemu na uitumie katika mahesabu yanayohusisha mchanganyiko wa gesi
Utafiti wa tabia ya kemikali ya gesi ilikuwa sehemu ya msingi wa labda mapinduzi ya kimsingi ya kemikali katika historia. Mheshimiwa wa Kifaransa Antoine Lavoisier, anayeonekana sana kama “baba wa kemia ya kisasa,” alibadilisha kemia kutoka kwa ubora hadi sayansi ya kiasi kupitia kazi yake na gesi. Aligundua sheria ya uhifadhi wa suala, aligundua jukumu la oksijeni katika athari za mwako, aliamua muundo wa hewa, alielezea kupumua kwa suala la athari za kemikali, na zaidi. Alikuwa majeruhi ya Mapinduzi ya Ufaransa, guillotined katika 1794. Kati ya kifo chake, mwanahisabati na mwanaastronomia Joseph-Louis Lagrange alisema, “Ilichukua kundi hilo muda tu kuondoa kichwa chake; karne haitoshi kuizaliana.”
Kama ilivyoelezwa katika sura ya awali ya maandishi haya, tunaweza kurejea kwa stoichiometry ya kemikali kwa majibu ya maswali mengi ambayo yanauliza “Ni kiasi gani?” Tunaweza kujibu swali kwa wingi wa vitu au kiasi cha ufumbuzi. Hata hivyo, tunaweza pia kujibu swali hili kwa njia nyingine: kwa kiasi cha gesi. Tunaweza kutumia usawa bora wa gesi kuhusisha shinikizo, kiasi, joto, na idadi ya moles ya gesi. Hapa tutachanganya usawa bora wa gesi na equations nyingine ili kupata wiani wa gesi na molekuli ya molar. Tutaweza kukabiliana na mchanganyiko wa gesi tofauti, na kuhesabu kiasi cha vitu katika athari zinazohusisha gesi. Sehemu hii haitaanzisha nyenzo yoyote mpya au mawazo, lakini itatoa mifano ya maombi na njia za kuunganisha dhana ambazo tumejadiliwa tayari.
Uzito wiani wa Gesi
Kumbuka kwamba wiani wa gesi ni wingi wake kwa uwiano wa kiasi,\(ρ=\dfrac{m}{V}\). Kwa hiyo, ikiwa tunaweza kuamua wingi wa kiasi fulani cha gesi, tutapata wiani wake. Uzito wa gesi isiyojulikana unaweza kutumika kuamua molekuli yake ya molar na hivyo kusaidia katika utambulisho wake. Sheria bora ya gesi, PV = NRT, inatupa njia ya kupata fomu hiyo ya hisabati ili kuhusisha wiani wa gesi kwa kiasi chake katika ushahidi ulioonyeshwa katika Mfano\(\PageIndex{1}\).
Tumia PV = NRT kupata formula kwa wiani wa gesi katika g/L
Suluhisho la S
\[PV = nRT \nonumber \]
Panga upya kupata (mol/L):
\[\dfrac{n}{v}=\dfrac{P}{RT} \nonumber \]
Kuzidisha kila upande wa equation na molekuli molar,. Wakati moles huongezeka kwa katika g/mol, g hupatikana:
\[(ℳ)\left(\dfrac{n}{V}\right)=\left(\dfrac{P}{RT}\right)(ℳ) \nonumber \]
\[ℳ/V=ρ=\dfrac{Pℳ}{RT} \nonumber \]
Gesi ilionekana kuwa na wiani wa 0.0847 g/L kwenye 17.0 °C na shinikizo la torr 760. Misa yake ya molar ni nini? Gesi ni nini?
- Jibu
-
\[ρ=\dfrac{Pℳ}{RT} \nonumber \]
\[\mathrm{0.0847\:g/L=760\cancel{torr}×\dfrac{1\cancel{atm}}{760\cancel{torr}}×\dfrac{\mathit{ℳ}}{0.0821\: L\cancel{atm}/mol\: K}×290\: K} \nonumber \]
= 2.02 g/mol; Kwa hiyo, gesi lazima iwe hidrojeni (H 2, 2.02 g/mol)
Lazima tufafanue joto na shinikizo la gesi wakati wa kuhesabu wiani wake kwa sababu idadi ya moles ya gesi (na hivyo wingi wa gesi) katika lita hubadilika na joto au shinikizo. Mara nyingi msongamano wa gesi huripotiwa katika STP.
Kutumia Sheria bora ya gesi na Wiani wa Cyclopropane ya gesi, gesi ambayo mara moja ilitumiwa na oksijeni kama anesthetic ya jumla, inaundwa na kaboni 85.7% na 14.3% ya hidrojeni kwa wingi. Kupata formula empirical. Ikiwa 1.56 g ya cyclopropane inachukua kiasi cha 1.00 L saa 0.984 atm na 50 °C, formula ya Masi ya cyclopropane ni nini?
Suluhisho
Mkakati:
Kwanza kutatua tatizo empirical formula kutumia mbinu kujadiliwa mapema. Fikiria 100 g na kubadilisha asilimia ya kila kipengele ndani ya gramu. Kuamua idadi ya moles ya kaboni na hidrojeni katika sampuli 100-g ya cyclopropane. Gawanya na idadi ndogo ya moles ili kuhusisha idadi ya moles ya kaboni kwa idadi ya moles ya hidrojeni. Katika hatua ya mwisho, tambua kwamba uwiano mdogo wa idadi nzima ni formula ya maandishi:
\[\mathrm{85.7\: g\: C×\dfrac{1\: mol\: C}{12.01\: g\: C}=7.136\: mol\: C\hspace{20px}\dfrac{7.136}{7.136}=1.00\: mol\: C} \nonumber \]
\[\mathrm{14.3\: g\: H×\dfrac{1\: mol\: H}{1.01\: g\: H}=14.158\: mol\: H\hspace{20px}\dfrac{14.158}{7.136}=1.98\: mol\: H} \nonumber \]
Fomu ya kimapenzi ni CH 2 [molekuli ya kimapenzi (EM) ya 14.03 g/kitengo cha upimaji].
Kisha, tumia usawa wa wiani unaohusiana na sheria bora ya gesi ili kuamua molekuli ya molar:
\[d=\dfrac{Pℳ}{RT}\hspace{20px}\mathrm{\dfrac{1.56\: g}{1.00\: L}=0.984\: atm×\dfrac{ℳ}{0.0821\: L\: atm/mol\: K}×323\: K} \nonumber \]
= 42.0 g/mol\(\dfrac{ℳ}{Eℳ}=\dfrac{42.0}{14.03}=2.99\), hivyo (3) (CH 2) = C 3 H 6 (formula ya molekuli)
Asetilini, taa za kulehemu zinazotumiwa na mafuta, zinajumuisha 92.3% C na 7.7% H kwa wingi. Kupata formula empirical. Ikiwa 1.10 g ya asetilini inachukua kiasi cha 1.00 L saa 1.15 atm na 59.5 °C, formula ya Masi ya asetilini ni nini?
- Jibu
-
Fomu ya kimapenzi, CH; Fomu ya molekuli, C 2 H 2
Misa ya Molar ya Gesi
Matumizi mengine muhimu ya sheria bora ya gesi inahusisha uamuzi wa molekuli ya molar. Kwa ufafanuzi, molekuli ya molar ya dutu ni uwiano wa wingi wake kwa gramu, m, kwa kiasi chake katika moles, n:
\[ℳ=\mathrm{\dfrac{grams\: of\: substance}{moles\: of\: substance}}=\dfrac{m}{n} \nonumber \]
Equation bora ya gesi inaweza kupangwa upya ili kutenganisha n:
\[n=\dfrac{PV}{RT} \nonumber \]
na kisha pamoja na equation molekuli molar mavuno:
\[ℳ=\dfrac{mRT}{PV} \nonumber \]
Equation hii inaweza kutumika kupata molekuli ya molar ya gesi kutokana na vipimo vya shinikizo lake, kiasi, joto, na molekuli.
Masi ya molar ya takriban ya kioevu tete inaweza kuamua na:
- Inapokanzwa sampuli ya kioevu kwenye chupa yenye shimo ndogo juu, ambayo hubadilisha kioevu ndani ya gesi ambayo inaweza kutoroka kupitia shimo
- Kuondoa chupa kutoka joto kwa papo hapo wakati kidogo ya kioevu inakuwa gesi, wakati huo chupa itajazwa na sampuli tu ya gesi kwenye shinikizo la kawaida
- Kuweka chupa na kuruhusu sampuli ya gesi ili kuimarisha kioevu, na kisha kupima chupa ili kuamua wingi wa sampuli (Kielelezo\(\PageIndex{1}\))

Kwa kutumia utaratibu huu, sampuli ya gesi ya klorofomu yenye uzito wa 0.494 g inakusanywa kwenye chupa yenye kiasi cha 129 cm 3 saa 99.6 °C wakati shinikizo la anga ni 742.1 mm Hg. Je, ni molekuli ya karibu ya molar ya chloroform?
Suluhisho
Tangu
\[ℳ=\dfrac{m}{n} \nonumber \]
na
\[n=\dfrac{PV}{RT} \nonumber \]
badala na rearranging inatoa
\[ℳ=\dfrac{mRT }{PV} \nonumber \]
basi
\[ℳ=\dfrac{mRT}{PV}=\mathrm{\dfrac{(0.494\: g)×0.08206\: L⋅atm/mol\: K×372.8\: K}{0.976\: atm×0.129\: L}=120\:g/mol} \nonumber \]
Sampuli ya fosforasi ambayo ina uzito wa 3.243 × 10 -2 g ina shinikizo la 31.89 kPa katika bulb 56.0-ml saa 550 °C Je, ni molekuli ya molar na formula ya molekuli ya mvuke ya fosforasi?
- Jibu
-
124 g/mol P 4
Shinikizo la Mchanganyiko wa Gesi: Sheria ya Dalton
Isipokuwa kemikali hugusana, gesi za mtu binafsi katika mchanganyiko wa gesi haziathiri shinikizo la kila mmoja. Kila gesi ya mtu binafsi katika mchanganyiko ina shinikizo sawa kwamba ingekuwa exert kama walikuwa sasa peke yake katika chombo (Kielelezo\(\PageIndex{2}\)). Shinikizo linalotumiwa na kila gesi ya mtu binafsi katika mchanganyiko huitwa shinikizo lake la sehemu. Uchunguzi huu umefupishwa na sheria ya Dalton ya shinikizo la sehemu: Shinikizo la jumla la mchanganyiko wa gesi bora ni sawa na jumla ya shinikizo la sehemu ya gesi za sehemu:
\[P_{Total}=P_A+P_B+P_C+...=\sum_iP_i \nonumber \]
Katika equation P Jumla ni shinikizo la jumla la mchanganyiko wa gesi, P A ni shinikizo la sehemu ya gesi A; P B ni shinikizo la sehemu ya gesi B; P C ni shinikizo la sehemu ya gesi C; na kadhalika.

Shinikizo la sehemu ya gesi A linahusiana na shinikizo la jumla la mchanganyiko wa gesi kupitia sehemu yake ya mole (X), kitengo cha mkusanyiko kinachojulikana kama idadi ya moles ya sehemu ya suluhisho iliyogawanywa na idadi ya jumla ya moles ya vipengele vyote:
\[P_A=X_A×P_{Total}\hspace{20px}\ce{where}\hspace{20px}X_A=\dfrac{n_A}{n_{Total}} \nonumber \]
ambapo P A, X A, na n A ni shinikizo la sehemu, sehemu ya mole, na idadi ya moles ya gesi A, kwa mtiririko huo, na n Jumla ni idadi ya moles ya vipengele vyote katika mchanganyiko.
Chombo cha 10.0-L kina 2.50 × 10 —3 mol ya H 2, 1.00 × 10 —3 mol ya He, na 3.00 × 10 —4 mol ya Ne saa 35 °C.
- Je! Ni shinikizo la sehemu gani za kila gesi?
- Shinikizo la jumla katika anga ni nini?
Suluhisho
Gesi hufanya kujitegemea, hivyo shinikizo la sehemu ya kila gesi linaweza kuamua kutoka kwa usawa bora wa gesi, kwa kutumia\(P=\dfrac{nRT}{V}\):
\[P_\mathrm{H_2}=\mathrm{\dfrac{(2.50×10^{−3}\:mol)(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=6.32×10^{−3}\:atm} \nonumber \]
\[P_\ce{He}=\mathrm{\dfrac{(1.00×10^{−3}\cancel{mol})(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=2.53×10^{−3}\:atm} \nonumber \]
\[P_\ce{Ne}=\mathrm{\dfrac{(3.00×10^{−4}\cancel{mol})(0.08206\cancel{L}atm\cancel{mol^{−1}\:K^{−1}})(308\cancel{K})}{10.0\cancel{L}}=7.58×10^{−4}\:atm} \nonumber \]
Shinikizo la jumla linatolewa kwa jumla ya shinikizo la sehemu:
\[P_\ce{T}=P_\mathrm{H_2}+P_\ce{He}+P_\ce{Ne}=\mathrm{(0.00632+0.00253+0.00076)\:atm=9.61×10^{−3}\:atm} \nonumber \]
Flaski 5.73-L saa 25 °C ina 0.0388 mol ya N 2, 0.147 mol ya CO, na 0.0803 mol ya H 2. Je! Shinikizo la jumla katika chupa katika anga ni nini?
- Jibu
-
1.137 atm
Hapa kuna mfano mwingine wa dhana hii, lakini kushughulika na mahesabu ya sehemu ya mole.
Mchanganyiko wa gesi unaotumiwa kwa anesthesia una oksijeni 2.83 mol, O 2, na 8.41 mol oksidi ya nitrous, N 2 O. shinikizo la jumla la mchanganyiko ni 192 kPa.
- Je! Ni sehemu gani za mole za O 2 na N 2 O?
- Shinikizo la sehemu ya O 2 na N 2 O ni nini?
Suluhisho
Sehemu ya mole hutolewa na
\[X_A=\dfrac{n_A}{n_{Total}} \nonumber \]
na shinikizo la sehemu ni
\[P_A = X_A \times P_{Total} \nonumber \]
Kwa O 2,
\[X_{O_2}=\dfrac{n_{O_2}}{n_{Total}}=\mathrm{\dfrac{2.83 mol}{(2.83+8.41)\:mol}=0.252} \nonumber \]
na
\[P_{O_2}=X_{O_2}×P_{Total}=\mathrm{0.252×192\: kPa=48.4\: kPa} \nonumber \]
Kwa N 2 O,
\[X_{N_2O}=\dfrac{n_{N_2O}}{n_{Total}}=\mathrm{\dfrac{8.41\: mol}{(2.83+8.41)\:mol}=0.748} \nonumber \]
na
\[P_{N_2O}=X_{N_2O}×P_{Total}=\mathrm{(0.748)×192\: kPa = 143.6 \: kPa} \nonumber \]
Je, ni shinikizo la mchanganyiko wa 0.200 g ya H 2, 1.00 g ya N 2, na 0.820 g ya Ar katika chombo kilicho na kiasi cha 2.00 L saa 20 °C?
- Jibu
-
1.87 atm
Ukusanyaji wa Gesi juu ya Maji
Njia rahisi ya kukusanya gesi ambazo hazipatikani na maji ni kuzikamata kwenye chupa ambayo imejaa maji na kuingizwa ndani ya sahani iliyojaa maji. Shinikizo la gesi ndani ya chupa linaweza kufanywa sawa na shinikizo la hewa nje kwa kuinua au kupunguza chupa. Wakati kiwango cha maji ni sawa ndani na nje ya chupa (Kielelezo\(\PageIndex{3}\)), shinikizo la gesi ni sawa na shinikizo la anga, ambalo linaweza kupimwa kwa barometer.
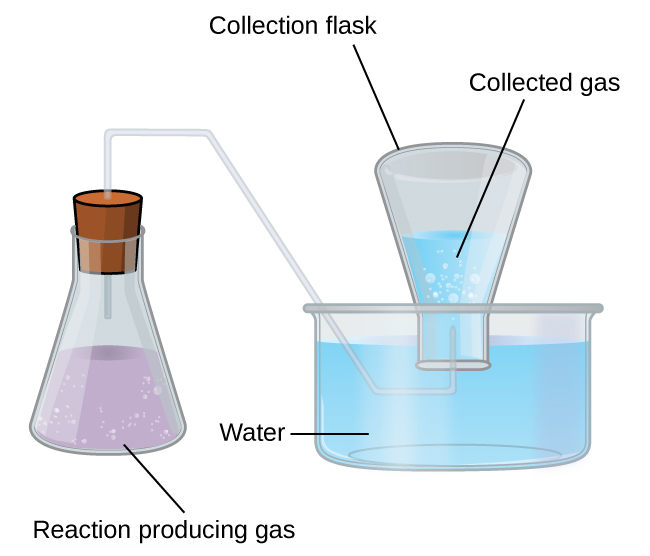
Hata hivyo, kuna jambo lingine ambalo tunapaswa kuzingatia wakati tunapima shinikizo la gesi kwa njia hii. Maji hupuka na daima kuna maji ya gesi (mvuke wa maji) juu ya sampuli ya maji ya kioevu. Kama gesi inakusanywa juu ya maji, inakuwa imejaa mvuke wa maji na shinikizo la jumla la mchanganyiko ni sawa na shinikizo la sehemu ya gesi pamoja na shinikizo la sehemu ya mvuke wa maji. Kwa hiyo shinikizo la gesi safi ni sawa na shinikizo la jumla linalopunguza shinikizo la mvuke wa maji—hii inajulikana kama shinikizo la gesi “kavu” yaani shinikizo la gesi pekee, bila mvuke wa maji.
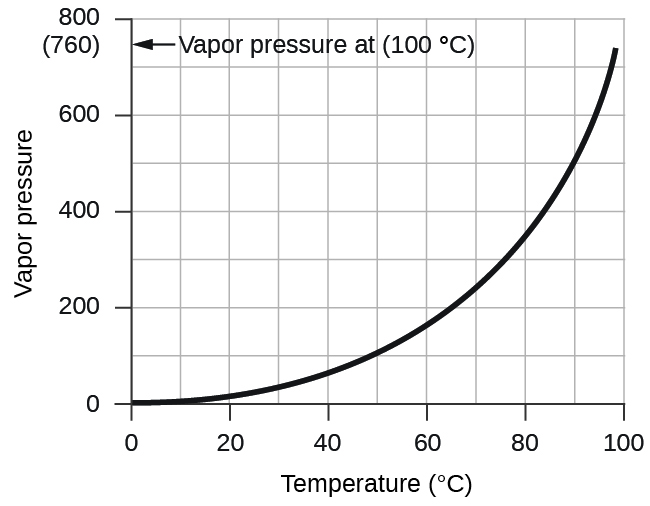
Shinikizo la mvuke la maji, ambalo ni shinikizo linalotumiwa na mvuke wa maji katika usawa na maji ya kioevu kwenye chombo kilichofungwa, inategemea joto (Kielelezo\(\PageIndex{4}\)); Maelezo zaidi juu ya utegemezi wa joto la mvuke wa maji yanaweza kupatikana katika Jedwali\(\PageIndex{1}\), na mvuke shinikizo litajadiliwa kwa undani zaidi katika sura inayofuata juu ya vinywaji.
| Joto (°C) | Shinikizo (torr) | Joto (°C) | Shinikizo (torr) | Joto (°C) | Shinikizo (torr) | ||
|---|---|---|---|---|---|---|---|
| —10 | 1.95 | 18 | 15.5 | 30 | 31.8 | ||
| —5 | 3.0 | 19 | 16.5 | 35 | 42.2 | ||
| —2 | 3.9 | 20 | 17.5 | 40 | 55.3 | ||
| 0 | 4.6 | 21 | 18.7 | 50 | 92.5 | ||
| 2 | 5.3 | 22 | 19.8 | 60 | 149.4 | ||
| 4 | 6.1 | 23 | 21.1 | 70 | 233.7 | ||
| 6 | 7.0 | 24 | 22.4 | 80 | 355.1 | ||
| 8 | 8.0 | 25 | 23.8 | 90 | 525.8 | ||
| 10 | 9.2 | 26 | 25.2 | 95 | 633.9 | ||
| 12 | 10.5 | 27 | 26.7 | 99 | 733.2 | ||
| 14 | 12.0 | 28 | 28.3 | 100.0 | 760.0 | ||
| 16 | 13.6 | 29 | 30.0 | 101.0 | 787.6 |
Kama 0.200 L ya argon ni zilizokusanywa juu ya maji katika joto la 26 °C na shinikizo la 750 torr katika mfumo kama ile inavyoonekana katika Kielelezo\(\PageIndex{3}\), ni nini shinikizo sehemu ya Argon?
Suluhisho
Kwa mujibu wa sheria ya Dalton, shinikizo la jumla katika chupa (750 torr) ni jumla ya shinikizo la sehemu ya argon na shinikizo la sehemu ya maji ya gesi:
\[P_\ce{T}=P_\ce{Ar}+P_\mathrm{H_2O} \nonumber \]
Kurekebisha equation hii kutatua kwa shinikizo la argon inatoa:
\[P_\ce{Ar}=P_\ce{T}−P_\mathrm{H_2O} \nonumber \]
Shinikizo la mvuke wa maji juu ya sampuli ya maji kiowevu saa 26 °C ni 25.2 torr (Kiambatisho E), hivyo:
\[P_\ce{Ar}=\mathrm{750\:torr−25.2\:torr=725\:torr} \nonumber \]
Sampuli ya oksijeni iliyokusanywa juu ya maji kwenye halijoto ya 29.0 °C na shinikizo la torr 764 ina kiasi cha 0.560 L. kiasi gani oksijeni kavu ingekuwa chini ya hali sawa ya joto na shinikizo?
- Jibu
-
0.583 L
Kemikali Stoichiometry na Gesi
Kemikali stoichiometry inaelezea uhusiano kiasi kati ya reactants na bidhaa katika athari za kemikali. Hapo awali tumepima kiasi cha reactants na bidhaa kwa kutumia raia kwa yabisi na kiasi kwa kushirikiana na molarity kwa ufumbuzi; sasa tunaweza pia kutumia kiasi cha gesi kuonyesha kiasi. Ikiwa tunajua kiasi, shinikizo, na joto la gesi, tunaweza kutumia usawa bora wa gesi kuhesabu jinsi moles nyingi za gesi zilizopo. Ikiwa tunajua ngapi za gesi zinazohusika, tunaweza kuhesabu kiasi cha gesi kwa joto lolote na shinikizo.
Sheria ya Avogadro ilibadilishwa
Wakati mwingine tunaweza kuchukua faida ya kipengele kurahisisha ya stoichiometry ya gesi ambayo yabisi na ufumbuzi hazionyeshe: Gesi zote zinazoonyesha tabia bora zina idadi sawa ya molekuli kwa kiasi sawa (kwa joto sawa na shinikizo). Hivyo, uwiano wa kiasi cha gesi zinazohusika katika mmenyuko wa kemikali hutolewa na coefficients katika equation kwa mmenyuko, isipokuwa kwamba kiasi cha gesi kinapimwa kwa joto sawa na shinikizo.
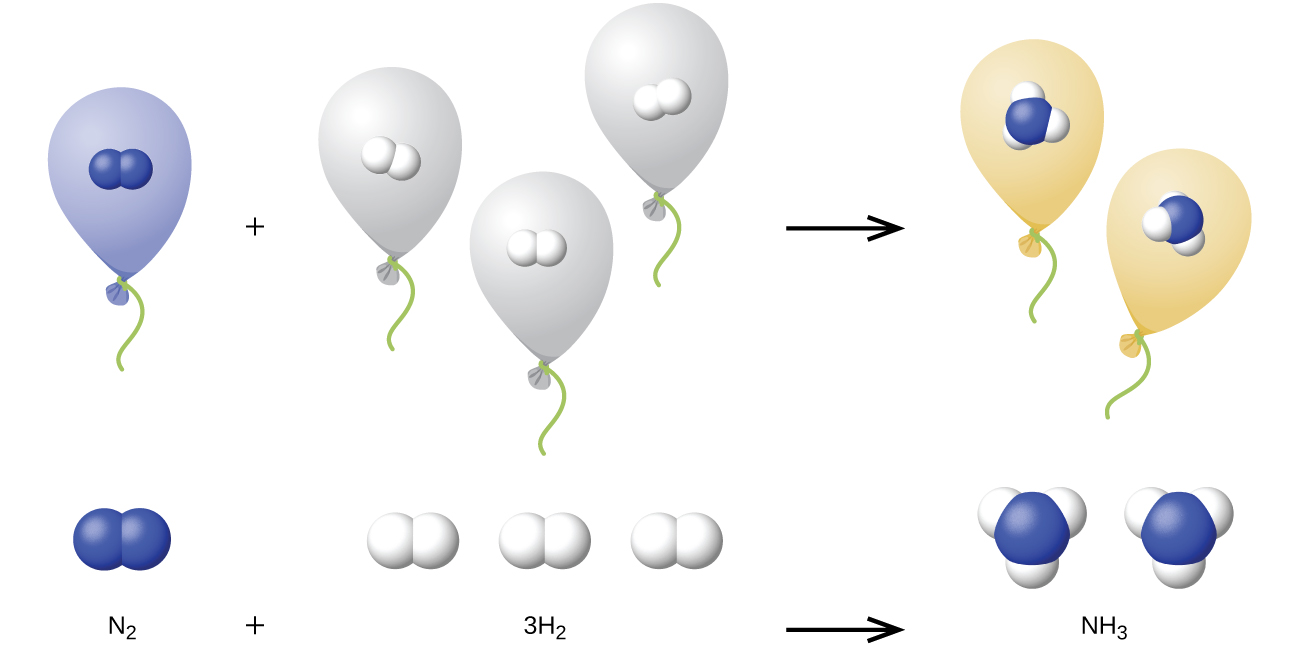
Tunaweza kupanua sheria ya Avogadro (kwamba kiasi cha gesi ni moja kwa moja sawia na idadi ya moles ya gesi) kwa athari za kemikali na gesi: Gesi huchanganya, au kuguswa, kwa idadi ya uhakika na rahisi kwa kiasi, ikiwa ni pamoja na kwamba kila kiasi cha gesi kinapimwa kwa joto sawa na shinikizo. Kwa mfano, tangu gesi za nitrojeni na hidrojeni huguswa ili kuzalisha gesi ya amonia kulingana na
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
kiasi fulani cha gesi ya nitrojeni humenyuka na mara tatu kiasi hicho cha gesi ya hidrojeni kuzalisha mara mbili kiasi hicho cha gesi ya amonia, ikiwa shinikizo na joto hubakia mara kwa mara.
Maelezo kwa ajili ya hii ni mfano katika Kielelezo\(\PageIndex{4}\). Kwa mujibu wa sheria ya Avogadro, kiasi sawa cha gesi N 2, H 2, na NH 3, kwa joto sawa na shinikizo, zina idadi sawa ya molekuli. Kwa sababu molekuli moja ya N 2 humenyuka na molekuli tatu za H 2 kuzalisha molekuli mbili za NH 3, kiasi cha H 2 kinachohitajika ni mara tatu kiasi cha N 2, na kiasi cha NH 3 zinazozalishwa ni mara mbili kiasi cha N 2.
Propane, C 3 H 8 (g), hutumiwa katika grills za gesi ili kutoa joto kwa kupikia. Ni kiasi gani cha O 2 (g) kilichopimwa saa 25 °C na 760 torr kinachohitajika kuguswa na 2.7 L ya propane kupimwa chini ya hali sawa ya joto na shinikizo? Fikiria kwamba propane inakabiliwa na mwako kamili.
Suluhisho
Uwiano wa kiasi cha C 3 H 8 na O 2 itakuwa sawa na uwiano wa coefficients yao katika usawa wa usawa kwa majibu:
\ [kuanza {align}
&\ ce {C3H8} (g) +\ ce {5O2} (g) &&\ ce {3CO2} (g) +\ ce {4H2O} (l)\\ ce {&1
\: kiasi + 5\: kiasi cha & & 3\: kiasi cha + 4\: kiasi cha + 4\: mwisho {align}\\ nonumber\]
Kutoka kwa equation, tunaona kwamba kiasi kimoja cha C 3 H 8 kitaitikia na kiasi cha tano cha O 2:
\[\mathrm{2.7\cancel{L\:C_3H_8}×\dfrac{5\: L\:\ce{O2}}{1\cancel{L\:C_3H_8}}=13.5\: L\:\ce{O2}} \nonumber \]
Kiasi cha 13.5 L cha O 2 kitahitajika kuguswa na 2.7 L ya C 3 H 8.
Tangi ya asetilini kwa tochi ya kulehemu ya oksiasetilini hutoa 9340 L ya gesi ya asetilini, C 2 H 2, saa 0 °C na atm 1. Ni mizinga ngapi ya oksijeni, kila ikitoa 7.00 × 10 3 L ya O 2 kwenye 0 °C na atm 1, itahitajika kuchoma asetilini?
\[\ce{2C2H2 + 5O2⟶4CO2 + 2H2O} \nonumber \]
- Jibu
-
3.34 mizinga (2.34 × 10 4 L)
Amonia ni mbolea muhimu na kemikali ya viwanda. Tuseme kwamba kiasi cha futi za ujazo bilioni 683 za amonia ya gesi, kipimo cha 25 °C na atm 1, kilitengenezwa. Ni kiasi gani cha H 2 (g), kilichopimwa chini ya hali hiyo, kilihitajika kuandaa kiasi hiki cha amonia kwa majibu na N 2?
\[\ce{N2}(g)+\ce{3H2}(g)⟶\ce{2NH3}(g) \nonumber \]
Suluhisho
Kwa sababu kiasi sawa cha H 2 na NH 3 zina idadi sawa ya molekuli na kila molekuli tatu za H 2 ambazo huguswa zinazalisha molekuli mbili za NH 3, uwiano wa kiasi cha H 2 na NH 3 itakuwa sawa na 3:2. Kiasi mbili cha NH 3, katika kesi hii katika vitengo vya bilioni ft 3, zitaundwa kutoka kwa kiasi cha tatu cha H 2:
\[\mathrm{683\cancel{billion\:ft^3\:NH_3}×\dfrac{3\: billion\:ft^3\:H_2}{2\cancel{billion\:ft^3\:NH_3}}=1.02×10^3\:billion\:ft^3\:H_2} \nonumber \]
Utengenezaji wa 683 bilioni ft 3 ya NH 3 ulihitaji 1020 bilioni ft 3 ya H 2. (Katika 25 °C na atm 1, hii ni kiasi cha mchemraba wenye urefu wa makali ya takriban maili 1.9.)
Ni kiasi gani cha O 2 (g) kilichopimwa saa 25 °C na 760 torr inahitajika kuguswa na 17.0 L ya ethylene, C 2 H 4 (g), kipimo chini ya hali sawa ya joto na shinikizo? Bidhaa hizo ni CO 2 na mvuke wa maji.
- Jibu
-
51.0 L
Ni kiasi gani cha hidrojeni katika 27 °C na 723 torr inaweza kutayarishwa na mmenyuko wa 8.88 g ya galliamu na ziada ya asidi hidrokloriki?
\[\ce{2Ga}(s)+\ce{6HCl}(aq)⟶\ce{2GaCl3}(aq)+\ce{3H2}(g) \nonumber \]
Solution
Ili kubadilisha kutoka kwa wingi wa gallium hadi kiasi cha H 2 (g), tunahitaji kufanya kitu kama hiki:
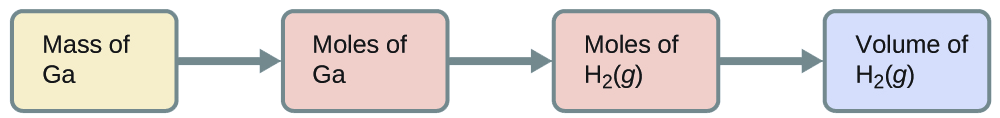
Mabadiliko mawili ya kwanza ni:
\[\mathrm{8.88\cancel{g\: Ga}×\dfrac{1\cancel{mol\: Ga}}{69.723\cancel{g\: Ga}}×\dfrac{3\: mol\:H_2}{2\cancel{mol\: Ga}}=0.191\:mol\: H_2} \nonumber \]
Hatimaye, tunaweza kutumia sheria bora ya gesi:
\[V_\mathrm{H_2}=\left(\dfrac{nRT}{P}\right)_\mathrm{H_2}=\mathrm{\dfrac{0.191\cancel{mol}×0.08206\: L\cancel{atm\:mol^{−1}\:K^{−1}}×300\: K}{0.951\:atm}=4.94\: L} \nonumber \]
Dioksidi ya sulfuri ni kati katika maandalizi ya asidi sulfuriki. Ni kiasi gani cha SO 2 katika 343 °C na 1.21 atm kinazalishwa kwa kuchoma l.00 kg ya sulfuri katika oksijeni?
- Jibu
-
1.30 × 10 3 L
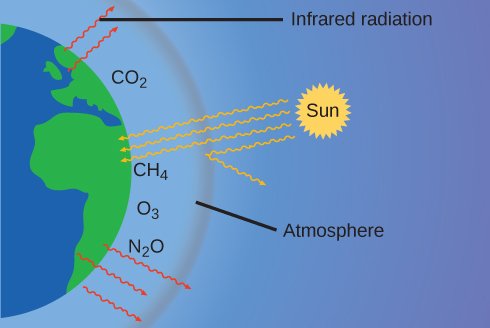
Ngozi nyembamba ya angahewa yetu inazuia dunia kuwa sayari ya barafu na kuifanya iweze kuishi. Kwa kweli, hii ni kutokana na chini ya 0.5% ya molekuli za hewa. Ya nishati kutoka jua inayofikia dunia,\(\dfrac{1}{3}\) karibu inaonekana nyuma katika nafasi, na wengine kufyonzwa na anga na uso wa dunia. Baadhi ya nishati ambayo dunia inachukua hutolewa tena kama mionzi ya infrared (IR), sehemu ambayo hupita nyuma kupitia anga hadi angani. Hata hivyo, wengi wa mionzi hii IR ni kufyonzwa na vitu fulani katika anga, inayojulikana kama gesi chafu, ambayo re-emit nishati hii katika pande zote, mtego baadhi ya joto. Hii inao mazingira mazuri—bila angahewa, wastani wa halijoto duniani wa 14 °C (57 °F) ingekuwa takriban —19 °C (—2 °F). Gesi kubwa za chafu (GHGs) ni mvuke wa maji, dioksidi kaboni, methane, na ozoni. Tangu Mapinduzi ya Viwanda, shughuli za binadamu zimeongezeka viwango vya GHGs, ambazo zimebadilika usawa wa nishati na zinabadilika kwa kiasi kikubwa hali ya hewa ya dunia (Kielelezo\(\PageIndex{6}\)).
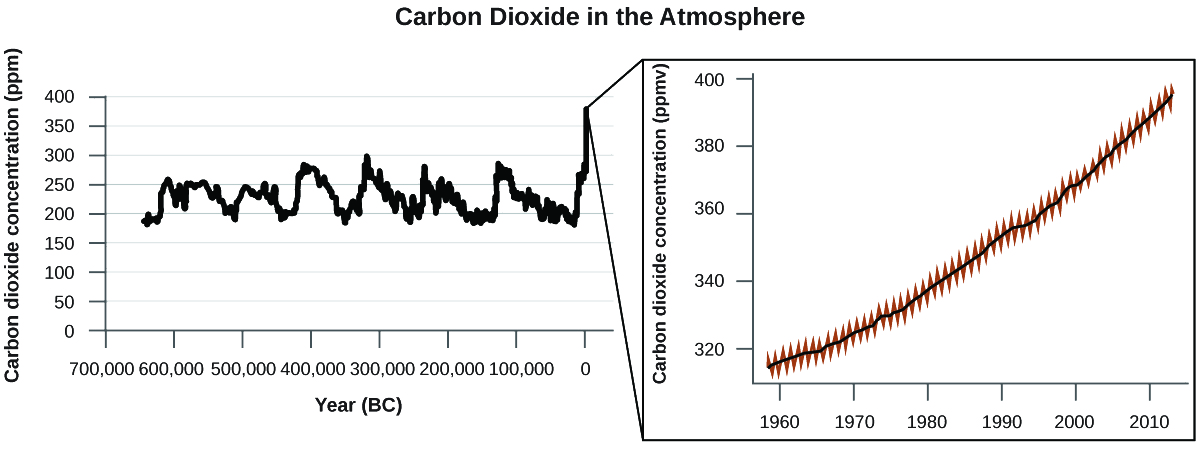
Kuna ushahidi mkubwa kutoka vyanzo vingi kwamba viwango vya juu vya anga vya CO 2 vinasababishwa na shughuli za binadamu, huku uhasibu wa\(\dfrac{3}{4}\) kuchomwa mafuta kwa takriban ongezeko la hivi karibuni la CO 2. Takwimu za kuaminika kutoka kwa vipande vya barafu zinaonyesha kuwa mkusanyiko wa CO 2 katika angahewa ni kiwango cha juu zaidi katika kipindi cha miaka 800,000; ushahidi mwingine unaonyesha kuwa inaweza kuwa katika kiwango chake cha juu katika miaka milioni 20. Katika miaka ya hivi karibuni, mkusanyiko wa CO 2 umeongezeka kutoka ngazi za kihistoria za chini ya 300 ppm hadi karibu 400 ppm leo (Kielelezo\(\PageIndex{7}\)).
Muhtasari
Sheria bora ya gesi inaweza kutumika kupata idadi ya equations rahisi zinazohusiana na kiasi cha kipimo cha moja kwa moja kwa mali ya riba kwa vitu vya gesi na mchanganyiko. Upyaji sahihi wa usawa bora wa gesi unaweza kufanywa ili kuruhusu hesabu ya densities ya gesi na raia wa molar. Sheria ya Dalton ya shinikizo la sehemu inaweza kutumika kuhusisha shinikizo la gesi lililopimwa kwa mchanganyiko wa gesi kwa nyimbo zao. Sheria ya Avogadro inaweza kutumika katika hesabu za stoichiometric kwa athari za kemikali zinazohusisha majibu ya gesi au bidhaa.
Mlinganyo muhimu
- P Jumla = P A + P B + P C +... = i P i
- P A = X A P Jumla
- \(X_A=\dfrac{n_A}{n_{Total}}\)
maelezo ya chini
- “Nukuu za Joseph-Louis Lagrange,” iliyopita tarehe Februari 2006, ilifikia tarehe 10 Februari 2015, www-history.mcs.st-andrews.ac... /Lagrange.html
Muhtasari
- Sheria ya Dalton ya shinikizo la sehemu
- shinikizo la jumla la mchanganyiko wa gesi bora ni sawa na jumla ya shinikizo la sehemu ya gesi za sehemu.
- sehemu ya mole (X)
- kitengo cha ukolezi kinachofafanuliwa kama uwiano wa kiasi cha molar cha sehemu ya mchanganyiko kwa jumla ya idadi ya moles ya vipengele vyote vya mchanganyiko
- shinikizo la sehemu
- shinikizo exerted na gesi ya mtu binafsi katika mchanganyiko
- shinikizo la mvuke la maji
- shinikizo linalotumiwa na mvuke wa maji katika usawa na maji ya kioevu kwenye chombo kilichofungwa kwenye joto maalum


