7.5: Nguvu za vifungo vya Ionic na Covalent
- Page ID
- 176577
- Eleza nguvu za malezi ya dhamana ya covalent na ionic na kuvunjika
- Tumia mzunguko wa Born-Haber kukokotoa nguvu za kimiani kwa misombo ya ionic
- Tumia nguvu za dhamana za covalent wastani ili kukadiria enthalpies ya mmenyuko
Nguvu ya dhamana inaeleza jinsi nguvu kila atomu inavyounganishwa na atomu nyingine, na kwa hiyo ni kiasi gani cha nishati kinachohitajika kuvunja dhamana kati ya atomi hizo mbili. Katika sehemu hii, utajifunza juu ya nguvu za dhamana za vifungo vya covalent, na kisha kulinganisha hiyo kwa nguvu za vifungo vya ionic, ambazo zinahusiana na nishati ya bandia ya kiwanja.
Bond Nguvu: Covalent vifungo
Molekuli imara zipo kwa sababu vifungo vya covalent vinashikilia atomi pamoja. Tunapima nguvu ya dhamana ya covalent na nishati inayotakiwa kuivunja, yaani, nishati muhimu kutenganisha atomi zilizofungwa. Kutenganisha jozi yoyote ya atomi zilizounganishwa kunahitaji nishati; nguvu ya dhamana, zaidi nishati inayotakiwa kuivunja. Nishati inayotakiwa kuvunja dhamana maalum ya covalent katika mole moja ya molekuli ya gesi inaitwa nishati ya dhamana au nishati ya kujitenga dhamana. Nishati ya dhamana kwa molekuli ya diatomic\(D_{X–Y}\), inaelezwa kama mabadiliko ya kawaida ya enthalpy kwa mmenyuko wa mwisho:
\[XY_{(g)}⟶X_{(g)}+Y_{(g)}\;\;\; D_{X−Y}=ΔH° \label{7.6.1} \]
Kwa mfano, dhamana nishati ya safi covalent H—H dhamana\(\Delta_{H–H}\), ni 436 kJ kwa mole ya H—H vifungo kuvunjwa:
\[H_{2(g)}⟶2H_{(g)} \;\;\; D_{H−H}=ΔH°=436kJ \label{EQ2} \]
Kuvunja dhamana daima kunahitaji nishati kuongezwa kwenye molekuli. Vivyo hivyo, kufanya dhamana daima hutoa nishati.
Molekuli zenye atomi tatu au zaidi zina vifungo viwili au zaidi. Jumla ya nguvu zote za dhamana katika molekuli hiyo ni sawa na mabadiliko ya kawaida ya enthalpy kwa mmenyuko wa mwisho ambao huvunja vifungo vyote katika molekuli. Kwa mfano, jumla ya nguvu nne za dhamana za C—H katika CH 4, 1660 kJ, ni sawa na mabadiliko ya kawaida ya enthalpy ya mmenyuko:
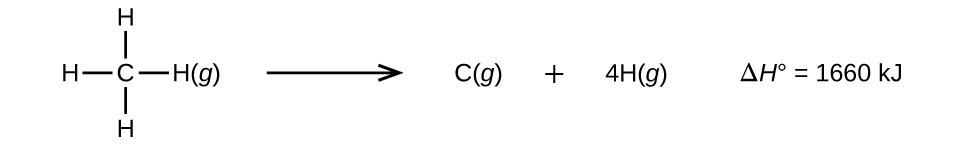
Wastani wa nishati ya dhamana ya C—H\(D_{C–H}\), ni 1660/4 = 415 kJ/mol kwa sababu kuna moles nne za vifungo vya C—H zilizovunjika kwa mole ya mmenyuko. Ingawa vifungo vinne vya C—H ni sawa katika molekuli ya awali, hawana kila mmoja huhitaji nishati sawa kuvunja; mara moja dhamana ya kwanza imevunjika (ambayo inahitaji 439 kJ/mol), vifungo vilivyobaki ni rahisi kuvunja. Thamani ya 415 KJ/mol ni wastani, sio thamani halisi inayotakiwa kuvunja dhamana yoyote.
Nguvu ya dhamana kati ya atomi mbili huongezeka kadiri idadi ya jozi za elektroni katika dhamana inavyoongezeka. Kwa ujumla, kama nguvu za dhamana zinaongezeka, urefu wa dhamana hupungua. Hivyo, tunaona kwamba vifungo vitatu vina nguvu na vifupi kuliko vifungo viwili kati ya atomi mbili sawa; vivyo hivyo, vifungo viwili vina nguvu na vifupi kuliko vifungo moja kati ya atomi hizo mbili. Wastani dhamana nguvu kwa baadhi ya vifungo kawaida kuonekana katika Jedwali\(\PageIndex{2}\), na kulinganisha urefu dhamana na uwezo dhamana kwa baadhi ya vifungo kawaida inaonekana katika Jedwali\(\PageIndex{2}\). Wakati atomu moja imefungwa na atomi mbalimbali katika kundi, nguvu dhamana kawaida itapungua kama sisi hoja chini ya kundi. Kwa mfano, C—F ni 439 KJ/mol, C—Cl ni 330 kJ/mol, na C—Br ni 275 KJ/mol.
| Bond | Bond Nishati | Bond | Bond Nishati | Bond | Bond Nishati | ||
|---|---|---|---|---|---|---|---|
| H—H | 436 | C—S | 260 | F—Cl | 255 | ||
| H—C | 415 | C—Cl | 330 | F—Br | 235 | ||
| H—N | 390 | C—Br | 275 | Si—Si | 230 | ||
| H—O | 464 | C—I | 240 | Si—P | 215 | ||
| H—F | 569 | N—N | 160 | Si—S | 225 | ||
| H—Si | 395 | \(\mathrm{N=N}\) | 418 | Si—Cl | 359 | ||
| H—P | 320 | \(\mathrm{N≡N}\) | 946 | Si—Br | 290 | ||
| H—S | 340 | HAKUNA—O | 200 | Si—I | 215 | ||
| H—Cl | 432 | N—F | 270 | P—P | 215 | ||
| H—Br | 370 | N—P | 210 | P—S | 230 | ||
| H—I | 295 | N—Cl | 200 | P—Cl | 330 | ||
| C—C | 345 | N—Br | 245 | P—Br | 270 | ||
| \(\mathrm{C=C}\) | 611 | O—O | 140 | P—I | 215 | ||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | —S | 215 | ||
| C—N | 290 | O—F | 160 | —Cl | 250 | ||
| \(\mathrm{C=N}\) | 615 | O—Si | 370 | —Br | 215 | ||
| \(\mathrm{C≡N}\) | 891 | O—P | 350 | Cl—Cl | 243 | ||
| C—O | 350 | O—Cl | 205 | Cl—Br | 220 | ||
| \(\mathrm{C=O}\) | 741 | O—I | 200 | Cl—I | 210 | ||
| \(\mathrm{C≡O}\) | 1080 | F—F | 160 | Br—Br | 190 | ||
| C—F | 439 | F—Si | 540 | Br—I | 180 | ||
| C—Si | 360 | F—P | 489 | I-I | 150 | ||
| C—P | 265 | F—S | 285 |
| Bond | Urefu wa Bond () | Bond Nishati (KJ/mol) |
|---|---|---|
| C—C | 1.54 | 345 |
| \(\mathrm{C=C}\) | 1.34 | 611 |
| \(\mathrm{C≡C}\) | 1.20 | 837 |
| C—N | 1.43 | 290 |
| \(\mathrm{C=N}\) | 1.38 | 615 |
| \(\mathrm{C≡N}\) | 1.16 | 891 |
| C—O | 1.43 | 350 |
| \(\mathrm{C=O}\) | 1.23 | 741 |
| \(\mathrm{C≡O}\) | 1.13 | 1080 |
Tunaweza kutumia nguvu za dhamana kuhesabu mabadiliko ya takriban ya enthalpy kwa athari ambapo enthalpies ya malezi haipatikani. Mahesabu ya aina hii pia yatatuambia kama mmenyuko ni exothermic au endothermic.
- Mmenyuko exothermic (Δ H hasi, joto zinazozalishwa) matokeo wakati vifungo katika bidhaa ni nguvu zaidi kuliko vifungo katika reactants.
- Menyu ya endothermic (Δ H chanya, joto kufyonzwa) matokeo wakati vifungo katika bidhaa ni dhaifu kuliko wale walio katika reactants.
Mabadiliko ya enthalpy, Δ H, kwa mmenyuko wa kemikali ni takriban sawa na jumla ya nishati inahitajika kuvunja vifungo vyote katika reactants (nishati “katika”, ishara chanya) pamoja na nishati iliyotolewa wakati vifungo vyote vinaundwa katika bidhaa (nishati “nje”, ishara hasi). Hii inaweza kuelezwa hesabu kwa njia ifuatayo:
\[\Delta H=\sum D_{\text{bonds broken}}− \sum D_{\text{bonds formed}} \label{EQ3} \]
Katika maneno haya, ishara\(\Sigma\) ina maana “jumla ya” na D inawakilisha nishati ya dhamana katika kilojoules kwa mole, ambayo daima ni idadi nzuri. Nishati ya dhamana inapatikana kutoka meza na itategemea kama dhamana fulani ni dhamana moja, mbili, au tatu. Kwa hiyo, kwa kuhesabu enthalpies kwa namna hii, ni muhimu kwamba tunazingatia kuunganishwa katika majibu yote na bidhaa. Kwa sababu D maadili ni kawaida wastani kwa aina moja ya dhamana katika molekuli mbalimbali, hesabu hii hutoa makadirio mbaya, si thamani halisi, kwa enthalpy ya mmenyuko.
Fikiria majibu yafuatayo:
\[\ce{H_{2(g)} + Cl_{2(g)}⟶2HCl_{(g)}} \label{EQ4} \]
au
\[\ce{H–H_{(g)} + Cl–Cl_{(g)}⟶2H–Cl_{(g)}} \label{\EQ5} \]
Ili kuunda moles mbili za HCl, mole moja ya vifungo vya H - H na mole moja ya vifungo vya Cl—Cl lazima ivunjwa. Nishati inayotakiwa kuvunja vifungo hivi ni jumla ya nishati ya dhamana ya dhamana ya H—H (436 KJ/mol) na dhamana ya Cl—Cl (243 kJ/mol). Wakati wa majibu, moles mbili za vifungo vya H—Cl huundwa (nishati ya dhamana = 432 kJ/mol), ikitoa 2 × 432 kJ; au 864 kJ. Kwa sababu vifungo katika bidhaa ni nguvu zaidi kuliko wale walio katika majibu, majibu hutoa nishati zaidi kuliko hutumia:
\ [kuanza {align*}
ΔH & =\ jumla\\ hesabu {D_ {vifungo\: kuvunjwa}}} -\ jumla\ hesabu {D_ {dhamana\: sumu}\\ [4pt]
&=\\ hesabu {[D_ {H} +D_ {Cl}] -2D_ {H-Cl}}\\ [4pt]
&=\ mathrm {[436+243] -2 (432) =-185\ :KJ}
\ mwisho {align*}\ hakuna idadi\]
Nishati hii ya ziada hutolewa kama joto, hivyo mmenyuko ni exothermic. Jedwali T2 linatoa thamani kwa enthalpy ya kawaida ya molar ya malezi ya HCl (g)\(ΔH^\circ_\ce f\), ya -92.307 kJ/mol. Mara mbili thamani hiyo ni -184.6 kJ, ambayo inakubaliana vizuri na jibu lililopatikana mapema kwa ajili ya kuundwa kwa moles mbili za HCl.
Methanol, CH 3 OH, inaweza kuwa mafuta mbadala bora. Mmenyuko wa joto la mvuke na kaboni hutoa mchanganyiko wa gesi monoxide kaboni, CO, na hidrojeni, H 2, ambayo methanol inaweza kuzalishwa. Kutumia nguvu za dhamana katika Jedwali\(\PageIndex{2}\), uhesabu mabadiliko ya takriban ya enthalpy, Δ H, kwa majibu hapa:
\[CO_{(g)}+2H2_{(g)}⟶CH_3OH_{(g)} \nonumber \]
Suluhisho
Kwanza, tunahitaji kuandika miundo ya Lewis ya wahusika na bidhaa:
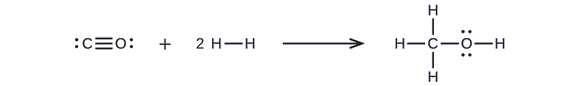
Kutokana na hili, tunaona kwamba Δ H kwa mmenyuko huu inahusisha nishati inayotakiwa kuvunja dhamana ya C—O tatu na vifungo viwili vya H - H, pamoja na nishati zinazozalishwa na kuundwa kwa vifungo vitatu vya C—H moja, dhamana moja ya C—O, na dhamana moja ya O—H. Tunaweza kueleza hii kama ifuatavyo (kupitia Equation\ ref {EQ3}):
\ [kuanza {align*}
ΔH & =\ jumla D_ {vifungo\: kuvunjwa} -\ jumla D_ {vifungo\: sumu}\
ΔH & =\ hesabu {[D_ {CO} +2 (D_ {H-H})] - [3 (D_ {C—H}) +D_ {C—O} +D_ {O-H}}}
\ mwisho {align*}\ nonumber\]
Kutumia maadili ya nishati ya dhamana katika Jedwali\(\PageIndex{2}\), tunapata:
\ [kuanza {align*}
ΔH&= [1080+2 (436)] - [3 (415) +350+464]\\
&=\ ce {-107\ :KJ}
\ mwisho {align*}\ nonumber\]
Tunaweza kulinganisha thamani hii kwa thamani iliyohesabiwa kulingana na\(ΔH^\circ_\ce f\) data kutoka Kiambatisho G:
\ [kuanza {align*}
ΔH&= [ΔH ^\ mduara _ {\ ce f}\ ce {CH3OH} (g)] - [ΔH^\ circ_ {\ ce f}\ ce {CO} (g) +2×ΔH^\ circ_ {\ ce f}\ ce {H2}]\\
&= [-201.0] 52+2×0]\\
&=\ hesabu {-90.5\ :KJ}
\ mwisho {align*}\ hakuna idadi\]
Kumbuka kuwa kuna pengo muhimu kati ya maadili yaliyohesabiwa kwa kutumia njia mbili tofauti. Hii hutokea kwa sababu D maadili ni wastani wa nguvu tofauti dhamana; kwa hiyo, mara nyingi kutoa tu makubaliano mbaya na data nyingine.
Pombe ya ethyl, CH 3 CH 2 OH, ilikuwa moja ya kemikali za kikaboni za kwanza zilizounganishwa kwa makusudi na wanadamu. Ina matumizi mengi katika sekta, na ni pombe zilizomo katika vileo. Inaweza kupatikana kwa fermentation ya sukari au synthesized na hydration ya ethylene katika majibu yafuatayo:

Kutumia nguvu za dhamana katika Jedwali\(\PageIndex{2}\), uhesabu mabadiliko ya takriban ya enthalpy, Δ H, kwa majibu haya.
- Jibu
-
—35 kJ
Ionic Bond Nguvu na Lattice Nishati
Kiwanja cha ionic ni imara kwa sababu ya mvuto wa umeme kati ya ions zake nzuri na hasi. Nishati ya tani ya kiwanja ni kipimo cha nguvu ya kivutio hiki. Nishati ya tani (\(ΔH_{lattice}\)) ya kiwanja cha ionic hufafanuliwa kama nishati inayotakiwa kutenganisha mole moja ya imara ndani ya sehemu yake ya ions ya gesi. Kwa MX imara ionic, nishati ya tani ni mabadiliko ya enthalpy ya mchakato:
\[MX_{(s)}⟶Mn^+_{(g)}+X^{n−}_{(g)} \;\;\;\;\; ΔH_{lattice} \label{EQ6} \]
Kumbuka kwamba tunatumia mkataba ambapo imara ya ionic imetenganishwa katika ions, hivyo nguvu zetu za bandia zitakuwa za mwisho (maadili mazuri). Baadhi ya maandiko hutumia mkataba sawa lakini kinyume, kufafanua nishati ya kimiani kama nishati iliyotolewa wakati ions tofauti zinachanganya ili kuunda kimiani na kutoa maadili hasi (exothermic). Kwa hiyo, ikiwa unatafuta nguvu za bandia katika kumbukumbu nyingine, hakikisha uangalie ufafanuzi gani unaotumiwa. Katika matukio hayo yote, ukubwa mkubwa wa nishati ya bandia inaonyesha kiwanja cha ionic imara zaidi. Kwa kloridi ya sodiamu, Δ H bandia = 769 kJ. Hivyo, inahitaji 769 kJ kutenganisha mole moja ya NaCl imara ndani ya gesi Na + na Cl — ions. Wakati mole moja kila ya gesi Na + na Cl — ions huunda NaCl imara, 769 kJ ya joto hutolewa.
Nishati\(ΔH_{lattice}\) ya tani ya kioo ya ionic inaweza kuelezwa na equation ifuatayo (inayotokana na sheria ya Coulomb, inayoongoza nguvu kati ya mashtaka ya umeme):
\[ΔH_{lattice}=\dfrac{C(Z^+)(Z^−)}{R_o} \label{EQ7} \]
ambayo
- \(\ce{C}\)ni mara kwa mara ambayo inategemea aina ya muundo wa kioo;
- \(Z^+\)na\(Z^–\) ni mashtaka juu ya ions; na
- \(R_o\)ni umbali wa interionic (jumla ya radii ya ions chanya na hasi).
Hivyo, nishati ya tani ya kioo ionic huongezeka kwa kasi kama mashtaka ya ions huongezeka na ukubwa wa ions hupungua. Wakati vigezo vingine vyote ni agizo mara kwa mara, mara mbili malipo ya wote cation na anion quadruples nishati kimiani. Kwa mfano, nishati ya kimiani ya LiF (Z + na Z — = 1) ni 1023 kJ/mol, ambapo ile ya MgO (Z + na Z — = 2) ni 3900 kJ/mol (R o ni karibu sawa-kuhusu 200pm kwa misombo yote).
Umbali tofauti wa interatomic huzalisha nguvu tofauti za bandia. Kwa mfano, tunaweza kulinganisha nishati ya kimiani ya MgF 2 (2957 kJ/mol) na ile ya MgI 2 (2327 kJ/mol) kuchunguza athari juu ya nishati ya kimiani ya ukubwa mdogo ionic ya F — ikilinganishwa na I —.
Ruby ya thamani ya gem ni oksidi ya alumini, Al 2 O 3, iliyo na athari za Cr 3 +. Kiwanja Al 2 Se 3 hutumiwa katika utengenezaji wa vifaa vingine vya semiconductor. Ambayo ina kubwa kimiani nishati, Al 2 O 3 au Al 2 Se 3?
Suluhisho
Katika misombo miwili ya ionic, mashtaka Z + na Z — ni sawa, hivyo tofauti katika nishati ya kimiani itategemea R o. O 2— ion ni ndogo kuliko Se 2 - ion. Hivyo, Al 2 O 3 ingekuwa mfupi interionic umbali kuliko Al 2 Se 3, na Al 2 O 3 ingekuwa kubwa kimiani nishati.
Oxydi ya zinki, ZnO, ni jua la jua la ufanisi sana. Nishati ya bandia ya ZNo ingekuwa ikilinganishaje na ile ya NaCl?
- Jibu
-
ZNo ingekuwa kubwa kimiani nishati kwa sababu maadili Z ya wote cation na anion katika ZnO ni kubwa, na umbali interionic ya ZNo ni ndogo kuliko ile ya NaCl.
Mzunguko wa Kuzaliwa Haber
Haiwezekani kupima nguvu za kimiani moja kwa moja. Hata hivyo, nishati ya bandia inaweza kuhesabiwa kwa kutumia equation iliyotolewa katika sehemu iliyopita au kwa kutumia mzunguko wa thermochemical. Mzunguko wa Born-Haber ni matumizi ya sheria ya Hess ambayo huvunja malezi ya imara ionic katika mfululizo wa hatua za mtu binafsi:
- \(ΔH^\circ_\ce f\), enthalpy ya kawaida ya malezi ya kiwanja
- IE, nishati ya ionization ya chuma
- EA, mshikamano wa elektroni wa nonmetal
- \(ΔH^\circ_s\), enthalpy ya upungufu wa chuma
- D, dhamana dissociation nishati ya nonmetal
- ΔH kimiani, nishati ya kimiani ya kiwanja
\(\PageIndex{1}\)Mchoro wa takwimu mzunguko wa Born-Haber kwa ajili ya malezi ya fluoride imara ya cesium.
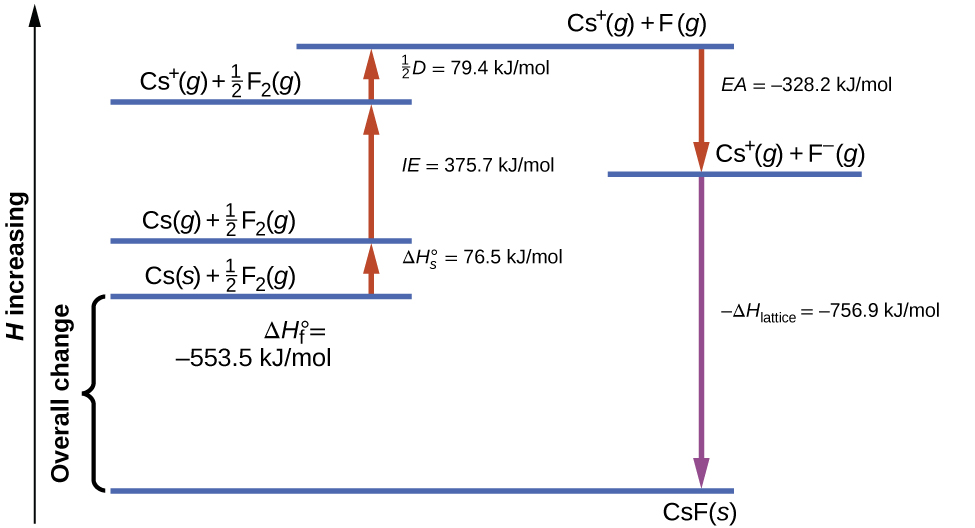
Tunaanza na vipengele katika majimbo yao ya kawaida, Cs (s) na F 2 (g). Ya\(ΔH^\circ_\ce s\) inawakilisha uongofu wa cesium imara ndani ya gesi, na kisha nishati ya ionization inabadilisha atomi za cesiamu za gesi ndani ya cations. Katika hatua inayofuata, tunahesabu nishati inayotakiwa kuvunja dhamana ya F—F ili kuzalisha atomi za fluorini. Kubadili mole moja ya atomi za fluorini ndani ya ions ya fluoride ni mchakato wa exothermic, hivyo hatua hii inatoa nishati (ushirika wa elektroni) na inavyoonekana kama kupungua kwa y -axis. Sasa tuna mole moja ya Cs cations na mole moja ya F anions. Ions hizi huchanganya kuzalisha fluoride imara ya cesium. Mabadiliko ya enthalpy katika hatua hii ni hasi ya nishati ya bandia, hivyo pia ni kiasi cha exothermic. Nishati ya jumla inayohusika katika uongofu huu ni sawa na enthalpy ya majaribio ya malezi,\(ΔH^\circ_\ce f\), ya kiwanja kutoka kwa vipengele vyake. Katika kesi hiyo, mabadiliko ya jumla ni exothermic.
Sheria ya Hess pia inaweza kutumika kuonyesha uhusiano kati ya enthalpies ya hatua za mtu binafsi na enthalpy ya malezi. Jedwali\(\PageIndex{3}\) linaonyesha hii kwa fluoride ya cesium, CSF.
| Enthalpy ya upungufu wa Cs (s) | \(\ce{Cs}(s)⟶\ce{Cs}(g)\hspace{20px}ΔH=ΔH^\circ_s=\mathrm{77\:kJ/mol}\) |
|---|---|
| Nusu moja ya nishati ya dhamana ya F 2 | \(\dfrac{1}{2}\ce{F2}(g)⟶\ce{F}(g)\hspace{20px}ΔH=\dfrac{1}{2}D=\mathrm{79\:kJ/mol}\) |
| Nishati ya ionization ya Cs (g) | \(\ce{Cs}(g)⟶\ce{Cs+}(g)+\ce{e-}\hspace{20px}ΔH=IE=\ce{376\:kJ/mol}\) |
| Hasi ya ushirika wa elektroni wa F | \(\ce{F}(g)+\ce{e-}⟶\ce{F-}(g)\hspace{20px}ΔH=−EA=\ce{-328\:kJ/mol}\) |
| Hasi ya nishati ya bandia ya CSF (s) | \(\ce{Cs+}(g)+\ce{F-}(g)⟶\ce{CsF}(s)\hspace{20px}ΔH=−ΔH_\ce{lattice}=\:?\) |
| Enthalpy ya malezi ya CSF (s), ongeza hatua 1—5 |
\(ΔH=ΔH^\circ_f=ΔH^\circ_s+\dfrac{1}{2}D+IE+(−EA)+(−ΔH_\ce{lattice})\) \(\ce{Cs}(s)+\dfrac{1}{2}\ce{F2}(g)⟶\ce{CsF}(s)=\ce{-554\:kJ/mol}\) |
Hivyo, nishati ya tani inaweza kuhesabiwa kutoka kwa maadili mengine. Kwa kloridi ya cesium, kwa kutumia data hii, nishati ya tani ni:
\[ΔH_\ce{lattice}=\mathrm{(411+109+122+496+368)\:kJ=770\:kJ} \nonumber \]
Mzunguko wa Born-Haber pia unaweza kutumika kuhesabu yoyote ya kiasi kingine katika equation kwa nishati ya kimiani, isipokuwa kwamba salio linajulikana. Kwa mfano, ikiwa enthalpy husika ya usawazishaji\(ΔH^\circ_s\), nishati ionization (IE), dhamana dissociation enthalpy (D), nishati ya kimiani Δ H kimiani, na kiwango cha enthalpy ya malezi\(ΔH^\circ_\ce f\), mzunguko wa Born-Haber inaweza kutumika kuamua elektroni mshikamano wa atomi.
Nguvu za kimiani zilizohesabiwa kwa misombo ya ionic ni kawaida kubwa zaidi kuliko nguvu za kujitenga dhamana zilizopimwa kwa vifungo vya covalent. Wakati nguvu za kimiani huanguka katika aina mbalimbali za 600—4000 KJ/mol (baadhi ya juu zaidi), nguvu za kujitenga kwa dhamana huwa kati ya 150-400 kJ/mol kwa vifungo vya moja. Kumbuka, hata hivyo, kwamba haya sio maadili ya kulinganishwa moja kwa moja. Kwa misombo ya ionic, nguvu za tani zinahusishwa na mwingiliano mwingiliano mwingi, kama cations na anions pakiti pamoja katika bandia iliyopanuliwa. Kwa vifungo vyema, nishati ya kujitenga kwa dhamana inahusishwa na mwingiliano wa atomi mbili tu.
Muhtasari
Nguvu ya dhamana ya covalent inapimwa na nishati yake ya kujitenga dhamana, yaani, kiasi cha nishati kinachohitajika kuvunja dhamana hiyo katika mole ya molekuli. Vifungo vingi vina nguvu kuliko vifungo moja kati ya atomi sawa. Enthalpy ya mmenyuko inaweza kukadiriwa kulingana na pembejeo ya nishati inayotakiwa kuvunja vifungo na nishati iliyotolewa wakati vifungo vipya vinapoundwa. Kwa vifungo vya ionic, nishati ya tani ni nishati inayohitajika kutenganisha mole moja ya kiwanja ndani ya ions zake za awamu ya gesi. Nishati ya tani huongezeka kwa ions na mashtaka ya juu na umbali mfupi kati ya ions. Nguvu za kimiani mara nyingi huhesabiwa kwa kutumia mzunguko wa Born-Haber, mzunguko wa thermochemical ikiwa ni pamoja na hatua zote za juhudi zinazohusika katika kugeuza vipengele kuwa kiwanja cha ionic.
Mlinganyo muhimu
- Nishati ya dhamana kwa molekuli ya diatomic:\(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy mabadiliko: Δ H = D vifungo kuvunjwa — dhamana D sumu
- Nishati ya kimiani kwa MX imara:\(\ce{MX}(s)⟶\ce M^{n+}(g)+\ce X^{n−}(g)\hspace{20px}ΔH_\ce{lattice}\)
- Nishati ya tani kwa kioo cha ionic:\(ΔH_\ce{lattice}=\mathrm{\dfrac{C(Z^+)(Z^-)}{R_o}}\)
maelezo ya chini
- Swali hili linachukuliwa kutoka kwa Uchunguzi wa Uwekaji wa Kemia ya Juu na hutumiwa kwa idhini ya Huduma ya Upimaji wa Elimu.
faharasa
- dhamana ya nishati
- (pia, dhamana dissociation nishati) nishati required kuvunja dhamana covalent katika dutu gesi
- Mzunguko wa mzaliwa wa Haber
- mzunguko wa thermochemical unaohusiana na hatua mbalimbali za juhudi zinazohusika katika malezi ya imara ionic kutoka kwa vipengele husika
- nishati ya kimiani (Δ H kimiani)
- nishati inahitajika kutenganisha mole moja ya imara ionic katika sehemu yake ions gesi


